Method Article
Cromatográfico en capa fina (TLC) Separaciones y bioensayos de extractos vegetales para identificar compuestos antimicrobianos
En este artículo
Resumen
Se describen procedimientos para cromatografía en capa fina (TLC) separación de extractos de plantas y el contacto bioautografía para identificar metabolitos antibacterianos. Los métodos se aplican a la selección de compuestos fenólicos de trébol rojo que inhiben las bacterias productoras de amoniaco hiper (HAB) nativas para el rumen bovino.
Resumen
Una pantalla común para los compuestos antimicrobianos de plantas consiste en la separación de extractos de plantas por papel o cromatografía en capa fina (PC o TLC), la exposición de los cromatogramas a las suspensiones microbianas (por ejemplo hongos o bacterias en caldo o agar), dejando tiempo para que los microbios para crecer en un ambiente húmedo, y la visualización de zonas sin crecimiento microbiano. La eficacia de este método de detección, conocido como bioautografía, depende tanto de la calidad de la separación cromatográfica y el cuidado con las condiciones de cultivo microbianos. Este artículo describe los protocolos estándar para TLC y el contacto bioautografía con una novedosa aplicación a los amino ácidos bacterias que fermentan. El extracto se separa en (aluminio con respaldo) placas de TLC de sílice flexibles, y las bandas se visualizaron bajo luz ultravioleta (UV). Las zonas se cortaron y se incubaron boca abajo en agar inoculado con el microorganismo de ensayo. Bandas inhibidoras se visualizaron por tinción de la placa de agars con tetrazolio rojo. El método se aplica a la separación de trébol rojo (Trifolium pratense cv. Kenland) compuestos fenólicos y su programación para la actividad contra Clostridium sticklandii, una bacteria productora de amoníaco hiper (HAB) que es nativa al rumen bovino. Los métodos de TLC se aplican a muchos tipos de extractos de plantas y otras especies bacterianas (aeróbicas o anaeróbicas), así como hongos, pueden ser utilizados como organismos de prueba si las condiciones de cultivo se modifican para adaptarse a los requisitos de crecimiento de las especies.
Introducción
El ensayo para compuestos antimicrobianos en las plantas requiere la separación de los componentes de un extracto de la planta, la exposición de un microorganismo de ensayo a los componentes, y la determinación de si el crecimiento del microorganismo es inhibido por cualquiera de los compuestos. Separaciones por papel o la cromatografía en capa fina (PC o TLC) son convenientes porque muchos compuestos pueden ser separados en una superficie plana. La separación se basa en la polaridad, con algunos compuestos que se unen fuertemente al adsorbente (celulosa en el caso de la PC, y una variedad de adsorbentes en el caso de TLC) y la migración de menos que otros 1. La Figura 1 proporciona un ejemplo de las posiciones relativas de compuestos fenólicos polares y no polares después de separación en una placa de TLC de sílice.
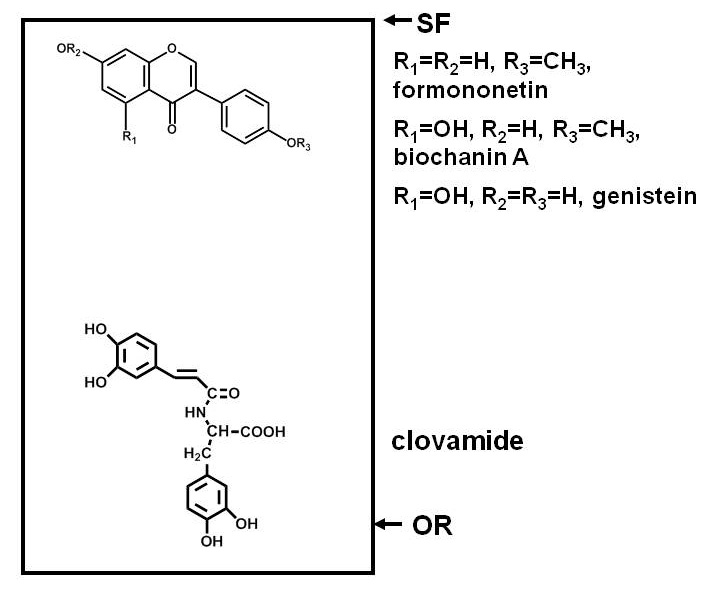
Figura 1. Diagrama que ilustra las distribuciones de compuestos de diferentes polaridades después de separación en una capa fina de sílice para cromatografía (TLC) placa. Compuestos fenólicos de trébol rojo (Trifolium pratense L.) se utilizan como un ejemplo. Los compuestos polares, tales como clovamide, tienen una fuerte afinidad por un adsorbente polar como sílice y permanecen cerca del origen (O), mientras que los compuestos polares menos, tales como las tres isoflavonas cerca de la frente del disolvente (SF), partición más fácilmente en los disolventes (que son menos polares que a menos que la sílice se incluyen agua, ácidos o bases) y migrar más arriba de la placa.
Después de la separación de un extracto en una placa de TLC, microorganismos de prueba pueden estar expuestos a todos los compuestos en la placa, acelerando así la identificación de los componentes activos de un extracto 2. Si un cultivo fúngico o bacteriano se expone a la cromatograma, el crecimiento microbiano se producirá en todas partes excepto en áreas con crecimiento-inhibidorcompuestos y. Las zonas de inhibición a continuación, se pueden visualizar mediante la observación del contraste entre el crecimiento del micelio y las áreas de crecimiento libre de hongos si se han aplicado 3 o por pulverización con compuestos que cambian de color cuando se reduce o hidrolizado por las células vivas 4. Aunque el uso de papel o de capa fina cromatogramas para los ensayos antimicrobianos se aplicó primero a los antibióticos y fungicidas 5 3,6, extractos de plantas ahora son analizados con frecuencia para los compuestos antimicrobianos con este método, a menudo referido como bioautografía. Los protocolos descritos en el presente documento se aplican a bioautografía de los cromatogramas de capa fina. TLC se utiliza ampliamente debido a que es relativamente rápida y se puede realizar en diferentes adsorbentes (por ejemplo, sílice, almidón, alúmina), así como proporcionando buena resolución y sensibilidad 1.
Los extractos de plantas se pueden preparar para TLC de muchas maneras. Los métodos comunes incluyen material vegetal de extracción en alcmezclas ohol-agua tales como etanol al 80% 7,8, posiblemente con la adición de ácido o base 9. Después de una extracción en tales disolventes, que contienen un poco de agua y son, posiblemente, ácido o básico, extractos deben concentrarse de manera que puedan ser aplicadas a placas de TLC en un volumen mínimo. La concentración de los extractos de alcohol-agua se puede lograr mediante la partición con disolventes orgánicos inmiscibles en agua 8 o con una mezcla de tales disolventes, tales como acetato de acetato de etilo-éter (1:1, v / v) 10,11. Diferentes metabolitos vegetales se extraen en diferentes disolventes orgánicos, dependiendo de sus polaridades. Para garantizar que los ácidos o bases orgánicos vegetales se extraen en disolventes orgánicos en esta etapa, el pH de un extracto de alcohol y agua se puede subir o bajar con un ácido o base soluble en agua para convertir los analitos disociadas en sus formas no disociada, que luego se soluble en disolventes orgánicos neutros 9. La fase orgánica puede entonces ser correovaporated bajo presión reducida o en atmósfera de nitrógeno y se ajustó hasta el volumen deseado para TLC. El pH del extracto es poco probable que sea letal para microorganismos de bioensayo debido a la compartimentación de los analitos en disolventes neutros, pequeño volumen final, y la evaporación del extracto sobre la placa de TLC antes de la separación.
Ambos hongos y bacterias se emplean como microorganismos de prueba en bioautografía de extractos de plantas 2. Las esporas de algunos hongos, tales como Cladosporium cucumerinum, germinan en placas de TLC (aparte de las zonas con compuestos inhibidores) si se pulveriza sobre las placas en una solución nutriente y se incubaron en un ambiente húmedo durante varios días 3. El micelio oscuro de la C. cucumerinum en zonas no inhibidor proporciona un fuerte contraste con las zonas francas de crecimiento del micelio. Aunque las bacterias se han aplicado a cromatografía en capa fina (TLC) placas de la misma manera 4,12, las bacterias también se vierten sobre TLCsuperficies de las placas de agar se superpone a 13,14. Levaduras, tales como Candida albicans, se puede aplicar en las capas de agar, así 14. Alternativamente, las placas de TLC se pueden colocar boca abajo en agar inoculado con bacterias o levaduras 10,15 8, un método conocido como el contacto bioautografía 2.
Se describe un método para el contacto bioautografía para la detección de compuestos fenólicos antimicrobianos a partir de trébol rojo (Trifolium pratense cv. Kenland). El microorganismo de ensayo es Clostridium sticklandii, un hiper bacteria productora de amoníaco ruminal (HAB) y obligar anaerobio. Aunque las separaciones utilizadas no resuelven todos los componentes del extracto, facilitan la identificación de las zonas de actividad antimicrobiana, reduciendo de este modo el conjunto de posibles compuestos antimicrobianos. El protocolo utiliza procedimientos estándar para TLC 1. El protocolo también describe algunas de las técnicas necesarias para obli cultivoanaerobios puerta de dicho ensayo, el uso de contactos bioautografía 15 y un método de visualización con una sal de tetrazolio, que tiñe las células vivas 2,4.
Protocolo
1. Preparación del extracto de la planta
- Ver Kagan y Flythe 10 para la extracción de compuestos fenólicos de cv Trifolium pratense. Kenland.
- Para extraer otros compuestos en otras plantas, comprobar la literatura análisis fitoquímico para los métodos de extracción de plantas-o-metabolitos específicos (muchos se describen), o buscar protocolos tales como los de Khurram et al. 7,8 que aíslan muchos compuestos con una amplia gama de polaridades.
2. Preparación de las placas de capa fina
- Limpiar las placas de TLC mediante el desarrollo en uno o más disolventes polares y neutros, con el fin de mover los contaminantes adsorbidos lejos de la zona de desarrollo.
- En una campana de humos, preparar suficiente disolvente de limpieza (por ejemplo 15-100 ml de acetato de etilo-metanol 2:1, v / v) para cubrir la parte inferior de la cámara de desarrollo de TLC, así como el borde inferior de una placa de TLC cuando conjunto dentro de la cámara.
- Utilice comercialmentevidrio cialmente disponibles TLC desarrollando cámaras (diferentes tamaños disponibles, con tapas) o vasos de precipitados Pyrex de papel de aluminio cubierto o tarros de conserva.
- Utilice unas tijeras para cortar aluminio-o (flexibles) placas de gel de sílice con forro de plástico, que vienen en varios tamaños (20 cm x 20 cm y más pequeñas), para adaptarse a la cubeta de desarrollo disponibles. (Precaución: La sílice puede causar daño a los pulmones si se inhala Trabajar en una campana extractora, y manejar las placas de TLC con guantes para evitar los aceites de la piel sobre la sílice.).
- Inserte las placas dentro de la cámara, con las partes superiores se inclinan contra las paredes de la cámara. Las placas no deben tocarse. Cubra la cámara y dejar que el disolvente se mueven hasta la placa por acción capilar.
- Cuando disolvente haya alcanzado la parte superior de las placas, quite las placas de la cámara y disponer en una posición de pie dentro de la campana de extracción hasta que el disolvente se ha evaporado.
- Compruebe si las impurezas han emigrado cerca de la parte superior de la placa de TLC mediante la búsqueda de una banda amarilla bajo visibleluz, o una banda fluorescente bajo la luz ultravioleta (UV) (véase el "frente impureza" o si en la Figura 2B). Si la mayoría de la placa todavía tiene un tinte amarillento, repita el proceso de limpieza.
- Después de quitar las placas de TLC de la cámara, desechar el disolvente. Permitir que el disolvente residual se evapore por completo antes de utilizar la cámara para el Protocolo 2.
- Para eliminar la humedad residual que puede afectar a la migración de los compuestos sobre sílice 16, apuntalar las placas en posición vertical en un horno de secado a 100 ° C (10-15 min para un 20 cm x 20 cm de placa, y 5 min de 7 cm x 10 cm placas ).
- Si un horno de secado 100 ° C no está disponible, placas de calor para un período de tiempo más largo a temperaturas más bajas (es decir, 40 min a 60 ° C).
- Después de que las placas están secas, deje que se enfríen a temperatura ambiente antes de la carga.
3. Preparación de Desarrollo de las Cámaras por la Separación Extract
- Utilice unas tijeras para cortar un trozo de papel de filtro ligeramente por debajo de la altura de la cámara, y aproximadamente la mitad del perímetro de la cámara de ancho. Este documento actúa como una mecha para extraer los solventes hasta la pared de la cámara y saturar la cámara con los vapores de solventes, lo que mejora la reproducibilidad de las separaciones 1.
- En una campana de extracción, mezcla de disolventes (acetato de etilo-metanol 4:1, v / v, para este estudio). Vierta la mezcla de disolvente en la cámara y la tapa. Espere hasta que la mecha está mojada con solvente, lo que indica la saturación de la cámara, para poner las placas en la cámara.
4. La carga y el Desarrollo de las placas de TLC
- Marque ligeramente el origen con el lápiz. Si la placa de adsorbente TLC es suave y fácil de dañar, hacer marcas en los bordes. Los compuestos deben estar por encima de la superficie del disolvente de desarrollo cuando las placas se insertan en la cámara de TLC.
- Disolver los extractos en disolvente orgánico suficiente (en este caso, metanol) para tener una solución concentrada en lugar de una turbiasuspensión.
- Cargue las muestras y estándares como bandas estrechas con una jeringa de microlitro o micropipetas capilares, dejando un borde de 1 cm en los lados de la placa. Permita que las bandas se sequen (avivando la placa o cargarlo en una campana de humos ayuda).
- Si se necesita una mayor concentración de la muestra en un plato, "overspot" de cargar las muestras una vez más en las bandas secas.
- Con unas pinzas o tenazas, placa (s) situada en el interior de la cámara de TLC saturado. Las placas no deben tocar la mecha, ya que puede proporcionar solvente a las placas en los puntos de contacto, alterando así el camino de la migración compuesto. Cubierta de la cámara y dejar que las placas se desarrollan.
5. Preparación de las placas para valoración biológica
- Quite la placa (s) de depósito de TLC antes de que el frente del disolvente alcance la parte superior de la placa, y marcar la altura de la frente del disolvente con un lápiz. Deje placa seca en la campana de humos.
- Desarrollar las placas de TLC restantes en la misma cámara de TLC, que es GEnerally utilizable para un día entero si se mantiene cerrado. Remake mezcla de disolvente para cámara de TLC si la cantidad de disolvente en la cámara disminuye notablemente.
- Después de placas están secas, visualizar bandas bajo luz visible o UV, y delimitar las bandas con un lápiz. Una cámara de visión con una lámpara UV portátil es conveniente, especialmente si la lámpara puede detectar compuestos, tanto en 254 nm (UV de onda corta) y 365 nm (longitud de onda larga UV).
Nota: En este momento o después de la etapa siguiente, las placas pueden ser envueltos en papel plástico, cubierto con papel de aluminio, y se almacenan a -20 ° C. El tiempo máximo de almacenamiento depende de la estabilidad del compuesto. Debido a que la sílice no es neutral, algunos compuestos se degradan mientras que en la placa de TLC. - Fotografiar o dibujar placas.
- Utilice un sistema de documentación fotográfica gel si uno equipado con UV por encima y / o luz visible está disponible.
- Si hay un sistema de documentación fotográfica comercial está disponible, placas fotografía dentro de una caja forrada con papel oscuro o de tela, with un conjunto de cámara en un trípode y una luz UV portable sujeta a un anillo de soporte 17. Al fotografiar las placas que no tienen ningún indicador fluorescente, utilice un filtro de luz azul sobre el lente de la cámara para mejorar la apariencia de banda 17.
- Para ayudar en la caracterización de las bandas, calcular los valores del factor de retención (Rf) midiendo las distancias recorridas por los compuestos y frente del solvente y dividiendo el primero por el segundo (Figura 2A).
6. Bacteriana cultura y Ensayo
- Preparar e inocular los medios de comunicación en condiciones anaeróbicas. El cultivo utilizado en este caso fue Clostridium SR cepa sticklandii, que se obtuvo de la colección de cultivos de James B. Russell, de la Universidad de Cornell, Ithaca, NY.
- Ver Flythe y Kagan 13 y la lista de materiales para una descripción de los medios de comunicación HAB.
- Mantener el cultivo hasta la fase exponencial o estacionaria. Utilice techniqu anaeróbico estériles cuando se trabaja con microorganismos anaerobios.
- Inocular la cultura (1% v / v) en agar fundido después que la temperatura del agar (0,75% W / V) ha disminuido a menos de 60 ° C. Mezclar suavemente y poner inmediatamente en una cámara anaeróbica (95% de CO 2 5% atmósfera de H2 para medios HAB) para verter.
- Vierta en x 100 mm placas Petri de plástico de 15 mm, y dejar que se solidifique.
- Con unas tijeras, corte la placa de TLC en zonas que contienen la banda (s) de interés. Coloque bandas boca abajo sobre placas de agar, marcando bandas en el forro de la placa para realizar un seguimiento de la orientación del original en la placa de TLC. Colocar una tira de TLC no utilizada en una placa de agar como control.
- Incubar las placas de agar, agar hacia abajo, en la cámara anaeróbica (24 hr, 39 ° C).
7. La visualización de las placas de agar bioensayan
- Con unas pinzas, extraer bandas de placas de agar mientras están en la cámara anaeróbica.
- Añadir 1% (w / v) de TErojo trazolium, preparada en agua, gota a gota sobre las superficies de las placas de agar. Deje que el color se desarrolle por lo menos durante 20 minutos, o hasta que la placa de control se vuelve completamente roja, antes de sacarlo de la cámara anaeróbica. Las bacterias anaerobias se comienzan a perder viabilidad después de la toma de la cámara anaeróbica, pero el color es estable durante más de 24 horas.
- Fotografiar bajo luz visible.
Resultados
Representante separaciones TLC de sílice de trébol rojo (Trifolium pratense cv. Kenland) extractos, que contienen compuestos fenólicos, se muestran en la Figura 2. Separación de extracto de trébol rojo en acetato de etilo-hexano (9:1, v / v), más de 8,5 cm, dio lugar a cinco bandas, una forma incompleta resuelto desde el origen (Figura 2A). Sin embargo, la Figura 2B demuestra que alrededor del doble de las bandas fueron reveladas cuando una muestra diferente de extracto de trébol rojo (de la misma variedad, pero se cultiva en una parcela independiente en la misma finca) se separó en una distancia mayor (15 cm en lugar de 8,5 cm) y con dos acontecimientos sucesivos en diferentes sistemas de disolventes. El cromatograma de la Figura 2B se desarrolló primero en acetato de etilo-hexano (9:1, v / v), y después se dejó secar y se separaron en acetato de etilo-metanol (78:22, v / v). Estos resultados demuestran que tanto el tamaño de la placa y la elección del sistema de disolvente (o serie de s disolventeISTEMAS) puede afectar el número de compuestos separados en un cromatograma. En este caso particular, la elución y la cromatografía líquida de alto rendimiento (HPLC) de bandas de otras separaciones de TLC de los mismos extractos confirmaron que los compuestos restantes en o cerca del origen consistían principalmente de compuestos fenólicos (ácidos fenólicos o isoflavonas) conjugados con restos polares tales como derivados de aminoácidos, azúcares, o ácido málico. Por el contrario, las isoflavonas no conjugados con restos polares emigraron más arriba en las placas de TLC 10.
Los resultados de un bioensayo de la placa de TLC se muestra en la Figura 2A con Clostridium sticklandii, una hiper bacteria productora de amoniaco ruminal (HAB), se muestran en la Figura 3. La adición de un 1% (w / v) de solución acuosa de rojo de tetrazolio a las placas de agar después de una incubación de 24 horas resultó en un color rojo brillante cuando se tiñeron las células vivas. La incubación de la banda 1 (biocanina A) y parte de baND 2 (formononetina) en agar bacterias cabeza de serie, resultó en una zona bien definida de inhibición (Figura 3A). Sin embargo, la incubación de el resto de la banda 2, junto con bandas 3 y 4, no inhibió el crecimiento bacteriano (Figura 3B). Estos resultados demostraron que la biochanina A era inhibidora a C. crecimiento sticklandii, pero no era formononetina.
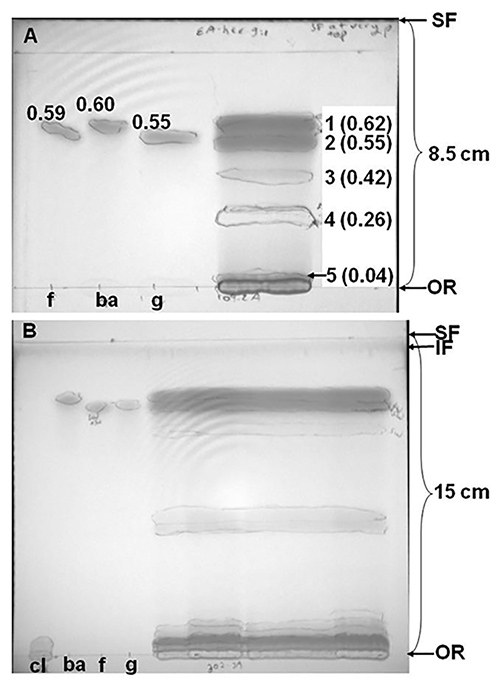
Figura 2. De sílice de capa fina de cromatografía (TLC) separaciones de extracto de Trifolium pratense cv. Kenland, desarrollado en (A) acetato de etilo-hexanos (9:1, v / v), o (b) que mismo disolvente seguido por el desarrollo en acetato de etilo-metanol (78:22, v / v). La distancia migrada por el disolvente entre el origen (O) y el frente de disolvente (SF) se indica cerca de lasoportes entre los dos límites. En la Figura 2B, el "frente de la impureza" (IF, la ubicación de las impurezas se trasladó hasta la placa de prelavado en disolventes polares) se ve como una banda oscura en la parte superior de la placa. Extractos, preparados 180-250 mg hojas de trébol rojo liofilizadas y tallos, se disolvieron en metanol y 10% de extracto (A) o 32% (B) se cargaron en placas de sílice. Normas cargadas fueron formononetina (f, 7,1 nmol), biocanina A (ba, 7,4 nmol), la genisteína (g, 9,8 nmol) y clovamide (Cl, Figura 2B solamente, 8,7 nmol). Las bandas se rodearon mientras se observa bajo una lámpara UV de mano a 254 nm (UV de onda corta) y 365 nm (longitud de onda larga UV). Una cámara digital se utiliza para fotografiar la placa bajo UV de onda corta. Los números a la derecha de las bandas de extracto de trébol en la Figura 2A se refieren a las zonas cortadas para bioensayos. Factores de retención (Rf, travele distanciad por banda / distancia recorrida por SF) se encuentran en paréntesis después de los números de la banda en la Figura 2A.

Figura 3. Resultados de la placa de TLC bioensayos de (A) la banda 1 y la parte superior resuelto de forma incompleta de la banda 2 de la placa de TLC de la figura 2A, y (B) bandas 2-4 de la misma placa de TLC. Las bandas se colocan boca abajo en un medio de HAB inoculó con Clostridium sticklandii y se incubó anaeróbicamente 24 horas a 39 ° C. Al final de este período de incubación, se extrajeron las bandas, y las placas de agar fueron teñidas con una solución acuosa de 1% (w / v) de tetrazolio de color rojo y se fotografiaron bajo luz visible.
Discusión
Este protocolo describe un método sencillo para la separación de un extracto en subconjuntos de compuestos y ensayando esos subconjuntos por contacto bioautografía. El método es bastante similar a uno utilizado por Chomnawang et al. 15 para la detección de metabolitos vegetales inhibitorios para las bacterias que causan la gonorrea. El tipo de bioautografía empleado para la detección de compuestos antimicrobianos de plantas depende de muchos factores, incluyendo el microorganismo de ensayo, la configuración de laboratorio, y las preferencias de la persona (s) de realizar el bioensayo. Contacto bioautografía, el método utilizado en este estudio, ha sido criticada por dependiendo de la capacidad de un compuesto para difundirse en medios inoculados 12. Las zonas de inhibición frente a los compuestos a concentraciones bajas, o con poca capacidad para difundirse en los medios de comunicación, pueden no ser detectables si se produce un crecimiento en el agar por debajo de la difusato. Además, una zona de inhibición creado por una banda puede extenderse más allá inicial de la bandalímites, por lo tanto posiblemente enmascarar zonas inhibitorias creados por compuestos vecinos 14. Sin embargo, el contacto bioautografía es un método fácil de usar, y la capacidad de apilar placas de Petri minimiza la cantidad de espacio necesario. Además, por el que se TLC bandas sobre agar elimina el riesgo de disolución de banda y la difusión que puede ocurrir cuando una placa de TLC se superpone con agar inoculado o rocía con el microorganismo de prueba.
La obtención de información de cualquiera de los tipos anteriores de bioautografía depende de las condiciones cromatográficas, la concentración de microorganismo de ensayo, y condiciones de cultivo / incubación. Resolución cromatográfica de las bandas antimicrobianas no es indispensable, pero la sensibilidad puede ser mayor para una banda bien resuelto 6. Las bandas pueden estar separados por el desarrollo en placas más largas o en múltiples sistemas de disolventes en una dimensión (Figura 2B), o en dos dimensiones girando una placa de TLC 90 grados antes del desarrolloen un segundo 16,19 solvente. Los compuestos polares pueden ser difíciles de separar sobre sílice sin utilizar mezclas de disolventes que contienen ácidos o bases. Estos pueden ser letal para el microorganismo de ensayo 12, aunque el uso de pequeñas cantidades de ácidos ha sido reportado 14,15. Sistemas de disolventes alternativos pueden incluir agua o metanol como componentes 20,21. Los compuestos polares también se pueden resolver en los diferentes tipos de placas de TLC, tales como placas recubiertas con C 18 adsorbente o celulosa microcristalina. Sin embargo, el crecimiento de 12 o sensibilidad a la agente de visualización 14 puede ser un impacto negativo en algunos de estos adsorbentes.
Muchas combinaciones diferentes de microorganismo de ensayo y medios de comunicación pueden ser utilizados para bioautografía. Sin embargo, varios factores deben ser considerados al seleccionar microorganismos y medios de comunicación. Los medios de comunicación debe ser probado para determinar que no hay componentes que reducen el tetrazolium sal y causar un cambio de color no biológica. El agar también debe ser lo suficientemente claro en color para proporcionar un contraste entre las células teñidas y sin teñir zonas de inhibición. Un microorganismo que sólo puede crecer en la superficie de agar se puede quitar junto con la banda TLC o lavado durante la tinción. Además, la selección de combinación microorganismo / medio que minimiza la producción de gas será reducir las burbujas en el agar. Rumen HAB crecer en un medio libre de carbohidratos carbonato de búfer con una mezcla de aminoácidos o péptidos como el sustrato de crecimiento. Las placas de agar son dorado claro y transparente. Cuando C. sticklandii se cultiva en el medio, la mayoría de los productos son solubles (ácidos grasos volátiles, amoníaco). Muy poco de gas se produce, lo que resulta en una placa de agar suave sin burbujas.
Este bioensayo tiene un par de aplicaciones potenciales. El tamaño de la zona de inhibición se puede utilizar como una estimación aproximada dela cantidad del compuesto inhibidor, ya que el radio de la zona de inhibidor es proporcional al logaritmo de la cantidad del compuesto que causa la inhibición 17,22. Tal vez el uso más común de TLC bioensayos placa es para reducir el rango de posibles compuestos antimicrobianos en un extracto de la planta. Después de zonas inhibidoras se identifican mediante un bioensayo, las regiones correspondientes sobre una placa de TLC duplicado se pueden eluir con un disolvente, tal como metanol o acetato de etilo, y se analizaron por HPLC con detección de espectroscopía ultravioleta para iniciar la caracterización de compuestos bioactivos 10,14.
Divulgaciones
La mención de nombres comerciales o productos comerciales en el artículo es el único fin de proporcionar información específica y no implica recomendación ni aprobación por el USDA. Los autores declaran no tener ningún interés financiero en competencia.
Agradecimientos
Damos las gracias al difunto Dr. Norma Taylor, Dept. Vegetal y Edafología de la Universidad de Kentucky, por permitirnos usar muestras de sus parcelas de trébol rojo para este estudio. Este proyecto fue financiado por el Departamento de Agricultura de los Estados Unidos.
Materiales
| Name | Company | Catalog Number | Comments |
| Silica F254 TLC plates, aluminum-backed, 0.2 mm thickness, 20 cm x 20 cm | EMD Chemicals | 5554/7 | These plates are coated with silica that contains an indicator fluorescing at 254 nm. Compounds absorbing at that wavelength appear dark on a fluorescent green background. Alternative sources include Analtech, Selecto Scientific, Fluka. Adsorbents other than silica may be needed. Plastic-backed plates may be suitable, depending on the solvents to be used. |
| Sharp, heavy-duty scissors | any sewing supply company | similar to Fiskars 175800-1002 | For cutting TLC plates. A paper cutter with a sharp blade can be used as well. Do not inhale silica dust. |
| Drying oven at 100 °C (mechanical convection) | Thermo Scientific | PR305225M | Quincy Lab, Inc, Chicago, IL (www.quincylab.com); Cascade Technical Sciences, Hillsboro, OR (www.cascadetek.com) |
| TLC chamber | Kimble Chase | 416180-0000 | Alternative sources: Aldrich. Pyrex beakers or preserving jars can be used for small plates (i.e. 5 cm x 10 cm). Cover with aluminum foil (jar lids may contain material extractable by solvent vapors). |
| 50 µl Syringe with flat needle tip | Hamilton | 80965 | For loading amounts of standard or sample exceeding 5-10 µl. Alternative sources are equivalent. |
| Micropipettes | Drummond | 2-000-001 | For loading small amounts of standards or samples. Alternative sources: VWR. Also, Pasteur pipets can be stretched to a thinner diameter with a butane torch. |
| Filter paper (#1 grade) | Whatman | 1001 917 | Serves as a chamber wick. Other grades of filter paper are OK. This size can be trimmed for the chambers holding 20 cm x 20 cm plates. |
| Beaker tongs | Fisher Scientific | 15-186 | For putting plates in and out of a large TLC chamber. Alternate sources: VWR |
| Flat-edge forceps | Fisher Scientific | 10-275 | For putting plates in and out of a small chamber. Alternate sources: VWR |
| Small portable UV lamp with 4 W or 6 W bulbs for short- and long-wave UV light illumination (254 and 365 nm, respectively) | Ultraviolet Products | 95-0271-01 | Alternate sources: Spectronics Corporation (www.spectroline.net) |
| Viewing cabinet for use with hand-held UV lamp | Ultraviolet Products | Chromato-Vue C-10E | UV-active bands are more easily circled if plates can be set in here. Alternate sources: Spectronics Corporation. |
| Photodocumentation system with overhead UV lamp and visible lamp | Kodak | Gel Logic 200 | Alternate sources: Ultraviolet Products (www.uvp.com). See protocol for homemade alternative. |
| Anaerobic Chamber, Type A, Vinyl | Coy | 7150000 | This chamber is appropriate for anaerobic bacteria, like Clostridium sticklandii, as described. However, growth conditions must be tailored to organism used in the assay. A biosafety cabinet and other precautions should be taken if pathogenic organisms are used. Alternate sources: Anaerobe Systems, BioRad, Plas Labs, others |
| Tetrazolium red | Sigma-Aldrich | T8877 | Alternate sources: MP Biomedicals, Santa Cruz Biotechnology, Alfa Aesar |
| Ingredients for HAB media | |||
| Pyridoxamine · 2HCl | Sigma-Aldrich | P9380 | For this and for all the other reagents in this table, alternative sources are equivalent. |
| Riboflavin | Sigma-Aldrich | R4500 | |
| Thiamine HCl | Sigma-Aldrich | T3902 | |
| Nicotinamide | Sigma-Aldrich | N3376 | |
| Calcium D-Pantothenate | Sigma-Aldrich | C8731 | |
| Lipoic Acid | Sigma-Aldrich | T5625 | |
| p-Aminobenzoic acid | Sigma-Aldrich | A9878 | |
| Folic acid | Sigma-Aldrich | F8798 | |
| Biotin | Sigma-Aldrich | B4639 | |
| Cobalamine | Sigma-Aldrich | C3607 | |
| Pyridoxal HCl | Sigma-Aldrich | P9130 | |
| Pyridoxine | Sigma-Aldrich | P5669 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Iron sulfate · 7H2O | Sigma-Aldrich | F8263 | |
| Zinc sulfate · 7H2O | Sigma-Aldrich | Z0251 | |
| Manganese chloride · 4H2O | Sigma-Aldrich | M8054 | |
| Boric acid | Sigma-Aldrich | B6768 | |
| Cobalt chloride · 6H2O | Sigma-Aldrich | C8661 | |
| Copper chloride · 2H2O | Sigma-Aldrich | 459097 | |
| Nickel chloride · 6H2O | Sigma-Aldrich | 203866 | |
| Sodium molybdate · 2H2O | Sigma-Aldrich | 331058 | |
| Trypticase (Pancreatic digest of casein) | Thermo Fisher | B11921 | |
| Potassium phosphate monobasic anhydrous | Thermo Fisher | P284 | |
| Sodium carbonate · H2O | Thermo Fisher | S636 | |
| Agar | Thermo Fisher | 50841063 | |
| Magnesium sulfate · 6H2O | Thermo Fisher | 7791-18-6 | |
| Calcium chloride · 2H2O | Thermo Fisher | BP510 | |
| Cysteine HCl | Thermo Fisher | 19464780 | |
| Potassium phosphate dibasic anhydrous | Thermo Fisher | P290 | |
| Sodium chloride | Thermo Fisher | BP358 | |
Referencias
- Stahl, E., Ashworth, M. R. F. Thin-layer chromatography. , Springer. (1969).
- Marston, A. Thin-layer chromatography with biological detection in phytochemistry. J. Chromatogr. A. 1218 (19), 2676-2683 Forthcoming.
- Homans, A. L., Fuchs, A. Direct bioautography on thin-layer chromatograms as a method for detecting fungitoxic substances. J. Chromatogr. 51, 327-329 Forthcoming.
- Lund, B. M., Lyon, G. D. Detection of inhibitors of Erwinia carotovora and E. herbicola on thin-layer chromatograms. J. Chromatogr. 110, 193-196 (1975).
- Betina, V. Bioautography in paper and thin-layer chromatography and its scope in the antibiotic field. J. Chromatogr. A. 78, 41-51 (1973).
- Weltzien, H. C. Ein biologischer Test für fungizide Substanzen auf dem Papierchromatogramm. Naturwissenschaften. 45, 288-289 (1958).
- Khurram, M., Khan, A. M., Hameed, A., Abbas, N., Quayum, A., Inayat, H. Antibacterial activities of Dodonaea viscosa using contact bioautography technique. Molecules. 14 (3), 1332-1341 (2009).
- Khurram, M., et al. Evaluation of anticandidal potential of Quercus baloot Griff. using contact bioautography technique. Afr. J. Pharm. Pharmacol. 5 (12), 1538-1542 (2012).
- Robinson, T. The Organic Constituents of Higher Plants. , Burgess Publishing Co. (1963).
- Kagan, I. A., Flythe, M. D. Factors affecting the separation and bioactivity of red clover (Trifolium pratense) extracts assayed against Clostridium sticklandii, a ruminal hyper ammonia-producing bacterium. Nat. Prod. Commun. 7 (12), 1605-1608 (2012).
- Mattila, P., Kumpulainen, J. Determination of free and total phenolic acids in plant-derived foods by HPLC with diode-array detection. J. Agric. Food Chem. 50 (13), 3660-3667 (2002).
- Hamburger, M. O., Cordell, G. A. A direct bioautographic TLC assay for compounds possessing antibacterial activity. J. Nat. Prod. 50 (1), 19-22 (1987).
- Flythe, M., Kagan, I. Antimicrobial effect of red clover (Trifolium pratense) phenolic extract on the ruminal hyper ammonia-producing bacterium, Clostridium sticklandii. Curr. Microbiol. 61, 125-131 Forthcoming.
- Rahalison, L., Hamburger, M., Hostettmann, K., Monod, M., Frenk, E. A bioautographic agar overlay method for the detection of antifungal compounds from higher plants. Phytochem. Anal. 2 (5), 199-203 (1991).
- Chomnawang, M. T., Trinapakul, C., Gritsanapan, W. In vitro antigonococcal activity of Coscinium fenestratum stem extract. J. Ethnopharmacol. 122, 445-449 (2009).
- Stahl, E., Kaldewey, H. Spurenanalyse physiologisch aktiver, einfacher Indolderivate. Hoppe-Seyler’s Z. Physiol. Chem. 323, 182-191 Forthcoming.
- Kagan, I. A., Hammerschmidt, R. Arabidopsis ecotype variability in camalexin production and reaction to infection by Alternaria brassicicola. J. Chem. Ecol. 28 (11), 2121-2140 (2002).
- Kline, R. M., Golab, T. A simple technique in developing thin-layer bioautographs. J. Chromatogr. 18, 409-411 (1965).
- Wedge, D. E., Nagle, D. G. A new 2D-TLC bioautography method for the discovery of novel antifungal agents to control plant pathogens. J. Nat. Prod. 63 (8), 1050-1054 (2000).
- Beck, A. B., Knox, J. R. The acylated isoflavone glycosides from subterranean clover and red clover. Aust. J. Chem. 24 (7), 1509-1518 (1971).
- Kahn, R. A., Bak, S., Svendsen, I., Halkier, B. A., Møller, B. L. Isolation and reconstitution of cytochrome P450ox and in vitro reconstitution of the entire biosynthetic pathway of the cyanogenic glucoside dhurrin from sorghum. Plant Physiol. 115 (4), (1997).
- Peterson, C. A., Edgington, L. V. Quantitative estimation of the fungicide benomyl using a bioautograph technique. J. Agr. Food Chem. 17 (4), 898-899 (1969).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados