Method Article
Dünnschicht-Chromatographie-(TLC) Trennungen und Bioassays der Pflanzenextrakte antimikrobielle Verbindungen zu identifizieren
In diesem Artikel
Zusammenfassung
Methoden werden für die Dünnschicht-Chromatographie (DC) Trennung von Pflanzenextrakten und Kontakt Bioautographie antibakterielle Metaboliten zu identifizieren beschrieben. Die Methoden sind für das Screening von Rotklee phenolischen Verbindungen Hemmung hyper Ammoniak-produzierende Bakterien (HAB) stammt aus dem Rinder-Pansen aufgebracht.
Zusammenfassung
Ein gemeinsamer Bildschirm für Pflanzen antimikrobielle Verbindungen besteht aus der Trennung von Pflanzenextrakten Papier oder Dünnschichtchromatographie (TLC oder PC), Aussetzen der Chromatogramme mikrobiellen Suspensionen (z. B. Pilze und Bakterien in der Brühe oder Agar), so dass genügend Zeit für die Mikroben wachsen in einer feuchten Umgebung und Visualisieren Zonen ohne mikrobielle Wachstum. Die Wirksamkeit dieser Screening-Methode, wie Bioautographie bekannt, hängt sowohl von der Qualität der chromatographischen Trennung und der Sorgfalt, mit mikrobiellen Kulturbedingungen behandelt. Dieses Papier beschreibt Standardprotokolle für TLC und Kontakt Bioautographie mit einer neuen Anwendung zu Säure-Fermentation von Bakterien Aminosäuren. Der Extrakt wird über flexible (Aluminium-backed) Kieselgel-DC-Platten getrennt, und die Banden werden unter UV-(UV-) Licht sichtbar gemacht. Zonen werden auf Agar mit dem Testmikroorganismus beimpft geschnitten und inkubiert Gesicht nach unten. Hemmende Banden werden durch Anfärben der Agar-Platte sichtbars mit Tetrazolium rot. Das Verfahren wird auf die Trennung von Rotklee (Trifolium pratense cv. Kenland) phenolischen Verbindungen und ihre Screening-Aktivität gegen Clostridium sticklandii, einem hyper Ammoniak-produzierenden Bakterium (HAB), die ursprünglich aus der Rinder-Pansen aufgebracht. Die TLC-Verfahren anzuwenden, um viele Arten von Pflanzenextrakten und anderen Bakterienspezies (aerob oder anaerob), sowie Pilze, können als Testorganismen verwendet werden, wenn Kulturbedingungen verändert werden, um die Wachstumsanforderungen der Art passen.
Einleitung
Untersuchung auf antimikrobielle Verbindungen in Pflanzen erfordert die Trennung der Komponenten eines Pflanzenextrakts, Belichten eines Testmikroorganismus zu diesen Komponenten und Bestimmen, ob das Wachstum des Mikroorganismus wird von irgendeiner der Verbindungen gehemmt. Trennungen von Papier-oder Dünnschichtchromatographie (TLC oder PC) sind praktisch, weil viele Verbindungen können auf einer ebenen Oberfläche getrennt werden. Trennung auf Polarität basiert, wobei einige Verbindungen feste Bindung an das Adsorbens (Zellulose im Fall von PC, und eine Vielzahl von Adsorptionsmitteln bei der TLC) und die Migration unter anderem 1. Fig. 1 stellt ein Beispiel für die relativen Positionen der polare und unpolare phenolische Verbindungen nach Trennung auf einer Silica-TLC-Platte.
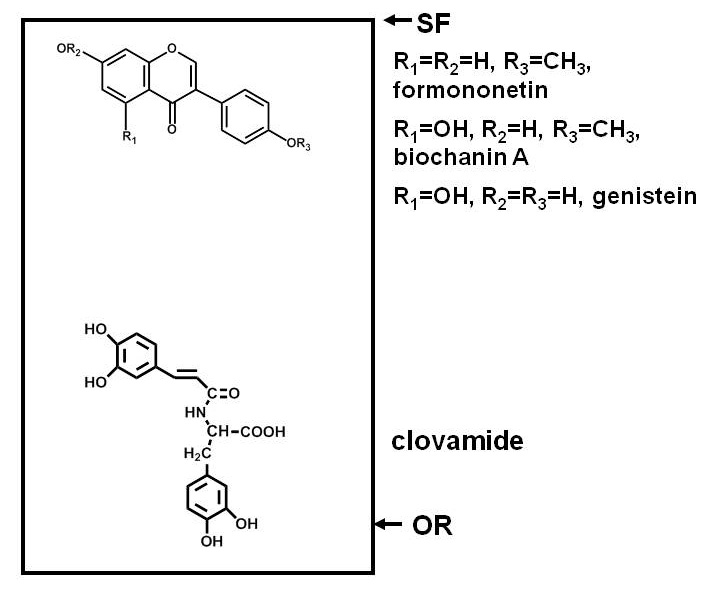
Fig. 1 ist. Schematische Darstellung Verteilungen von Verbindungen unterschiedlicher Polarität nach der Trennung auf einer Silica-Dünnschicht-Chromatographie (DC)-Platte. Phenolverbindungen von Rotklee (Trifolium pratense L.) als Beispiel verwendet. Polare Verbindungen, wie clovamide, haben eine starke Affinität zu einem polaren Adsorbens wie Siliciumdioxid und bleiben in der Nähe des Ursprungs (OR), während weniger polaren Verbindungen, wie die drei Isoflavone in der Nähe der Lösungsmittelfront (SF), Partition leichter in den Lösungsmitteln (es sei denn, das Wasser, Säuren oder Basen enthalten sind weniger polar als Kieselsäure) und wandern weiter bis der Platte.
Nach der Abtrennung eines Extrakts auf eine DC-Platte können Testmikroorganismen zu allen Verbindungen auf der Platte freigelegt werden, und beschleunigt somit die Identifizierung der aktiven Komponenten eines Extraktes 2. Wenn ein Pilz-oder Bakterienkultur wird dem Chromatogramm ausgesetzt ist, wird das mikrobielle Wachstum überall, außer in Bereichen mit Wachstums-Inhibitor auftreteny-Verbindungen. Inhibitionszonen dann kann durch die Beobachtung der Kontrast zwischen Mycel-Wachstum und die Wachstumsfreie Bereiche, wenn Pilze angewendet wurden 3 oder durch Besprühen mit Verbindungen, die Farbe ändern, wenn reduziert oder durch lebende Zellen 4 hydrolysiert visualisiert werden. Obwohl die Verwendung von Papier-oder Dünnschicht-Chromatogramme antimikrobiellen Assays wurde zuerst 5 Antibiotika und Fungizide 3,6 aufgebracht, Pflanzenextrakte werden jetzt häufig für antimikrobielle Verbindungen mit diesem Verfahren, das oft als Bioautographie bezeichnet gescreent. Die beschriebenen Protokolle hierin Bioautographie von Dünnschichtchromatogrammen gelten. TLC wird weithin verwendet, weil es relativ schnell und kann auf verschiedene Adsorbentien (z. B. Siliciumdioxid, Stärke, Aluminiumoxid), sowie eine gute Auflösung und Empfindlichkeit 1 durchgeführt werden.
Pflanzenextrakte können für TLC auf viele Arten hergestellt werden. Gängige Methoden sind extraPflanzenMaterial in alcohol-Wasser-Gemische, wie 80% Ethanol 7,8, gegebenenfalls unter Zusatz von Säure oder Base 9. Nach einer Extraktion in solchen Lösungsmitteln, die etwas Wasser enthalten und gegebenenfalls sauren oder basischen, müssen Extrakte konzentriert werden, so dass sie auf TLC-Platten in einem minimalen Volumen angewendet werden. Die Konzentration der Alkohol-Wasser-Extrakte können durch Aufteilung mit Wasser nicht mischbaren organischen Lösungsmitteln 8 oder mit einem Gemisch solcher Lösungsmittel, wie Ethylacetat-Ethylether (1:1, v / v) 10,11 erreicht werden. Verschiedenen Pflanzenmetabolite werden in verschiedenen organischen Lösungsmitteln extrahiert werden, in Abhängigkeit von ihrer Polarität. Um sicherzustellen, dass die Pflanze organischen Säuren oder Basen werden bei dieser Stufe in organischen Lösungsmitteln extrahiert werden, kann der pH-Wert einer Alkohol-Wasser-Extrakt erhöht oder mit einer wasserlöslichen Säure oder Base zu dissoziierten Analyten in ihre nondissociated Formen, die dann konvertiert abgesenkt löslich in organischen Lösungsmitteln 9 neutral. Die organische Phase kann dann e seinunter Vakuum oder unter Stickstoff vaporated und auf das gewünschte Volumen für die DC eingestellt. Der pH-Wert des Extrakts ist unwahrscheinlich letal Bioassay Mikroorganismen aufgrund der Partitionierung des Analyten in neutralen Lösungsmittel, kleine Endvolumen und Eindampfen des Extraktes auf der DC-Platte vor der Trennung ist.
Beide Pilze und Bakterien werden als Test Mikroorganismen in Bioautographie von Pflanzenextrakten eingesetzt 2. Sporen einiger Pilze wie Cladosporium cucumerinum, keimen auf TLC-Platten (abgesehen von den Bereichen mit Inhibitorverbindungen), wenn auf Platten in einer Nährlösung besprüht und in einer feuchten Umgebung für mehrere Tage 3 inkubiert. Die dunkle Myzel von C. cucumerinum auf nichthemmenden Zonen bietet einen scharfen Kontrast zu den Zonen frei von Myzel-Wachstum. Obwohl Bakterien zu Dünnschicht-Chromatographie (DC)-Platten in der gleichen Weise 4,12 angewendet wurde, werden die Bakterien auch über TLC gegossenPlattenoberflächen in Agar überlagert 13,14. Hefen, wie Candida albicans, in Agar-Overlay sowie 14 aufgebracht werden. Alternativ DC-Platten können dem Gesicht nach unten auf Agar mit Bakterien oder Hefe 10,15 8, ein Verfahren, wie Kontakt Bioautographie 2 bekannt geimpft platziert werden.
Wir beschreiben ein Verfahren zur Kontakt Bioautographie für antimikrobielle phenolische Verbindungen aus Rotklee (Trifolium pratense cv. Kenland) zu screenen. Das Testmikroorganismus Clostridium sticklandii eine Pansen hyper Ammoniak-produzierenden Bakterium (HAB) und anaerobe verpflichten. Obwohl die verwendeten Abstände nicht alle Komponenten des Extrakts zu beheben, erleichtern sie die Identifizierung von Bereichen der antimikrobiellen Aktivität, wodurch Verengung der Pool von möglichen antimikrobielle Verbindungen. Das Protokoll nutzt Standardverfahren für die DC ein. Das Protokoll beschreibt auch einige der Techniken zur Kultivierung erforderlichen VerGate Anaerobier für einen solchen Test ein Verwendungskontakt Bioautographie 15 und einer Visualisierungsmethode mit einem Tetrazolium-Salz, das lebende Zellen 2,4 färbt.
Protokoll
1. Herstellung von Pflanzenextrakt
- Siehe Kagan und Flythe 10 für die Extraktion von phenolischen Verbindungen aus Trifolium pratense cv. Kenland.
- Zum anderen Verbindungen in andere Pflanzen zu extrahieren, überprüfen Sie die phytochemical Analyse Literatur für Pflanzen oder Metaboliten-spezifischen Extraktionsmethoden (viele sind beschrieben), oder schauen Sie für Protokolle wie die von Khurram et al. 7,8, die viele Verbindungen mit einem breiten isolieren Bereich von Polaritäten.
2. Herstellung von Dünnschicht-Platten
- Saubere DC-Platten durch die Entwicklung in einem oder mehreren polaren, neutralen Lösungsmittel, um adsorbierte Verunreinigungen von der Zone der Entwicklung zu bewegen.
- In einer Abzugshaube, bereiten genug Reinigungsmittel (zB 15-100 ml Ethylacetat-Methanol 2:1, V / V), um den Boden der TLC-Entwicklungskammer sowie den unteren Rand einer DC-Platte, wenn Satz decken im Inneren der Kammer.
- Verwenden Sie handelsüblichen Glas TLC Entwicklungskammern (verschiedene Größen, mit Deckel) oder Folie abgedeckten Pyrex Bechergläser oder Einmachgläser.
- Mit einer Schere aus Aluminium-oder Kunststoff-Backed (flexibel) Kieselgel-Platten, die in verschiedenen Größen (20 cm x 20 cm und kleiner) zu kommen, um die verfügbare Entwicklungskammer passen geschnitten. (Vorsicht: Kieselsäure kann Lungenschäden verursachen beim Einatmen Arbeiten in einem Abzug, und Griff DC-Platten mit Handschuhen zu vermeiden, Hautöle auf der Kieselsäure.).
- Legen Sie die Platten in die Kammer, mit den Spitzen lehnte sich gegen den Kammerwänden. Die Platten sollten sich nicht berühren. Decken Sie die Kammer und ließ das Lösungsmittel bewegen sich die Platte durch Kapillarwirkung.
- Als Lösungsmittel die obere der Platten erreicht hat, entfernen Platten von Kammer-und arrangieren in einer stehenden Position innerhalb der Abzug bis das Lösungsmittel verdampft ist.
- Prüfen Sie, ob Verunreinigungen in der Nähe der Spitze der DC-Platte durch die Suche nach einem gelben Band unter sichtbarem migriertLicht, oder eine fluoreszierende Bande unter UV-Licht (UV) (siehe die "Verunreinigung vor" oder IF in Abbildung 2B). Wenn die Mehrheit der Platte noch einen Gelbstich, wiederholen Sie den Reinigungsvorgang.
- Nach DC-Platten aus der Kammer zu entfernen, entsorgen Sie die Lösungsmittel. Lassen Restlösemittel vollständig, bevor Sie die Kammer für Protokoll 2 verdampfen.
- So entfernen Restfeuchte, die die Migration von Verbindungen auf Kieselgel 16 beeinflussen können, stütze die Platten aufrecht in einem Trockenofen bei 100 ° C (10-15 min für eine 20 cm x 20 cm Platte, und 5 min für 7 cm x 10 cm-Platten ).
- Wenn eine 100 º C Trockenofen nicht verfügbar ist, Heizplatten für eine längere Zeit bei niedrigeren Temperaturen (z. B. 40 Minuten bei 60 ° C).
- Nachdem die Platten trocken sind, lassen Sie sie auf Umgebungstemperatur vor dem Laden abkühlen.
3. Vorbereitung der Entwicklung von Kammern für Extract Trennung
- Mit einer Schere ein Stück Filterpapier leicht unter Kammerhöhe, und etwa die Hälfte der Kammer Umfang in der Breite geschnitten. Dieses Papier dient als Docht zu zeichnen Lösungsmittel die Kammerwand und die Sättigung der Kammer mit Lösungsmitteldämpfen und verbessert so die Reproduzierbarkeit der Trennungen ein.
- In einem Abzug, Mischungslösemittel (Ethylacetat-Methanol 4:1 v / v, für diese Studie). Gießen Sie Lösungsmittel-Gemisch in die Kammer und zu decken. Warten Sie, bis die gesamte Docht nass mit Lösungsmittel, was Kammersättigung, um Platten in die Kammer gestellt.
4. Laden und Entwicklung von DC-Platten
- Leicht markieren den Ursprung mit Bleistift. Wenn die DC-Platte Adsorbens ist weich und leicht beschädigt, stellen Marken Kanten. Verbindungen oberhalb der Oberfläche des Entwicklungsmittel, wenn Platten in der TLC-Kammer eingeführt werden.
- Auflösen Extrakte genügend organische Lösungsmittel (in diesem Fall Methanol), um eine konzentrierte Lösung anstelle eines trüben habenFederung.
- Laden Sie die Proben und Standards als schmale Bänder mit einer Mikroliter-Spritze oder Kapillare Mikropipetten, so dass eine 1 cm Rand an den Seiten der Platte. Lassen Sie die Bänder, um zu trocknen (schüren die Platte oder Einlegen in einer Abzugshaube hilft).
- Wenn eine größere Konzentration der Probe wird auf einer Platte, "Überdrucken" von dem Laden der Proben wieder auf die getrocknete Bänder nötig.
- Mit einer Pinzette oder einer Zange, setzen Platte (n) in der gesättigten DC-Kammer. Platten sollten nicht den Docht berührt, da dies zu den Platten an Kontaktpunkten bereitzustellen Lösungsmittel unter Änderung der Pfad der Verbindung Migration. Decken Sie Kammer und lassen Platten zu entwickeln.
5. Herstellung von Platten für Bioassay
- Entfernen Platte (n) von TLC Tank, bevor die Lösungsmittelfront die Oberkante der Platte erreicht, und markieren Sie die Höhe der Mittelfront mit einem Bleistift. Lassen Platte trocken in Abzug.
- Entwickeln Sie alle restlichen DC-Platten in der gleichen DC-Kammer, die ge istnerally nutzbar für einen ganzen Tag, wenn geschlossen gehalten. Erneuern Lösungsmittelgemisch für DC-Kammer, wenn die Menge des Lösungsmittels in der Kammer abnimmt, insbesondere.
- Nach Platten trocken sind, Banden sichtbar unter sichtbarem oder UV-Licht, und abzugrenzen Bands mit einem Bleistift. Ein Sichtkammer mit einem tragbaren UV-Lampe ist bequem, vor allem, wenn die Lampe an beiden Verbindungen 254 nm (kurzwelliges UV) und 365 nm (langwelliges UV) zu erfassen.
Hinweis: Zu diesem Zeitpunkt oder nach dem nächsten Schritt können Platten in Kunststofffolie eingewickelt werden, mit Folie abgedeckt und bei -20 ° C gelagert Die maximale Lagerzeit ist abhängig von Verbindung Stabilität. Da Kieselsäure ist nicht neutral, können einige Verbindungen, während auf der DC-Platte abzubauen. - Fotografieren oder zeichnen Platten.
- Verwenden Sie eine Fotodokumentation Gel-System, wenn man mit Overhead-UV-und / oder sichtbares Licht ausgestattet zur Verfügung steht.
- Wenn keine kommerzielle Fotodokumentation System verfügbar ist, fotografieren Platten innerhalb einer Box ausgekleidet mit dunklen Papier oder Stoff, with eine Kamera auf ein Stativ und einen tragbaren UV-Licht eingespannt zu einem Ring stehen 17. Beim Fotografieren von Platten, die keine Fluoreszenzindikator, verwenden Sie einen Blaulichtfilter über der Kameralinse zu Band 17 Aussehen zu verbessern.
- Um bei der Charakterisierung von Bands zu unterstützen, berechnen Retentionsfaktor (R f)-Werte durch Messen von Entfernungen durch Verbindung und Lösungsmittelfront gereist und Aufteilung der ehemaligen von dieser (Abbildung 2A).
6. Bakterielle Kultur und Assay
- Vorbereiten und impfen Medien unter anaeroben Bedingungen. Das in diesem Fall verwendete Kultur war Clostridium-Stamm sticklandii SR, die aus der Kultur Sammlung von James B. Russell, Cornell University, Ithaca, NY erhalten.
- Siehe Flythe Kagan und 13 und die Materialliste für eine Beschreibung der HAB Medien.
- Die Kultur exponentielle oder stationären Phase. Verwenden Sie sterile anaeroben techniques bei der Arbeit mit anaeroben Mikroorganismen.
- Inokulieren die Kultur (1% v / v) in geschmolzenem Agar, nachdem die Temperatur des Agar (0,75% w / v) wurde auf unter 60 ° C gesenkt Vorsichtig mischen und sofort in einer anaeroben Kammer zu bringen (95% CO 2 -5% H 2-Atmosphäre für HAB-Medien) zu gießen.
- Gießen Sie in 15 mm x 100 mm Petrischalen aus Kunststoff und lassen sich zu verfestigen.
- Mit Schere, schneiden Sie die DC-Platte in Zonen-Band (en), die von Interesse sind. Legen Bands Gesicht nach unten auf Agar-Platten, Markierungsstreifen auf der Kennzeichenträger zu verfolgen ursprünglichen Ausrichtung auf DC-Platte zu halten. Legen Sie eine unbenutzte TLC Streifen auf einer Agar-Platte als Kontrolle.
- Inkubieren Agar-Platten, Agar Seite nach unten in der anaeroben Kammer (24 h, 39 ° C).
7. Visualisierung von Bioassay-Agar-Platten
- Mit Pinzette Bands aus Agar-Platten, während sie in der anaeroben Kammer sind.
- 1% (w / v) tetrazolium rot, in Wasser, tropfenweise auf die Oberfläche der Agar-Platten. Lassen Sie die Farbe, die für mindestens 20 min zu entwickeln, oder bis der Steuerplatte schaltet sich komplett rot, vor dem Entfernen aus dem anaeroben Kammer. Die anaeroben Bakterien beginnt Fähigkeit unmittelbar nach der Entnahme aus der anaeroben Kammer zu verlieren, aber die Farbe ist für mehr als 24 h stabil.
- Fotografieren unter sichtbarem Licht.
Ergebnisse
Repräsentative Kieselgel-DC-Trennungen von Rotklee (Trifolium pratense cv. Kenland) Extrakte, mit phenolischen Verbindungen, sind in Abbildung 2 dargestellt. Trennung von Rotklee-Extrakt in Ethylacetat-Hexan (9:1, v / v), mehr als 8,5 cm, ergab fünf Bänder, eines unvollständig vom Ursprung gelöst (Fig. 2A). Allerdings zeigt, 2B, dass etwa doppelt so viele Bands offenbart wurden, wenn eine andere Probe von Rotklee-Extrakt (aus der gleichen Sorte, aber in einem separaten Grundstück in der gleichen Farm angebaut) wurde über eine größere Distanz 15 cm statt getrennt (8,5 cm) und mit zwei aufeinanderfolgenden Entwicklungen in den verschiedenen Lösungsmittelsystemen. Das Chromatogramm von Fig. 2B wurde in Ethylacetat-Hexan entwickelt (9:1, v / v), und dann trocknen gelassen und in Ethylacetat-Methanol abgetrennt (78:22, v / v). Diese Ergebnisse zeigen, dass beide Plattengröße und Wahl des Lösungsmittels (oder der Lösungsmittelreihe systems) kann die Anzahl von Verbindungen auf einem Chromatogramm getrennt beeinflussen. In diesem besonderen Fall, Elution und Hochleistungs-Flüssigkeits-Chromatographie (HPLC) von Bändern aus anderen TLC Trennungen der gleichen Extrakten bestätigt, daß die an oder nahe dem Ursprung übrigen Verbindungen in erster Linie aus phenolischen Verbindungen (Phenol Säuren oder Isoflavone) zu polaren Gruppierungen konjugiert wie Aminosäurederivaten, Zucker oder Äpfelsäure. Im Gegensatz dazu migriert Isoflavone nicht polaren Gruppierungen konjugiert weiter oben den DC-Platten 10.
Die Ergebnisse eines Bioassays des in 2A mit Clostridium sticklandii eine Pansenhyper Ammoniak produzierenden Bakteriums (HAB), TLC-Platte dargestellt sind in Fig. 3 gezeigt. Hinzufügen einer 1% (w / v) wässrige Lösung von Tetrazolium rot auf die Agar-Platten nach einer 24-stündigen Inkubation führte zu einer leuchtend roten Farbe, wenn lebende Zellen wurden gefärbt. Inkubation von Band 1 (Biochanin A) und ein Teil der ba2 nd (Formononetin) auf Bakterien beimpften Agar zu einer gut definierten Zone der Hemmung (Fig. 3A). Jedoch Inkubation des restlichen Band 2 zusammen mit Bändern 3 und 4, nicht bakterielle Wachstum (3B) zu hemmen. Diese Ergebnisse zeigten, dass Biochanin A war inhibitorisch C. sticklandii Wachstum, aber Formononetin war es nicht.
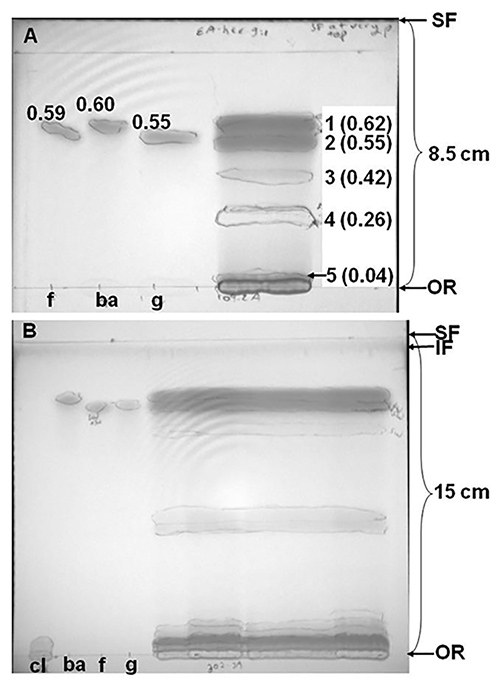
Abbildung 2. Silica Dünnschicht-Chromatographie (DC) Trennung von Extrakt von Trifolium pratense cv. Kenland, in (A) Ethylacetat-Hexan (9:1, v / v) oder (B) das gleiche Lösungsmittel, gefolgt von Entwicklung in Ethylacetat-Methanol (78:22, v / v). Der Abstand migriert entwickelten das Lösungsmittel zwischen dem Ursprung (OR) und die Lösungsmittelfront (SF) in der Nähe der angezeigteKlammern zwischen diesen beiden Grenzen. In 2B der "Verunreinigung Front" (IF, die Lage der Verunreinigungen bewegt sich die Platte durch Vorwäsche in polaren Lösemitteln) als dunkles Band in der Nähe der Oberseite der Platte gesehen. Extrakte, 180 bis 250 mg gefriergetrockneter Rotklee Blätter hergestellt und Stiele wurden in Methanol gelöst und mit 10%-Extrakt (A) oder 32% (B) wurde auf Silica-Platten geladen. Standards geladen wurden Formononetin (f, 7,1 nmol), Biochanin A (ba, 7,4 nmol), Genistein (g, 9,8 nmol) und clovamide (Cl, 2B nur 8,7 nmol). Bands wurden eingekreist, während unter einer UV-Handlampe bei 254 nm (kurzwellige UV) und 365 nm (langwelliges UV) angesehen. Eine Digitalkamera wurde verwendet, um die Platte zu fotografieren unter kurzwelligem UV-Licht. Die Zahlen auf der rechten Seite der Klee-Extrakt Bands in 2A beziehen sich auf die Zonen ausgeschnitten für Biotests. Retentionsfaktoren (Rf, Entfernung traveled durch Band / Distanz von SF gereist) sind in Klammern nach Bandnummern in 2A.

Abbildung 3. Ergebnisse der DC-Platte Biotests (A) Band 1 und der nicht vollständig gelöst oberen Teil der Band 2 von der DC-Platte von 2A und (B) 2-4 Bands aus der gleichen DC-Platte. Bands wurden Gesicht festgelegt HAB auf Medium mit Clostridium sticklandii beimpft und bei 39 ° C inkubiert anaerob 24 h Am Ende dieser Inkubationszeit wurden die Streifen entfernt, und die Agar-Platten wurden mit einer wässrigen Lösung von 1% (w / v) Tetrazolium-Rot und unter sichtbarem Licht fotografiert gefärbt.
Diskussion
Dieses Protokoll beschreibt ein einfaches Verfahren zum Trennen eines Extrakts in Untergruppen von Verbindungen und Testen dieser Untermengen von Kontakt Bioautographie. Die Methode ist ganz ähnlich wie ein von Chomnawang et al. Verwendet werden, um für 15 Pflanzenstoffe hemmend auf Gonorrhoe-Bakterien zu untersuchen. Die Art der Bioautographie zu Bildschirm für die antimikrobielle Pflanzenstoffe verwendet, hängt von vielen Faktoren, einschließlich der Testmikroorganismus, der Laboraufbau und den Vorlieben der Person (en) die Durchführung der Bioassay. Kontakt Bioautographie, die in dieser Studie verwendete Verfahren wurde für je auf die Fähigkeit einer Verbindung, in inokulierten Medien 12 diffundieren kritisiert. Hemmzonen gegenüber Verbindungen bei niedrigen Konzentrationen oder mit wenig Fähigkeit, in Medien zu diffundieren kann nicht nachweisbar sein, wenn das Wachstum in dem Agar unter der Diffusat auftritt. Auch kann eine Zone der Hemmung erstellt von einem Band über den anfänglichen der Band verteiltGrenzen, so möglicherweise Maskierung hemmende Zonen, die von benachbarten Verbindungen 14. Allerdings ist Kontakt Bioautographie eine einfache Methode zu verwenden, und die Fähigkeit, Petrischalen stapeln die Menge an Speicherplatz benötigt minimiert. Zusätzlich zur TLC Bands auf Agar eliminiert das Risiko von Band Auflösung und verbreiten die auftreten können, wenn ein DC-Platte mit beimpften Agar überlagert oder mit dem Testmikroorganismus versprüht.
Erhalten von Informationen von einer der oben genannten Arten von Bioautographie hängt von den chromatographischen Bedingungen, Testkeimkonzentration und Kultur / Inkubationsbedingungen. Chromatographische Auflösung von antimikrobiellen Bändern ist nicht unentbehrlich, aber die Empfindlichkeit größer für einen gut aufgelöste Band 6 sein. Bänder können durch die Entwicklung von mehr Platten oder in mehreren Lösungsmittelsystemen in einer Dimension (Fig. 2B) oder in zwei Dimensionen, indem eine DC-Platte 90 Grad vor der Entwicklung voneinander getrennt werden,in einem zweiten Lösungsmittel 16,19. Polare Verbindungen kann schwierig sein, auf Kieselgel ohne Lösungsmittelgemische, die Säuren oder Basen enthalten, zu trennen. Diese können tödlich Testmikroorganismus 12 sein, obwohl die Verwendung von geringen Mengen an Säuren wurde berichtet, 14,15. Alternative Lösungsmittelsysteme können Wasser oder Methanol als Komponenten 20,21 enthalten. Polare Verbindungen können auch auf verschiedene Arten von DC-Platten wie Platten mit 18 C Adsorbens oder mikrokristalline Cellulose beschichtet gelöst werden. Jedoch können Wachstums 12 oder Empfindlichkeit gegenüber dem Visualisierungsmittel 14 negativ auf einige dieser Adsorbentien beeinflusst werden.
Viele verschiedene Kombinationen von Testmikroorganismus und Medien können für Bioautographie verwendet werden. Jedoch müssen verschiedene Faktoren berücksichtigt werden, wenn Mikroorganismus und Medien werden. Die Medien sollten getestet werden, um festzustellen, dass es keine Komponenten, die den tet reduzierenrazolium Salz und verursachen eine nicht-biologische Farbwechsel. Der Agar sollte auch leicht genug sein, in der Farbe, um den Kontrast zwischen den gefärbten Zellen und ungefärbten Inhibitionszonen bieten. Ein Mikroorganismus, der nur wachsen kann auf der Oberfläche des Agar kann zusammen mit dem TLC-Band entfernt oder während der Färbung gewaschen werden. Darüber hinaus wird die Auswahl der Mikroorganismus / Medium-Kombination, Gasproduktion minimiert Blasen in dem Agar zu reduzieren. Pansen HAB wachsen in einer Carbonat-gepufferten, Kohlenhydrat-freiem Medium mit einem Gemisch von Aminosäuren oder Peptiden als Wachstumssubstrat. Die Agar-Platten sind leicht Gold und transparent. Wenn C. sticklandii in dem Medium löslich sind, die meisten der Produkte (flüchtigen Fettsäuren, Ammoniak). Wenig Gas erzeugt, was zu einer glatten Agarplatte ohne Blasen führt.
Dieser Bioassay hat ein paar Anwendungsmöglichkeiten. Die Größe der Hemmzone als grobe Schätzung verwendet werdendie Menge der Inhibitorverbindung, da der Radius der Hemmzone ist proportional zu dem Logarithmus der Menge der Verbindung, wodurch die Hemmung 17,22. Vielleicht die häufigste Verwendung von DC-Platte Biotests ist es, den Bereich der möglichen antimikrobielle Verbindungen in einem Pflanzenextrakt einzugrenzen. Nach hemmenden Zonen sind durch einen Bioassay identifiziert sind, können die entsprechenden Bereiche auf einem Duplikat-TLC-Platte mit einem Lösungsmittel eluiert werden, wie Methanol oder Ethylacetat, extrahiert und durch HPLC mit UV-Detektion Spektroskopie Charakterisierung bioaktiver Verbindungen 10,14 beginnen analysiert.
Offenlegungen
Die Erwähnung von Handelsnamen oder kommerzielle Produkte in dem Artikel ist ausschließlich für den Zweck der Bereitstellung von spezifischen Informationen und impliziert nicht, Empfehlung oder Billigung durch den USDA. Die Autoren erklären, keine konkurrierenden Finanz Interesse.
Danksagungen
Wir danken dem späten Dr. Norm Taylor, Abteilung Pflanzen-und Bodenwissenschaften an der Universität von Kentucky, für die Erlaubnis, seine Proben aus Rotklee Grundstücke für diese Studie zu verwenden. Dieses Projekt wurde von der United States Department of Agriculture finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Silica F254 TLC plates, aluminum-backed, 0.2 mm thickness, 20 cm x 20 cm | EMD Chemicals | 5554/7 | These plates are coated with silica that contains an indicator fluorescing at 254 nm. Compounds absorbing at that wavelength appear dark on a fluorescent green background. Alternative sources include Analtech, Selecto Scientific, Fluka. Adsorbents other than silica may be needed. Plastic-backed plates may be suitable, depending on the solvents to be used. |
| Sharp, heavy-duty scissors | any sewing supply company | similar to Fiskars 175800-1002 | For cutting TLC plates. A paper cutter with a sharp blade can be used as well. Do not inhale silica dust. |
| Drying oven at 100 °C (mechanical convection) | Thermo Scientific | PR305225M | Quincy Lab, Inc, Chicago, IL (www.quincylab.com); Cascade Technical Sciences, Hillsboro, OR (www.cascadetek.com) |
| TLC chamber | Kimble Chase | 416180-0000 | Alternative sources: Aldrich. Pyrex beakers or preserving jars can be used for small plates (i.e. 5 cm x 10 cm). Cover with aluminum foil (jar lids may contain material extractable by solvent vapors). |
| 50 µl Syringe with flat needle tip | Hamilton | 80965 | For loading amounts of standard or sample exceeding 5-10 µl. Alternative sources are equivalent. |
| Micropipettes | Drummond | 2-000-001 | For loading small amounts of standards or samples. Alternative sources: VWR. Also, Pasteur pipets can be stretched to a thinner diameter with a butane torch. |
| Filter paper (#1 grade) | Whatman | 1001 917 | Serves as a chamber wick. Other grades of filter paper are OK. This size can be trimmed for the chambers holding 20 cm x 20 cm plates. |
| Beaker tongs | Fisher Scientific | 15-186 | For putting plates in and out of a large TLC chamber. Alternate sources: VWR |
| Flat-edge forceps | Fisher Scientific | 10-275 | For putting plates in and out of a small chamber. Alternate sources: VWR |
| Small portable UV lamp with 4 W or 6 W bulbs for short- and long-wave UV light illumination (254 and 365 nm, respectively) | Ultraviolet Products | 95-0271-01 | Alternate sources: Spectronics Corporation (www.spectroline.net) |
| Viewing cabinet for use with hand-held UV lamp | Ultraviolet Products | Chromato-Vue C-10E | UV-active bands are more easily circled if plates can be set in here. Alternate sources: Spectronics Corporation. |
| Photodocumentation system with overhead UV lamp and visible lamp | Kodak | Gel Logic 200 | Alternate sources: Ultraviolet Products (www.uvp.com). See protocol for homemade alternative. |
| Anaerobic Chamber, Type A, Vinyl | Coy | 7150000 | This chamber is appropriate for anaerobic bacteria, like Clostridium sticklandii, as described. However, growth conditions must be tailored to organism used in the assay. A biosafety cabinet and other precautions should be taken if pathogenic organisms are used. Alternate sources: Anaerobe Systems, BioRad, Plas Labs, others |
| Tetrazolium red | Sigma-Aldrich | T8877 | Alternate sources: MP Biomedicals, Santa Cruz Biotechnology, Alfa Aesar |
| Ingredients for HAB media | |||
| Pyridoxamine · 2HCl | Sigma-Aldrich | P9380 | For this and for all the other reagents in this table, alternative sources are equivalent. |
| Riboflavin | Sigma-Aldrich | R4500 | |
| Thiamine HCl | Sigma-Aldrich | T3902 | |
| Nicotinamide | Sigma-Aldrich | N3376 | |
| Calcium D-Pantothenate | Sigma-Aldrich | C8731 | |
| Lipoic Acid | Sigma-Aldrich | T5625 | |
| p-Aminobenzoic acid | Sigma-Aldrich | A9878 | |
| Folic acid | Sigma-Aldrich | F8798 | |
| Biotin | Sigma-Aldrich | B4639 | |
| Cobalamine | Sigma-Aldrich | C3607 | |
| Pyridoxal HCl | Sigma-Aldrich | P9130 | |
| Pyridoxine | Sigma-Aldrich | P5669 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Iron sulfate · 7H2O | Sigma-Aldrich | F8263 | |
| Zinc sulfate · 7H2O | Sigma-Aldrich | Z0251 | |
| Manganese chloride · 4H2O | Sigma-Aldrich | M8054 | |
| Boric acid | Sigma-Aldrich | B6768 | |
| Cobalt chloride · 6H2O | Sigma-Aldrich | C8661 | |
| Copper chloride · 2H2O | Sigma-Aldrich | 459097 | |
| Nickel chloride · 6H2O | Sigma-Aldrich | 203866 | |
| Sodium molybdate · 2H2O | Sigma-Aldrich | 331058 | |
| Trypticase (Pancreatic digest of casein) | Thermo Fisher | B11921 | |
| Potassium phosphate monobasic anhydrous | Thermo Fisher | P284 | |
| Sodium carbonate · H2O | Thermo Fisher | S636 | |
| Agar | Thermo Fisher | 50841063 | |
| Magnesium sulfate · 6H2O | Thermo Fisher | 7791-18-6 | |
| Calcium chloride · 2H2O | Thermo Fisher | BP510 | |
| Cysteine HCl | Thermo Fisher | 19464780 | |
| Potassium phosphate dibasic anhydrous | Thermo Fisher | P290 | |
| Sodium chloride | Thermo Fisher | BP358 | |
Referenzen
- Stahl, E., Ashworth, M. R. F. Thin-layer chromatography. , Springer. (1969).
- Marston, A. Thin-layer chromatography with biological detection in phytochemistry. J. Chromatogr. A. 1218 (19), 2676-2683 Forthcoming.
- Homans, A. L., Fuchs, A. Direct bioautography on thin-layer chromatograms as a method for detecting fungitoxic substances. J. Chromatogr. 51, 327-329 Forthcoming.
- Lund, B. M., Lyon, G. D. Detection of inhibitors of Erwinia carotovora and E. herbicola on thin-layer chromatograms. J. Chromatogr. 110, 193-196 (1975).
- Betina, V. Bioautography in paper and thin-layer chromatography and its scope in the antibiotic field. J. Chromatogr. A. 78, 41-51 (1973).
- Weltzien, H. C. Ein biologischer Test für fungizide Substanzen auf dem Papierchromatogramm. Naturwissenschaften. 45, 288-289 (1958).
- Khurram, M., Khan, A. M., Hameed, A., Abbas, N., Quayum, A., Inayat, H. Antibacterial activities of Dodonaea viscosa using contact bioautography technique. Molecules. 14 (3), 1332-1341 (2009).
- Khurram, M., et al. Evaluation of anticandidal potential of Quercus baloot Griff. using contact bioautography technique. Afr. J. Pharm. Pharmacol. 5 (12), 1538-1542 (2012).
- Robinson, T. The Organic Constituents of Higher Plants. , Burgess Publishing Co. (1963).
- Kagan, I. A., Flythe, M. D. Factors affecting the separation and bioactivity of red clover (Trifolium pratense) extracts assayed against Clostridium sticklandii, a ruminal hyper ammonia-producing bacterium. Nat. Prod. Commun. 7 (12), 1605-1608 (2012).
- Mattila, P., Kumpulainen, J. Determination of free and total phenolic acids in plant-derived foods by HPLC with diode-array detection. J. Agric. Food Chem. 50 (13), 3660-3667 (2002).
- Hamburger, M. O., Cordell, G. A. A direct bioautographic TLC assay for compounds possessing antibacterial activity. J. Nat. Prod. 50 (1), 19-22 (1987).
- Flythe, M., Kagan, I. Antimicrobial effect of red clover (Trifolium pratense) phenolic extract on the ruminal hyper ammonia-producing bacterium, Clostridium sticklandii. Curr. Microbiol. 61, 125-131 Forthcoming.
- Rahalison, L., Hamburger, M., Hostettmann, K., Monod, M., Frenk, E. A bioautographic agar overlay method for the detection of antifungal compounds from higher plants. Phytochem. Anal. 2 (5), 199-203 (1991).
- Chomnawang, M. T., Trinapakul, C., Gritsanapan, W. In vitro antigonococcal activity of Coscinium fenestratum stem extract. J. Ethnopharmacol. 122, 445-449 (2009).
- Stahl, E., Kaldewey, H. Spurenanalyse physiologisch aktiver, einfacher Indolderivate. Hoppe-Seyler’s Z. Physiol. Chem. 323, 182-191 Forthcoming.
- Kagan, I. A., Hammerschmidt, R. Arabidopsis ecotype variability in camalexin production and reaction to infection by Alternaria brassicicola. J. Chem. Ecol. 28 (11), 2121-2140 (2002).
- Kline, R. M., Golab, T. A simple technique in developing thin-layer bioautographs. J. Chromatogr. 18, 409-411 (1965).
- Wedge, D. E., Nagle, D. G. A new 2D-TLC bioautography method for the discovery of novel antifungal agents to control plant pathogens. J. Nat. Prod. 63 (8), 1050-1054 (2000).
- Beck, A. B., Knox, J. R. The acylated isoflavone glycosides from subterranean clover and red clover. Aust. J. Chem. 24 (7), 1509-1518 (1971).
- Kahn, R. A., Bak, S., Svendsen, I., Halkier, B. A., Møller, B. L. Isolation and reconstitution of cytochrome P450ox and in vitro reconstitution of the entire biosynthetic pathway of the cyanogenic glucoside dhurrin from sorghum. Plant Physiol. 115 (4), (1997).
- Peterson, C. A., Edgington, L. V. Quantitative estimation of the fungicide benomyl using a bioautograph technique. J. Agr. Food Chem. 17 (4), 898-899 (1969).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten