Method Article
Тонкослойная Хроматографическое (ТСХ) Разделение и Биоанализы растительных экстрактов для идентификации антимикробные соединения
В этой статье
Резюме
Описаны методы тонкослойной хроматографии (ТСХ) разделения растительных экстрактов и контактной bioautography выявления антибактериальных метаболитов. Методы применяются к скрининга клевера лугового фенольных соединений, ингибирующих гипер аммиака бактерии-продуцента (ВЦВ) родные к бычьей рубце.
Аннотация
Общий экран для растений антимикробных соединений состоит из разделения растительных экстрактов на бумаге или тонкослойной хроматографии (ПК или ТСХ), подвергая хроматограммы в микробных суспензий (например, грибы или бактерии в бульон или агар), позволяя время для микробов расти в влажной среде, и визуализации зон, не микробного роста. Эффективность этого метода скрининга, известный как bioautography, зависит как от качества хроматографическим разделением и на тщательные с микробными условиях культивирования. Эта статья описывает стандартные протоколы для ТСХ и контактной bioautography с новым приложением для аминокислотных брожения бактерий. Экстракт отделяют на гибких (алюминий спинкой) кремнезема ТСХ пластин, и полосы визуализируются под ультрафиолетовым (УФ) света. Зоны вырезать и инкубировали лицевой стороной вниз на агаре инокулировали с тест-микроорганизма. Тормозные полосы визуализировали окрашиванием агара пластиныс с тетразолий красный. Метод применяется к разделению красного клевера (клевер луговой резюме. Kenland) фенольных соединений и их скрининга на активность в отношении Clostridium sticklandii, гипер аммиака производящих бактерии (ВЦВ), что является родным для крупного рогатого скота рубце. ТСХ методы применимы ко многим типам растительных экстрактов и других видов бактерий (аэробных или анаэробных), а также грибов, могут быть использованы в качестве тестовых организмов, если условия культивирования модифицированы, чтобы соответствовать требованиям роста видов.
Введение
Анализа на антимикробных соединений в растениях требует разделения компонентов растительного экстракта, подвергая тест-микроорганизма в тех компонентов, и определения, является ли рост микроорганизма в ингибируется любого из соединений. Разделение с помощью бумажной или тонкослойной хроматографии (ПК или ТСХ) удобны тем, что многие соединения могут быть разделены на плоской поверхности. Разделение основано на полярности, при этом некоторые соединения связывания крепко адсорбента (целлюлозы в случае ПК, а также ряд адсорбентов в случае ТСХ) и миграции меньше, чем другие 1. Рисунок 1 дает пример взаимного расположения полярные и неполярные фенольные соединения после разделения на диоксид кремния ТСХ пластины.
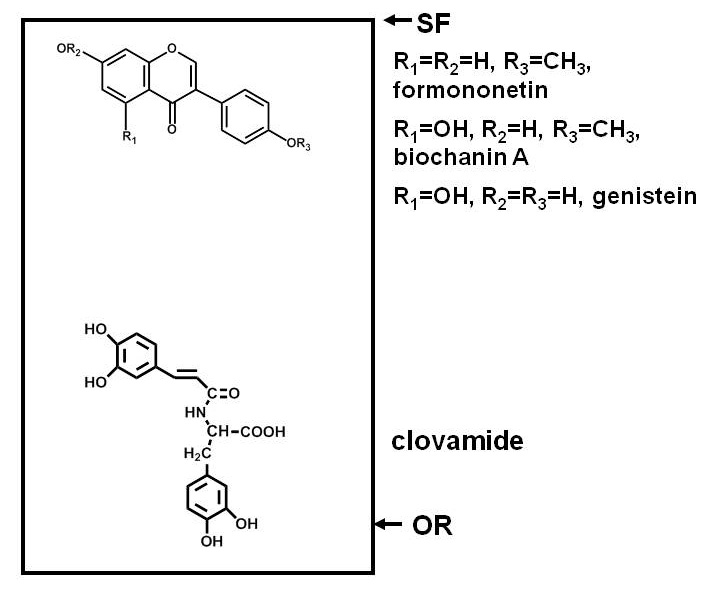
Рисунок 1. Диаграмма, иллюстрирующая распределение соединений различной полярности после разделения на силикагеле, тонкослойной хроматографии (ТСХ) пластины. Фенольные соединения из красного клевера (Trifolium луговой L.) используются в качестве примера. Полярные соединения, такие как clovamide, имеют сильное сродство к полярным адсорбентом, как диоксид кремния и остаются вблизи начала координат (OR), а менее пол рные соединени, такие как три изофлавонов вблизи фронта растворителя (SF), раздел более легко в растворителях (которые являются менее полярным, чем кремнезема, если вода, кислоты, основания или не включены) и мигрировать дальше вверх пластины.
После отделения экстракта на ТСХ пластине, тестовые микроорганизмы могут подвергаться воздействию всех соединений на пластине, тем самым ускоряя идентификацию активных компонентов экстракта 2. Если грибковая или бактериальная культура подвергается хроматограмме, микробный рост будет происходить везде, кроме над районами с роста-ингибиторау соединения. Зон ингибирования могут быть визуализированы при наблюдении контраст между мицелия и областей роста свободной если грибы были применены три или распылением с соединениями, которые меняют цвет, когда уменьшается или гидролизованный живыми клетками, 4. Хотя использование бумажных или тонкослойных хроматограмм для антимикробных анализов был впервые применен к антибиотикам 5 и фунгицидов 3,6, растительные экстракты в настоящее время часто скрининг на антимикробных соединений с этим методом, часто упоминается как bioautography. Протоколы, описанные здесь, относятся к bioautography тонкослойных хроматограмм. ТСХ широко используется, потому что это относительно быстрый и могут быть выполнены на различных адсорбентов (например, кремнезема, крахмал, оксид алюминия), а также обеспечивает хорошую разрешение и чувствительность 1.
Растительные экстракты могут быть подготовлены для ТСХ во многих отношениях. Общие методы включают извлекающий растительный материал в алкohol-водные смеси, такие как 80%-ного этанола 7,8, возможно, с добавлением кислоты или основания 9. После экстракции в таких растворителей, содержащих воду и, возможно, кислой или основной, экстракты должны быть сконцентрированы, так что они могут быть применены к пластинах ТСХ в минимальном объеме. Концентрация алкоголя водных экстрактов может быть достигнуто путем разделения с несмешивающихся с водой органических растворителей 8 или смесью этих растворителей, таких как этилацетат-этиловый эфир (1:1, об / об) 10,11. Различные метаболиты растений экстрагировали в различных органических растворителей, в зависимости от их полярности. Чтобы гарантировать, что растительные органические кислоты или основания извлекаются в органических растворителях на этой стадии, рН экстракта водно-спиртовой может быть повышена или понижена с водорастворимой кислоты или основания для преобразования диссоциированных аналитов в их недиссоциированных форм, которые затем растворимый в нейтральных органических растворителях 9. Органическую фазу может быть адресvaporated при пониженном давлении или в атмосфере азота и доводили до требуемого объема для ТСХ. РН экстракта вряд ли будет смертельным для биопроб микроорганизмов за счет разбиения аналитов в нейтральных растворителей, небольшой конечного объема, и испарения экстракта на ТСХ пластине перед разделением.
Оба грибки и бактерии используют в качестве тестовых микроорганизмов в bioautography растительных экстрактов 2. Споры некоторых грибов, таких как Cladosporium cucumerinum, прорастают на пластинах ТСХ (кроме областей с ингибирующих соединений) если распыляют на пластинах в питательном растворе и инкубировали во влажной среде в течение нескольких дней 3. Темная мицелий С. cucumerinum на noninhibitory зон обеспечивает резкий контраст зон, свободных от роста мицелия. Хотя бактерии были применены к тонкослойной хроматографии (ТСХ) пластин таким же образом, 4,12, бактерии также выливают на ТСХповерхности пластины в агар перекрывает 13,14. Дрожжи, таких как Candida Albicans, может быть применен в чашках с накладками, а 14. Кроме того, ТСХ пластины могут быть размещены лицевой стороной вниз на агаре инокулировали с бактерий или дрожжей 10,15 8, способом, известным как контактное bioautography 2.
Мы опишем метод для контактной bioautography для выявления противомикробных фенольных соединений из красного клевера (клевер луговой CV. Kenland). Тест микроорганизм Clostridium sticklandii, рубца гипер аммиака бактерия-продуцент (ВЦВ) и обязать анаэробные. Хотя разделение используемые не решают все компоненты экстракта, они облегчают идентификацию зон антимикробной активности, таким образом, сужение круга возможных противомикробным соединений. Протокол использует стандартные процедуры для ТСХ 1. Протокол также описывает некоторые из методов, необходимых для культивирования обяворота анаэробы для такого анализа, использование контактной bioautography 15 и способу визуализации с тетразолиевого соли, которая окрашивает живые клетки 2,4.
протокол
1. Получение экстракта растений
- См. Каган и Flythe 10 для извлечения фенольных соединений из клевер луговой сорта. Kenland.
- Чтобы извлечь другие соединения в других растениях, проверьте фитохимическое анализа литературы для растений или метаболитов конкретных методов извлечения (многие из них, описанный), или искать протоколов, таких как те, из Khurram др.. 7,8, которое изолирует много соединений с широким диапазон полярности.
2. Подготовка тонкослойной Плиты
- Чистые ТСХ путем разработки в одном или нескольких полярных нейтральных растворителей, в целях продвижения адсорбированных загрязнений из зоны развития.
- В вытяжном шкафу, подготовить достаточно очистки растворителем (например, 15-100 мл смеси этилацетат-метанол 2:1, об / об), чтобы покрыть дно камеры развивающихся ТСХ, а также нижний край на ТСХ пластине, когда множество внутри камеры.
- Используйте Commerбенно доступны стекло ТСХ разработке камеры (различные имеющиеся размеры, с крышками) или фольги, покрытой Pyrex стаканы или банки для консервирования.
- Используйте ножницы, чтобы вырезать алюминия или пластика спинкой (гибкий) силикагельных пластинах, которые бывают различных размеров (20 см х 20 см и меньше), чтобы соответствовать доступной развивающихся камеру. (Внимание: кремнезем может вызвать повреждение легких при вдыхании Работа в вытяжной шкаф, и обрабатывать ТСХ-пластин в перчатках, чтобы избежать попадания масла кожи на кремнезема..)
- Вставьте пластины в камеру, с вершинами, прислонившись стенок камеры. Пластины не должны касаться друг друга. Накройте камеру и пусть растворитель двигаться вверх пластину под действием капиллярных сил.
- Когда растворитель достиг вершины пластин, снять тарелки из камеры и организовать в положении стоя внутри вытяжного шкафа до растворитель не испарится.
- Проверьте, если примеси мигрировали в верхней части ТСХ-планшета, глядя на желтой полосой под видимымсвет, или флуоресцентный группа под ультрафиолетовой (УФ) (см. "примесей фронт» или если в рисунке 2B). Если большинство пластины все еще имеет желтоватый оттенок, повторите процесс очистки.
- После удаления ТСХ-пластин из камеры, отказаться от растворителя. Разрешить остаточный растворитель испаряется полностью, прежде чем использовать камеру для протокола 2.
- Для удаления остаточной влаги, что может повлиять на миграцию соединений на силикагеле 16, проп пластины в вертикальном положении в сушильном шкафу при 100 ° С (10-15 мин в течение 20 см х 20 см пластины, а 5 мин в течение 7 см х 10 см пластины ).
- Если 100 ° С сушильный шкаф не доступен, тепловые пластины для более длительного периода времени при более низких температурах (например, 40 мин при 60 ° С).
- После того, как пластины сухой, пусть остыть до комнатной температуры перед загрузкой.
3. Подготовка Разработка палаты для Extract разъединении
4. Загрузка и развитие ТСХ
- Слегка отметить происхождение с карандашом. Если пластина адсорбент ТСХ мягкий и легко повредить, сделать отметки на краях. Соединения должна быть выше поверхности проявляющего растворителя, когда пластины, вставленной в камеру ТСХ.
- Растворить экстракты в достаточно органическом растворителе (в данном случае, метанол), чтобы иметь концентрированного раствора вместо мутныйподвеска.
- Образцы нагрузки и стандарты как узких полос с микролитра шприца или капиллярных микропипеток, оставляя 1 см границу по бокам пластины. Разрешить полосы высохнуть (разжигание тарелку или загрузкой в вытяжной шкаф помогает).
- Если большая концентрация образца необходима на тарелке "репорт" по загрузки образцов снова на высушенных полос.
- С щипцов или щипцов, установить пластину (ы) внутри насыщенного ТСХ камеры. Пластины не должны касаться фитиль, поскольку это может обеспечить растворитель к пластинам в точках контакта, тем самым изменяя путь соединения миграции. Крышка отсека и пусть пластины развиваться.
5. Подготовка пластин для биопроб
- Удалить пластину (ы) из ТСХ до переднего растворитель достигает верхней плите, и отметить высоту фронта растворителя с карандашом. Пусть пластины сухой в вытяжной шкаф.
- Разработка оставшиеся ТСХ-пластин в той же TLC камеры, которая GEnerally использовать в течение всего дня, если закрыты. Переделка смеси растворителей для ТСХ камеры, если количество растворителя в камере особенно уменьшается.
- После пластины сухие, визуализировать полосы при видимом или УФ-излучения, и разграничить полосы с карандашом. Просмотра камера с портативным УФ-лампы удобно, особенно если лампа может обнаружить соединения как на длине волны 254 нм (коротковолновое УФ) и 365 нм (длинноволновое УФ).
Примечание: На данный момент или после следующего шага, пластины могут быть завернуты в полиэтиленовую пленку, накрывают пленкой и хранить при температуре -20 ° С. Максимальное время хранения зависит от соединения стабильности. Потому что кремнезем не является нейтральной, некоторые соединения могут ухудшить то время как на пластину ТСХ. - Сфотографируйте или фильеры.
- Используйте систему гель фотодокументация если оснащен подвесным УФ и / или видимого света доступен.
- Если не коммерческая система фотодокументация не доступен, фотография пластины внутри коробки выстроились с темной бумаге или ткани, шй набор камеру на штатив и портативный ультрафиолетовый свет зажат в кольцо стоять 17. При фотографировании пластины, которые не имеют флуоресцентного индикатора, использовать синий светофильтр на объектив камеры, чтобы улучшить внешний вид полосы 17.
- Для помощи в характеризующая полосы, рассчитать коэффициент удержания (R F) значения путем измерения расстояния, пройденные соединения и фронта растворителя, и деления бывший на последней (рис. 2А).
6. Бактериальный Культура и анализа
- Подготовка и привить СМИ в анаэробных условиях. Культура используется в данном случае было Clostridium sticklandii штамм SR, который был получен из коллекции культур Джеймс Б. Рассел, Корнельского университета, Итака, штат Нью-Йорк.
- Смотреть Flythe и Каган 13 и список материалов для описания ВЦВ СМИ.
- Расти культуру к экспоненциальному или стационарной фазы. Используйте стерильную анаэробного techniquэс при работе с анаэробных микроорганизмов.
- Инокулировать культуру (1% об / об) в расплавленный агар После того как температура агара (0,75% вес / объем) снизилась до менее чем 60 ° С. Осторожно перемешать и немедленно привести в анаэробной камере (95% CO 2 -5% Н 2 атмосфера для ВЦВ СМИ) налить.
- Налейте в 15 мм х 100 мм пластиковые чашки Петри, и позволяют затвердеть.
- С ножницами, вырезать пластинки ТСХ на зоны, содержащие группу (ы) интерес. Положите полосы лицом вниз на чашках с агаром, маркировка полосы на пластины поддержке отслеживать исходной ориентации на ТСХ пластине. Lay неиспользуемый ТСХ полосу на чашке с агаром в качестве контроля.
- Выдержите агаром, агар стороной вниз, в анаэробной камере (24 часа в сутки, 39 ° C).
7. Визуализация биоанализу чашках с агаром
- С пинцетом удалите полосы от чашки с агаром, пока они находятся в анаэробной камере.
- Добавить 1% (вес / объем) TEtrazolium красный, получены в воде, по каплям на поверхность чашек с агаром. Разрешить цвет разработать по крайней мере 20 минут, или пока управление пластина не получается полностью красный, прежде чем снимать с анаэробной камере. В анаэробных бактерий начнет терять жизнеспособность сразу после снятия с анаэробной камере, но цвет стабилен в течение более чем 24 часов.
- Сфотографируйте под видимого света.
Результаты
Представительства кремнезема TLC разделения красного клевера (клевер луговой резюме. Kenland) экстракты, содержащие фенольные соединения, показаны на рисунке 2. Разделение красного клевера экстракта в смеси этилацетат-гексан (9:1, об / об), более 8,5 см, в результате пять групп, одна полностью решены от начала координат (рис. 2а). Тем не менее, 2В показывает, что примерно в два раза много групп были выявлены, когда другой образец экстракта красного клевера (из того же сорта, но вырос в отдельном участке в одной ферме) был отделен на большем расстоянии (15 см вместо 8.5 см) и с двух последовательных событий в различных системах растворителей. Хроматограмма фиг.2В был разработан первый в смеси этилацетат-гексан (9:1, об / об), и затем дают высохнуть и разделены в смеси этилацетат-метанол (78:22, объем / объем). Эти результаты показывают, что оба размер пластины и выбор системы растворителей (или серии растворителей сystems) может повлиять на количество соединений, разделенных на хроматограмме. В данном конкретном случае, элюирование и жидкостной хроматографии высокого разрешения (ЖХВР) полос из других ТСХ разделения одних и тех же экстрактов подтверждено, что соединения оставшиеся на или вблизи начала состояла главным образом из фенольных соединений (фенольные кислоты или изофлавоны), конъюгированных с полярными фрагментами такие как производные аминокислот, сахаров или яблочной кислоты. В противоположность этому, изофлавоны не сопряженные к полярным фрагментов мигрировали дальше вверх ТСХ пластин 10.
Результаты биотестирования ТСХ пластины, показанной на рисунке 2А с Clostridium sticklandii, в рубце гипер аммиака производящих бактерии (ВЦВ), показаны на рисунке 3. Добавление 1% (вес / объем) водного раствора тетразолия красного до чашек с агаром после 24 ч инкубации в результате ярко-красного цвета, когда живые клетки окрашивали. Инкубация полосы 1 (биоханин А) и часть бай 2 (формононетин) на бактерии семенами агар привело к четко определенной зоны ингибирования (фиг.3А). Тем не менее, инкубация оставшейся части полосы 2, вместе с группами 3 и 4, не ингибирует рост бактерий (фиг.3В). Эти результаты показали, что биоханин был ингибирующее действие на C. sticklandii рост, но формононетин не было.
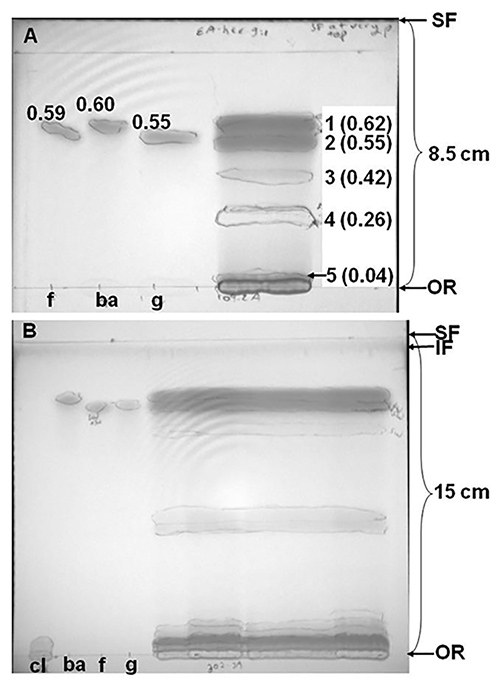
Рисунок 2. Silica тонкослойной хроматографии (ТСХ) разделение из экстракта клевер луговой сорта. Kenland, разработанный в (А) смеси этилацетат-гексаны (9:1, об / об), или (б) в том же растворителе с последующим развитием в смеси этилацетат-метанол (78:22, объем / объем). Расстояние мигрировали на растворитель между происхождения (OR) и фронта растворителя (SF) указывается рядомскобки между этими двумя границами. На фиг.2В, в "примеси фронта" (IF, местоположение примесей перемещается вверх пластину по предварительной стирки в полярных растворителях) рассматривается как темной полосы в верхней части пластины. Экстракты, приготовленные из 180-250 мг лиофилизированных красного клевера листьев и стеблей, растворяют в метаноле и 10% экстракта (а) или 32% (В) загружали кремнезема пластин. Стандарты загруженные были формононетина (F, 7,1 нмоль), биоханин A (ба, 7,4 нмоль), генистеин (г, 9,8 нмоль), и clovamide (Cl, 2В только 8,7 нмоль). Полосы кружил в то время смотреть под ручной УФ-лампы на 254 нм (коротковолновое УФ) и 365 нм (длинноволновое УФ). Цифровая камера использовалась для фотографирования пластину под коротковолновой УФ. Цифры справа от клевера выписки полос в рисунке 2А относятся к зонам вырезал для биопроб. Факторы удерживания (R F, расстояние traveleд по полосе / расстояние, пройденное SF) в скобках после номера группы на рисунке 2а.

Рисунок 3. Результаты биоанализа ТСХ-пластинку (а) группы 1 и полностью решены верхней части диапазона от 2 ТСХ пластине фиг.2А, и (б) 2-4 полос из того же ТСХ пластине. Полосы были заложены лицевой стороной вниз на ВЦВ среднего засевают Clostridium sticklandii и инкубируют в анаэробных условиях через 24 часа при температуре 39 ° С. В конце этого инкубационного периода, полосы были удалены, и агаром окрашивали с водным раствором 1% (вес / объем) тетразолия красный и фотографировали при видимом свете.
Обсуждение
Этот протокол описывает простой способ разделения выписку на подмножества соединений и анализируя эти подмножества контактным bioautography. Метод очень похож на одного используемой Chomnawang др.. 15 для выявления метаболитов растений ингибирующих чтобы гонореей бактерий. Тип bioautography, используемого для экрана для антимикробных соединений растений зависит от многих факторов, в том числе тест-микроорганизма, лабораторной установки и предпочтений лица (лиц), осуществляющего биопробы. Связаться bioautography, метод, используемый в данном исследовании, был подвергнут критике за зависимости от способности соединения к диффузии в привитых СМИ 12. Зоны торможения над соединений при низких концентрациях, или с небольшим способности диффундировать в средствах массовой информации, не могут быть обнаружены, если рост происходит в агар ниже диффузат. Кроме того, зона ингибирования создано одним полоса может распространиться за пределы начальной группыГраницы, таким образом, возможно маскировки ингибирующие зон, созданных соседних соединений 14. Тем не менее, контакт bioautography является простой метод использовать, а также возможность укладывать чашках Петри минимизирует количество пространства, необходимого. Кроме того, прокладка ТСХ полосы на агар исключает риск группы растворения и распространение, что может произойти, если ТСХ-пластинку покрывали инокулированной агар или опрыскивали испытуемым микроорганизмом.
Получение информации от любого из вышеуказанных типов bioautography зависит от хроматографических условиях, концентрации тестируемого микроорганизма и условий культуры / инкубации. Хроматографическое разрешение антимикробных полос не является необходимым, но чувствительность может быть больше для хорошо разрешенная группы 6. Полосы могут быть разделены на развитие более длинных пластин или в различных системах растворителей в одном измерении (фиг. 2B), или в двух измерениях поворотом пластины тонкослойной хроматограммы, 90 градусов до развитияво втором 16,19 растворителей. Полярных соединений может быть трудно отделить на силикагеле, без использования смеси растворителей, содержащие кислоты или щелочи. Они могут быть смертельным для тестового микроорганизма 12, хотя использование небольших количеств кислот сообщалось 14,15. Альтернативные системы растворителей могут включать воду или метанол в качестве компонентов 20,21. Полярных соединений также могут быть решены на различных типах пластинах ТСХ, таких как планшетах, покрытых C 18 адсорбента или микрокристаллической целлюлозы. Тем не менее, рост 12 или чувствительность к визуализации агента 14 может негативно повлияли на некоторые из этих адсорбентов.
Много различных комбинаций тестовой микроорганизма и средств массовой информации может быть использован для bioautography. Однако ряд факторов необходимо учитывать при выборе микроорганизма и средств массовой информации. Средства массовой информации должны быть проверены, чтобы определить, что нет никаких компонентов, которые снижают тетrazolium соль и вызвать небиологическое изменение цвета. Агар также должны быть достаточно светлый цвет, чтобы обеспечить контраст между окрашенных клеток и неокрашенных зон ингибирования. Микроорганизм, который может расти только на поверхности агара может быть удален вместе с ТСХ полосы или смыты в течение окрашивания. Кроме того, выбор комбинации микроорганизм / средней что сводит к минимуму производство газа позволит снизить пузырьков в агаре. Rumen НАВ расти в карбонатной буфером, углеводов среде без смесью аминокислот или пептидов, как ростового субстрата. Чашки с агаром светло золото и прозрачным. Когда С. sticklandii выращивают в среде, большинство продуктов растворимы (летучие жирные кислоты, аммиак). Очень мало газ получают, что приводит к гладкой чашки с агаром без каких-либо пузырьков.
Это биопроб имеет несколько потенциальных применений. Размер зоны ингибирования может использоваться в качестве грубой оценкиколичество ингибирующего соединения, так как радиус ингибирующей зоны пропорциональна логарифму количества соединения вызывают ингибирование 17,22. Пожалуй, самый распространенный способ использования ТСХ пластины биоанализах является сузить диапазон возможных антимикробных соединений в растительном экстракте. После ингибирующие зоны определяются по биоанализа, соответствующие области на дубликат ТСХ пластине можно элюировать с растворителем, таким как метанол или этилацетат, и анализировали с помощью ВЭЖХ с ультрафиолетовым обнаружения спектроскопии, чтобы начать биологически активных соединений, характеризующий 10,14.
Раскрытие информации
Упоминание торговых наименований или коммерческих продуктов в статье исключительно для целей предоставления конкретной информации и не подразумевает рекомендацию или одобрения со стороны Министерства сельского хозяйства США. Авторы заявляют никакого конкурирующий финансовый интерес.
Благодарности
Мы благодарим покойный д-р Норма Тейлор, Средств растительного и почвенного наук в Университете штата Кентукки, за предоставленную нам возможность использовать образцы из своих красных клевера участков для данного исследования. Этот проект финансировался США Департамент сельского хозяйства.
Материалы
| Name | Company | Catalog Number | Comments |
| Silica F254 TLC plates, aluminum-backed, 0.2 mm thickness, 20 cm x 20 cm | EMD Chemicals | 5554/7 | These plates are coated with silica that contains an indicator fluorescing at 254 nm. Compounds absorbing at that wavelength appear dark on a fluorescent green background. Alternative sources include Analtech, Selecto Scientific, Fluka. Adsorbents other than silica may be needed. Plastic-backed plates may be suitable, depending on the solvents to be used. |
| Sharp, heavy-duty scissors | any sewing supply company | similar to Fiskars 175800-1002 | For cutting TLC plates. A paper cutter with a sharp blade can be used as well. Do not inhale silica dust. |
| Drying oven at 100 °C (mechanical convection) | Thermo Scientific | PR305225M | Quincy Lab, Inc, Chicago, IL (www.quincylab.com); Cascade Technical Sciences, Hillsboro, OR (www.cascadetek.com) |
| TLC chamber | Kimble Chase | 416180-0000 | Alternative sources: Aldrich. Pyrex beakers or preserving jars can be used for small plates (i.e. 5 cm x 10 cm). Cover with aluminum foil (jar lids may contain material extractable by solvent vapors). |
| 50 µl Syringe with flat needle tip | Hamilton | 80965 | For loading amounts of standard or sample exceeding 5-10 µl. Alternative sources are equivalent. |
| Micropipettes | Drummond | 2-000-001 | For loading small amounts of standards or samples. Alternative sources: VWR. Also, Pasteur pipets can be stretched to a thinner diameter with a butane torch. |
| Filter paper (#1 grade) | Whatman | 1001 917 | Serves as a chamber wick. Other grades of filter paper are OK. This size can be trimmed for the chambers holding 20 cm x 20 cm plates. |
| Beaker tongs | Fisher Scientific | 15-186 | For putting plates in and out of a large TLC chamber. Alternate sources: VWR |
| Flat-edge forceps | Fisher Scientific | 10-275 | For putting plates in and out of a small chamber. Alternate sources: VWR |
| Small portable UV lamp with 4 W or 6 W bulbs for short- and long-wave UV light illumination (254 and 365 nm, respectively) | Ultraviolet Products | 95-0271-01 | Alternate sources: Spectronics Corporation (www.spectroline.net) |
| Viewing cabinet for use with hand-held UV lamp | Ultraviolet Products | Chromato-Vue C-10E | UV-active bands are more easily circled if plates can be set in here. Alternate sources: Spectronics Corporation. |
| Photodocumentation system with overhead UV lamp and visible lamp | Kodak | Gel Logic 200 | Alternate sources: Ultraviolet Products (www.uvp.com). See protocol for homemade alternative. |
| Anaerobic Chamber, Type A, Vinyl | Coy | 7150000 | This chamber is appropriate for anaerobic bacteria, like Clostridium sticklandii, as described. However, growth conditions must be tailored to organism used in the assay. A biosafety cabinet and other precautions should be taken if pathogenic organisms are used. Alternate sources: Anaerobe Systems, BioRad, Plas Labs, others |
| Tetrazolium red | Sigma-Aldrich | T8877 | Alternate sources: MP Biomedicals, Santa Cruz Biotechnology, Alfa Aesar |
| Ingredients for HAB media | |||
| Pyridoxamine · 2HCl | Sigma-Aldrich | P9380 | For this and for all the other reagents in this table, alternative sources are equivalent. |
| Riboflavin | Sigma-Aldrich | R4500 | |
| Thiamine HCl | Sigma-Aldrich | T3902 | |
| Nicotinamide | Sigma-Aldrich | N3376 | |
| Calcium D-Pantothenate | Sigma-Aldrich | C8731 | |
| Lipoic Acid | Sigma-Aldrich | T5625 | |
| p-Aminobenzoic acid | Sigma-Aldrich | A9878 | |
| Folic acid | Sigma-Aldrich | F8798 | |
| Biotin | Sigma-Aldrich | B4639 | |
| Cobalamine | Sigma-Aldrich | C3607 | |
| Pyridoxal HCl | Sigma-Aldrich | P9130 | |
| Pyridoxine | Sigma-Aldrich | P5669 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Iron sulfate · 7H2O | Sigma-Aldrich | F8263 | |
| Zinc sulfate · 7H2O | Sigma-Aldrich | Z0251 | |
| Manganese chloride · 4H2O | Sigma-Aldrich | M8054 | |
| Boric acid | Sigma-Aldrich | B6768 | |
| Cobalt chloride · 6H2O | Sigma-Aldrich | C8661 | |
| Copper chloride · 2H2O | Sigma-Aldrich | 459097 | |
| Nickel chloride · 6H2O | Sigma-Aldrich | 203866 | |
| Sodium molybdate · 2H2O | Sigma-Aldrich | 331058 | |
| Trypticase (Pancreatic digest of casein) | Thermo Fisher | B11921 | |
| Potassium phosphate monobasic anhydrous | Thermo Fisher | P284 | |
| Sodium carbonate · H2O | Thermo Fisher | S636 | |
| Agar | Thermo Fisher | 50841063 | |
| Magnesium sulfate · 6H2O | Thermo Fisher | 7791-18-6 | |
| Calcium chloride · 2H2O | Thermo Fisher | BP510 | |
| Cysteine HCl | Thermo Fisher | 19464780 | |
| Potassium phosphate dibasic anhydrous | Thermo Fisher | P290 | |
| Sodium chloride | Thermo Fisher | BP358 | |
Ссылки
- Stahl, E., Ashworth, M. R. F. Thin-layer chromatography. , Springer. (1969).
- Marston, A. Thin-layer chromatography with biological detection in phytochemistry. J. Chromatogr. A. 1218 (19), 2676-2683 Forthcoming.
- Homans, A. L., Fuchs, A. Direct bioautography on thin-layer chromatograms as a method for detecting fungitoxic substances. J. Chromatogr. 51, 327-329 Forthcoming.
- Lund, B. M., Lyon, G. D. Detection of inhibitors of Erwinia carotovora and E. herbicola on thin-layer chromatograms. J. Chromatogr. 110, 193-196 (1975).
- Betina, V. Bioautography in paper and thin-layer chromatography and its scope in the antibiotic field. J. Chromatogr. A. 78, 41-51 (1973).
- Weltzien, H. C. Ein biologischer Test für fungizide Substanzen auf dem Papierchromatogramm. Naturwissenschaften. 45, 288-289 (1958).
- Khurram, M., Khan, A. M., Hameed, A., Abbas, N., Quayum, A., Inayat, H. Antibacterial activities of Dodonaea viscosa using contact bioautography technique. Molecules. 14 (3), 1332-1341 (2009).
- Khurram, M., et al. Evaluation of anticandidal potential of Quercus baloot Griff. using contact bioautography technique. Afr. J. Pharm. Pharmacol. 5 (12), 1538-1542 (2012).
- Robinson, T. The Organic Constituents of Higher Plants. , Burgess Publishing Co. (1963).
- Kagan, I. A., Flythe, M. D. Factors affecting the separation and bioactivity of red clover (Trifolium pratense) extracts assayed against Clostridium sticklandii, a ruminal hyper ammonia-producing bacterium. Nat. Prod. Commun. 7 (12), 1605-1608 (2012).
- Mattila, P., Kumpulainen, J. Determination of free and total phenolic acids in plant-derived foods by HPLC with diode-array detection. J. Agric. Food Chem. 50 (13), 3660-3667 (2002).
- Hamburger, M. O., Cordell, G. A. A direct bioautographic TLC assay for compounds possessing antibacterial activity. J. Nat. Prod. 50 (1), 19-22 (1987).
- Flythe, M., Kagan, I. Antimicrobial effect of red clover (Trifolium pratense) phenolic extract on the ruminal hyper ammonia-producing bacterium, Clostridium sticklandii. Curr. Microbiol. 61, 125-131 Forthcoming.
- Rahalison, L., Hamburger, M., Hostettmann, K., Monod, M., Frenk, E. A bioautographic agar overlay method for the detection of antifungal compounds from higher plants. Phytochem. Anal. 2 (5), 199-203 (1991).
- Chomnawang, M. T., Trinapakul, C., Gritsanapan, W. In vitro antigonococcal activity of Coscinium fenestratum stem extract. J. Ethnopharmacol. 122, 445-449 (2009).
- Stahl, E., Kaldewey, H. Spurenanalyse physiologisch aktiver, einfacher Indolderivate. Hoppe-Seyler’s Z. Physiol. Chem. 323, 182-191 Forthcoming.
- Kagan, I. A., Hammerschmidt, R. Arabidopsis ecotype variability in camalexin production and reaction to infection by Alternaria brassicicola. J. Chem. Ecol. 28 (11), 2121-2140 (2002).
- Kline, R. M., Golab, T. A simple technique in developing thin-layer bioautographs. J. Chromatogr. 18, 409-411 (1965).
- Wedge, D. E., Nagle, D. G. A new 2D-TLC bioautography method for the discovery of novel antifungal agents to control plant pathogens. J. Nat. Prod. 63 (8), 1050-1054 (2000).
- Beck, A. B., Knox, J. R. The acylated isoflavone glycosides from subterranean clover and red clover. Aust. J. Chem. 24 (7), 1509-1518 (1971).
- Kahn, R. A., Bak, S., Svendsen, I., Halkier, B. A., Møller, B. L. Isolation and reconstitution of cytochrome P450ox and in vitro reconstitution of the entire biosynthetic pathway of the cyanogenic glucoside dhurrin from sorghum. Plant Physiol. 115 (4), (1997).
- Peterson, C. A., Edgington, L. V. Quantitative estimation of the fungicide benomyl using a bioautograph technique. J. Agr. Food Chem. 17 (4), 898-899 (1969).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены