Method Article
Floresan Etiketli Suşların Cocultivation'ı ile Bakteri Hücre Popülasyonunda İntraspecies Rekabetini İzleme
Bu Makalede
Özet
Bakteriler yaşamları boyunca zararlı veya faydalı mutasyonlar biriktirebilir. Bir hücre popülasyonunda, yararlı mutasyonlar biriktirmiş bireyler, arkadaşlarını hızla geride kalabilir. Burada, floresan etiketli bireyleri kullanarak zaman içinde bakteri hücresi popülasyonunda tür içi rekabeti görselleştirmek için basit bir prosedür sunuyoruz.
Özet
Bakteri gibi birçok mikroorganizma son derece hızlı çoğalır ve popülasyonlar yüksek hücre yoğunluklarına ulaşabilir. Bir popülasyondaki hücrelerin küçük fraksiyonları her zaman hücre için zararlı veya faydalı olan birikmiş mutasyonlara sahiptir. Bir mutasyonun fitness etkisi, alt nüfusa güçlü bir seçici büyüme avantajı sağlarsa, bu alt nüfusa sahip bireyler hızla rakip olabilir ve hatta yakın arkadaşlarını tamamen ortadan kaldırabilir. Bu nedenle, yararlı mutasyonlar elde eden hücrelerin küçük genetik değişiklikleri ve seçim odaklı birikimi, bir hücre popülasyonunun genotipinin tamamen kaymasına neden olabilir. Burada, gram-pozitif model bakteri bacillus subtilisfloresan etiketli bireylerinin birlikte çalıştırıldığı zaman içinde bakteri hücre popülasyonunda, sırasıyla yararlı ve zararlı mutasyonların hızlı klonal genişlemesini ve ortadan kaldırılmasını izlemek için bir prosedür sunuyoruz. Yöntemin gerçekleştirilmesi kolaydır ve bakteri hücre popülasyonundaki bireyler arasında tür içi rekabeti göstermek çok açıklayıcıdır.
Giriş
Toprak bakterileri genellikle esnek düzenleyici ağlar ve geniş metabolik kapasitelerle donatılmıştır. Her iki özellik de hücrelerin katabolik ve anabolik yollarını, belirli bir ekolojik nişte bulunan besinler için arkadaşları ve diğer mikroorganizmalarla rekabet edecek şekilde ayarlamalarını sağlar1. Bununla birlikte, bakteriler çevrelerine uyum sağlayamazsa, diğer mekanizmalar bir türün hayatta kalmasını açıklayabilir. Gerçekten de, birçok bakteri hızlı çoğaldığı ve popülasyonlar yüksek hücre yoğunluklarına ulaşabildiğinden, alt popülasyonlar hücrelere seçici bir büyüme avantajı sağlayan ve bu nedenle zindeliklerini artıran kendiliğinden birikmiş faydalı mutasyonlara sahip olabilir. Ayrıca, mutasyonel sıcak noktalar ve strese bağlı adaptif mutajensis, maladapted bir bakterinin evrimini kolaylaştırabilir2,3. Bu nedenle, sürekli seçim altında mutasyonların ve büyümenin birikmesi, aynı cins içinde bile muazzam mikrobiyal çeşitliliğin kökenidir4,5. Doğada olduğu gibi, bakteri genomlarının şekillendirilmesi de seçim altında sürekli ekim nedeniyle laboratuvarda meydana gelir. Bu, temel araştırmalarda ve endüstride dünya çapında kullanılan Gram-pozitif bakteri B. subtilis'in evcilleştirilmesi ile örneklenmiştir. 1940'larda B. subtilis DNA'ya zarar veren X ışınları ile tedavi edildi ve ardından belirli bir büyüme koşulu altında ekimyapıldı 6. Evcilleştikleri sırada bakterilerde biriken mutasyonlar, birçok büyüme özelliğinin kaybını, yani B. subtilis laboratuvar suşu 168 karmaşık koloniler oluşturma yeteneğini kaybetti7,8.
Günümüzde, en iyi çalışılan model bakteriler Escherichia coli ve B. subtilisiçin, belirli bilimsel soruları ele almak için genomlarını genetik olarak manipüle etmek için çeşitli güçlü araçlar mevcuttur. Bazen bir ilgi geninin inaktivasyonu, daha sonra standart büyüme ortamında açıkça görülebilen ciddi bir büyüme kusuruna neden olur9. Bunun aksine, zayıf bir büyüme kusuru neden olan ve böylece suşun kondisyonunu sadece biraz etkileyen mutasyonlar genellikle göz ardı edilir. Bununla birlikte, her iki durumda da mutant suşlarının birkaç nesil boyunca uzun süreli inkübasyonu ve geçişi genellikle ana suşun fenotipini geri kazandıran baskılayıcı mutantların birikmesine neden2,9. Baskılayıcı mutantların karakterizasyonu ve ebeveyn mutant suşunun büyüme kusurunu geri kazandıran mutasyonların tanımlanması, önemli ve genellikle yeni hücresel süreçlerin aydınlatılmasına izin veren çok yararlı bir yaklaşımdır10,11.
Biz B. subtilis12glutamat homeostaz kontrolü ile ilgileniyoruz. E. coli'yebenzer şekilde, B. subtilis glutamat homeostazının(yaniglutamat bozulmasında blok2)bastırıcı mutantların birikmesiyle pertürbasyonuna yanıt verir. Spontan mutasyonla elde edilen bu baskılayıcı mutantlardaki genomik değişikliklerin glutamat homeostazını hızla geri getirdiği gösterilmiştir9,13. Bu nedenle, B. subtilis'in bakterinin evcilleştirmesi sırasında belirli bir büyüme durumuna adaptasyonunun enzim sentezinde ve glutamat metabolizmasında yer alan evrimleşmiş enzimatik aktivitelerde yansıtılması şaşırtıcı değildir12. Evcilleştirme işlemi sırasında büyüme ortamında eksojen glutamat eksikliğinin, laboratuvar suşu 1682,14'tekriyotik glutamat dehidrogenaz (GDH) gudBCR geninin ortaya çıkması ve sabitlenmesi için itici güç olduğu ileri sürülmüştür. Bu hipotez, laboratuvar suşundaki GDH aktivitesinin azalmasının, eksojen glutamat az olduğunda bakterilere seçici bir büyüme avantajı sağladığı gözlemimiz ile desteklenmektedir2. Ayrıca, bir B. subtilis suşunun yetiştirilmesi, GDH GudB sentezlenmesi, eksojen glutamat yokluğunda gudB genini inaktive eden baskılayıcı mutantların birikmesi ile sonuçlanır2. Açıkçası, katabolik olarak aktif bir GDH'nin varlığı hücre için dezavantajlıdır, çünkü anabolizma için kullanılabilecek endojen olarak üretilen glutamat amonyum ve 2-oksioglutarat olarak bozulur (Şekil 1). Bunun aksine, glutamat ortam tarafından sağlandığında, üst düzey GDH aktivitesi ile donatılmış bir B. subtilis suşu, sadece bir fonksiyonel GDH sentezleyen bir suş üzerinde seçici bir büyüme avantajına sahiptir. Üst düzey GDH aktivitesinin, bakterilerin orta2 tarafından sağlanan diğer karbon kaynaklarına ek olarak ikinci bir karbon kaynağı olarak glutamat kullanmasına izin verdiğini varsaymak mantıklıdır (bkz. Şekil 1). Bu nedenle, GDH aktivitesi, eksojen glutamanın mevcudiyetine bağlı olarak bakterilerin zindeliğini güçlü bir şekilde etkiler.
Burada, kromozom üzerinde tek bir lokusta farklılık gösteren iki B. subtilis suşu arasındaki tür içi rekabeti izlemek ve görselleştirmek için çok açıklayıcı bir yöntem sunuyoruz (Şekil 2). İki suş, floroforlar YFP ve CFP'yi kodlayan yfp ve cfp genleri ile etiketlendi ve farklı beslenme koşulları altında birlikte çalıştı. Zamanla örnekleme yaparak ve agar plakalarına uygun seyreltmeler yaparak, kültürlerin her birinde hayatta kalanlar ortak bir stereo floresan mikroskobu kullanılarak kolayca izlenebilir. Bu makalede açıklanan prosedürün gerçekleştirilmesi kolaydır ve zaman içinde bir hücre popülasyonunda sırasıyla yararlı ve zararlı mutasyonların hızlı klonal genişlemesini ve ortadan kaldırılmasını görselleştirmek için uygundur.
Protokol
1. Agar Tabaklarının, Kültür Medyasının, Kriyostockların ve Ön Kültürlerin Hazırlanması
- Büyüme ortamı ve gerekli reaktifleri hazırlayın (bkz. malzeme ve reaktifler tablosu).
- B. subtilis suşlarını çizgile (örneğin. BP40 (rocG+ gudBCR amyE::PgudB-yfp) ve BP52 (rocG+ gudB+ amyE::PgudB-cfp) sırasıyla bir ve iki aktif GDH ifade eden)2 tek koloniler elde etmek için SP orta agar plakaları üzerinde yapılacak yarışma deneyinde kullanılacaktır. Plakaları gece boyunca 37 °C'de kuluçkaya yatırın.
- Tek kolonileri alın ve 4 ml LB sıvı ortam içeren steril kültür tüplerini aşılayın. Bakterileri gece boyunca 28 °C ve 220 rpm'de yetiştirin.
- Hücrelerin 28 °C'de geceleme veya sporulate olmasını önlemek için gece kültürlerini büyütün.
- Standart bir spektrofotometre kullanarak kültürlerin optik yoğunluğunu 600 nm (OD600)dalga boyunda ölçün.
- Kültürler2.0'ın 600'üne ulaştıysa, 0.75 ml'lik kültürleri 1.5 ml reaksiyon tüplerinde 0.75 ml steril% 50 gliserol çözeltisi ile karıştırın. Yaklaşık10 8 hücre/ml içeren kriyostocklar elde etmek için son OD 600 1.0 olmalıdır.
- Tüpleri -80 °C'de saklayın.
- Cfp ve yfp kodlama florofor genleri ile etiketlenmiş her bir suşun üç ön kültürünü yapın. -80 °C kriyostocklardan 1 μl hücre ile ön ürünleri (4 ml LB sıvı ortam içeren steril kültür tüpleri) aşılayın. Kültürleri bir gecede 28 °C ve 220 rpm'de kuluçkaya yatırın.
2. Bakterilerin BirlikteLiği, Numune Toplama ve Numune Depolama
- 100 ml C-Glc ve CE-Glc minimal ortamı yeni hazırlayın (reaktifler ve malzemeler tablosuna bakın) ve her ortamın 20 ml'lik kısmını steril 100 ml sallama şişelerine aktarın.
- Bir gecede yetiştirilen 0,1 ml'lik ön ürünleri alın, 1,5 ml'lik bir cuvette 0,9 ml LB orta ile seyreltin ve OD600'übelirleyin.
- Yarışma deneyi için,1.0-1.5 arasında benzer bir OD 600'e sahip farklı suşların ön kültürlerini alın.
- Karışık hücre popülasyonları elde etmek için, uygun OD600'e sahip olan ön kültürlerin hücrelerini 20 ml C-Glc'de 0,05'in 600'ünE ve 100 ml sallama şişelerinde desteklenmiş CE-Glc minimal ortamına seyreltin. Yarışma deneyi için iki suş 1:1 oranında karıştırılmalıdır.
- Şişelerden 10 ml numune alın, 15 ml plastik tüplere aktarın, hücreleri standart bir masa üstü santrifüjde 4.000 x g'da 10 dakika santrifüjleme ile hasat edin ve süpernatantı atın.
- Hücreleri 0,5 ml taze LB ortamında yeniden biriktirin ve hücreleri steril 1,5 ml reaksiyon kabına aktarın. 0,5 ml% 50 steril gliserol ekleyin, süspansiyonu titiz bir girdapla karıştırın ve numuneleri bir sonraki tedaviye kadar -80 ° C dondurucuda saklayın.
- Sallama şişelerinde kalan hücreleri 37 °C ve 220 rpm'de 24 saate kadar kuluçkaya yatırın. Floroforların fotoğraf ağartmasını önlemek için sallama şişelerini karanlıkta tutun.
- 7 saat ve 24 saat büyümeden sonra 0,1 ml'lik daha fazla örnek alın. Numunelerin1:10 seyreltmelerinin (C-Glc veya CE-Glc minimal ortamında) OD 600'lerini ölçün ve not edin.
- OD600/1.0 olan kriyostocklar yapmak için her kültürden uygun miktarda hücre alın. Numuneleri bir sonraki tedaviye kadar -80 °C'de saklayın.
3. Nicel Analizler için Numune Tedavisi, Kaplama ve Kuluçka
- Tüm örnekleri topladıktan sonra, kriyostockları çözün ve hücreleri% 0,9 tuzlu su çözeltisinde seyreltin (reaktifler ve malzemeler tablosuna bakın) 10-3'ekadar.
- SP orta agar plakaları üzerinde 10 -3 seyreltmenin0.1 ml'si plaka ve steril cam pipetler kullanarak hücreleri dağıtın.
- Plakaları tek koloniler ortaya çıkana kadar karanlıkta 37 °C'de bir gecede kuluçkaya yatırın.
4. Kantitatif Analiz için Stereo Floresan Mikroskopisi ile Hayatta Kalanları Saymak
- Stereo floresan mikroskobu altında hayatta kalanları sayarken daha iyi bir yönlendirme için agar plakasının altını siyah bir kalemle dört parçaya bölün.
- Plakayı mikroskobun altına baş aşağı yerleştirin ve soğuk ışık kaynağını kullanarak kolonileri odak noktasına getirin.
- Koloniler odakta olduğunda, CFP etiketli gerinimde kalan hücreleri görselleştirmek için CFPiçin uygun filtre kümesine geçin. Kolonileri bir kalemle etiketleyerek bu gerginlikte hayatta kalanları sayın ve sayıyı not edin.
- Etiketleri etanol ile çıkarın ve yfp etiketli gerinimde kalan hücreleri görselleştirmek için YFPfiltre kümesine geçin. Kolonileri bir kalemle etiketleyarak hayatta kalanları tekrar sayın ve sayıyı not edin.
5. Yarı Saydam Analizler için Örnek Tedavi ve Mikroskopi
- Açıklayıcı rakamlar için, SP agar plakasındaki 3.1 adımından10 -4 seyreltmenin (yaklaşık 100 hücre) 10 μl'sini tespit edin (bkz. Şekil 3).
- Plakaları tek koloniler ortaya çıkana kadar karanlıkta 37 °C'de bir gecede kuluçkaya yatırın.
- Petri kabını kapaksız olarak mikroskop altına yerleştirin ve soğuk ışık kaynağını kullanarak noktayı odak noktasına getirin.
- Açıklayıcı figürler için lekelerin fotoğraflarını çekin. Soğuk ışık kaynağı ile kolonilerin fotoğraflarını çekmek için uygun bir pozlama süresi seçin.
- Plakayı hareket ettirmeden CFP filtre kümesine değiştirin, pozlama süresini ayarlayın ve fotoğraf çekin. Aynı şeyi YFP filtre kümesiyle de yapın ve daha fazla analiz için resimleri kaydedin.
6. Veri Analizi
- Nicel veri analizleri için Excel gibi yazılımları kullanın. Sayılan kolonilere dayanarak, sarı ve mavi kolonilerin yüzdesini% 100 olarak ayarlanmış tüm koloni sayısına göre hesaplayın.
- Yığılmış çubuk diyagramı oluşturmak için hesaplanan sayıları kullanın (bkz. Şekil 4 ve Şekil 5). Farklı noktalardan çekilen resimlerin birleştirilmiş resimlerini oluşturmak için Adobe Photoshop gibi bir görüntü işleme programı kullanın. Alternatif olarak, http://rsbweb.nih.gov/ij/ indirilebilen serbestçe kullanılabilen ImageJ yazılımı görüntü işleme için kullanılabilir.
- CfP filtre kümesi ve YFP filtre kümesiyle çekilen resimleri tek bir noktadan açın. Medyadan gelen arka plan floresanlarını azaltmak için kontrastı ve parlaklığı optimize edin.
- Resimlerden birine gidin ve tümlerini seçin. Resmi kopyalayın ve diğer resme yapıştırın.
- Resimleri birleştirmek için "renk atlatma" işlevini kullanın veya kanallar sekmesini kullanarak floresan resimlerin üzerine bindirin. Farklı ortamlardan ve farklı zaman noktalarından kolonilerin birleştirilmiş resimleri, sıvı kültürü içindeki farklı suşların büyümesini temsil eder.
7. Özel İpuçları: Cfp ve yfp ile Etiketlenmiş İzojenik Suşların Boya Anahtarı Deneyi ve Cocultivation
B. subtilis'teki iki florofor kodlayan genden birinin ifadesi zindeliği ve dolayısıyla bakterilerin büyüme hızını etkileyebilir. Bu nedenle, ekim sırasında bir rakip suşunun hücre popülasyonundan elimine edilmesi sadece floroforun olumsuz etkisinden kaynaklandığını dışlamak için aşağıdaki deneylerin yapılması önerilir:
- Tüm deneyi tekrarlayın ve ters etiketli suşları birlikte kullanın(örneğin, önceki cfpetiketli suş şimdi yfp geni ile etiketlenmiştir ve bunun tersi de vardır). Ters olmasına rağmen, elde edilen sonuçlar, bir suşun diğer suşa göre seçici bir büyüme avantajına sahip olduğu önceki gözlemle karşılaştırılabilir olmalıdır.
- Tüm deneyi tekrarlayın ve yfp ve cfp ile etiketlenmiş izojenik suşları koordine edin (örneğin BP40 (rocG+ gudBCR amyE::PgudB-yfp) ve BP41 (rocG+ gudBCR amyE::PgudB-cfp)). Zaman içinde hücre popülasyonunun bileşimini takip ederek iki florofordan birinin bakterilerin zindeliği üzerindeki olumsuz etkisini tahmin edin.
Sonuçlar
Burada açıklanan yöntem, sırasıyla florofor cfp ve YFP'yi kodlayan cfp ve yfp genleri ile etiketlenmiş B. subtilis suşlarından oluşan bir hücre popülasyonunda tür içi rekabeti görselleştirmek için başarıyla uygulanmıştır. Şekil 3'tegösterildiği gibi, yöntem tür içi rekabeti çok açıklayıcı bir şekilde görselleştirmek için kullanılabilir. Örneklerin küçük alanlarda tespit haline getirerek, hücre popülasyonunun klonal bileşimi bir bakışta görünür hale getirildi. Nicel analizler için uygun olmasa da, bu yaklaşım, farklı büyüme parametrelerinin(yaniazot kaynağının) başlangıçta her iki suşu da eşit miktarlarda içeren bir hücre popülasyonunun gelişimi üzerindeki etkisini kabaca tahmin etmek için yararlıdır(Şekil 3). Ayrıca, küçük ölçekli bir yaklaşımda, aynı büyüme koşulu altında yetiştirilen farklı B. subtilis suşlarının zindeliği tek bir agar plakası kullanılarak test edilebilir. Nicel analizler için numunelerin bir agar plakasının tüm yüzeyine yayılması önerilir. Bu, kolonilerin üst üste bindirilmesini önleyecek ve böylece tek hücrelerden çıkan kolonilerin farklı tanımlanmasına ve sayısına izin verecektir. Agar plakalarına uygun seyreltmeleri kaplayarak, zaman içinde bir hücre popülasyonunun klonal bileşimi, sarı ve mavi floresan kolonileri sayılarak kesin olarak belirlenebilir (bkz. Şekil 4). Daha önce bildirdiğimiz gibi, GDH aktivitesi, eksojen glutamat mevcudiyetine bağlı olarak B. subtilis'in kondisyonlarını güçlü bir şekilde etkiler2. Açıkçası, eksojen glutamat yokluğunda üst düzey GDH aktivitesi, anabolizmada ihtiyaç duyulan RocG ve GudB glutamat enzimleri olarak bakteriler için dezavantajlıdır (bkz. Şekil 1 ve Şekil 4A). Bunun aksine, bakterilere sağlanırsa, glutamat transaminasyon reaksiyonlarında amino grup bağışçısı olarak hizmet edebilir. Ayrıca, glutamat karbon metabolizmasına beslenebilir ve katabolik olarak aktif GDH'lerin varlığı nedeniyle enerji kaynağı olarak kullanılabilir RocG ve GudB (Şekil 1 ve Şekil 4B). Şekil 4C ve 4D'degösterildiği gibi, bir boya anahtarı deneyinde benzer sonuçlar elde edilmiştir. Yine, üst düzey GDH aktivitesi ile donatılmış bakteriler, glutamat eksikliği olan büyüme medyasında GDH aktivitesi azalmış hücreler tarafından yetersiz kaldı. Bunun aksine, sadece bir aktif GDH sentezleyen bakteriler, ortam glutamat ile desteklendiğinde kültürden elimine edildi. Şekil 5A ve 5B'de gösterildiği gibi, karışık hücre popülasyonunun ilk bileşimi zamanla neredeyse sabit kaldı. Bu nedenle, yarışma deneyinde, farklı miktarlarda GDH aktivitesi ile donatılmış iki suşun herhangi birinin ortadan kaldırılması, floroforların neden olduğu bir büyüme kusurundan kaynaklanmamıştır (bkz. Şekil 4). Birlikte ele alındığında, floroforların kullanımı bakteri hücre popülasyonunda tür içi rekabeti izlemek için güçlü bir araçtır.

Şekil 1. B. subtiliskarbon ve azot metabolizması arasındaki bağlantı. Glutamat ortam tarafından sağlanmadığında, anabolizma için gerekli olan ana amino donör, glutamin sentezi (GS) ve glutamat sentezinin (GOGAT) kombine etkisi ile amonyum ve 2-oksioglutarattan sentez edilir. Bunun aksine, eksojen glutamat varlığında, katabolik olarak aktif GDHs RocG ve / veya GudB glutamat amonyum ve 2-oksioglutarat, daha sonra bir karbon kaynağı olarak hizmet edebilir.
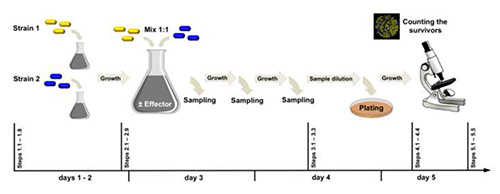
Şekil 2. Deneysel iş akışı. Strain 1 (yfpile etiketlenmiştir) ve strain 2 (cfpile etiketlenmiştir) bir çekirgede birbirinden farklıdır. Burada sunulan örnekte, eksojen glutamatın (efektör) başlangıçta rocG + gudB+ (iki aktif GDH'yi kodlayan) ve rocG+ gudB CR (bir aktif GDH'yi kodlayan) hücrelerinin% 50'sini içeren hücre popülasyonunun genotipik kayması üzerindeki etkisini karşılaştırdık. Daha büyük resmi görüntülemek için burayı tıklatın.

Şekil 3. Tür içi rekabeti açıklayıcı bir şekilde görselleştirmek için yarı niteliksel yaklaşım (bkz. bölüm 5). Cocultivation 'dan önce (0 saat) ve SP agar plakalarında 7 saat ve 24 saat büyüme seyreltmelerinden(10 -4)sonra hücreler görüldü. 37 °C'de 12 saat inkübasyondan sonra koloniler oluşturan hayatta kalan hücreler stereo floresan mikroskopi ile tanımlandı. Pozlama süresi, 0,6 sn; ölçek çubuğu, 1 mm. Bu rakam Gunka ve ark. 20132.

Şekil 4. Tür içi rekabetin nicelemesi. Sp ortamında numune seyreltme ve hücrelerin yayılmasından sonra (bkz. adımlar 3.1-3.3) plakalar gece boyunca 37 °C'de inkübe edildi. Sarı ve mavi koloniler Protokol 4 ve 6'da açıklandığı gibi ölçüldür. Siyah hata çubukları, bağımsız olarak tekrarlanan en az dört deneme için standart sapmaları temsil eder. Her agar plakası en az 100 sayısız koloni içeriyordu. (A) Eksojen glutamat yokluğunda, sadece bir fonksiyonel GDH ile donatılmış B. subtilis suşu BP40 (sarı), hem glutamat düşürücü enzimleri, RocG'yi hem de GudB'yi sentezleyen BP54 (mavi) suşunu geride çıkarır. (B) Bunun aksine, eksojen glutamat mevcut olduğunda iki fonksiyonel GDH sentezi bakteriler için avantajlıdır, çünkü glikozun yanı sıra glutamat karbon kaynağı olarak kullanılır. (C )ve (D) olarak gösterildiği gibi, bir boya anahtarı deneyinde karşılaştırılabilir sonuçlar elde edilmiştir. Bu rakam Gunka ve ark. 20132. Daha büyük resmi görüntülemek için burayı tıklatın.

Şekil 5. Florofor kodlayan cfp ve yfp genlerinin bakterilerin zindeliği üzerindeki etkisini değerlendirmek için kontrol deneyi. İsojenik suşların karışık popülasyonları BP40 (rocG+ gudBCR amyE::yfp) ve BP41 (rocG+ gudBCR amyE::cfp) veya BP52 (rocG+ gudB+ amyE::cfp) ve BP156 (rocG+ gudB+ amyE::yfp) eksojen glutamatın yokluğunda (A) ve (B) varlığında yetiştirildi. Hayatta kalan hücreler sırasıyla Protokol 1-4 ve 6'da açıklandığı gibi sayıldı. Çubuklar, bağımsız olarak tekrarlanan en az dört deney için standart sapmaları temsil eder. Bu rakam Gunka ve ark. 20132. Daha büyük resmi görüntülemek için burayı tıklatın.
Tartışmalar
Bakterilerin rekabetçi uygunluğunu analiz etmek için çeşitli yöntemler geliştirilmiştir16. Çoğu durumda bakteriler farklı antibiyotik direnç kasetleri ile etiketlenmiştir17. Yaklaşımımıza benzer şekilde, hücrelerin antibiyotik direnç kasetleri ile etiketlanması, tanımlanmış büyüme koşulları altında kokültivasyon sırasında bakterilerin rekabetçi zindeliğinin değerlendirilmesini sağlar. Ayrıca, bu yöntem kromozom17'dekibelirli bir çekirgede birbirinden farklı hücrelerin rekabetçi uygunluğunu belirlemek için kullanılabilir. Bununla birlikte, rekabetçi zindeliği izlemek için antibiyotik direnç kasetleri kullanmanın bazı dezavantajları vardır. Direnç genlerinin ekspresy ifadesi çoğunlukla eşit olmayan güce sahip organizatörler tarafından yönlendirildikçe, antibiyotiklere direnç taşıyan enzimler muhtemelen farklı seviyelerde üretilir. Bu nedenle bu yaklaşımla zayıf fitness etkileri tespit edilemeyebilir. Yaklaşımımızda, her iki florofor geni de aynı seçim işaretleyicisi ile entegre edildi ve ifadeleri aynı organizatörler tarafından yönlendiriliyor2. Antibiyotik direnç kasetleri ile rekabetçi zindeliği izlemenin bir başka dezavantajı, koloni sayımı için uygun antibiyotiklerle desteklenmiş iki tür agar plakası gerektiğinden yaklaşımın daha zahmetli olması olabilir. Alternatif olarak, bakterilerin uygunluğu sadece büyüme hızını izleyerek ve fitness indeksi16olarak adlandırılan hesaplama ile belirlenebilir. Açıkçası, bu en kesin yaklaşımdır, çünkü bakteriler ayrı ayrı yetiştirilir ve belirli bir genotipe sahip bir suş tarafından üretilebilen toksik bileşikler rakip suşun büyümesini etkilemez. Ayrıca, hücrelerin büyümesini etkileyebilecek antibiyotik kullanmaya gerek yoktur. Bununla birlikte, rekabetçi zindeliği tanımlayan sayılar sadece oldukça nötr bir şekilde sunulabildiği için her iki yaklaşım da çok açıklayıcı değildir.
Tür içi rekabeti izlemek ve ölçmek için florofor kodlama genlerinin kullanılması, diğer yöntemlere göre çeşitli avantajlara sahiptir. Her iki suş da florofor kodlama genlerini çift homolog rekombinasyonla kromozyona entegre etmişse, ekim adımlarının hiçbirinde antibiyotik kullanmaya gerek yoktur. Bu nedenle, ekim sırasında kültürden alınan örnekler aynı büyüme ortamında analiz edilebilir ve her iki suş da büyüyebilir. Bu yaklaşım, tür içi rekabetin çok açıklayıcı bir şekilde görselleştirilmesini sağlar. Ayrıca, bu yarı niteliksel yaklaşımı kullanarak aynı anda birkaç büyüme koşulu test edilebilir ve birçok farklı suş paralel olarak karşılaştırılabilir. Son olarak, mikroskop slaytlarındaki örneklerin sabitlenmesine gerek yoktur, çünkü birliktelik sırasında bakteri kültüründen alınan örnekler bir dondurucuda saklanabilir18. Böylece, tüm örnekler ve çoğaltmalar aynı anda analiz edilebilir.
Protokolümüzde iki kritik adımdan bahsedilmelidir. Kriyostockların her rakip suşunun aynı büyüme aşamasında eşit miktarda hücre içermesi gerektiğini belirtmek önemlidir. Deneye başlamadan önce kriyostocklardaki ve dolayısıyla sallama şişelerindeki suşların ilk orantısızlığı, yarışma deneyinin sonucu üzerinde güçlü bir etkiye sahip olacaktır. Bu nedenle, deneyden önce kriyostockların bileşimini kontrol etmek akıllıca olacaktır. Ayrıca, plaka üzerinde uygun miktarda hücre eşit olarak yayılmalıdır. Aksi takdirde ortaya çıkan koloniler birbirine çok yakındır ve hayatta kalan hücrelerin kesin bir şekilde belirlenmesi zorlaşacaktır.
Florofor tabanlı yaklaşımın bazı sınırlamaları ve dezavantajları da vardır. Çok kuyulu bir plaka okuyucuda cocultivation ve CFP ve YFP sinyallerinin aynı anda algılanması, floroforların heyecan ve emisyon spektrumu birbirine çok yakın olduğu için mümkün değildir. Bununla birlikte, bu teknik sorun, aynı protein iskelesine dayanarak en uygun şekilde yeşil ve kırmızı ışık yayanlar gibi farklı floresan proteinler kullanılarak atlatılabilir. Florofor temelli yaklaşımın bir başka dezavantajı, bazı mutasyonların bakterilerin sadece zayıf bir büyüme kusuruna neden olması olabilir. Bu nedenle, florofor kodlayan genlerden herhangi birinin neden olabileceği büyüme kusuru, belirli bir mutasyonun neden olduğu büyüme kusurundan daha güçlüyse, florofor bazlı yaklaşım tür içi rekabeti analiz etmek için uygun değildir. Bu nedenle, bir dizi suş oluşturmadan önce, önce sadece üst suşun hem cfp hem de yfp ile etiketlanması ve suşların birlikte kullanılması önerilir. Büyüme deneyleri, floroforların bakterilerin zindeliğini ne kadar güçlü etkilediğini ortaya koymaktadır (bkz. Şekil 5A ve 5B).
Gelecekte, hayatta kalan hücreler akış sitometrisi kullanılarak sayılırsa, tür içi rekabeti izlemek için florofor tabanlı yaklaşımın daha doğru ve daha az zahmetli olup olmayacağını test etmek ilginç olacaktır. Son zamanlarda, akış sitometrisinin B. subtilis biyofilmlerinin bileşimini analiz etmek için güçlü bir araç olduğu gösterilmiştir19. Ayrıca, bir fermentördeki florofor etiketli bakterilerin sürekli birlikteliği ile bakterilerin rekabetçi zindeliğini etkileyen zayıf fitness etkilerini analiz etmek daha uygun olabilir. Sallama şişelerinin aksine, bu yaklaşım büyüme koşullarını sabit tutmaya ve böylece uzun bir süre boyunca tür içi rekabeti izlemeye izin verir.
Açıklamalar
Yazarlar rakip finansal çıkarları olmadığını beyan ederler.
Teşekkürler
Yazarların laboratuvarındaki çalışmalar Deutsche Forschungsgemeinschaft (http://www.dfg.de tarafından desteklendi; CO 1139/1-1), Fonds der Chemischen Industrie (http://www.vci.de/fonds) ve Göttingen Moleküler Biyoloji Merkezi (GZMB). Yazarlar Jörg Stülke'yi yararlı yorumlar ve makalenin eleştirel okuması için kabul etmek istiyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| (NH4)2SO4 | Roth, Germany | 3746 | |
| Agar | Difco, USA | 214010 | |
| Ammonium ferric citrate (CAF) | Sigma-Aldrich, Germany | 9714 | |
| CaCl2 | Roth, Germany | 5239 | |
| Glucose | Applichem, Germany | A3617 | |
| Glycerol | Roth, Germany | 4043 | |
| K2HPO4•3H2O | Roth, Germany | 6878 | |
| KCl | Applichem, Germany | A3582 | |
| KH2PO4 | Roth, Germany | 3904 | |
| KOH | Roth, Germany | 6751 | |
| MgSO4•7H2O | Roth, Germany | P027 | |
| MnCl2 | Roth, Germany | T881 | |
| MnSO4•4H2O | Merck Millipore, Germany | 102786 | |
| NaCl | Roth, Germany | 9265 | |
| Nutrient broth | Roth, Germany | X929 | |
| Potassium glutamate | Applichem, Germany | A3712 | |
| Tryptone | Roth, Germany | 8952 | |
| Tryptophan | Applichem, Germany | A3445 | |
| Yeast extract | Roth, Germany | 2363 | |
| 1.5 ml Reaction tubes | Sarstedt, Germany | 72,690,001 | |
| 2.0 ml Reaction tubes | Sarstedt, Germany | 72,691 | |
| 15 ml Plastic tubes with screw cap | Sarstedt, Germany | 62,554,001 | |
| Petri dishes | Sarstedt, Germany | 82.1473 | |
| 1.5 ml Polystyrene cuvettes | Sarstedt, Germany | 67,742 | |
| 15 ml Glass culture tubes | Brand, Germany | 7790 22 | |
| 100 ml Shake flasks with aluminium caps | Brand, Germany | 928 24 | |
| Sterile 10 ml glass pipettes | Brand, Germany | 278 23 | |
| Incubator (28 and 37 °C) | New Brunswick | M1282-0012 | |
| Standard pipette set (2-20 μl, 10-100 μl, 100-1,000 μl) | Eppendorf, Germany | 4910 000.034, 4910 000.042, | |
| Table top centrifuge for 1.5 and 2 ml reaction tubes | Thermo Scientific, Heraeus Fresco 21, Germany | 75002425 | |
| Table top centrifuge for 15 ml plastic tubes | Heraeus Biofuge Primo R, Germany | 75005440 | |
| Standard spectrophotometer | Amersham Biosciences Ultrospec 2100 pro, Germany | 80-2112-21 | |
| Stereofluorescence microscope | Zeiss SteREO Lumar V12, Germany | 495008-0009-000 | |
| Freezer (-20 and -80 °C) | - | - | |
| Fridge (4 °C) | - | - | |
| Autoclave | Zirbus, LTA 2x3x4, Germany | - | |
| pH meter | pH-meter 766, Calimatic, Knick, Germany | 766 | |
| Vortex | Vortex 3, IKA, Germany | 3340000 | |
| Balance | CP2202S, Sartorius, Germany | replaced by | |
| Black pen (permanent marker) | Staedler, Germany | 317-9 | |
| Powerpoint program | Microsoft, USA | - | |
| Office Excel program | Microsoft, USA | - | Program for data processing |
| Adobe Photoshop CS5 | Adobe, USA | replaced by CS6, download | Computer program for image processing |
| Computer | PC or Mac | - | |
| ZEN pro 2011 software for the stereofluorescence microscope | Zeiss, Germany | 410135 1002 110 | AxioCam MRc Rev. Obtained through Zeiss |
| Specific solution recipes | |||
| SP Medium | |||
| 8 g Nutrient broth | |||
| 0.25 mg MgSO4•7H2O | |||
| 1 g KCl | |||
| 15 g agar for solid SP medium | if required | ||
| add 1 L with H2O | autoclave for 20 min at 121 °C | ||
| 1 ml CaCl2 (0.5 M), sterilized by filtration | |||
| 1 ml MnCl2 (10 mM), sterilized by filtration | |||
| 2 ml ammonium ferric citrate (CAF, 2.2 mg/ml), sterilized by filtration | |||
| LB Medium | |||
| 10 g Tryptone | |||
| 5 g Yeast extract | |||
| 10 g NaCl | |||
| 15 g agar for solid LB medium | if required | ||
| add 1 L with H2O | autoclave for 20 min at 121 °C | ||
| C-Glc Minimal Medium | |||
| 200 ml 5 x C salts | |||
| 10 ml L-Tryptophan (5 mg/ml), sterilized by filtration | |||
| 10 ml ammonium ferric citrate (CAF, 2.2 mg/ml), sterilized by filtration | |||
| 10 ml III’ salts | |||
| 25 ml Glucose (20%) | autoclaved for 20 min at 121 °C | ||
| add 1 L with sterile H2O | |||
| CE-Glc Minimal Medium | |||
| 200 ml 5 x C salts | |||
| 10 ml L-Tryptophan (5 mg/ml), sterilized by filtration | |||
| 10 ml ammonium ferric citrate (CAF, 2.2 mg/ml), sterilized by filtration | |||
| 10 ml III’ salts | |||
| 20 ml Glutamate (40%) | |||
| 25 ml Glucose (20%), autoclaved for 20 min at 121 °C | |||
| add 1 L with sterile H2O | |||
| 5 x C salts | |||
| 20 g KH2PO4 | |||
| 80 g K2HPO4•3H2O | |||
| 16.5 g (NH4)2SO4 | |||
| add 1 L with sterile H2O | autoclave for 20 min at 121 °C | ||
| III’ salts | |||
| 0.232 g MnSO4•4H2O | |||
| 12.3 g MgSO4•7H2O | |||
| add 1 L with sterile H2O, autoclave for 20 min at 121 °C | |||
| 40% Glutamate solution | |||
| 200 g L-Glutamic acid | |||
| adjust the pH to 7.0 by adding approximately 80 g KOH | |||
| add 0.5 L with sterile H2O | autoclave for 20 min at 121 °C | ||
| 0.9% Saline (NaCl) Solution | |||
| add 1 L with sterile H2O | autoclave for 20 min at 121 °C | ||
| 50% Glycerol solution | |||
| 295 ml Glycerol (87%) | |||
| add 0.5 L with sterile H2O | autoclave for 20 min at 121 °C | ||
| Bacteria (All strains are based on the Bacillus subtilis strain 168) | |||
| Bacillus subtilis BP40 (rocG+ gudBCR amyE::PgudB-yfp) | Laboratory strain collection | ||
| Bacillus subtilis BP41 (rocG+ gudBCR amyE::PgudB-cfp) | |||
| Bacillus subtilis BP52 (rocG+ gudB+ amyE::PgudB-cfp) | |||
| Bacillus subtilis BP156 (rocG+ gudB+ amyE::PgudB-yfp) | |||
Referanslar
- Buescher, F. I., et al. Global network reorganization during dynamic adaptations of Bacillus subtilis metabolism. Science. 335, 1099-1103 (2012).
- Gunka, K., Stannek, L., Care, R. A., Commichau, F. M. Selection-driven accumulation of suppressor mutants in Bacillus subtilis: the apparent high mutation frequency of the cryptic gudB gene and the rapid clonal expansion of gudB+ suppressors are due to growth under selection. PLoS One. 8, (2013).
- Al Mamum, A. A. M., et al. Identity and function of a large gene network underlying mutagenic repair of DNA breaks. Science. 338, 1344-1348 (2012).
- Koeppel, A. F., Wertheim, J. O., Barone, L., Gentile, N., Krizanc, D., Cohan, F. M. Speedy speciation in a bacterial microcosm: new species can arise as frequently as adaptations within a species. ISME J. 7, 1080-1091 (2013).
- Maughan, H., Nicholson, W. L. Increased fitness and alteration of metabolic pathways during Bacillus subtilis evolution in the laboratory. Appl. Environ. Microbiol. 77, 4105-4118 (2011).
- Burkholder, P. R., Giles, N. H. Induced biochemical mutations in Bacillus subtilis. Am. J. Bot. 34, 345-348 (1947).
- McLoon, A. L., Guttenplan, S. B., Kearns, D. B., Kolter, R., Losick, R. Tracing the domestication of a biofilm-forming bacterium. J. Bacteriol. 193, 2027-2034 (2011).
- Zeigler, D. R., et al. The origins of 168, W23, and other Bacillus subtilis legacy strains. J. Bacteriol. 190, 6983-6995 (2008).
- Gunka, K., Tholen, S., Gerwig, J., Herzberg, C., Stülke, J., Commichau, F. M. A high-frequency mutation in Bacillus subtilis: requirements for the decryptification of the gudB glutamate dehydrogenase. 194, 1036-1044 (2012).
- Commichau, F. M., et al. Characterization of Bacillus subtilis mutants with carbon source-independent glutamate biosynthesis. J. Mol. Microbiol. Biotechnol. 12, 106-113 (2007).
- Beckwith, J. Genetic suppressors and recovery of repressed biochemical memory. J. Biol. Chem. 284, 12585-12592 (2009).
- Gunka, K., Commichau, F. M. Control of glutamate homeostasis in Bacillus subtilis: a complex interplay between ammonium assimilation, glutamate biosynthesis and degradation. Mol. Microbiol. 85, 213-224 (2012).
- Yan, D. Protection of the glutamate pool concentrations in enteric bacteria. Proc. Natl. Acad. Sci. U.S.A. 104, 9475-9480 (2007).
- Belitsky, B. R., Sonenshein, A. L. Role and regulation of Bacillus subtilis glutamate dehydrogenase genes. J. Bacteriol. 180, 6298-6305 (1998).
- Commichau, F. M., Herzberg, C., Tripal, P., Valerius, O., Stülke, J. A regulatory protein-protein interaction governs glutamate biosynthesis in Bacillus subtilis: the glutamate dehydrogenase RocG moonlights in controlling the transcription factor GltC. Mol. Microbiol. 65, 642-654 (2007).
- Gordo, I., Perfeito, L., Sousa, A. Fitness effects of mutations in bacteria. J. Mol. Microbiol. Biotechnol. 21, 20-35 (2011).
- Rabatinová, A., et al. The δ subunit of RNA polymerase is required for rapid changes in gene expression and competitive fitness of the cell. J. Bacteriol. 195, 2603-2611 (2013).
- Capra, E. J., Perchuk, B. S., Skerker, J. M., Laub, M. T. Adaptive mutations that prevent crosstalk enable the expansion of paralogous signalling protein families. Cell. 150, 222-232 (2012).
- García-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J. Vis. Exp. (15), (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır