Method Article
Мониторинг внутривидовой конкуренции в бактериальной популяции клеток путем кокултивации флуоресцентно маркированных штаммов
В этой статье
Резюме
Бактерии могут накапливаться либо вредные или полезные мутации в течение своей жизни. В популяции клеток особи, накопившие полезные мутации, могут быстро переутомиться со своими собратьями. Здесь мы представляем простую процедуру визуализации внутривидовой конкуренции в популяции бактериальных клеток с течением времени с использованием флуоресцентно помечены лиц.
Аннотация
Многие микроорганизмы, такие как бактерии размножаются очень быстро, и популяции могут достигать высокой плотности клеток. Небольшие фракции клеток в популяции всегда имеют накопленные мутации, которые являются либо вредными или полезными для клетки. Если фитнес-эффект мутации обеспечивает субпопуляцию с сильным селективным преимуществом роста, люди этой субпопуляции могут быстро переутомляться и даже полностью устранить своих непосредственных собратьев. Таким образом, небольшие генетические изменения и отборное накопление клеток, которые приобрели полезные мутации, могут привести к полному сдвигу генотипа клеточной популяции. Здесь мы представляем процедуру мониторинга быстрого клонального расширения и устранения полезных и вредных мутаций, соответственно, в популяции бактериальных клеток с течением времени путем кокултивации флуоресцентно помеченных особей грамположительных моделей бактерий Bacillus subtilis. Метод прост в работе и очень иллюстративно для отображения внутривидовой конкуренции между лицами в популяции бактериальных клеток.
Введение
Почвенные бактерии, как правило, наделены гибкими регулирующими сетями и широкими метаболическими возможностями. Обе функции позволяют клеткам регулировать свои катаболические и анаболические пути, чтобы конкурировать со своими собратьями и другими микроорганизмами для питательных веществ, которые доступны в данной экологическойнише 1. Однако, если бактерии не в состоянии адаптироваться к окружающей среде другие механизмы могут объяснить выживание вида. Действительно, так как многие бактерии размножаются быстро и популяции могут достигать высокой плотности клеток субпопуляции, возможно, спонтанно накопленных полезных мутаций, которые обеспечивают клетки с селективным преимуществом роста и, следовательно, увеличить их пригодность. Кроме того, мутационные горячие точки и вызванный стрессом адаптивный мутагенез могут способствовать эволюции неадаптированныхбактерий 2,3. Таким образом, накопление мутаций и рост при непрерывном отборе является источником огромного микробного разнообразия, даже в пределах одногои того же рода 4,5. Как и в природе, формирование бактериальных геномов также происходит в лаборатории из-за непрерывного культивирования под отбором. Об этом свидетельствует одомашнивания грамположительных бактерий B. subtilis, которая используется во всем мире в фундаментальных исследованиях и промышленности. В 1940-х годах B. subtilis был обработан ДНК-повреждающих рентгеновских лучей с последующим культивированием при определенномсостоянии роста 6. Мутации, которые накопились в бактериях во время их одомашнивания, обустраивания составляют потерю многих характеристик роста, т.е. лабораторный штамм B. subtilis 168 потерял способность формировать сложныеколонии 7,8.
В настоящее время для наиболее изученных моделей бактерий Escherichia coli и B. subtilis,различные мощные инструменты доступны для генетического манипулирования их геномами для решения конкретных научных вопросов. Иногда инактивация гена интереса вызывает серьезный дефект роста, который затем хорошо виден на стандартной среде роста9. В отличие от этого, мутации, которые вызывают слабый дефект роста и, таким образом, лишь незначительно влияют на пригодность штамма часто игнорируются. Однако в обоих случаях длительная инкубация и пролет мутантных штаммов в течение нескольких поколений обычно приводят к накоплению мутантов-супрессоров, которые восстановили фенотип родительскогоштамма 2,9. Характеристика мутантов-супрессоров и выявление мутаций, которые восстановили дефект роста родительского мутантного штамма, является очень полезным подходом, который позволяет прояснить важные и часто новые клеточныепроцессы 10,11.
Мы заинтересованы в контроле глютамата гомеостаза в B. subtilis12. Как и к кишечной палочке, B. subtilis реагирует на возмущение глютамата гомеостаза(т.е.блокв деградации глутамата 2) путем накопления мутантов-супрессоров. Геномные изменения в этих мутантов супрессора, которые были приобретены спонтанной мутации было показано, быстро восстановить глютамат гомеостаз9,13. Поэтому неудивительно, что адаптация B. subtilis к определенному состоянию роста во время одомашнивания бактерии отражается в синтезе ферментов и в развитых ферментных действиях, которые участвуют в метаболизме глутамата12. Было высказано предположение, что отсутствие экзогенного глутамата в среде роста в процессе одомашнивания было движущей силой для появления и фиксации загадочного дегидрогеназы глутамата (GDH) gudBCR гена в лабораторном штамме 1682,14. Эта гипотеза подтверждается нашим наблюдением, что снижение количества активности GDH в лабораторном штамме обеспечивает бактериям селективное преимущество роста, когда экзогенный глутаматдефицитен 2. Кроме того, культивирование штамма B. subtilis, синтезируя GDH GudB, при отсутствии экзогенного глутамата приводит к накоплению мутантов-супрессоров, которые инактивировали ген gudB 2. Очевидно, что наличие катаболически активного GDH невыгодно для клетки, потому что эндогенно производства глутамата, которые могли бы быть использованы для анаболизма деградирует до аммония и 2-оксоглутарат (Рисунок 1). В отличие от этого, когда глутамат обеспечивается средой, штамм B. subtilis, оснащенный высокоуровневой активностью GDH, имеет избирательное преимущество роста по сравнению с штаммом, который синтезирует только один функциональный GDH. Разумно предположить, что активность ГДГ высокого уровня позволяет бактериям использовать глутамат в качестве второго источника углерода в дополнение к другим источникам углерода, предоставляемымсредой 2 (см. рисунок 1). Таким образом, активность ГДГ сильно влияет на пригодность бактерий, в зависимости от наличия экзогенного глутамата.
Здесь мы представляем очень иллюстративный метод мониторинга и визуализации внутривидовой конкуренции между двумя штаммами B. subtilis, которые отличаются одним локусом нахромосоме (рисунок 2). Эти два штамма были помечены генами yfp и cfp, кодирующих фторфоры YFP и CFP, и сокультивированы в различных условиях питания. Путем выборки с течением времени и путем покрытия соответствующих разбавлений на агарных пластинах выживших в каждой из культур можно было бы легко контролировать с помощью общего стерео флуоресценции микроскопа. Процедура, описанная в настоящем документе, проста в работе и подходит для визуализации быстрого расширения клонов и устранения полезных и вредных мутаций, соответственно, в популяции клеток с течением времени.
протокол
1. Подготовка Агар плиты, культуры СМИ, Cryostocks, и прекультуры
- Подготовка средств роста и необходимых реагентов (см. таблицу материалов и реагентов).
- Полоса штаммов B. subtilis (например. BP40 (rocG- gudBCR amyE::PgudB-yfp) и BP52(rocG - gudB - amyE::PgudB-cfp), выражающий один и два активных GDH, соответственно)2, которые будут использоваться в конкурсе эксперимента на средних агарных пластинах SP, чтобы получить одиночные колонии. Инкубировать пластины на ночь при 37 градусов по Цельсию.
- Возьмите одиночные колонии и привить стерильные трубки культуры, содержащие 4 мл жидкой среды LB. Выращиваем бактерии на ночь при 28 градусах Цельсия и 220 об/мин.
- Выращивайте ночные культуры при 28 градусах Цельсия, чтобы избежать, чтобы клетки лизали или спорулируют.
- Измерьте оптическую плотность культур на длине волны 600 нм (OD600) с помощью стандартного спектрофотометра.
- Если культуры достигли OD600 из 2.0, смешайте 0,75 мл культур с 0,75 мл стерильного 50% глицеролового раствора в 1,5 мл реакционной трубки. Окончательный OD600 должен быть 1.0 для получения криостоков, содержащих около 108 клеток/мл.
- Храните трубки при -80 градусов по Цельсию.
- Сделайте три прекультуры каждого штамма помечены cfp и yfp кодирования флюорофор генов. Прививать прекультуры (стерильные трубки культуры, содержащие 4 мл ЛБ жидкой среды) с 1 клеток мкл от -80 градусов по Цельсию криостоков. Инкубировать культуры на ночь при 28 градусов по Цельсию и 220 об / мин.
2. Кокултивация бактерий, сбор образцов и хранение образцов
- Свежеприготовь 100 мл C-Glc и CE-Glc минимальной среды (см. таблицу реагентов и материалов), и передать 20 мл каждой среды в стерильные 100 мл встряхнуть колбы.
- Возьмите 0,1 мл прекультур, которые были выращены на ночь, разбавить их 0,9 мл ЛБ среды в 1,5 мл кюветт, и определить OD600.
- Для конкурсного эксперимента возьмем те предкультуры различных штаммов, которые имеют аналогичный OD600 между 1.0-1.5.
- Чтобы получить смешанные популяции клеток, разбавить клетки прескультур, которые имели соответствующие OD600 к OD600 из 0,05 в 20 мл C-Glc и CE-Glc минимальной среде дополняется в 100 мл встряхнуть колбы. Для конкурсных экспериментов два штамма должны быть смешаны в соотношении 1:1.
- Возьмите 10 мл образцов из колб, перенесите их на 15 мл пластиковых трубок, соуродайте клетки центрифугой в течение 10 минут при 4000 х г в стандартной центрифуге столешного верха и отбросьте супернатант.
- Переусердуй клетки в 0,5 мл свежей среды LB, и передать клетки стерильной 1,5 мл реакции чашки. Добавьте 0,5 мл 50% стерильного глицерола, смешайте суспензию с помощью строгого вихря и храните образцы в морозильной камере -80 градусов по Цельсию до дальнейшей обработки.
- Инкубировать клетки, которые остаются в колбы встряхивания до 24 часов при 37 градусов по Цельсию и 220 об / мин. Держите колбы встряхивания в темноте, чтобы предотвратить отбеливание фото фторфоров.
- Возьмите дополнительные образцы 0,1 мл после 7 часов и 24 часов роста. Измерьте и обратите внимание на OD600 из 1:10 разбавления (в C-Glc или CE-Glc минимальной среде) образцов.
- Возьмите соответствующее количество клеток из каждой культуры, чтобы сделать криостоки, которые имеют OD600 из 1,0. Храните образцы при -80 градусов по Цельсию до дальнейшего лечения.
3. Примеры лечения, платирования и инкубации для количественного анализа
- После сбора всех образцов, оттаивать криостоки, и разбавить клетки в 0,9% солевой раствор (см. таблицу реагентов и материалов) до 10-3.
- Плита 0,1 мл из 10-3 разбавления на SP средних пластин агара и распространять клетки с помощью стерильных стеклянных пипеток.
- Инкубировать пластины ночь на 37 градусов по Цельсию в темноте, пока не появились одиночные колонии.
4. Подсчет выживших с помощью стерео флуоресцентной микроскопии для количественного анализа
- Разделите дно агарной пластины черной ручкой на четыре части для лучшей ориентации, считая выживших под стерео флуоресцентным микроскопом.
- Поместите пластину вверх дном под микроскопом и привести колонии в фокусе с помощью холодного источника света.
- После того, как колонии находятся в фокусе, переключитесь на соответствующий набор фильтров для CFP, чтобы визуализировать уцелевшие клетки штамма,помеченного cFP. Подсчитайте выживших в этом штамме, помемив колонии ручкой и обратите внимание на число.
- Удалите этикетки с этанолом и переключитесь на набор фильтров YFP, чтобы визуализировать уцелевшие клетки штамма с маркировкой yfp. Подсчитайте выживших снова, помекая колонии ручкой и обратите внимание на номер.
5. Пример лечения и микроскопии для семиколичного анализа
- Для иллюстративных рисунков, пятно 10 мкл из 10-4 разбавления (примерно 100 клеток) от шага 3.1 на пластине SP агара (см. Рисунок 3).
- Инкубировать пластины ночь на 37 градусов по Цельсию в темноте, пока не появились одиночные колонии.
- Поместите чашку Петри без крышки под микроскопом и привести пятно в фокусе с помощью холодного источника света.
- Сфот фотографируете пятна для иллюстративных фигур. Выберите подходящее время экспозиции для съемки колоний с холодным источником света.
- Не перемещая пластину, измените набор фильтров CFP, отрегулируйте время экспозиции и смойте. Сделай то же самое с набором фильтров YFP и сохраните фотографии для дальнейшего анализа.
6. Анализ данных
- Используйте программное обеспечение, такое как Excel, для количественного анализа данных. Исходя из подсчитанных колоний, вычислите процент желто-синих колоний по отношению к целому количеству колоний, которые установлены на 100%.
- Используйте рассчитанные числа для создания сложенной диаграммы бара (см. рисунок 4 и рисунок 5). Используйте программу обработки изображений, такую как Adobe Photoshop, чтобы создавать объединенные фотографии фотографий, сделанных из разных мест. Кроме того, для обработки изображений можно использовать свободно доступное программное обеспечение ImageJ, http://rsbweb.nih.gov/ij/ загружаемое из системы.
- Откройте фотографии из одного места, которые были сделаны с набором фильтров CFP и набором фильтров YFP. Оптимизируйте контрастность и яркость, чтобы уменьшить фоновое флуоресценцию от мультимедиа.
- Перейти к одной из фотографий и выбрать все. Скопируйте картинку и вставьте ее на другую картинку.
- Либо использовать функцию "цвет Dodge", чтобы объединить фотографии или наложения флуоресцентных изображений с помощью вкладки каналов. Слитые изображения колоний из разных средств массовой информации и различных точек времени представляют собой рост различных штаммов в жидкой культуре.
7. Конкретные советы: краситель переключатель эксперимент и cocultivation изогенных штаммов помечены cfp и yfp
Выражение любого из двух генов, кодирующих фторфор в B. subtilis, может повлиять на пригодность и, следовательно, темпы роста бактерий. Поэтому рекомендуется провести следующие эксперименты, чтобы исключить, что устранение одного штамма конкурента из популяции клеток во время культивирования просто обусловлено негативным эффектом флюорофора:
- Повторите весь эксперимент и cocultivate обратно помечены штаммов(например, ранее cFP-помеченыштамм в настоящее время помечены геном yfp и наоборот). Хотя и на обратной стороне, полученные результаты должны быть сопоставимы с предыдущим наблюдением, что один штамм имеет избирательное преимущество роста по сравнению с другим штаммом.
- Повторите весь эксперимент и cocultivate изогенных штаммов помечены yfp и cfp (например, BP40 (rocG и gudBCR amyE::PgudB-yfp) и BP41 ( rocG и gudBCR amyE::PgudB-cfp)). Оцените негативное влияние любого из двух флюорофоров на пригодность бактерий, следуя составу популяции клеток с течением времени.
Результаты
Описанный здесь метод был успешно применен для визуализации внутривидовой конкуренции в популяции клеток, состоящей из штаммов B. subtilis, которые были помечены генами cfp и yfp, кодирующих фторфоры CFP и YFP, соответственно. Как показано на рисунке 3, метод может быть использован для визуализации внутривидовой конкуренции в очень иллюстративным образом. При обнаружении образцов на небольших участках с первого взгляда был виден клональный состав популяции клеток. Хотя этот подход не подходит для количественного анализа, он полезен для приблизительной оценки влияния различных параметров роста(т.е.источника азота) на развитие популяции клеток, которая первоначально содержала оба штамма в равных количествах(рисунок 3). Кроме того, при мелкомасштабной подходе пригодность различных штаммов B. subtilis, которые культивировались в одном и том же состоянии роста, может быть проверена с помощью одной агарной пластины. Для количественного анализа рекомендуется распространять образцы по всей поверхности агарной пластины. Это предотвратит наложение колоний и, таким образом, позволит четко идентифицировать и считать колонии, которые возникли из одиночных ячеек. Путем покрытия соответствующих разбавлений на агарных пластинах клональный состав популяции клеток с течением времени может быть точно определен просто путем подсчета желтых и синих флуоресцентных колоний (см. рисунок 4). Как мы уже сообщали ранее, активность GDH сильно влияет на пригодность B. subtilis в зависимости от наличия экзогенного глутамата2. Очевидно, что при отсутствии экзогенного глутамата активность высокого уровня ГДГ невыгодна для бактерий, так как ферменты RocG и GudB деградируют глутаматом, который необходим при анаболизме (см. рисунок 1 и рисунок 4A). В отличие от этого, если предоставляется бактериям, глутамат может служить в качестве донора аминокислотной группы в трансаминации реакций. Кроме того, глутамат может быть подан в метаболизм углерода и используется в качестве источника энергии из-за присутствия катаболически активных GDHs RocG и GudB(рисунок 1 и рисунок 4B). Как показано на рисунках 4C и 4D, аналогичные результаты были получены в эксперименте красителя-переключателя. Опять же, бактерии, оснащенные высокоуровневой активностью GDH, были outcompeted клетками с пониженной активностью GDH в средствах роста, не имеющих глутамата. В отличие от этого, бактерии, синтезующие только один активный GDH были исключены из культуры, когда среда была дополнена глутамата. Как показано на рисунках 5A и 5B, первоначальный состав смешанной популяции клеток оставался почти неизменным с течением времени. Таким образом, в конкурсном эксперименте устранение любого из двух штаммов, которые были оснащены различными количествами активности GDH, не было связано с дефектом роста, вызванным флюорофорами (см. рисунок 4). В совокупности использование фторфоров является мощным инструментом для мониторинга внутривидовой конкуренции в популяции бактериальных клеток.

Рисунок 1. Связь между метаболизмом углерода и азота в B. subtilis. Когда глутамат не обеспечивается средой, основным донором аминокислот, который необходим для анаболизма синтезируется из аммония и 2-оксоглутарата путем комбинированного действия глутамина синтезазы (GS) и глутамат синтазы (GOGAT). В отличие от этого, в присутствии экзогенного глутамата катаболически активный GDHs RocG и/или GudB может деградировать глутамата до аммония и 2-оксоглутарата, который затем служит источником углерода.
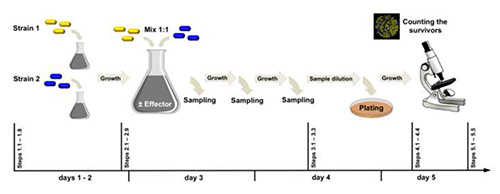
Рисунок 2. Экспериментальный рабочий процесс. Штамм 1 (помеченный yfp) иштамм 2 (помеченный cfp) отличаются одним локусом друг от друга. В приведенном здесь примере мы сравнили влияние экзогенного глутамата (эффектора) на генотипический сдвиг популяции клеток, который первоначально содержал 50% rocG и gudB (кодирование двух активных GDH) и 50% клеток rocG и gudBCR (кодирование одной активной GDH). Нажмите здесь, чтобы просмотреть изображение большего размера.

Рисунок 3. Полуквантитивный подход к визуализации внутривидовой конкуренции описательным образом (см. раздел 5). До кокултивации (0 часов), а после 7 часов и 24 часов разбавления роста (10-4)клеток были замечены на пластинах SP агара. Выжившие клетки, которые образовали колонии после 12 часов инкубации при 37 градусах Цельсия, были выявлены с помощью стерео флуоресцентной микроскопии. Время экспозиции, 0,6 сек; шкала бар, 1 мм. Эта цифра была изменена из Гунка и др. 20132.

Рисунок 4. Количественная оценка внутривидовой конкуренции. После разбавления образца и распространения клеток (см. шаги 3.1-3.3) на среде SP пластины были инкубированы на ночь при 37 градусах Цельсия. В протоколах 4 и 6 были определены желтые и синие колонии. Черные бары ошибок представляют собой стандартные отклонения по крайней мере для четырех независимо повторяющихся экспериментов. Каждая агарная пластина содержала не менее 100 подсчитывается колониями. (A) При отсутствии экзогенного глутамата штамм B. subtilis BP40 (желтый) оснащен только одним функциональным штаммом GDH outcompetes BP54 (синий), который синтезирует как глутамат-унизительные ферменты, RocG и GudB. (B) В отличие от этого, синтез двух функциональных GDHs выгодно для бактерий, когда экзогенный глутамат доступен, потому что в дополнение к глюкозе, глутамат используется в качестве источника углерода. Как показано в(C) и (D), сопоставимые результаты были получены в эксперименте переключателя красителя. Эта цифра была изменена из Гунка и др. 20132. Нажмите здесь, чтобы просмотреть изображение большего размера.

Рисунок 5. Контрольный эксперимент для оценки влияния флюорофорно-кодирующих cfp и yfp генов на пригодность бактерий. Смешанные популяции изогенных штаммов BP40 ( rocG - gudBCR amyE::yfp) и BP41 (rocG - gudBCR amyE::cfp) или BP52 ( rocG -gudB : :cfp ) и BP156(rocG - gudB -amyE::yfp ) были выращены в отсутствие(вотсутствие) Оставшиеся в живых ячейки были засчитаны как описанные в протоколах 1-4 и 6, соответственно. Бары представляют собой стандартные отклонения по крайней мере для четырех независимо повторяющихся экспериментов. Эта цифра была изменена из Гунка и др. 20132. Нажмите здесь, чтобы просмотреть изображение большего размера.
Обсуждение
Несколько методов были разработаны для анализа конкурентоспособной пригодностибактерий 16. Во многих случаях бактерии были помечены различными кассетами устойчивости к антибиотикам17. Как и наш подход, маркировка клеток с помощью кассет с устойчивостью к антибиотикам позволяет оценку конкурентоспособной пригодности бактерий во время кокултивации в определенных условиях роста. Кроме того, этот метод может быть использован для определения конкурентоспособной пригодности клеток, которые отличаются друг от друга в определенном локусе нахромосоме 17. Тем не менее, Есть некоторые недостатки, используя антибиотикорезистентности кассеты для мониторинга конкурентоспособной пригодности. Поскольку экспрессия генов резистентности в основном определяется промоутеров, имеющих неравную силу ферментов, присутующих устойчивость к антибиотикам, вероятно, производятся на различных уровнях. Таким образом, слабые эффекты фитнеса могут быть не обнаружены с помощью этого подхода. В нашем подходе, оба гена фторфора были интегрированы с тем же маркером отбора и их экспрессия обусловлена теми же промоутерами2. Другим недостатком для мониторинга конкурентоспособной пригодности с помощью кассет с устойчивостью к антибиотикам может быть то, что подход является более трудоемким, поскольку для подсчета колонии необходимы два типа агарных пластин, дополненных соответствующими антибиотиками. Кроме того, пригодность бактерий может быть определена путем простого мониторинга темпов роста и расчета так называемого фитнес-индекса16. Очевидно, что это наиболее точный подход, потому что бактерии выращиваются индивидуально и токсичных соединений, которые могут быть произведены штамма с определенным генотипом не повлияет на рост конкурирующих штамма. Кроме того, нет необходимости использовать антибиотики, которые могут повлиять на рост клеток. Тем не менее, оба подхода не очень показательны, поскольку цифры, описывающие конкурентную пригодность, могут быть представлены только в довольно нейтральном ключе.
Использование генов кодирования фторфора для мониторинга и количественной оценки внутривидовой конкуренции имеет ряд преимуществ по сравнению с другими методами. Если оба штамма интегрировали гены флюорофора, кодирующиеся путем двойной гомологичной рекомбинации в хромосому, нет необходимости использовать антибиотики ни в одном из этапов культивирования. Таким образом, образцы, взятые из культуры во время выращивания могут быть проанализированы на той же среде роста и оба штамма способны расти. Такой подход позволяет очень показательно визуализировать внутривидовую конкуренцию. Кроме того, с помощью этого полуколичественный подход несколько условий роста могут быть проверены в то же время и много различных штаммов можно сравнить параллельно. Наконец, нет необходимости в фиксации образцов на слайдах микроскопа, потому что образцы, взятые из бактериальной культуры во время кокултивации, могут храниться вморозильной камере 18. Таким образом, все образцы и репликации могут быть проанализированы одновременно.
Необходимо упомянуть о двух важных шагах в нашем протоколе. Важно отметить, что криостоки должны содержать одинаковое количество клеток в одной фазе роста каждого штамма конкурента. Первоначальная диспропорция штаммов в криостоках и, следовательно, в колбе встряхивания перед началом эксперимента будет иметь сильное влияние на исход эксперимента конкуренции. Поэтому перед экспериментом целесообразно проверить состав криостоков. Кроме того, соответствующее количество клеток должно равномерно распространяться по пластине. В противном случае возникшие колонии находятся слишком близко друг к другу, и точное определение выживших клеток станет трудным.
Существуют также некоторые ограничения и недостатки подхода, основанного на фторфоре. Кокултивация в многоясхвачих считыватель пластин и одновременное обнаружение сигналов CFP и YFP невозможны, так как возбуждение и эмиссионной спектры фторфоров слишком близко друг к другу. Тем не менее, эта техническая проблема может быть обойти с помощью различных флуоресцентных белков, таких как те, излучающих зеленый и красный свет, оптимально на основе того же белка эшафот. Еще одним недостатком подхода, основанного на фторфоре, может быть то, что некоторые мутации вызывают лишь слабый дефект роста бактерий. Таким образом, если дефект роста, который может быть вызван одним из генов, кодирующих фторфор, сильнее, чем дефект роста, вызванный определенной мутацией, подход на основе фторфора не подходит для анализа внутривидовой конкуренции. Поэтому, прежде чем создавать целый набор штаммов рекомендуется сначала маркировать только родительский штамм с обоими, cfp и yfp, и cocultivate штаммов. Эксперименты роста покажет, насколько сильны флюорофоры влияют на пригодность бактерий (см. рисунки 5A и 5B).
В будущем будет интересно проверить, будет ли флюорофорный подход к мониторингу внутривидовой конкуренции более точным и менее трудоемким, если считать выжившие клетки с помощью цитометрии потока. В последнее время цитометрия потока была показана как мощный инструмент для анализа состава биопленок B. subtilis 19. Кроме того, было бы более целесообразным проанализировать слабые фитнес-эффекты, которые влияют на конкурентную пригодность бактерий путем непрерывной кокултивации фторфора помечены бактерий в ферментер. В отличие от колб, такой подход позволяет сохранить условия роста постоянными и, таким образом, контролировать внутривидовую конкуренцию в течение длительного периода времени.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Работа в лаборатории авторов была поддержана Deutsche Forschungsgemeinschaft (http://www.dfg.de; CO 1139/1-1), Фонды дер Chemischen промышленности (http://www.vci.de/fonds), и Гёттинген Центр молекулярной биологии (ГЗМБ). Авторы хотели бы отметить, что ярг Штюльке сделал полезные комментарии и критические замечания по поводу прочтения рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| (NH4)2SO4 | Roth, Germany | 3746 | |
| Agar | Difco, USA | 214010 | |
| Ammonium ferric citrate (CAF) | Sigma-Aldrich, Germany | 9714 | |
| CaCl2 | Roth, Germany | 5239 | |
| Glucose | Applichem, Germany | A3617 | |
| Glycerol | Roth, Germany | 4043 | |
| K2HPO4•3H2O | Roth, Germany | 6878 | |
| KCl | Applichem, Germany | A3582 | |
| KH2PO4 | Roth, Germany | 3904 | |
| KOH | Roth, Germany | 6751 | |
| MgSO4•7H2O | Roth, Germany | P027 | |
| MnCl2 | Roth, Germany | T881 | |
| MnSO4•4H2O | Merck Millipore, Germany | 102786 | |
| NaCl | Roth, Germany | 9265 | |
| Nutrient broth | Roth, Germany | X929 | |
| Potassium glutamate | Applichem, Germany | A3712 | |
| Tryptone | Roth, Germany | 8952 | |
| Tryptophan | Applichem, Germany | A3445 | |
| Yeast extract | Roth, Germany | 2363 | |
| 1.5 ml Reaction tubes | Sarstedt, Germany | 72,690,001 | |
| 2.0 ml Reaction tubes | Sarstedt, Germany | 72,691 | |
| 15 ml Plastic tubes with screw cap | Sarstedt, Germany | 62,554,001 | |
| Petri dishes | Sarstedt, Germany | 82.1473 | |
| 1.5 ml Polystyrene cuvettes | Sarstedt, Germany | 67,742 | |
| 15 ml Glass culture tubes | Brand, Germany | 7790 22 | |
| 100 ml Shake flasks with aluminium caps | Brand, Germany | 928 24 | |
| Sterile 10 ml glass pipettes | Brand, Germany | 278 23 | |
| Incubator (28 and 37 °C) | New Brunswick | M1282-0012 | |
| Standard pipette set (2-20 μl, 10-100 μl, 100-1,000 μl) | Eppendorf, Germany | 4910 000.034, 4910 000.042, | |
| Table top centrifuge for 1.5 and 2 ml reaction tubes | Thermo Scientific, Heraeus Fresco 21, Germany | 75002425 | |
| Table top centrifuge for 15 ml plastic tubes | Heraeus Biofuge Primo R, Germany | 75005440 | |
| Standard spectrophotometer | Amersham Biosciences Ultrospec 2100 pro, Germany | 80-2112-21 | |
| Stereofluorescence microscope | Zeiss SteREO Lumar V12, Germany | 495008-0009-000 | |
| Freezer (-20 and -80 °C) | - | - | |
| Fridge (4 °C) | - | - | |
| Autoclave | Zirbus, LTA 2x3x4, Germany | - | |
| pH meter | pH-meter 766, Calimatic, Knick, Germany | 766 | |
| Vortex | Vortex 3, IKA, Germany | 3340000 | |
| Balance | CP2202S, Sartorius, Germany | replaced by | |
| Black pen (permanent marker) | Staedler, Germany | 317-9 | |
| Powerpoint program | Microsoft, USA | - | |
| Office Excel program | Microsoft, USA | - | Program for data processing |
| Adobe Photoshop CS5 | Adobe, USA | replaced by CS6, download | Computer program for image processing |
| Computer | PC or Mac | - | |
| ZEN pro 2011 software for the stereofluorescence microscope | Zeiss, Germany | 410135 1002 110 | AxioCam MRc Rev. Obtained through Zeiss |
| Specific solution recipes | |||
| SP Medium | |||
| 8 g Nutrient broth | |||
| 0.25 mg MgSO4•7H2O | |||
| 1 g KCl | |||
| 15 g agar for solid SP medium | if required | ||
| add 1 L with H2O | autoclave for 20 min at 121 °C | ||
| 1 ml CaCl2 (0.5 M), sterilized by filtration | |||
| 1 ml MnCl2 (10 mM), sterilized by filtration | |||
| 2 ml ammonium ferric citrate (CAF, 2.2 mg/ml), sterilized by filtration | |||
| LB Medium | |||
| 10 g Tryptone | |||
| 5 g Yeast extract | |||
| 10 g NaCl | |||
| 15 g agar for solid LB medium | if required | ||
| add 1 L with H2O | autoclave for 20 min at 121 °C | ||
| C-Glc Minimal Medium | |||
| 200 ml 5 x C salts | |||
| 10 ml L-Tryptophan (5 mg/ml), sterilized by filtration | |||
| 10 ml ammonium ferric citrate (CAF, 2.2 mg/ml), sterilized by filtration | |||
| 10 ml III’ salts | |||
| 25 ml Glucose (20%) | autoclaved for 20 min at 121 °C | ||
| add 1 L with sterile H2O | |||
| CE-Glc Minimal Medium | |||
| 200 ml 5 x C salts | |||
| 10 ml L-Tryptophan (5 mg/ml), sterilized by filtration | |||
| 10 ml ammonium ferric citrate (CAF, 2.2 mg/ml), sterilized by filtration | |||
| 10 ml III’ salts | |||
| 20 ml Glutamate (40%) | |||
| 25 ml Glucose (20%), autoclaved for 20 min at 121 °C | |||
| add 1 L with sterile H2O | |||
| 5 x C salts | |||
| 20 g KH2PO4 | |||
| 80 g K2HPO4•3H2O | |||
| 16.5 g (NH4)2SO4 | |||
| add 1 L with sterile H2O | autoclave for 20 min at 121 °C | ||
| III’ salts | |||
| 0.232 g MnSO4•4H2O | |||
| 12.3 g MgSO4•7H2O | |||
| add 1 L with sterile H2O, autoclave for 20 min at 121 °C | |||
| 40% Glutamate solution | |||
| 200 g L-Glutamic acid | |||
| adjust the pH to 7.0 by adding approximately 80 g KOH | |||
| add 0.5 L with sterile H2O | autoclave for 20 min at 121 °C | ||
| 0.9% Saline (NaCl) Solution | |||
| add 1 L with sterile H2O | autoclave for 20 min at 121 °C | ||
| 50% Glycerol solution | |||
| 295 ml Glycerol (87%) | |||
| add 0.5 L with sterile H2O | autoclave for 20 min at 121 °C | ||
| Bacteria (All strains are based on the Bacillus subtilis strain 168) | |||
| Bacillus subtilis BP40 (rocG+ gudBCR amyE::PgudB-yfp) | Laboratory strain collection | ||
| Bacillus subtilis BP41 (rocG+ gudBCR amyE::PgudB-cfp) | |||
| Bacillus subtilis BP52 (rocG+ gudB+ amyE::PgudB-cfp) | |||
| Bacillus subtilis BP156 (rocG+ gudB+ amyE::PgudB-yfp) | |||
Ссылки
- Buescher, F. I., et al. Global network reorganization during dynamic adaptations of Bacillus subtilis metabolism. Science. 335, 1099-1103 (2012).
- Gunka, K., Stannek, L., Care, R. A., Commichau, F. M. Selection-driven accumulation of suppressor mutants in Bacillus subtilis: the apparent high mutation frequency of the cryptic gudB gene and the rapid clonal expansion of gudB+ suppressors are due to growth under selection. PLoS One. 8, (2013).
- Al Mamum, A. A. M., et al. Identity and function of a large gene network underlying mutagenic repair of DNA breaks. Science. 338, 1344-1348 (2012).
- Koeppel, A. F., Wertheim, J. O., Barone, L., Gentile, N., Krizanc, D., Cohan, F. M. Speedy speciation in a bacterial microcosm: new species can arise as frequently as adaptations within a species. ISME J. 7, 1080-1091 (2013).
- Maughan, H., Nicholson, W. L. Increased fitness and alteration of metabolic pathways during Bacillus subtilis evolution in the laboratory. Appl. Environ. Microbiol. 77, 4105-4118 (2011).
- Burkholder, P. R., Giles, N. H. Induced biochemical mutations in Bacillus subtilis. Am. J. Bot. 34, 345-348 (1947).
- McLoon, A. L., Guttenplan, S. B., Kearns, D. B., Kolter, R., Losick, R. Tracing the domestication of a biofilm-forming bacterium. J. Bacteriol. 193, 2027-2034 (2011).
- Zeigler, D. R., et al. The origins of 168, W23, and other Bacillus subtilis legacy strains. J. Bacteriol. 190, 6983-6995 (2008).
- Gunka, K., Tholen, S., Gerwig, J., Herzberg, C., Stülke, J., Commichau, F. M. A high-frequency mutation in Bacillus subtilis: requirements for the decryptification of the gudB glutamate dehydrogenase. 194, 1036-1044 (2012).
- Commichau, F. M., et al. Characterization of Bacillus subtilis mutants with carbon source-independent glutamate biosynthesis. J. Mol. Microbiol. Biotechnol. 12, 106-113 (2007).
- Beckwith, J. Genetic suppressors and recovery of repressed biochemical memory. J. Biol. Chem. 284, 12585-12592 (2009).
- Gunka, K., Commichau, F. M. Control of glutamate homeostasis in Bacillus subtilis: a complex interplay between ammonium assimilation, glutamate biosynthesis and degradation. Mol. Microbiol. 85, 213-224 (2012).
- Yan, D. Protection of the glutamate pool concentrations in enteric bacteria. Proc. Natl. Acad. Sci. U.S.A. 104, 9475-9480 (2007).
- Belitsky, B. R., Sonenshein, A. L. Role and regulation of Bacillus subtilis glutamate dehydrogenase genes. J. Bacteriol. 180, 6298-6305 (1998).
- Commichau, F. M., Herzberg, C., Tripal, P., Valerius, O., Stülke, J. A regulatory protein-protein interaction governs glutamate biosynthesis in Bacillus subtilis: the glutamate dehydrogenase RocG moonlights in controlling the transcription factor GltC. Mol. Microbiol. 65, 642-654 (2007).
- Gordo, I., Perfeito, L., Sousa, A. Fitness effects of mutations in bacteria. J. Mol. Microbiol. Biotechnol. 21, 20-35 (2011).
- Rabatinová, A., et al. The δ subunit of RNA polymerase is required for rapid changes in gene expression and competitive fitness of the cell. J. Bacteriol. 195, 2603-2611 (2013).
- Capra, E. J., Perchuk, B. S., Skerker, J. M., Laub, M. T. Adaptive mutations that prevent crosstalk enable the expansion of paralogous signalling protein families. Cell. 150, 222-232 (2012).
- García-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J. Vis. Exp. (15), (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены