Method Article
مراقبة المنافسة داخل الأنواع في مجموعة الخلايا البكتيرية عن طريق Cocultivation من السلالات المسمى Fluorescently
In This Article
Summary
البكتيريا قد تتراكم إما الطفرات الضارة أو المفيدة خلال حياتهم. في مجموعة من الخلايا الأفراد التي تراكمت الطفرات المفيدة قد تفوق بسرعة زملائهم. هنا نقدم إجراء بسيط لتصور المنافسة داخل الأنواع في مجموعة خلايا بكتيرية مع مرور الوقت باستخدام الأفراد المسمى fluorescently.
Abstract
العديد من الكائنات الحية الدقيقة مثل البكتيريا تتكاثر بسرعة كبيرة والسكان قد تصل إلى كثافات الخلايا العالية. الكسور الصغيرة من الخلايا في السكان لديها دائما الطفرات المتراكمة التي هي إما ضارة أو مفيدة للخلية. إذا كان تأثير اللياقة البدنية للطفرة يوفر للزم السكان الفرعيين ميزة نمو انتقائية قوية ، فقد يتفوق أفراد هذه الاكتظاظ السكاني الفرعي بسرعة وحتى القضاء التام على زملائهم المباشرين. وهكذا، فإن التغيرات الجينية الصغيرة والتراكم القائم على الاختيار للخلايا التي اكتسبت طفرات مفيدة قد يؤدي إلى تحول كامل في النمط الجيني لخلايا المجموعة. هنا نقدم إجراء لرصد التوسع اللاستنساخي السريع والقضاء على الطفرات المفيدة والضارة ، على التوالي ، في مجموعة الخلايا البكتيرية مع مرور الوقت عن طريق cocultivation من الأفراد المسمى فلوريا من البكتيريا نموذج إيجابي غرام عصيات subtilis. طريقة سهلة الأداء وتوضيحية جدا لعرض المنافسة داخل الأنواع بين الأفراد في مجموعة خلايا بكتيرية.
Introduction
وعادة ما تكون بكتيريا التربة مزودة بشبكات تنظيمية مرنة وقدرات استقلابية واسعة. كلا الميزتين تمكن الخلايا لضبط مساراتها تقويضي والابتنائية للتنافس مع زملائهم والكائنات الحية الدقيقة الأخرى للمغذيات, التي تتوفر في مكانة بيئية معينة1. ومع ذلك ، إذا كانت البكتيريا غير قادرة على التكيف مع بيئتها آليات أخرى قد تفسر بقاء الأنواع. في الواقع، كما العديد من البكتيريا تتكاثر بسرعة والسكان يمكن أن تصل إلى كثافة الخلايا العالية التجمعات السكانية الفرعية قد تراكمت تلقائيا الطفرات المفيدة التي توفر للخلايا مع ميزة النمو الانتقائي، وبالتالي زيادة لياقتهم البدنية. وعلاوة على ذلك، يمكن أن النقاط الساخنة الطفرة وطفرات التكيف الناجمة عن الإجهاد تسهيل تطور بكتيريا غير معدلة2،3. وهكذا، فإن تراكم الطفرات والنمو في ظل الاختيار المستمر هو أصل التنوع الميكروبي الهائل، حتى داخل نفس الجنس4،5. كما هو الحال في الطبيعة ، فإن تشكيل الجينوم البكتيري يحدث أيضا في المختبر بسبب الزراعة المستمرة قيد الاختيار. ويتجلى ذلك في تدجين البكتيريا الفرعية B. إيجابية الغرام، والتي تستخدم في جميع أنحاء العالم في البحوث الأساسية وفي الصناعة. في 1940s B. تم التعامل مع subtilis الحمض النووي الضارة الأشعة السينية تليها زراعة تحت شرط نمو محدد6. الطفرات التي تراكمت في البكتيريا خلال تدجينها مسؤولة عن فقدان العديد من خصائص النمو ، أي سلالة مختبر B. subtilis 168 فقدت القدرة على تشكيل مستعمرات معقدة7،8.
في الوقت الحاضر، لأفضل دراسة نموذج البكتيريا Escherichia القولونية وB. subtilis، مجموعة متنوعة من الأدوات القوية المتاحة للتلاعب وراثيا الجينوم من أجل معالجة مسائل علمية محددة. في بعض الأحيان يسبب تعطيل جين الفائدة عيبا حادا في النمو ، والذي يظهر بوضوح على متوسط النمو القياسي9. وعلى النقيض من ذلك، غالبا ما يتم تجاهل الطفرات التي تسبب عيبا ضعيفا في النمو وبالتالي تؤثر بشكل طفيف على لياقة السلالة. ومع ذلك ، في كلتا الحالتين الحضانة المطولة و passaging من سلالات متحولة لعدة أجيال وعادة ما يؤدي إلى تراكم المسوخ القامع التي استعادت النمط الظاهري للسلالة الأم2،9. إن توصيف المسوخ القامعة وتحديد الطفرات التي أعادت عيب نمو السلالة المتحولة الأم هو نهج مفيد للغاية يسمح بجلاء العمليات الخلوية الهامة والجديدة في كثير من الأحيان10،11.
نحن مهتمون في السيطرة على التوازن الغلوتامات في B. subtilis12. على غرار الإشريكية القولونية، يستجيب B. subtilis لاثارة الغلوتامات التوازن(أيكتلة في تدهور الغلوتامات2)من خلال تراكم المسوخ القامعة. وتبين أن التعديلات الجينومية في هذه المسوخ القامعة التي تم الحصول عليها عن طريق طفرة عفوية لاستعادة الغلوتامات التوازنبسرعة 9,13. لذلك ، ليس من المستغرب أن التكيف مع B. subtilis إلى حالة نمو محددة أثناء تدجين البكتيريا ينعكس في تخليق الإنزيم وفي الأنشطة الأنزيمية المتطورة ، والتي تشارك في استقلاب الغلوتامات12. وقد اقترح أن عدم وجود الغلوتامات الخارجية في المتوسط النمو خلال عملية التدجين كان القوة الدافعة لظهور تثبيت خفي الغلوتامات ديهيدروجيناز (GDH) gudBCR الجينات في سلالة المختبر 1682,14. ويدعم هذه الفرضية ملاحظتنا أن انخفاض كمية نشاط GDH في سلالة المختبر يوفر البكتيريا مع ميزة النمو الانتقائي عندما الغلوتامات الخارجية نادرة2. وعلاوة على ذلك، فإن زراعة سلالة B. subtilis، توليف GDH GudB، في غياب الغلوتامات الخارجية يؤدي إلى تراكم المسوخ القامعة التي أدت إلى تعطيل الجين gudB 2. من الواضح أن وجود GDH نشط تقويضيا غير مؤات للخلية لأن الغلوتامات المنتجة داخليا التي يمكن استخدامها لولا ذلك للتأيض تتحلل إلى الأمونيوم و 2-oxoglutarate (الشكل 1). وعلى النقيض من ذلك، عندما يتم توفير الغلوتامات عن طريق الوسط، فإن سلالة B. subtilis المجهزة بنشاط GDH عالي المستوى لها ميزة نمو انتقائية على سلالة تجمع GDH وظيفية واحدة فقط. من المعقول افتراض أن نشاط GDH عالي المستوى يسمح للبكتيريا باستخدام الغلوتامات كمصدر كربون ثان بالإضافة إلى مصادر الكربون الأخرى التي يوفرها الوسيط2 (انظر الشكل 1). وبالتالي، يؤثر نشاط GDH بقوة على لياقة البكتيريا، اعتمادا على توافر الغلوتامات الخارجية.
هنا نقدم طريقة توضيحية جدا لرصد وتصور المنافسة داخل الأنواع بين اثنين من سلالات subtilis B. التي تختلف في مكان واحد على الكروموسوم(الشكل 2). وصفت سلالات اثنين مع الجينات yfp وcfp ترميز YFP الفلوروفوريس وCFP، و cocultivated في ظل ظروف غذائية مختلفة. عن طريق أخذ العينات مع مرور الوقت والطلاء المخففات المناسبة على لوحات أجار يمكن رصد الناجين في كل من الثقافات بسهولة باستخدام المجهر مضان ستيريو المشتركة. الإجراء الموصوف في هذه الورقة سهل الأداء ومناسب لتصور التوسع اللاستنساخي السريع والقضاء على الطفرات المفيدة والضارة ، على التوالي ، في مجموعة خلايا بمرور الوقت.
Protocol
1. إعداد لوحات أجار، وسائل الإعلام الثقافية، Cryostocks، والثقافات المسبقة
- إعداد وسائط النمو والكواشف المطلوبة (انظر جدول المواد والكواشف).
- خط سلالات B. subtilis (على سبيل المثال. BP40 (rocG+ gudBCR amyE::PgudB-yfp) و BP52 (rocG+ gudB+ amyE::PgudB-cfp) معبرا عن واحد واثنين من GDHs النشطة ، على التوالي) 2 التي سيتم استخدامها في تجربة المنافسة على لوحات أجار متوسطة SP للحصول علىمستعمرات واحدة. احتضان لوحات بين عشية وضحاها في 37 °C.
- خذ مستعمرات واحدة وأنابيب زراعة معقمة تلقيح تحتوي على 4 مل LB السائل المتوسط. تنمو البكتيريا بين عشية وضحاها في 28 درجة مئوية و 220 دورة في الدقيقة.
- تنمو الثقافات بين عشية وضحاها في 28 درجة مئوية لتجنب أن الخلايا lyse أو sporulate.
- قياس الكثافة البصرية للثقافات على طول موجي من 600 نانومتر (OD600)باستخدام مطياف قياسي.
- إذا كانت الثقافات قد وصلت إلى OD600 من 2.0, مزيج 0.75 مل من الثقافات مع 0.75 مل من محلول الجلسرين 50٪ معقمة في أنابيب رد الفعل 1.5 مل. يجب أن يكون OD600 النهائي 1.0 للحصول على cryostocks تحتوي على حوالي 108 خلايا / مل.
- تخزين الأنابيب في -80 درجة مئوية.
- جعل ثلاثة ثقافات مسبقة من كل سلالة وصفت مع cfp وyfp ترميز جينات الفلوروفور. تلقيح الثقافات المسبقة (أنابيب زراعة معقمة تحتوي على 4 مل LB السائل المتوسط) مع 1 ميكرولتر من خلايا التبريد -80 درجة مئوية. احتضان الثقافات بين عشية وضحاها في 28 درجة مئوية و 220 دورة في الدقيقة.
2. Cocultivation من البكتيريا، وجمع العينات، وتخزين العينات
- إعداد طازجة 100 مل C-Glc و CE-Glc الحد الأدنى المتوسط (انظر الجدول من الكواشف والمواد), ونقل 20 مل من كل وسيط في العقيمة 100 مل يهز قوارير.
- خذ 0.1 مل من الثقافات المسبقة التي نمت بين عشية وضحاها، وتمييعها مع 0.9 مل LB المتوسطة في cuvette 1.5 مل، وتحديد OD600.
- لتجربة المنافسة، خذ تلك الثقافات المسبقة من السلالات المختلفة التي لديها OD600 مماثلة بين 1.0-1.5.
- للحصول على مجموعات الخلايا المختلطة، تمييع خلايا الثقافات المسبقة التي كان OD600 المناسبة إلى OD600 من 0.05 في 20 مل C-Glc و CE-Glc الحد الأدنى المتوسط تكملها في 100 مل يهز قوارير. لتجربة المنافسة يجب أن تكون مختلطة بين سلالة اثنين في نسبة 1:1.
- خذ عينات 10 مل من القوارير، ونقلها إلى أنابيب بلاستيكية 15 مل، وحصاد الخلايا عن طريق الطرد المركزي لمدة 10 دقائق في 4000 × غرام في جهاز طرد مركزي أعلى الجدول القياسي، والتخلص من supernatant.
- Resuspend الخلايا في 0.5 مل من المتوسطة LB الطازجة, ونقل الخلايا إلى معقمة 1.5 مل كوب رد الفعل. إضافة 0.5 مل من 50٪ الجلسيرول العقيمة, خلط تعليق دوامة صارمة, وتخزين العينات في الفريزر -80 درجة مئوية حتى مزيد من العلاج.
- احتضان الخلايا التي تترك في قوارير اهتزاز لمدة تصل إلى 24 ساعة في 37 درجة مئوية و 220 دورة في الدقيقة. الحفاظ على قوارير يهز في الظلام لمنع تبييض الصور من الفلوروفوريس.
- خذ عينات أخرى من 0.1 مل بعد 7 ساعات و 24 ساعة من النمو. قياس وملاحظة OD600 من 1:10 التخفيف (في C-Glc أو CE-Glc الحد الأدنى المتوسط) من العينات.
- خذ الكمية المناسبة من الخلايا من كل ثقافة لجعل cryostocks التي لديها OD600 من 1.0. تخزين العينات في -80 درجة مئوية حتى مزيد من العلاج.
3. عينة العلاج، والطلاء، واحتضان للتحليلات الكمية
- بعد جمع جميع العينات، إذابة المبردات، وتمييع الخلايا في محلول ملحي 0.9٪ (انظر جدول الكواشف والمواد) تصل إلى10-3.
- لوحة 0.1 مل من تخفيف10-3 على لوحات أجار متوسطة SP وتوزيع الخلايا باستخدام ماصة الزجاج العقيم.
- احتضان لوحات بين عشية وضحاها في 37 درجة مئوية في الظلام حتى ظهرت مستعمرات واحدة.
4. عد الناجين من قبل مجسم مضان المجهر للتحليل الكمي
- تقسيم الجزء السفلي من لوحة أجار مع قلم أسود في أربعة أجزاء للحصول على اتجاه أفضل في حين عد الناجين تحت المجهر مضان ستيريو.
- ضع اللوحة رأسا على عقب تحت المجهر واجلب المستعمرات إلى التركيز باستخدام مصدر الضوء البارد.
- مرة واحدة في المستعمرات هي في التركيز، والتحول إلى مجموعة مرشح المناسبة لCFP لتصور الخلايا المتبقية من سلالة cfpالمسمى. عد الناجين من هذه السلالة عن طريق وضع علامة على المستعمرات بقلم وملاحظة الرقم.
- إزالة التسميات مع الإيثانول والتحول إلى مرشح YFP تعيين لتصور الخلايا المتبقية من سلالة yfpالمسمى. عد الناجين مرة أخرى عن طريق وضع علامة على المستعمرات بقلم وملاحظة الرقم.
5. عينة العلاج والتنظير المجهري للتحليلات شبه الكمي
- للاطلاع على الأرقام التوضيحية، بقعة 10 ميكرولتر من تخفيف10-4 (حوالي 100 خلية) من الخطوة 3.1 على لوحة أجار SP (انظر الشكل 3).
- احتضان لوحات بين عشية وضحاها في 37 درجة مئوية في الظلام حتى ظهرت مستعمرات واحدة.
- ضع طبق بيتري دون غطاء تحت المجهر واجلب البقعة إلى التركيز باستخدام مصدر الضوء البارد.
- التقاط صور للبقع لشخصيات توضيحية. اختيار وقت التعرض المناسب لالتقاط صور المستعمرات مع مصدر الضوء البارد.
- دون تحريك لوحة، وتغيير إلى مجموعة مرشح CFP، وضبط وقت التعرض واتخاذ صورة. افعل الشيء نفسه مع مجموعة فلتر YFP وحفظ الصور لإجراء مزيد من التحليلات.
6. تحليل البيانات
- استخدام برامج مثل Excel لتحليل البيانات الكمية. استنادا إلى المستعمرات التي تم عدها، احسب النسبة المئوية للمستعمرات الصفراء والزرقاء فيما يتعلق بعدد المستعمرات بالكامل، والتي تم تعيينها إلى 100٪.
- استخدم الأرقام المحسوبة لإنشاء مخطط شريطي مكدس (انظر الشكل 4 والشكل 5). استخدم برنامج معالجة الصور مثل Adobe Photoshop لإنشاء صور مدمجة للصور الملتقطة من مواقع مختلفة. بدلا من ذلك ، يمكن استخدام برنامج ImageJ المتاح مجانا ، القابل للتنزيل من http://rsbweb.nih.gov/ij/ لمعالجة الصور.
- افتح الصور من بقعة واحدة تم التقاطها باستخدام مجموعة فلتر CFP ومجموعة مرشح YFP. تحسين التباين والسطوع للحد من أي مضان الخلفية من وسائل الإعلام.
- انتقل إلى إحدى الصور وحدد الكل. نسخ الصورة ولصقها على الصورة الأخرى.
- إما استخدام وظيفة "دودج اللون" لدمج الصور أو تراكب الصور الفلورية باستخدام علامة التبويب القنوات. الصور المدمجة للمستعمرات من وسائل الإعلام المختلفة ونقاط زمنية مختلفة تمثل نمو سلالات مختلفة داخل الثقافة السائلة.
7. نصائح محددة: صبغ التبديل التجربة و Cocultivation من سلالات Isogenic المسمى مع cfp وyfp
التعبير عن أي من اثنين من الجينات ترميز الفلوروفوري في B. subtilis قد تؤثر على اللياقة البدنية، وبالتالي معدل نمو البكتيريا. لذلك ، يوصى بإجراء التجارب التالية لاستبعاد أن القضاء على سلالة منافس واحد من مجموعة الخلايا أثناء الزراعة يرجع ببساطة إلى تأثير سلبي للفلوروفور:
- كرر التجربة بأكملها و cocultivate سلالات وصفت عكسيا(على سبيل المثال، في وقت سابق cfpالمسمى سلالة الآن مع الجين yfp والعكس بالعكس). وعلى الرغم من عكس ذلك، ينبغي أن تكون النتائج التي تم الحصول عليها مماثلة للملاحظة السابقة بأن إحدى السلالات تتمتع بميزة نمو انتقائية على السلالة الأخرى.
- كرر التجربة بأكملها وسلالات cocultivate isogenic المسمى مع yfp وcfp (على سبيل المثال BP40 (rocG+ gudBCR amyE::PgudB-yfp) و BP41 (rocG+ gudBCR amyE::PgudB-cfp)). تقدير التأثير السلبي لأي من الفلوروفوريس اثنين على اللياقة البدنية للبكتيريا باتباع تكوين السكان الخلية مع مرور الوقت.
النتائج
تم تطبيق الطريقة الموصوفة هنا بنجاح لتصور المنافسة داخل الأنواع في مجموعة خلايا تتكون من سلالات B. subtilis التي تم تصنيفها بجينات cfp و yfp لترميز الفلوروفوريس CFP و YFP ، على التوالي. كما هو مبين في الشكل 3، يمكن استخدام هذه الطريقة لتصور المنافسة داخل الأنواع بطريقة توضيحية للغاية. من خلال اكتشاف العينات على مناطق صغيرة ، تم جعل التكوين اللاستنساخي تجمعات الخلايا مرئيا في لمحة. وعلى الرغم من أن هذا النهج غير مناسب للتحليلات الكمية، إلا أنه مفيد لتقدير تأثير معلمات النمو المختلفة(أيمصدر النيتروجين) تقريبا على تطوير مجموعة خلايا تحتوي في البداية على كلا النوعين بكميات متساوية(الشكل 3). وعلاوة على ذلك، في نهج صغير النطاق اللياقة البدنية من سلالات B. subtilis المختلفة التي كانت تزرع في ظل نفس حالة النمو يمكن اختبارها باستخدام لوحة أجار واحدة. وللتحليلات الكمية، يوصى بنشر العينات على سطح صفيحة أغار بأكملها. وهذا سوف يمنع تراكب المستعمرات، وبالتالي يسمح بتحديد متميزة وعدد المستعمرات التي ظهرت من خلايا واحدة. عن طريق طلاء التخفيفات المناسبة على لوحات أجار التركيب اللاستنساخي للسكان الخلية مع مرور الوقت يمكن تحديدها بدقة ببساطة عن طريق عد المستعمرات الفلورية الصفراء والزرقاء (انظر الشكل 4). كما سبق أن ذكرت، نشاط GDH يؤثر بقوة على اللياقة البدنية من B. subtilis اعتمادا على توافر الغلوتامات الخارجية2. من الواضح أنه في غياب الغلوتامات الخارجية عالية المستوى نشاط GDH غير مؤات للبكتيريا كما الإنزيمات RocG و GudB تحلل الغلوتامات المطلوبة في استقلاب (انظر الشكل 1 والشكل 4A). وعلى النقيض من ذلك، إذا قدمت إلى البكتيريا، الغلوتامات يمكن أن تكون بمثابة المانحة مجموعة أمينية في ردود الفعل transamination. وعلاوة على ذلك، يمكن تغذية الغلوتامات في استقلاب الكربون واستخدامها كمصدر للطاقة بسبب وجود GDHs RocG النشطة تقويضيا وغودب(الشكل 1 والشكل 4B). كما هو مبين في الشكلين 4C و 4D، تم الحصول على نتائج مماثلة في تجربة تبديل الصبغة. مرة أخرى، كانت البكتيريا المجهزة بنشاط GDH عالي المستوى تفوقها الخلايا ذات النشاط المنخفض ل GDH في وسائل الإعلام التي تفتقر إلى الغلوتامات. وعلى النقيض من ذلك، تم القضاء على البكتيريا توليف GDH نشط واحد فقط من الثقافة عندما تم استكمال المتوسط مع الغلوتامات. وكما هو مبين في الشكلين 5 ألف و 5ب،ظل التكوين الأولي للخلايا المختلطة ثابتا تقريبا مع مرور الوقت. وهكذا، في تجربة المنافسة لم يكن القضاء على أي من السلالات اثنين التي كانت مجهزة بكميات مختلفة من نشاط GDH بسبب عيب في النمو الناجم عن الفلوروفوريس (انظر الشكل 4). إذا أخذنا معا، فإن استخدام الفلوروفوريس هو أداة قوية لرصد المنافسة داخل الأنواع في مجموعة الخلايا البكتيرية.

الشكل 1 - الأرقام 1- الأرقام 1 الصلة بين استقلاب الكربون والنيتروجين في B. subtilis. عندما لا يتم توفير الغلوتامات من قبل الوسط, يتم توليفها المانح الأميني الرئيسي الذي هو مطلوب لالايض من الأمونيوم و 2-oxoglutarate من خلال العمل المشترك من synthetase الجلوتامين (GS) وsyntaase الغلوتامات (GOGAT). وعلى النقيض من ذلك، في وجود الغلوتامات الخارجية يمكن ل GDHs RocG النشطة تقويضيا و/أو GudB أن تتحلل الغلوتامات إلى الأمونيوم و2-oxoglutarate، والتي تعمل بعد ذلك كمصدر للكربون.
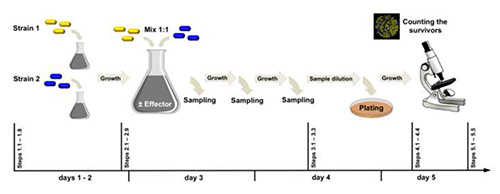
الشكل 2 - الأرقام 2- الأرقام التي تم سير العمل التجريبي. سلالة 1 (وصفت مع yfp)وسلالة 2 (وصفت مع cfp)تختلف في مكان واحد من بعضها البعض. في المثال المعروض هنا، قارنا تأثير الغلوتامات الخارجية (المؤثر) على التحول الجيني تجمعات الخلايا التي احتوت في البداية على 50٪ من rocG+ gudB+ (ترميز اثنين من GDHs النشطة) و 50٪ من rocG+ gudBCR (ترميز واحدة نشطة GDH) الخلايا. انقر هنا لعرض صورة أكبر.

الشكل 3 - الأرقام 3- الأرقام التي يمكن أن النهج شبه الكمي لتصور المنافسة داخل الأنواع بطريقة وصفية (انظر القسم 5). قبل cocultivation (0 ساعة), وبعد 7 ساعة و 24 ساعة من تخفيف النمو (10-4)من الخلايا رصدت على لوحات أجار SP. تم تحديد الخلايا الناجية التي شكلت المستعمرات بعد 12 ساعة من الحضانة عند 37 درجة مئوية عن طريق المجهر المضان ستيريو. وقت التعرض، 0.6 ثانية؛ شريط مقياس، 1 مم. تم تعديل هذا الرقم من غونكا وآخرون. 20132.

الشكل 4 - الأرقام 4- الأرقام التي تم ال تحديد كمي للمنافسة داخل الأنواع. بعد تخفيف العينة ونشر الخلايا (انظر الخطوات 3.1-3.3) على SP المتوسطة تم احتضان لوحات بين عشية وضحاها في 37 درجة مئوية. وتم قياس المستعمرات الصفراء والزرقاء كميا كما هو موضح في البروتوكولين 4 و6. تمثل أشرطة الخطأ الأسود انحرافات معيارية لأربع تجارب متكررة بشكل مستقل على الأقل. كل لوحة أجار تحتوي على ما لا يقل عن 100 مستعمرة قابلة للتعداد. (أ) في غياب الغلوتامات الخارجية B. subtilis سلالة BP40 (الأصفر) مجهزة واحدة فقط GDH وظيفية تفوق سلالة BP54 (الأزرق)، الذي يجمع كل من الإنزيمات المهينة الغلوتامات، روكغ وغودب. (ب)وعلى النقيض من ذلك، توليف GDHs وظيفية اثنين مفيد للبكتيريا عندما الغلوتامات الخارجية متاح لأنه بالإضافة إلى الجلوكوز، يستخدم الغلوتامات كمصدر للكربون. كما هو مبين في (C) و (D)، تم الحصول على نتائج مماثلة في تجربة تبديل الصبغة. تم تعديل هذا الرقم من غونكا وآخرون. 20132. انقر هنا لعرض صورة أكبر.

الشكل 5 - الأرقام 5- الأرقام التي تم تجربة التحكم لتقييم تأثير جينات cfp وyfp التي تشفرة الفلوروفوري على لياقة البكتيريا. السكان مختلطة من سلالات متساوية المنشأ BP40 (rocG+ gudBCR amyE:::yfp) و BP41 (rocG+ gudBCR amyE::cfp) أو BP52 (rocG+ gudB + amyE: yfp ) نمت في غياب (A) وفي وجود (ب) من الغلوتامات الخارجية. وقد أحصيت الخلايا الباقية على قيد الحياة على النحو المبين في البروتوكولين 1-4 و 6 على التوالي. تمثل الأشرطة انحرافات معيارية لأربع تجارب متكررة بشكل مستقل على الأقل. تم تعديل هذا الرقم من غونكا وآخرون. 20132. انقر هنا لعرض صورة أكبر.
Discussion
وقد وضعت عدة طرق لتحليل اللياقة التنافسية للبكتيريا16. في كثير من الحالات وصفت البكتيريا مع أشرطة مقاومة المضادات الحيوية المختلفة17. على غرار نهجنا ، فإن وضع العلامات على الخلايا باستخدام أشرطة مقاومة المضادات الحيوية يسمح بتقييم اللياقة التنافسية للبكتيريا أثناء cocultivation في ظل ظروف نمو محددة. وعلاوة على ذلك، يمكن استخدام هذه الطريقة لتحديد اللياقة التنافسية للخلايا التي تختلف عن بعضها البعض في مكان معين على الكروموسوم17. ومع ذلك، هناك بعض العيوب باستخدام أشرطة مقاومة المضادات الحيوية لمراقبة اللياقة التنافسية. وبما أن التعبير عن جينات المقاومة مدفوع في الغالب من قبل المروجين الذين لديهم قوة غير متكافئة ، فمن المحتمل أن يتم إنتاج الإنزيمات التي تمنح مقاومة للمضادات الحيوية على مستويات مختلفة. لذلك، قد لا تكون تأثيرات اللياقة البدنية الضعيفة قابلة للكشف مع هذا النهج. في نهجنا، تم دمج كل من الجينات الفلوروفوري مع علامة الاختيار نفسها وتعبيرهم مدفوع من قبل نفس المروجين2. قد يكون عيب آخر لمراقبة اللياقة التنافسية مع أشرطة مقاومة المضادات الحيوية هو أن النهج هو أكثر شاقة كما هناك حاجة إلى نوعين من لوحات أجار تكملها المضادات الحيوية المناسبة لعد مستعمرة. بدلا من ذلك، يمكن تحديد اللياقة البدنية للبكتيريا ببساطة عن طريق رصد معدل النمو وحساب ما يسمى مؤشر اللياقة البدنية16. ومن الواضح أن هذا هو النهج الأكثر دقة لأن البكتيريا تزرع بشكل فردي والمركبات السامة التي قد تنتج عن طريق سلالة مع نوع وراثي معين لن تؤثر على نمو السلالة المتنافسة. وعلاوة على ذلك، ليست هناك حاجة لاستخدام المضادات الحيوية التي قد تؤثر على نمو الخلايا. ومع ذلك ، فإن كلا النهجين ليست توضيحية للغاية لأن الأرقام التي تصف اللياقة التنافسية لا يمكن تقديمها إلا بطريقة محايدة إلى حد ما.
استخدام جينات ترميز الفلوروفوري لرصد وقياس المنافسة داخل الأنواع له العديد من المزايا على الطرق الأخرى. إذا كانت كلتا السلالات قد دمجت جينات ترميز الفلوروفور عن طريق إعادة التركيب المتجانس المزدوج في الكروموسوم ، فلا حاجة لاستخدام المضادات الحيوية في أي من خطوات الزراعة. لذلك ، يمكن تحليل العينات المأخوذة من الثقافة أثناء الزراعة على نفس متوسط النمو وكلا الضغطين قادران على النمو. هذا النهج يسمح تصور المنافسة داخل الأنواع بطريقة توضيحية جدا. وعلاوة على ذلك، يمكن اختبار العديد من ظروف النمو في نفس الوقت، ويمكن مقارنة العديد من السلالات المختلفة بالتوازي باستخدام هذا النهج شبه الكمي. وأخيرا، ليست هناك حاجة لتثبيت العينات على الشرائح المجهر لأن العينات التي أخذت من الثقافة البكتيرية أثناء cocultivation يمكن تخزينها في الثلاجة18. وبالتالي، يمكن تحليل جميع العينات والنماذج المتماثلة في نفس الوقت.
وينبغي ذكر خطوتين حاسمتين في بروتوكولنا. من المهم ملاحظة أن الخلايا المبردة يجب أن تحتوي على كميات متساوية من الخلايا في نفس مرحلة النمو لكل سلالة منافسة. وسيكون يترتب على عدم التناسب الأولي بين السلالات في الكريوستوك وبالتالي في قوارير الهزة قبل بدء التجربة تأثير قوي على نتيجة تجربة المنافسة. لذلك ، من الحكمة التحقق من تكوين الكريوستوك قبل التجربة. وعلاوة على ذلك، ينبغي نشر كمية مناسبة من الخلايا بالتساوي على اللوحة. وإلا فإن المستعمرات الناشئة قريبة جدا من بعضها البعض، وسيصبح من الصعب تحديد الخلايا الناجية بدقة.
وهناك أيضا بعض القيود والعيوب التي يفرضها النهج القائم على الفلوروفور. Cocultivation في قارئ لوحة متعددة الآبار والكشف المتزامن عن إشارات CFP و YFP غير ممكن لأن أطياف الإثارة والانبعاثات من الفلوروفوريس قريبة جدا من بعضها البعض. ومع ذلك ، قد يتم التحايل على هذه المشكلة التقنية باستخدام بروتينات فلورية مختلفة ، مثل تلك التي تنبعث منها الضوء الأخضر والأحمر ، على النحو الأمثل استنادا إلى نفس سقالة البروتين. عيب آخر من النهج القائم على الفلوروفور يمكن أن يكون أن بعض الطفرات تسبب سوى عيب نمو ضعيف للبكتيريا. وهكذا، إذا كان عيب النمو الذي قد يكون سببه أي من الجينات ترميز الفلوروفوري أقوى من عيب النمو الناجم عن طفرة معينة، فإن النهج القائم على الفلوروفوري غير مناسب لتحليل المنافسة داخل الأنواع. لذلك، قبل إنشاء مجموعة كاملة من سلالات فمن المستحسن أن التسمية الأولى فقط سلالة الأم مع كل من، cfp وyfp، و cocultivate السلالات. وسوف تكشف تجارب النمو مدى قوة الفلوروفوريس تؤثر على لياقة البكتيريا (انظر الشكلين 5A و 5B).
في المستقبل سيكون من المثير للاهتمام اختبار ما إذا كان النهج القائم على الفلوروفور لرصد المنافسة داخل الأنواع سيكون أكثر دقة وأقل صعوبة إذا تم حساب الخلايا الناجية باستخدام قياس التدفق الخلوي. في الآونة الأخيرة ، وقد ثبت تدفق قياس الخلايا لتكون أداة قوية لتحليل تكوين B. subtilis بيو فيلم19. وعلاوة على ذلك، قد يكون من الأنسب تحليل تأثيرات اللياقة البدنية الضعيفة التي تؤثر على اللياقة التنافسية للبكتيريا عن طريق cocultivation المستمر للبكتيريا المسمى الفلوروفوري في المخمرة. وعلى النقيض من قوارير الهز، يسمح هذا النهج بالحفاظ على ظروف النمو ثابتة وبالتالي مراقبة المنافسة داخل الأنواع على مدى فترة طويلة من الزمن.
Disclosures
ويعلن أصحاب البلاغ أنه ليس لديهم مصالح مالية متنافسة.
Acknowledgements
وقد دعم العمل في مختبر المؤلفين دويتشه فرانشونجسجيمينشافت (http://www.dfg.de؛ CO 1139/1-1)، ومؤسسة دير شيمشين للصناعات (http://www.vci.de/fonds)، ومركز غوتنغن للبيولوجيا الجزيئية (GZMB). ويود المؤلفون أن يعترفوا بيورغ ستولكي لتعليقاته المفيدة وقراءة المخطوطة النقدية.
Materials
| Name | Company | Catalog Number | Comments |
| (NH4)2SO4 | Roth, Germany | 3746 | |
| Agar | Difco, USA | 214010 | |
| Ammonium ferric citrate (CAF) | Sigma-Aldrich, Germany | 9714 | |
| CaCl2 | Roth, Germany | 5239 | |
| Glucose | Applichem, Germany | A3617 | |
| Glycerol | Roth, Germany | 4043 | |
| K2HPO4•3H2O | Roth, Germany | 6878 | |
| KCl | Applichem, Germany | A3582 | |
| KH2PO4 | Roth, Germany | 3904 | |
| KOH | Roth, Germany | 6751 | |
| MgSO4•7H2O | Roth, Germany | P027 | |
| MnCl2 | Roth, Germany | T881 | |
| MnSO4•4H2O | Merck Millipore, Germany | 102786 | |
| NaCl | Roth, Germany | 9265 | |
| Nutrient broth | Roth, Germany | X929 | |
| Potassium glutamate | Applichem, Germany | A3712 | |
| Tryptone | Roth, Germany | 8952 | |
| Tryptophan | Applichem, Germany | A3445 | |
| Yeast extract | Roth, Germany | 2363 | |
| 1.5 ml Reaction tubes | Sarstedt, Germany | 72,690,001 | |
| 2.0 ml Reaction tubes | Sarstedt, Germany | 72,691 | |
| 15 ml Plastic tubes with screw cap | Sarstedt, Germany | 62,554,001 | |
| Petri dishes | Sarstedt, Germany | 82.1473 | |
| 1.5 ml Polystyrene cuvettes | Sarstedt, Germany | 67,742 | |
| 15 ml Glass culture tubes | Brand, Germany | 7790 22 | |
| 100 ml Shake flasks with aluminium caps | Brand, Germany | 928 24 | |
| Sterile 10 ml glass pipettes | Brand, Germany | 278 23 | |
| Incubator (28 and 37 °C) | New Brunswick | M1282-0012 | |
| Standard pipette set (2-20 μl, 10-100 μl, 100-1,000 μl) | Eppendorf, Germany | 4910 000.034, 4910 000.042, | |
| Table top centrifuge for 1.5 and 2 ml reaction tubes | Thermo Scientific, Heraeus Fresco 21, Germany | 75002425 | |
| Table top centrifuge for 15 ml plastic tubes | Heraeus Biofuge Primo R, Germany | 75005440 | |
| Standard spectrophotometer | Amersham Biosciences Ultrospec 2100 pro, Germany | 80-2112-21 | |
| Stereofluorescence microscope | Zeiss SteREO Lumar V12, Germany | 495008-0009-000 | |
| Freezer (-20 and -80 °C) | - | - | |
| Fridge (4 °C) | - | - | |
| Autoclave | Zirbus, LTA 2x3x4, Germany | - | |
| pH meter | pH-meter 766, Calimatic, Knick, Germany | 766 | |
| Vortex | Vortex 3, IKA, Germany | 3340000 | |
| Balance | CP2202S, Sartorius, Germany | replaced by | |
| Black pen (permanent marker) | Staedler, Germany | 317-9 | |
| Powerpoint program | Microsoft, USA | - | |
| Office Excel program | Microsoft, USA | - | Program for data processing |
| Adobe Photoshop CS5 | Adobe, USA | replaced by CS6, download | Computer program for image processing |
| Computer | PC or Mac | - | |
| ZEN pro 2011 software for the stereofluorescence microscope | Zeiss, Germany | 410135 1002 110 | AxioCam MRc Rev. Obtained through Zeiss |
| Specific solution recipes | |||
| SP Medium | |||
| 8 g Nutrient broth | |||
| 0.25 mg MgSO4•7H2O | |||
| 1 g KCl | |||
| 15 g agar for solid SP medium | if required | ||
| add 1 L with H2O | autoclave for 20 min at 121 °C | ||
| 1 ml CaCl2 (0.5 M), sterilized by filtration | |||
| 1 ml MnCl2 (10 mM), sterilized by filtration | |||
| 2 ml ammonium ferric citrate (CAF, 2.2 mg/ml), sterilized by filtration | |||
| LB Medium | |||
| 10 g Tryptone | |||
| 5 g Yeast extract | |||
| 10 g NaCl | |||
| 15 g agar for solid LB medium | if required | ||
| add 1 L with H2O | autoclave for 20 min at 121 °C | ||
| C-Glc Minimal Medium | |||
| 200 ml 5 x C salts | |||
| 10 ml L-Tryptophan (5 mg/ml), sterilized by filtration | |||
| 10 ml ammonium ferric citrate (CAF, 2.2 mg/ml), sterilized by filtration | |||
| 10 ml III’ salts | |||
| 25 ml Glucose (20%) | autoclaved for 20 min at 121 °C | ||
| add 1 L with sterile H2O | |||
| CE-Glc Minimal Medium | |||
| 200 ml 5 x C salts | |||
| 10 ml L-Tryptophan (5 mg/ml), sterilized by filtration | |||
| 10 ml ammonium ferric citrate (CAF, 2.2 mg/ml), sterilized by filtration | |||
| 10 ml III’ salts | |||
| 20 ml Glutamate (40%) | |||
| 25 ml Glucose (20%), autoclaved for 20 min at 121 °C | |||
| add 1 L with sterile H2O | |||
| 5 x C salts | |||
| 20 g KH2PO4 | |||
| 80 g K2HPO4•3H2O | |||
| 16.5 g (NH4)2SO4 | |||
| add 1 L with sterile H2O | autoclave for 20 min at 121 °C | ||
| III’ salts | |||
| 0.232 g MnSO4•4H2O | |||
| 12.3 g MgSO4•7H2O | |||
| add 1 L with sterile H2O, autoclave for 20 min at 121 °C | |||
| 40% Glutamate solution | |||
| 200 g L-Glutamic acid | |||
| adjust the pH to 7.0 by adding approximately 80 g KOH | |||
| add 0.5 L with sterile H2O | autoclave for 20 min at 121 °C | ||
| 0.9% Saline (NaCl) Solution | |||
| add 1 L with sterile H2O | autoclave for 20 min at 121 °C | ||
| 50% Glycerol solution | |||
| 295 ml Glycerol (87%) | |||
| add 0.5 L with sterile H2O | autoclave for 20 min at 121 °C | ||
| Bacteria (All strains are based on the Bacillus subtilis strain 168) | |||
| Bacillus subtilis BP40 (rocG+ gudBCR amyE::PgudB-yfp) | Laboratory strain collection | ||
| Bacillus subtilis BP41 (rocG+ gudBCR amyE::PgudB-cfp) | |||
| Bacillus subtilis BP52 (rocG+ gudB+ amyE::PgudB-cfp) | |||
| Bacillus subtilis BP156 (rocG+ gudB+ amyE::PgudB-yfp) | |||
References
- Buescher, F. I., et al. Global network reorganization during dynamic adaptations of Bacillus subtilis metabolism. Science. 335, 1099-1103 (2012).
- Gunka, K., Stannek, L., Care, R. A., Commichau, F. M. Selection-driven accumulation of suppressor mutants in Bacillus subtilis: the apparent high mutation frequency of the cryptic gudB gene and the rapid clonal expansion of gudB+ suppressors are due to growth under selection. PLoS One. 8, (2013).
- Al Mamum, A. A. M., et al. Identity and function of a large gene network underlying mutagenic repair of DNA breaks. Science. 338, 1344-1348 (2012).
- Koeppel, A. F., Wertheim, J. O., Barone, L., Gentile, N., Krizanc, D., Cohan, F. M. Speedy speciation in a bacterial microcosm: new species can arise as frequently as adaptations within a species. ISME J. 7, 1080-1091 (2013).
- Maughan, H., Nicholson, W. L. Increased fitness and alteration of metabolic pathways during Bacillus subtilis evolution in the laboratory. Appl. Environ. Microbiol. 77, 4105-4118 (2011).
- Burkholder, P. R., Giles, N. H. Induced biochemical mutations in Bacillus subtilis. Am. J. Bot. 34, 345-348 (1947).
- McLoon, A. L., Guttenplan, S. B., Kearns, D. B., Kolter, R., Losick, R. Tracing the domestication of a biofilm-forming bacterium. J. Bacteriol. 193, 2027-2034 (2011).
- Zeigler, D. R., et al. The origins of 168, W23, and other Bacillus subtilis legacy strains. J. Bacteriol. 190, 6983-6995 (2008).
- Gunka, K., Tholen, S., Gerwig, J., Herzberg, C., Stülke, J., Commichau, F. M. A high-frequency mutation in Bacillus subtilis: requirements for the decryptification of the gudB glutamate dehydrogenase. 194, 1036-1044 (2012).
- Commichau, F. M., et al. Characterization of Bacillus subtilis mutants with carbon source-independent glutamate biosynthesis. J. Mol. Microbiol. Biotechnol. 12, 106-113 (2007).
- Beckwith, J. Genetic suppressors and recovery of repressed biochemical memory. J. Biol. Chem. 284, 12585-12592 (2009).
- Gunka, K., Commichau, F. M. Control of glutamate homeostasis in Bacillus subtilis: a complex interplay between ammonium assimilation, glutamate biosynthesis and degradation. Mol. Microbiol. 85, 213-224 (2012).
- Yan, D. Protection of the glutamate pool concentrations in enteric bacteria. Proc. Natl. Acad. Sci. U.S.A. 104, 9475-9480 (2007).
- Belitsky, B. R., Sonenshein, A. L. Role and regulation of Bacillus subtilis glutamate dehydrogenase genes. J. Bacteriol. 180, 6298-6305 (1998).
- Commichau, F. M., Herzberg, C., Tripal, P., Valerius, O., Stülke, J. A regulatory protein-protein interaction governs glutamate biosynthesis in Bacillus subtilis: the glutamate dehydrogenase RocG moonlights in controlling the transcription factor GltC. Mol. Microbiol. 65, 642-654 (2007).
- Gordo, I., Perfeito, L., Sousa, A. Fitness effects of mutations in bacteria. J. Mol. Microbiol. Biotechnol. 21, 20-35 (2011).
- Rabatinová, A., et al. The δ subunit of RNA polymerase is required for rapid changes in gene expression and competitive fitness of the cell. J. Bacteriol. 195, 2603-2611 (2013).
- Capra, E. J., Perchuk, B. S., Skerker, J. M., Laub, M. T. Adaptive mutations that prevent crosstalk enable the expansion of paralogous signalling protein families. Cell. 150, 222-232 (2012).
- García-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J. Vis. Exp. (15), (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved