Method Article
蛍光標識株の共同栽培による細菌細胞集団における種内競争のモニタリング
要約
細菌は、その生涯の間に有害または有益な突然変異のいずれかを蓄積することができます。細胞の集団では、有益な突然変異を蓄積した個体は、急速に仲間を上回る可能性があります。ここでは、蛍光標識された個体を用いて、時間の経過とともに細菌細胞集団における種内競争を可視化する簡単な手順を提示する。
要約
細菌などの多くの微生物は非常に急速に増殖し、集団は高い細胞密度に達する可能性があります。集団の細胞の小さい分数は、常に細胞にとって有害または有益な突然変異を蓄積している。突然変異の適性効果がサブ人口に強力な選択的成長優位性を提供するならば、この亜集団の個体は急速に競争し、さらには彼らの直近の仲間を完全に排除するかもしれない。したがって、有益な突然変異を獲得した細胞の小さな遺伝的変化および選択主導的蓄積は、細胞集団の遺伝子型の完全なシフトにつながる可能性がある。ここでは、グラム陽性モデル 細菌サブティリスの蛍光標識体の共培養によって、時間の経過とともに細菌細胞集団における有益および有害な突然変異の迅速なクローン拡張および消失を監視する手順を提示する。この方法は、細菌細胞集団における個体間の種内競争を表示する方法が容易かつ非常に例示的である。
概要
土壌細菌は、通常、柔軟な規制ネットワークと広範な代謝能力に恵まれています。両方の特徴は、細胞が与えられた生態学的ニッチ1で利用可能である栄養素のために彼らの仲間や他の微生物と競合するために、それらの同化および同化経路を調整することを可能にする。しかし、細菌が環境に適応できない場合、他のメカニズムは種の生存を説明する可能性があります。確かに、多くの細菌が急速に増殖し、集団が高い細胞密度に達することができるように、亜集団は自発的に細胞に選択的な成長の利点を提供し、したがって、その適性を高める有益な突然変異を蓄積している可能性があります。さらに、突然変異ホットスポットおよびストレス誘発適応性変異発生は、不適合細菌2,3の進化を促進することができる。したがって、連続選択下での突然変異および増殖の蓄積は、同一属4,5内であっても、巨大な微生物多様性の起源である。自然界と同様に、細菌ゲノムの形成は、選択下の連続栽培のために実験室でも起こる。これは、基礎研究および産業界で世界的に使用されているグラム陽性細菌B.サブティリスの家畜化によって例示される。1940年代にB.サチリスをDNA損傷X線で処理し、その後、特定の成長条件6で培養した。それらの家畜化中に細菌に蓄積された突然変異は、多くの成長特性の喪失を占める、すなわちB.サブチリス実験室株168は、複雑なコロニー7,8を形成する能力を失った。
今日では、最もよく研究されたモデル細菌 大腸菌 と B.サブティリスのために、特定の科学的な質問に対処するためにゲノムを遺伝的に操作するための様々な強力なツールが利用可能です。時には、目的の遺伝子の不活性化は、重篤な成長欠陥を引き起こし、その後、標準的な成長培地9ではっきりと見える。対照的に、弱い成長欠陥を引き起こし、ひずみの適性にわずかに影響を与える突然変異はしばしば無視される。しかしながら、いずれの場合も、数世代にわたって変異株の培養および経架を長時間化すると、通常は親株2,9の表現型を回復したサプレッサー変異体の蓄積をもたらす。サプレッサー変異体の特徴付けと、親突然変異株の成長欠陥を回復した突然変異の同定は、重要かつしばしば新しい細胞プロセス10,11の解明を可能にする非常に有用なアプローチである。
我々はB.サチリス12におけるグルタミン酸恒常性の制御に興味を持っている。大腸菌と同様に、B.サチリスは、サプレッサー突然変異体の蓄積によるグルタミン酸恒常性(すなわちグルタミン酸分解2のブロック)の摂動に応答する。自発的突然変異によって獲得されたこれらのサプレッサー変異体におけるゲノム変化は、グルタミン酸恒常性9,13を迅速に回復させることが示された。したがって、細菌の家畜化中の特定の成長条件に対するB.サチリスの適応が酵素合成および進化した酵素活性においてミラーリングされ、グルタミン酸代謝12に関与していることは驚くべきことではない。家畜化過程中の成長培地における外因性グルタミン酸の欠如が、実験室株1682,14における暗号性グルタミン酸脱水素酵素(GDH)gudB CR遺伝子の出現および固定化の原動力であったことが示唆されている。この仮説は、実験室株におけるGDH活性の減少量が外因性グルタミン酸が不足しているときに選択的増殖の利点を細菌に提供するという我々の観察によって支持される2。また、B.サチリス株の培養は、GDH GudBを合成し、外因性グルタミン酸がない場合には、gudB遺伝子2を不活性化したサプレッサー変異体の蓄積をもたらす。明らかに、同化活性GDHの存在は、他の方法で使用できる内因的に産生されたグルタミン酸がアンモニウムおよび2-オキソグルタル酸に分解されるため、細胞にとって不利である(図1)。対照的に、グルタミン酸が培地によって提供される場合、高レベルGDH活性を有するB.サチリス株は、1つの機能GDHのみを合成する株に対して選択的な増殖性を有する。高レベルのGDH活性により、細菌は培地2によって提供される他の炭素源に加えて、第2の炭素源としてグルタミン酸を利用することを可能にする(図1を参照)。したがって、GDH活性は、外因性グルタミン酸の入手可能性に応じて、細菌の適性に強く影響を及ぼす。
ここでは、染色体上の単一の遺伝子座で異なる2つの B.サチリス 株間の種内競争を監視し、可視化するための非常に例示的な方法を提示する(図2)。この2株を、フルオロフォアYFPおよびCFPをコードする yfp および cfp 遺伝子で標識し、異なる栄養条件下で共栽培した。時間をかけてサンプリングし、寒天プレートに適切な希釈液をめっきすることにより、各培養物の生存者は、一般的なステレオ蛍光顕微鏡を使用して容易に監視することができます。この論文に記載されている手順は、細胞集団における有益および有害な突然変異の急速なクローン拡張および除去を、時間の経過とともに容易に行い、視覚化するのに適している。
プロトコル
寒天プレート、培養メディア、クライオストック、プレカルチャーの製造
- 成長培地と必要な試薬を準備します(材料および試薬の表を参照)。
- B.サチリス株をストリーク(例えば.BP40(rocG+ gudBCR amyE::PgudB-yfp)および BP52(rocG+ gudB+ amyE::PgudB-cfp) は、それぞれ1つと2つのアクティブなGDHを発現します)2 SPミディアガルプレートの競技実験で使用される単一コロニーを得る。プレートを一晩37°Cでインキュベートする。
- 単一コロニーを取り、4 ml LB液体培地を含む滅菌培養管を接種する。28°Cおよび220のrpmで一晩細菌を成長させる。
- 細胞がライスまたは胞子を避けるために28°Cで一晩培養を成長させます。
- 標準分光光度計を用いて、波長600nm(OD600)で培養液の光学濃度を測定します。
- 培養物が2.0のOD600 に達した場合、1.5ml反応チューブ中の無菌50%グリセロール溶液の0.75mlと培養物の0.75mlを混合する。最終OD600 は、約108 細胞/mlを含む凍結ストックを得るために1.0でなければなりません。
- チューブは-80°Cで保管してください。
- フルオロフォア遺伝子をコードする cfp および yfp で標識された各株の3つの前培養を行う。-80°Cのクライオストックから1μl細胞で前培養(4ml LB液体培地を含む無菌培養チューブ)を接種する。培養物を28°Cおよび220rpmで一晩インキュベートする。
2. 細菌の共同栽培、サンプル採取、試料保存
- 100 ml の C-Glc および CE-Glc の最小限の培地 (試薬と材料の表を参照) を準備し、各培地の 20 ml を滅菌 100 ml の振るフラスコに移します。
- 一晩栽培したプレカルチャーの0.1mlを取り、1.5mlキュベットで0.9ml LB培地で希釈し、OD600を決定する。
- 競技実験では、1.0~1.5の間に類似のOD600 を有する異なる株の前培養を行う。
- 混合細胞集団を得るために、適切なOD600 を有した培養前培養の細胞を、20mlC-GlcおよびCE-Glc最小培地中の0.05のOD600 に希釈し、100mlの揺れフラスコで補充した。競技実験では、2つの株を1:1の比率で混合する必要があります。
- フラスコから10mlのサンプルを取り、15mlのプラスチックチューブに移し、標準的なテーブル上部遠心分離機で4,000 x gで10分間遠心分離して細胞を収穫し、上清を捨てます。
- 0.5 ml新鮮なLB培地で細胞を再懸濁し、細胞を無菌1.5 ml反応カップに移します。0.5 mlの50%無菌グリセロールを加え、厳密なボルテックスで懸濁液を混合し、さらに処理するまで-80°Cの冷凍庫に保存します。
- 37°Cおよび220rpmで最大24時間、振るフラスコに残された細胞をインキュベートする。蛍光色素の写真の漂白を防ぐために、暗闇の中で揺れるフラスコを保ちます。
- 7時間および24時間の成長の後に0.1 mlのさらなるサンプルを取る。サンプルの1:10希釈液(C-GlcまたはCE-Glc最小媒体)のOD600 を測定して注意してください。
- 各培養物から適切な量の細胞を取り出し、OD600 が1.0の凍結ストックを作ります。さらに処理するまで-80°Cでサンプルを保管してください。
3. 定量分析のためのサンプル処理、めっき、インキュベーション
- すべてのサンプルを採取した後、凍結ストックを解凍し、細胞を0.9%の生理食塩水(試薬および材料の表を参照)で10-3まで希釈した。
- SP培地寒天プレート上の10-3 希釈液の0.1mlをプレートし、滅菌ガラスピペットを使用して細胞を分配する。
- 単一のコロニーが出現するまで、暗闇の中で37°Cで一晩プレートをインキュベートします。
4. 定量分析のための立体蛍光顕微鏡による被爆者数
- ステレオ蛍光顕微鏡の下で生存者を数えながら、より良い方向のために4つの部分に黒いペンで寒天プレートの底を分割します。
- プレートを顕微鏡の下に逆さまに置き、冷たい光源を使用してコロニーを焦点にします。
- コロニーが焦点を合わせられたら、CFP用に適切なフィルタセットに切り替えて 、cfp標識株の生存細胞を視覚化します。ペンでコロニーにラベルを付けることによって、この株の生存者を数え、数をメモします。
- エタノールでラベルを取り除き、YFPフィルタセットに切り替えて 、yfpラベル付き歪みの生存細胞を可視化します。ペンでコロニーにラベルを付けることによって、再び生存者を数え、番号をメモします。
5. 半定量分析のためのサンプル処理と顕微鏡
- 例示的な図では、SP寒天プレート上のステップ3.1から10-4 希釈液(約100細胞)の10μlをスポットする( 図3を参照)。
- 単一のコロニーが出現するまで、暗闇の中で37°Cで一晩プレートをインキュベートします。
- 顕微鏡の下に蓋をせずにペトリ皿を置き、冷たい光源を使用してスポットを焦点にします。
- 例示の図のためのスポットの写真を撮ります。冷たい光源でコロニーの写真を撮るための適切な露出時間を選択してください。
- プレートを動かさずに、CFPフィルタセットに変更し、露光時間を調整して写真を撮ります。YFP フィルタセットでも同じ操作を行い、画像を保存してさらに解析を行います。
6. データ分析
- 定量的データ分析には、Excel などのソフトウェアを使用します。カウントされたコロニーに基づいて、100%に設定されたコロニーの総数に対する黄色と青のコロニーの割合を計算します。
- 計算された数値を使用して、積み上げバー図を作成します ( 図 4 および図 5を参照)。Adobe Photoshop などの画像処理プログラムを使用して、さまざまな場所から撮影した写真のマージされた画像を作成します。あるいは、自由に入手可能なソフトウェアImageJは 、http://rsbweb.nih.gov/ij/ からダウンロード可能な画像処理に使用することができる。
- CFP フィルタ セットと YFP フィルタ セットで撮影した 1 つの場所から画像を開きます。メディアから任意のバックグラウンド蛍光を低減するためにコントラストと明るさを最適化します。
- いずれかの画像に移動し、すべてを選択します。図をコピーして、他の図に貼り付けます。
- 「カラードッジ」機能を使用して画像をマージするか、チャンネルタブを使用して蛍光画像をオーバーレイします。異なる媒体および異なる時点からのコロニーの結合された写真は、液体培養中の異なる株の成長を表す。
7. 具体的なヒント:色素スイッチ実験とcfpとyfpで標識された同種株の共同栽培
B.サブティリスにおける2つのフルオロフォアコード遺伝子のどちらかの発現は、適性および細菌の増殖速度に影響を与える可能性がある。したがって、栽培中の細胞集団からの1つの競合株の排除が単にフルオロフォアの悪影響によるものであることを排除するために、以下の実験を行うことを推奨する。
- 実験全体を繰り返し、逆に標識された株を共同栽培する(例えば、以前の cfp標識株は yfp 遺伝子で標識され、 その逆も同様である)。逆であるが、得られた結果は、一方の株が他の株よりも選択的な成長優位性を有するという以前の観察と同等であるべきである。
- 実験全体を繰り返し、yfpおよびcfpでラベル付けされた同等体性株(例えばBP40(rocG+ gudBCR amyE::PgudB-yfp)およびBP41(rocG+ gudBCR amyE::PgudB-cfp))を共同栽培する。時間の経過に伴う細胞集団の組成に従うことによって、細菌の適合性に対する2つのフルオロフォアのどちらかの負の効果を推定する。
結果
ここで説明した方法は、フルオロフォアCFPおよびYFPをコードするcfp遺伝子およびyfp遺伝子で標識されたB.サチリス株からなる細胞集団における種内競争を可視化するために、それぞれうまく適用された。図3に示すように、この方法は、非常に例示的な方法で種内競争を視覚化するために使用することができる。小さな領域にサンプルを見つけることによって、細胞集団のクローン組成が一目で見えるようにした。定量的分析には適していないが、このアプローチは、異なる成長パラメータ(すなわち、窒素源)が最初に両方の株を等量で含んでいた細胞集団の発達に及ぼす影響を概算するのに有用である(図3)。また、小規模アプローチでは、同じ成長条件下で栽培された異なるB.サチリス株の適性を単一の寒天プレートを用いて試験することができる。定量分析では、寒天プレートの表面全体にサンプルを伝播することをお勧めします。これにより、コロニーのオーバーレイが防止され、単一細胞から出現したコロニーの識別と数が明確になります。寒天板に適切な希釈液をめっきすることにより、時間の経過に伴う細胞集団のクローン組成物は、黄色と青色の蛍光コロニーを数えることによって正確に決定することができる(図4参照)。我々が既に報告したように、GDH活性は、外因性グルタミン酸2の入手可能性に応じてB.サチリスの適性に強く影響を及ぼす。明らかに、外因性グルタミン酸の存在しない場合、高レベルのGDH活性は、酵素RocGおよびGudBが、アナボリズムに必要なグルタミン酸を分解するので、細菌にとって不利である(図1および図4Aを参照)。対照的に、細菌に提供すれば、グルタミン酸は、アミノ基ドナーとして、経AMI化反応の役割を果たすことができる。また、グルタミン酸は炭素代謝に供給され、同化活性GDHs RocGとGudBの存在によりエネルギー源として使用することができる(図1および図4B)。図4Cおよび4Dに示すように、同様の結果が色素スイッチ実験で得られた。再び、高レベルGDH活性を有する細菌は、グルタミン酸を欠く増殖培地におけるGDH活性低下を有する細胞によって上回った。対照的に、培地をグルタミン酸で添加した場合、活性GDHを1つだけ合成する細菌は、培養物から排除された。図5Aおよび図5Bに示すように、混合細胞集団の初期組成は時間の経過とともにほぼ一定のままであった。したがって、競争実験では、異なる量のGDH活性を有していた2株のどちらかの排除は、フルオロフォアによって引き起こされる成長欠陥によるものではなかった(図4参照)。 一緒に考えて、フルオロフォアの使用は、細菌細胞集団における種内競争を監視するための強力なツールです。

図 1. B.サブチリスにおける炭素と窒素代謝の間のリンク. グルタミン酸が培地によって提供されない場合、同化に必要な主要アミノドナーは、グルタミンシンセターゼ(GS)とグルタミン酸シンターゼ(GOGAT)との組み合わせ作用によりアンモニウムと2-オキソグルタル酸から合成される。対照的に、外因性グルタミン酸の存在下では、異化活性GDHs RocGおよび/またはGudBは、アンモニウムおよび2-オキソグルタル酸にグルタミン酸を分解し、炭素源として機能する。
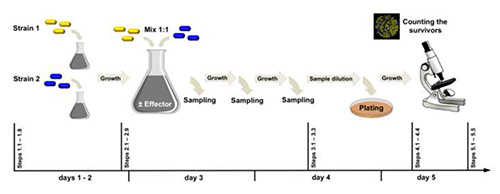
図 2.実験的なワークフロー。ひずみ 1 (yfpでラベル付け) とひずみ 2 (cfpでラベル付け) は、1 つの軌跡が互いに異なります。ここで示した例では、最初にrocG+gudB+の50%を含む細胞集団の遺伝子学的シフトに対する外因性グルタミン酸(エフェクター)の効果を比較した。 ここをクリックすると、より大きな画像が表示されます。

図 3. 種内競争を記述的な方法で可視化する半定量的アプローチ(セクション5を参照)。 コスピリウション(0時間)の前に、7時間および24時間後の増殖希釈(10-4)の細胞がSP寒天プレート上に発見された。37°Cで12時間のインキュベーション後にコロニーを形成した生き残った細胞を、ステレオ蛍光顕微鏡で同定した。露出時間、0.6秒;スケールバー、1ミリメートル。この図は、群華 ららから修正された。20132.

図 4. 種内競争の定量化。 サンプル希釈および細胞の伝播後(ステップ3.1〜3.3を参照)、プレートを37°Cで一晩インキュベートした。 黄と青のコロニーは、プロトコル4および6に記載されているように定量化された。黒い誤差範囲は、少なくとも4つの独立して繰り返される実験の標準偏差を表します。各寒天プレートには、少なくとも100個の計数可能なコロニーが含まれていました。(A)外因性グルタミン酸がない場合 、B.サチリス 株BP40(黄色)は、グルタミン酸分解酵素、RocGおよびGudBの両方を合成する1つの機能GDHを備えたBP54(青)株を上回る。(B)対照的に、2つの機能性GDHsの合成は、グルコースに加えて、グルタミン酸が炭素源として使用されるため、外因性グルタミン酸が利用可能な場合に細菌にとって有利である。(C)および(D)に示すように、色素スイッチ実験で同等の結果が得られた。この図は、群華 ららから修正された。20132. ここをクリックすると、より大きな画像が表示されます。

図 5.細菌の適合性に対するフルオロフォアコードcfpおよびyfp遺伝子の効果を評価する制御実験。等原性株BP40(rocG+ gudBCR amyE::yfp)とBP41(rocG+ gudBCR amyE::cfp)またはBP52(rocG + gu)の混合集団dB + amyE::cfp)およびBP156(rocG+ gudB+ amyE::yfp)は、存在しない状態で成長した (A) および外因性グルタミン酸の存在 (B) .生き残った細胞を、それぞれプロトコル1〜4及び6に記載されているように数えた。バーは、少なくとも4つの独立して繰り返される実験の標準偏差を表します。この図は、群華ららから修正された。20132.ここをクリックすると、より大きな画像が表示されます。
ディスカッション
細菌の競争力のある適合性を分析するためにいくつかの方法が開発されています16.多くの場合、細菌は異なる抗生物質耐性カセット17で標識された。我々のアプローチと同様に、抗生物質耐性カセットを用いた細胞の標識は、定義された成長条件下での共培養中の細菌の競争力の適合性の評価を可能にする。さらに、この方法は、染色体17上の特定の軌跡において互いに異なる細胞の競争力を決定するために使用することができる。しかし, 競争力のあるフィットネスを監視する抗生物質耐性カセットを使用していくつかの欠点があります。.抵抗性遺伝子の発現は主に不等強度のプロモーターによって駆動されるため、抗生物質に対する耐性を与える酵素はおそらく異なるレベルで産生される。したがって、このアプローチでは弱いフィットネス効果が検出できない場合があります。我々のアプローチでは、両方のフルオロフォア遺伝子が同じ選択マーカーと統合され、その発現は同じプロモーター2によって駆動される。抗生物質耐性カセットで競争力のあるフィットネスを監視するもう一つの欠点は、コロニーカウントに適切な抗生物質を補った2種類の寒天プレートが必要であるため、このアプローチがより面倒である可能性があります。あるいは、細菌の適性は、単に成長率を監視し、いわゆるフィットネス指標16の計算によって決定することができる。明らかに、これは細菌が個別に栽培され、特定の遺伝子型の株によって生成される可能性のある有毒な化合物が競合株の成長に影響を与えないので、最も正確なアプローチです。さらに、細胞の成長に影響を与える可能性のある抗生物質を使用する必要はありません。しかし、両方のアプローチは、競争力のあるフィットネスを記述する数字はかなり中立的な方法でしか提示できないので、あまり例示されていません。
フッ素酸コード遺伝子を使用して、種内競争を監視および定量することは、他の方法よりもいくつかの利点を有する。両方の株が二重相同組換えによって遺伝子をコードするフルオロフォアを染色体に統合している場合、いずれの培養工程においても抗生物質を使用する必要はない。したがって、培養中に培養物から採取したサンプルは、同じ増殖培地で分析することができ、両方の株が増殖することができる。このアプローチは、非常に例示的な方法で種内競争の視覚化を可能にする。また、この半定量的アプローチを用いて、複数の成長条件を同時に試験することができ、多くの異なる株を並列に比較することができる。最後に、共培養中に細菌培養から採取したサンプルを冷凍庫18に保存できるため、顕微鏡スライド上にサンプルを固定する必要はない。したがって、すべてのサンプルと反復を同時に分析することができます。
プロトコルの2つの重要なステップを挙げられる必要があります。クライオストックは、各競合株の同じ成長段階で同量の細胞を含む必要があることに注意することが重要です。クライオストックの株の最初の不均衡、そして実験を開始する前のシェイクフラスコでは、競争実験の結果に強い影響を与えます。したがって、実験の前に凍結ストックの組成を確認することが賢明である。さらに、適切な量の細胞がプレート上に均等に伝播されるべきである。そうでなければ、出現したコロニーはお互いに近すぎて、生き残った細胞の正確な決定が困難になります。
また、フルオロフォアベースのアプローチには、いくつかの制限と欠点があります。蛍光色素の励起および発光スペクトルが互いに近すぎるため、マルチウェルプレートリーダーでのコクロピションとCFPおよびYFP信号の同時検出は不可能です。しかし、この技術的な問題は、緑色と赤色の光を放出するものなど、同じタンパク質足場に基づいて最適に異なる蛍光タンパク質を使用して回避することができます。フルオロフォアベースのアプローチのもう一つの欠点は、いくつかの突然変異が細菌の弱い成長欠陥のみを引き起こすことである可能性があります。したがって、いずれかのフルオロフォアコード遺伝子によって引き起こされる可能性のある成長欠陥が、ある種の突然変異によって引き起こされる成長欠陥よりも強い場合、フルオロフォアベースのアプローチは、種内競争を分析するのに適していない。したがって、株のセット全体を作成する前に、最初に親株のみを cfp と yfp の両方でラベル付けし、株を共栽培することをお勧めします。成長実験は、蛍光体が細菌の適性にどの程度強く影響するかを明らかにします( 図5A および 5Bを参照)。
今後、生き残った細胞がフローサイトメトリーを使用して数えられると、種内競争を監視するフルオロフォアベースのアプローチがより正確で手間が低くなるかどうかをテストすることは興味深いでしょう。近年、フローサイトメトリーは B.サブチリス バイオフィルム19の組成を解析する強力なツールであることが示されている。さらに、発酵槽内のフルオロフォア標識細菌の連続的な共同培養によって細菌の競争適性に影響を与える弱いフィットネス効果を分析することがより適切である可能性があります。揺れるフラスコとは対照的に、このアプローチは成長条件を一定に保ち、長期間にわたって種内競争を監視することを可能にする。
開示事項
著者らは、競合する財政的利益はないと宣言している。
謝辞
著者の研究室での作業は、ドイツ・フォルシュングスゲミンシャフト(http://www.dfg.de によってサポートされました。CO 1139/1-1)、フォンズ・デア・ケミッシェン・インダストリー(http://www.vci.de/fonds)、ゲッティンゲン分子生物学センター(GZMB)。著者たちは、ヨルグ・シュテルケに対する有益なコメントと原稿の批判的な読み取りを認めたいと考えています。
資料
| Name | Company | Catalog Number | Comments |
| (NH4)2SO4 | Roth, Germany | 3746 | |
| Agar | Difco, USA | 214010 | |
| Ammonium ferric citrate (CAF) | Sigma-Aldrich, Germany | 9714 | |
| CaCl2 | Roth, Germany | 5239 | |
| Glucose | Applichem, Germany | A3617 | |
| Glycerol | Roth, Germany | 4043 | |
| K2HPO4•3H2O | Roth, Germany | 6878 | |
| KCl | Applichem, Germany | A3582 | |
| KH2PO4 | Roth, Germany | 3904 | |
| KOH | Roth, Germany | 6751 | |
| MgSO4•7H2O | Roth, Germany | P027 | |
| MnCl2 | Roth, Germany | T881 | |
| MnSO4•4H2O | Merck Millipore, Germany | 102786 | |
| NaCl | Roth, Germany | 9265 | |
| Nutrient broth | Roth, Germany | X929 | |
| Potassium glutamate | Applichem, Germany | A3712 | |
| Tryptone | Roth, Germany | 8952 | |
| Tryptophan | Applichem, Germany | A3445 | |
| Yeast extract | Roth, Germany | 2363 | |
| 1.5 ml Reaction tubes | Sarstedt, Germany | 72,690,001 | |
| 2.0 ml Reaction tubes | Sarstedt, Germany | 72,691 | |
| 15 ml Plastic tubes with screw cap | Sarstedt, Germany | 62,554,001 | |
| Petri dishes | Sarstedt, Germany | 82.1473 | |
| 1.5 ml Polystyrene cuvettes | Sarstedt, Germany | 67,742 | |
| 15 ml Glass culture tubes | Brand, Germany | 7790 22 | |
| 100 ml Shake flasks with aluminium caps | Brand, Germany | 928 24 | |
| Sterile 10 ml glass pipettes | Brand, Germany | 278 23 | |
| Incubator (28 and 37 °C) | New Brunswick | M1282-0012 | |
| Standard pipette set (2-20 μl, 10-100 μl, 100-1,000 μl) | Eppendorf, Germany | 4910 000.034, 4910 000.042, | |
| Table top centrifuge for 1.5 and 2 ml reaction tubes | Thermo Scientific, Heraeus Fresco 21, Germany | 75002425 | |
| Table top centrifuge for 15 ml plastic tubes | Heraeus Biofuge Primo R, Germany | 75005440 | |
| Standard spectrophotometer | Amersham Biosciences Ultrospec 2100 pro, Germany | 80-2112-21 | |
| Stereofluorescence microscope | Zeiss SteREO Lumar V12, Germany | 495008-0009-000 | |
| Freezer (-20 and -80 °C) | - | - | |
| Fridge (4 °C) | - | - | |
| Autoclave | Zirbus, LTA 2x3x4, Germany | - | |
| pH meter | pH-meter 766, Calimatic, Knick, Germany | 766 | |
| Vortex | Vortex 3, IKA, Germany | 3340000 | |
| Balance | CP2202S, Sartorius, Germany | replaced by | |
| Black pen (permanent marker) | Staedler, Germany | 317-9 | |
| Powerpoint program | Microsoft, USA | - | |
| Office Excel program | Microsoft, USA | - | Program for data processing |
| Adobe Photoshop CS5 | Adobe, USA | replaced by CS6, download | Computer program for image processing |
| Computer | PC or Mac | - | |
| ZEN pro 2011 software for the stereofluorescence microscope | Zeiss, Germany | 410135 1002 110 | AxioCam MRc Rev. Obtained through Zeiss |
| Specific solution recipes | |||
| SP Medium | |||
| 8 g Nutrient broth | |||
| 0.25 mg MgSO4•7H2O | |||
| 1 g KCl | |||
| 15 g agar for solid SP medium | if required | ||
| add 1 L with H2O | autoclave for 20 min at 121 °C | ||
| 1 ml CaCl2 (0.5 M), sterilized by filtration | |||
| 1 ml MnCl2 (10 mM), sterilized by filtration | |||
| 2 ml ammonium ferric citrate (CAF, 2.2 mg/ml), sterilized by filtration | |||
| LB Medium | |||
| 10 g Tryptone | |||
| 5 g Yeast extract | |||
| 10 g NaCl | |||
| 15 g agar for solid LB medium | if required | ||
| add 1 L with H2O | autoclave for 20 min at 121 °C | ||
| C-Glc Minimal Medium | |||
| 200 ml 5 x C salts | |||
| 10 ml L-Tryptophan (5 mg/ml), sterilized by filtration | |||
| 10 ml ammonium ferric citrate (CAF, 2.2 mg/ml), sterilized by filtration | |||
| 10 ml III’ salts | |||
| 25 ml Glucose (20%) | autoclaved for 20 min at 121 °C | ||
| add 1 L with sterile H2O | |||
| CE-Glc Minimal Medium | |||
| 200 ml 5 x C salts | |||
| 10 ml L-Tryptophan (5 mg/ml), sterilized by filtration | |||
| 10 ml ammonium ferric citrate (CAF, 2.2 mg/ml), sterilized by filtration | |||
| 10 ml III’ salts | |||
| 20 ml Glutamate (40%) | |||
| 25 ml Glucose (20%), autoclaved for 20 min at 121 °C | |||
| add 1 L with sterile H2O | |||
| 5 x C salts | |||
| 20 g KH2PO4 | |||
| 80 g K2HPO4•3H2O | |||
| 16.5 g (NH4)2SO4 | |||
| add 1 L with sterile H2O | autoclave for 20 min at 121 °C | ||
| III’ salts | |||
| 0.232 g MnSO4•4H2O | |||
| 12.3 g MgSO4•7H2O | |||
| add 1 L with sterile H2O, autoclave for 20 min at 121 °C | |||
| 40% Glutamate solution | |||
| 200 g L-Glutamic acid | |||
| adjust the pH to 7.0 by adding approximately 80 g KOH | |||
| add 0.5 L with sterile H2O | autoclave for 20 min at 121 °C | ||
| 0.9% Saline (NaCl) Solution | |||
| add 1 L with sterile H2O | autoclave for 20 min at 121 °C | ||
| 50% Glycerol solution | |||
| 295 ml Glycerol (87%) | |||
| add 0.5 L with sterile H2O | autoclave for 20 min at 121 °C | ||
| Bacteria (All strains are based on the Bacillus subtilis strain 168) | |||
| Bacillus subtilis BP40 (rocG+ gudBCR amyE::PgudB-yfp) | Laboratory strain collection | ||
| Bacillus subtilis BP41 (rocG+ gudBCR amyE::PgudB-cfp) | |||
| Bacillus subtilis BP52 (rocG+ gudB+ amyE::PgudB-cfp) | |||
| Bacillus subtilis BP156 (rocG+ gudB+ amyE::PgudB-yfp) | |||
参考文献
- Buescher, F. I., et al. Global network reorganization during dynamic adaptations of Bacillus subtilis metabolism. Science. 335, 1099-1103 (2012).
- Gunka, K., Stannek, L., Care, R. A., Commichau, F. M. Selection-driven accumulation of suppressor mutants in Bacillus subtilis: the apparent high mutation frequency of the cryptic gudB gene and the rapid clonal expansion of gudB+ suppressors are due to growth under selection. PLoS One. 8, (2013).
- Al Mamum, A. A. M., et al. Identity and function of a large gene network underlying mutagenic repair of DNA breaks. Science. 338, 1344-1348 (2012).
- Koeppel, A. F., Wertheim, J. O., Barone, L., Gentile, N., Krizanc, D., Cohan, F. M. Speedy speciation in a bacterial microcosm: new species can arise as frequently as adaptations within a species. ISME J. 7, 1080-1091 (2013).
- Maughan, H., Nicholson, W. L. Increased fitness and alteration of metabolic pathways during Bacillus subtilis evolution in the laboratory. Appl. Environ. Microbiol. 77, 4105-4118 (2011).
- Burkholder, P. R., Giles, N. H. Induced biochemical mutations in Bacillus subtilis. Am. J. Bot. 34, 345-348 (1947).
- McLoon, A. L., Guttenplan, S. B., Kearns, D. B., Kolter, R., Losick, R. Tracing the domestication of a biofilm-forming bacterium. J. Bacteriol. 193, 2027-2034 (2011).
- Zeigler, D. R., et al. The origins of 168, W23, and other Bacillus subtilis legacy strains. J. Bacteriol. 190, 6983-6995 (2008).
- Gunka, K., Tholen, S., Gerwig, J., Herzberg, C., Stülke, J., Commichau, F. M. A high-frequency mutation in Bacillus subtilis: requirements for the decryptification of the gudB glutamate dehydrogenase. 194, 1036-1044 (2012).
- Commichau, F. M., et al. Characterization of Bacillus subtilis mutants with carbon source-independent glutamate biosynthesis. J. Mol. Microbiol. Biotechnol. 12, 106-113 (2007).
- Beckwith, J. Genetic suppressors and recovery of repressed biochemical memory. J. Biol. Chem. 284, 12585-12592 (2009).
- Gunka, K., Commichau, F. M. Control of glutamate homeostasis in Bacillus subtilis: a complex interplay between ammonium assimilation, glutamate biosynthesis and degradation. Mol. Microbiol. 85, 213-224 (2012).
- Yan, D. Protection of the glutamate pool concentrations in enteric bacteria. Proc. Natl. Acad. Sci. U.S.A. 104, 9475-9480 (2007).
- Belitsky, B. R., Sonenshein, A. L. Role and regulation of Bacillus subtilis glutamate dehydrogenase genes. J. Bacteriol. 180, 6298-6305 (1998).
- Commichau, F. M., Herzberg, C., Tripal, P., Valerius, O., Stülke, J. A regulatory protein-protein interaction governs glutamate biosynthesis in Bacillus subtilis: the glutamate dehydrogenase RocG moonlights in controlling the transcription factor GltC. Mol. Microbiol. 65, 642-654 (2007).
- Gordo, I., Perfeito, L., Sousa, A. Fitness effects of mutations in bacteria. J. Mol. Microbiol. Biotechnol. 21, 20-35 (2011).
- Rabatinová, A., et al. The δ subunit of RNA polymerase is required for rapid changes in gene expression and competitive fitness of the cell. J. Bacteriol. 195, 2603-2611 (2013).
- Capra, E. J., Perchuk, B. S., Skerker, J. M., Laub, M. T. Adaptive mutations that prevent crosstalk enable the expansion of paralogous signalling protein families. Cell. 150, 222-232 (2012).
- García-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J. Vis. Exp. (15), (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved