Method Article
Membran Kutup, Membran Dürüstlük ve Hücre içi İyon Konsantrasyonlarında İzleme değişiklikler
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Ökaryotlar için görülenden farklı olarak, esas olarak, küçük boyutu olarak bakterilerde ayrıntılı membran depolarizasyon ve iyon konsantrasyonu değişiklikleri, ölçüm zor geleneksel yöntemler yapan çok az çalışma vardır. Burada, biz floresan teknikleri kullanılarak anlamlı Gram-pozitif bir patojen Streptococcus pneumoniae tür olayları izlemek için detay protokolleri.
Özet
Membran depolarizasyon ve iyon tozları nedeniyle derinden enerjilerine ve sinyal iletiminin gibi hücresel fonksiyonları, darbe yetenekleri biyolojik sistemlerde yaygın olarak incelenmiştir olaylardır. Elektrot kullanımı ve patch-sıkma de dahil olmak üzere hem fluoresan hem de elektrofizyolojik yöntemler, iyi ökaryotik hücrelerde bu olayları ölçmek için geliştirilmiş olmasına rağmen, mikroorganizmalar içindeki etkinlik ölçümü için yöntem daha kompleksi ile bir arada, küçük boyutu göz önüne alındığında geliştirmek için daha zor olduğu kanıtlanmıştır membran koruyucu bakterilerin dış yüzeyi. Streptococcus pneumoniae (pnömokok) ölüm-inisiyasyon çalışmalar sırasında, kutupluluk değişiklikler, bütünlük, ve hücre içi iyon konsantrasyonları dahil membran olayların rolünü aydınlatmak istedim. Literatür taraması, biz çok az çalışma var olduğunu buldu. Diğer araştırmacılar iyon grip ölçmek için radyoizotop alımını ya da denge takip ettixes ve membran potansiyeli ve çoğunlukla Gram-negatif organizmaların çalışmaları, sınırlı sayıda, membran potansiyelini ölçmek için karbosiyanin veya oksonol floresan boyalar kullanılarak, ya da (AM) ester versiyonlarının hücre permeant asetoksimetil bakterileri yüklenirken bazı başarılar görmüştü iyon duyarlı floresan göstergesi boyalar. Bu nedenle Gram-pozitif organizma S. membran potansiyeli, rüptürü ve iyon taşıma ölçmek için protokoller kurulmuş ve optimize pneumoniae. Biz yöntem en iyi şekilde rasyometrik boyaların AM esterleri ile pnömokok yüklemek için, sırasıyla, membran depolarizasyonunu ve kopma ölçmek için hem de bis-oksonol boya DiBAC 4 (3) ve hücre-geçirgen olmayan boya propidyum iyodür kullanılarak protokolleri geliştirilmiştir Fura-2, PBFI ve BCECF bir floresans algılama plaka okuyucusu kullanılarak, Ca2 +, K +, H +, sırasıyla, hücre içi konsantrasyonlarında değişiklikleri tespit etmek. Bu protokoller pnömokok için kendi türünün ilk olarakve bu boyaların büyük çoğunluğu başka bakteri türleri kullanılmıştır edilmemiştir. Bizim protokoller S. için optimize edilmiş olsa pneumoniae, bu yaklaşımlar, diğer bakteri türleri içindeki çalışmaları için mükemmel bir başlangıç noktası oluşturan inanıyoruz.
Giriş
Bizim laboratuvar tümör hücrelerinde apoptoza neden (Tümör hücreleri için öldürücü yapılan insan alfa-laktalbümin için) HAMLET adlandırılan insan sütünden bir protein-lipid kompleksi tespit değil, aynı zamanda bakteri türlerinin 1,2 çeşitli öldürmek mümkün olduğunu sahiptir. Özellikle duyarlı olduğu bulunmuştur Bu tür büyük hassasiyet ve ölüm 2,3 bir apoptoz gibi bir fenotip gösteren Streptococcus pneumoniae (pnömokok) ile, solunum yolu hedef olanlar olmuştur. Membran depolarizasyon ve spesifik iyon taşıma etkinlikleri de tarif edilen ve radyoaktif TPP + iyonları ve JC-1 ve TMRE flüoresan boyalar da dahil olmak üzere, mitokondriyal membran depolarizasyonunu 3 göstermek için kullanılmış olan mitokondri, özellikle ökaryotik hücreler, apoptoz sırasında çok önemli bir etkinlik -5. Böylece, biz çabalarımızı odaklı olarak pnömokokkustan bu zar ilgili özellikleri HAMLET etkisi hakkında daha fazla bilgi edinmek için çalıştıbu süreçte yeni antibakteriyel tedavi ya da aşı adaylarını tanımlamak için büyük bir potansiyele sahip bakterilerde apoptosis-benzeri fenotip, mekanistik bileşenlerin daha iyi anlaşılması.
Bizim mekanik çalışmalar için protokolleri kurmak isteyen olarak, ökaryotik sistemlerde de tarif edilen yöntem aksine, bakteriyel zar, 6,7 elektrofizyolojisi ve iyon taşıma mekanizmaları ayrıntılı olarak, çok az sayıda çalışma olduğunu keşfettiler. Bu, esas olarak daha küçük mikroorganizmaların boyutu ve yüzey mimari, dev protoplast kullanarak bazı çalışmalar, karışık başarı ile gösterilmiş olsa da, özellikle hücre çeperinin mevcudiyeti, bu, yama sıkma gibi geleneksel ökaryotik yöntemleri kullanım için zarın erişilebilirlik sınırlayan atfedilir 8,9. Bu adam gerektirir çünkü bu dev protoplastları ile iş çoğu bakteri türleri için ideal ya da pratik bir yöntem değil gibiipulated bakteri doğal olmayan bir halde ve abiyotik, gerçekleştirilmiştir bakteriyel zarı polarite sınırlı çalışmalar, esas olarak akış sitometrisi kullanılabilir ve siyanin ve oksonol floresan boyaların kullanımı 10-16.
Tek bir zaman noktasında tek bir bakteriden floresans bir araya gelirler, akış sitometrisi yerine, zaman içinde, 96 kuyucuklu bir plaka biçiminde bakteriyel süspansiyonlar floresan yoğunluğunu tespit etmek için bir floresans saptama plaka okuyucusu kullanmak tercih etti. Bu çok daha büyük sadeliği ile çeşitli zaman noktalarında bir bakteri nüfusunu ve kolaylığı ve sürekli akım sitometri kullanarak elde etmek zordur, uzun zaman süreleri için tüm nüfusun floresan kinetiği izlemek sağladı. (Mitokondri ile kullanım için yukarıda tarif edilenler de dahil olmak üzere) potansiyel duyarlı fluoresan boyalar geniş bir yelpazede test sonra, kullanarak en iyi teknik ve pratik başarıDiBAC 4 adı verilen bis-oksonol boya (3) (bis-(1,3-dibutylbarbituric asit) trimethine oksonol) polariteli değişiklikleri izlemek için.
Ayrıca, bu aynı zamanda değerli propidyum iyodür (PI) ile membranın bütünlüğüne parazitlerin izlemek bulunmuştur. Bu boya nükleik aside bağlanması üzerine fluoresces ama bakteri zarın bütünlüğünün canlı ölü-lekeleme deneylerinde ölü hücreleri tespit etmek için kullanılan bileşen popüler hale tehlikeye zaman bunu yapmak için tek edebilmektedir. PI ek olarak, SYTOX yeşil ve TO-PRO-1 harekete benzerdir ve daha önce tespit yöntemleri 17 akış sitometrisi kullanılarak birkaç çalışmalarda bakteriler için kullanılmış olan floresan boyalardır. Biz bize nedeniyle verilen bir numunede DiBAC ile eş zamanlı olarak flüoresanını izlemek için izin onun dalgaboyu PI kullanmayı seçti.
Çalışmalarımızda, biz Hamlet'teki, hem de bakteri öldürücü etkinliğe sahip başka bir ilgili protein-lipit kompleksi gözlemledikpnömokok 3,18,26 tedavisi üzerine hem boyaların floresanstaki artış ile gösterildiği gibi bakteri membranının Eloa indükte depolarizasyon ve kopma olarak da bilinir. Her iki kompleksleri için, DiBAC 4 florasan yoğunluğu (3) depolarizasyon kopma önce meydana geldiğini gösteren, önceki PI yoğunluğundaki artışa bağlı artış, olduğu görülmektedir Bu nedenle, bakterisidal protein-lipid komplekslerinin neden olduğu bir özel olay faiz. Bu fark, membranın kırılma gibi kendisinin spesifik olmayan depolarizasyonu neden olabilir yapmak için önemlidir. DiBAC 4 iki ölçüm ve analiz (3) ve PI floresan kinetik eşzamanlı bize fluorometri kullanarak yerine akış sitometri ek bir avantajı, iki zar, olaylar arasındaki bu ilişkiyi incelemek için izin verdi.
Bakteriyel iyon akımına izlemek için, alımını ölçme dahil, radyoizotoplar kullanarak önceki bazı başarı olmuştur45 Ca biz de son yıllarda yapılan çalışmalarda 18, 21 kullanmış pnömokokkustan 19,20, 2 +. Bununla birlikte, bu radyoaktif iyonlar ile çalışan birkaç dezavantajları vardır. Bunlar pahalı olabilir, zaman alıcı ve dağınık ve de ilginç izotopu bağlı olarak, zarar deneyi gerçekleştiren bireysel açığa çıkarabilir. Buna ek olarak, zaman içinde hızlı bir değişim gözlem altında tutmak güçtür. Böylece, iyona duyarlı floresan göstergesi boyalar asetoksimetil (AM) ester versiyonları kullanan ölçüm alternatif bir yöntem döndü. Kendi başına, gösterge boya şarj edilir ve kolay bir şekilde membrandan geçmez, fakat lipofilik ester grubunun eklenmesi ile, şimdi yüksüz molekül, bakterinin zar içinden geçebilir. Iç girdikten sonra, bakteriyel esterazlar yüklü daha önemli hücre çıkmak kabiliyetini yavaşlama ve izin boya t hücre içinde serbest bırakarak boya, ester grubunun ayrılması veo zamanla birikebilir. Bununla birlikte, bu ester boyaların kullanımı sadece yükleme, algılama ve başarı çeşitli yöntemlerle, hücre içi Ca2 + ve H +, 22-24 16 değişiklikleri tespit etmek için bir kaç bakteri türlerinde tanımlanmıştır.
Hücre içi Ca değişiklikleri izlemek için bir arzu ile 2 + ve S. de K + ve H + düzeyleri pneumoniae HAMLET ve diğer bileşikler ile işlenmesi üzerine, başarılı etkili bir bakteri hücrelerine floresan göstergesi boyalar yüklemek için protokolleri oluşturulur. Anyon-taşıyıcıları ve PowerLoad, yükleme verimliliğini artırır Life Technologies tescilli bir bileşik engelleyerek boya tutma gücünü arttırır hem probenesit gerekli bakteri içine etkili yükleniyor. (K + tespit) Fura-2/AM (Ca 2 + algılama), PBFI / AM ve BCECF / AM (H + algılama) başarıyla kapsüllenmemiş ve kapsüllü hem pnömokok st yüklenmiştirbir floresans saptama plaka okuyucusu 18, 21 ile (K + uncoupler) ve CCCP (H + uncoupler) valinomycin gibi ionomisin (Ca 2 + uncoupler) ve iyonoforlar, ilave edildikten sonra, elde edilen flüoresan desen ölçümünü sağlayan yağmurlar.
Protokol
1.. Bakteriyel Kültürler hazırlanması
- Deneylerinde kullanılmak üzere kültür yetiştirilmesi
- 37 ° C ısıtma bloğu, S. dondurulmuş bir stok-şişeyi çözülme pneumoniae ve taze 9 ml de içerik, bir kültür cam tüp içinde 10 ml toplam hacim için% 0.5 maya ekstraktı (THY) olan Todd-Hewitt lapasının önceden ısıtılmış.
- Kültür orta log fazı (Abs 600 nm ≈ 0,5-0,6) ulaşana kadar 37 ° C'de statik inkübe edin.
2. Membran depolarizasyon ve ACL algılama
- Hazırlama reaktifler
- DiBAC 4 bir 50 uM stok (3)% 100 DMSO içinde ve GKD 2 O'da PI bir 2 mg / ml stok hazırlamak DiBAC 4 (3), hisse senedi, en az 6 ay boyunca -20 ° C 'de stabildir. PI stok en az 6 ay boyunca 4 ° C'de stabildir.
- Işıktan korumak için folyo stokları sarın.
- Yüklemebakteriler
- Oda sıcaklığında 10 dakika boyunca 2400 x g'de santrifüj ile adım 1.2.2, bakteri hücrelerinin taneleştirilmesi ve 2400 x g hızında tekrar 1x Fosfat Tamponlu Salin (PBS), ve santrifüj 10 ml pelet yeniden süspansiyona, süpernatant kaldırarak iki kez yıkayın 10 dakika için.
- Orijinal hacmine gelinceye kadar PBS içinde tekrar süspansiyon süpernatan ve topak çıkarın. Bu, ml başına yaklaşık 10 bakteri 8 koloni oluşturan birim sağlayacaktır. Yıkanmış hücreler (5 numuneleri için yeterli) 1 ml çıkarın ve bir mikrosantrifüj tüpü içine koyun.
- Bu hücreler için, 25 mM bir son glükoz konsantrasyonu bir glükoz, 1 M filtre ile sterilize edilmiş stok çözeltisi (GKD 2 O hazırlanmış ve 0.45 um'lik bir filtreden filtre edildi) 25 ul ekleyin ve 37 ° C bir ısıtma bloğu içinde inkübe On beş dakika karıştırıldı. NOT: Bu, tüm ATP-bağımlı membran kanalları ve hücresel bileşenleri için enerji sağlar. Bu aşama için gereken deneye bağlı olarak değişebilir.
- 50 uM DiBAC 4 (3) için stoklar 5 ul ve 2 mg / ml stok PI 10 ul ekle. Bu, sırasıyla, 250 nM nihai konsantrasyonlarda ve 20 ug / ml içerir. Pipetleme ve birkaç kez aşağı iyice karıştırın. Açık bir 96 oyuklu plakanın her bir oyuğuna, bu örnek, hücre süspansiyonu 200 ul ekleyin.
- Floresans saptama
- Bir önceden ısıtılmış (37 ° C) floresans saptama plaka okuyucusu içinde yer plakası.
- Uygun filtreler DiBAC 4 (3) (490 nm uyarma, 516 nm emisyon) ve PI (535 nm uyarma, 617 nm emisyon) tespiti için yerinde olduğundan emin olun.
- Okuma stabilize olana kadar (3) membran üzerinde, yaklaşık 30-40 dakika boyunca her dakika floresan ölçümler almak için okuyucu ayarlamak veya DiBAC 4 dengede (ve aynı anda monitör) için izin vermek için, bu bir "ön arıtma" okuma olarak hizmet vermektedir.
- Plakasını çıkarın ve seçim deneysel ajan eklemek ve immedgeçirmeden DiBAC 4 istenen zaman süresi için (3) ve PI floresans izleme devam etmek için okuyucu arka plaka yerleştirilir. Çok kanallı bir pipet kullanılarak, aynı anda birkaç numune tedavisinde aynı anda tüm çukurlara ajan ilave etmek yararlı olabilir edin.
- Microsoft Excel gibi bir veri analizi programı okuma ihracat. Membran depolarizasyonuna ve rüptürü değerlendirmek için zamanla arsa floresan. Ile iki kere durulanmış ve PI artan flüoresans depolarizasyon ve kopma meydana geldiğini gösterir.
3. Hücre içi Ca 2 + veya K + konsantrasyonlarında değişiklikler algılama
- Hazırlama reaktifler ve yükleme tamponu
- Aşağıdaki reaktifler hazırlayın: iyon duyarlı fluoresan boya, 5 mM stok (Fura-2/AM veya PBFI / AM; boyanın 50 ug içeren bir tüpe DMSO uygun miktarda ekleme), "100 x" probenesid (eklenti 1 Bir 77 mg şişeye PBS ml). Çözündürülmüşboyalar, -20 ° C'de bir defada dondurulabilir ve probenesid 6 ay boyunca -20 ° C'de, çözelti içinde stabil olan, oysa 3 ay boyunca çözelti içinde stabil olan edilebilir.
- Aşağıdaki gibi 2x Yükleme Tamponu ve 1 ml hazırlayın: 15 ml'lik plastik konik tüpün altındaki olarak, 5 mM iyonu 2 ul ve ardından (6 ay boyunca 2-8 ° C'de sabit) 100x PowerLoad konsantresi 20 ul, dağıtım doğrudan PowerLoad içine duyarlı boya. Vortex kısaca karıştırın. 100x Probenesidin 20 ul ardından PBS 960 ul ekleyin. Karışımını son bir kez vorteksleyin. Işıktan korumak için folyo ile sarın.
- Boyası ile bakteri yükleme
- Pelet ve 2.2.1 'de tarif edildiği gibi, orta log faz bakteriyel kültür yıkayın. Bir "2x" hücrelik bir süspansiyon hazırlamak için 5 ml PBS içinde tekrar süspansiyon ve süpernatan pelet çıkarın.
- 2x yükleme tampon maddesi için 2x hücre süspansiyonu, 1 ml ilave edilir. Bu, 2 ml 'lik nihai hacim ve son concentr sağlayacaktır1x PowerLoad, 5 mcM floresan boya ve 1x Probenesidin maktadır. Not: Ölçme için her bir örnek de 200 ul ihtiva edecektir, çünkü bu süspansiyon, 10 numune için yeterli hacim sağlar.
- Işıksız bir ortamda 75 dakika için bir 37 ° C su banyosu içinde inkübe edin. NOT: bir boya alt-tabakalar glikolitik yokluğunda ve boyanın dışarı akışını en aza indirmek için probenesid varlığında, bakteriyel hücrelerin yüklenir.
- YIKAMA 1: 10 dakika boyunca 2400 x g'de santrifüj ile hücreler topak süpernatantı çıkarın ve 2 ml PBS içinde tekrar süspansiyon 1x probenesit içeren. WASH 2, 3: adımı tekrarlayın 3.2.4 2x. Başka bir 30 dakika boyunca 37 ° C'de inkübe edilir. Bu bakteri esteraz için zaman uzak içsel floresan boyalar arasındaki AM ester grubu hidrolize sağlayacaktır.
- YIKAMA 4: 10 dakika boyunca 2400 x g'de santrifüj ile hücreler topak süpernatantı kaldırmak ve tekrar süspansiyon 1x probenesit içeren PBS içinde 2 ml. NOT: experime bağlınt, glikoz yeniden enerji bakteriler için buraya eklenebilir.
- Floresans saptama
- 37 ° C'ye floresans saptama plâka okuyucusu plaka okuyucusu Prewarm
- İstenilen her bir örnek için, 96 oyuklu bir plakanın oyuklarına (aşama 3.2.8 'dan itibaren) yüklü hücre 200 ul ekleyin. (Bir defada bir kuyu / numune için tamamlanması için aşağıdaki adımları uygulayın.)
- At ("Değer 1" ve "Değer 2" için 380 nm uyarma / 510 nm emisyon için 340 nm uyarma / 510 nm emisyon) floresan ölçmek için floresan algılama plaka okuyucu, iyi, yer plaka okuma bir temel kurmak için Bir dakika boyunca her saniye.
- , Levha çıkarma (yaklaşık 5 ul küçük bir hacim içinde) bu oyuk için tercih edilen bir tedavi eklemek, hızlı bir şekilde pipet ile birkaç kez aşağı karıştırmak ve hemen istenen her saniye okumak için floresans saptama plaka-okuyucu içinde geri yerleştirmek sürenin uzunluğu. (If deplaka okuyucu ile ilişkili jectors) Bu da sorunsuz okuma durdurmak ve plakasını çıkarmak için ihtiyacı ortadan kaldırarak, istenen tedaviyi eklemek için kullanılır olabilir, vardır.
- Microsoft Excel gibi bir veri analizi programı okuma ihracat. Değer 2 tarafından Değer 1 bölerek her zaman noktası için floresan değerlerin oranını hesaplamak, ve bir grafik üzerinde oranı değerlerini çizmek.
4. Hücre içi pH algılama değişiklikler
- Hazırlama reaktifler ve kalibrasyon tamponlar
- Aşağıdaki reaktifler hazırlayın: BCECF / AM 5 mM stok (. Boyanın 50 ug içeren bir tüpe DMSO uygun miktarda eklemek Bu stok 3 ay boyunca -20 ° C'de sabit olduğu); 100x probenesid (1 ml ilave edin PBS, bir 77 mg şişeye). etanol nigerisin 1 mM stok hazırlama çevreleyen tamponun pH hücrelerin (hücre içi pH (pH i denge sağlaması için gerekli) Bu stok s6 ay boyunca -20 ° C) 'de tablo;. DMSO (proton itici kuvvet çözmek için protonophore olarak, karbonil siyanit 3-klorofenilhidrazon (CCCP), 0.5 mM stok Bu stok 6 ay boyunca -20 ° C'de stabildir)
- 135 mM KH 2 PO 4/20 mM NaOH (monobasik) ve 110 mM K 2 HPO 4/20 mM NaOH (dibazik): aşağıdaki yüksek potasyum tampon 10 ml hazırlayın. Filtre 0.45 mikron filtre kullanılarak sterilize. (Bu tamponlar, kullanılana kadar 4 ° C 'de muhafaza edilebilir).
- 6,5-8,0 arasında değişen en az 5-6 pH değerleri ile, yüksek potasyum tampon oluşturmak için gerekli oranlarda yüksek potasyum tampon karıştırın.
- Aşağıdaki gibi 2x Yükleme Tamponu ve 1 ml hazırlayın: 15 ml'lik plastik konik tüpün alt alanına, PowerLoad içine 5 mM iyona duyarlı bir boya 20 ul, ardından 100x PowerLoad 40 ul, dağıtmak. Vortex kısaca karıştırın. 100x Probenesidin 40 ul ardından PBS 900 ul ekleyin. Vorteski karışım bir final zamanı. Işıktan korumak için folyo ile sarın.
- Boyası ile bakteri yükleme
- Pellet ve 2.2.1 'de tarif edildiği gibi, orta log faz bakteriyel kültür 8 ml yıkayın. Bir "4x" hücrelik bir süspansiyon hazırlamak için PBS içinde 2 ml süpernatan, tekrar süspansiyon pelet çıkarın.
- 2x yükleme tampon maddesi için 4x hücre süspansiyonu, 1 ml ilave edilir. Bu, 2 ml nihai bir hacimde ve 2x hücrelerin nihai konsantrasyonlar, 2x PowerLoad, 50 uM floresan boya ve 2x probenesid sağlayacaktır.
- Işıksız bir ortamda 40 dakika için bir 30 ° C su banyosu içinde inkübe edin. Not: boya 30 ° C daha düşük bir ısıda ve boyanın dışarı akışını en aza indirmek için herhangi bir alt-tabakalar glikolitik yokluğunda bakteriyel hücreler içine yüklenir.
- YIKAMA 1: Pelet 10 dakika boyunca 2400 x g'de santrifüj ile hücreler, fazla boyanın kurtulmak için süpernatant kaldırmak ve 4 ml PBS içinde tekrar süspansiyon 2x probenesid içeren vend 1 mM glükoz (bakteri reenergize). WASH 2, 3: 2x probenesit ve 10 mM glukoz ihtiva eden (1x hücre son bir konsantrasyon için) 4 ml PBS içinde yeniden süspansiyon ile iki kez son adımı tekrar 4.2.7.
- 5 dakika boyunca 37 ° C'de inkübe edilir. Bu hücreler tamamen enerji ve uzak içselleştirilmiş BCECF gelen AM ester grubunun bölünmesi bakteriyel esterazlarla için zaman olanak sağlayacaktır.
- Arka plan floresan kurulması ve in vivo kalibrasyon eğrisi
- 37 ° C'ye floresans saptama plâka okuyucusu plaka okuyucusu Prewarm
- Background fîoresanını tespit etmek için, bakterileri uzaklaştırmak için (aşama 4.2.7 'dan itibaren) yüklenen ve enerjik bakteri süspansiyonu 500 ul filtre-sterilize ve 96 oyuklu plakanın oyuğuna süzüntünün 200 ul ekleyin.
- (490 nm uyarma / 530 nm emisyon floresansı ölçmek için floresans saptama plaka-okuyucu içinde plaka koyun"Value 1" ve 1 dakika boyunca "Değer 2"), 440 nm uyarım / emisyon 530 nm. Bu arka plan floresan kalibrasyon eğrisi ve deney numuneleri hem de oranların hesaplanmasında önce çıkarılmalıdır.
- Bir in vivo bir kalibrasyon eğrisi elde etmek için, (6,5-8,0 arasında değişen) değişik pH değerlerinde, yüksek potasyum tampon içinde tekrar süspansiyon ve bir kez ikinci aşama 4.2.7 yüklenen ve enerjik hücre 500 ul alikotları yıkayın.
- Çevredeki tamponun pH hücrelerin hücre içi pH denge ve 5 dakika boyunca 37 ° C'de inkübe etmek için örnekler 20 uM nigerisin ekleyin. 96 oyuklu bir plakanın oyuklarına bakteri / pH tampon kombinasyonları 200 ul ekleyin.
- Her bir oyuk için sürekli bir okuma kurmak için bir kaç dakika için floresansı ölçmek için floresans saptama plaka-okuyucu içinde plaka koyun. Microsoft Excel gibi bir veri analizi programı okuma ihracat.
- Ba çıkarıldıktan sonrackground floresan değerleri, Değer 2 ile Değer 1 bölerek floresan değerlerin oranını hesaplamak. Kalibrasyon eğrisi oluşturmak için her bir pH tamponu için oran değerleri çizilir. (Bakterilerin yüklenir floresan boya miktarı, her zaman değişebilir edilen bir kalibrasyon eğrisi, yüklü hücrelerin her yeni partisi için elde edilmelidir.)
- Hücre içi pH ölçümü değişikliği
- İstenilen her bir örnek için, 96 oyuklu bir plakanın oyuklarına (aşama 4.2.7 'dan itibaren) yüklenen ve enerjik hücrelerinin 200 ul ekleyin.
- Floresans saptama plaka-okuyucu içinde plaka koyun ve 5 dakika boyunca her 5 saniye örneklerin floresan ölçer.
- Plakayı çıkarın ve bir kuyu (hücre içi pH azaltmak için pozitif bir kontrol olarak hizmet eder) ve kuyu ilgilendiren deneysel ajan (lar) için 10 uM CCCP ekleyin. Doğru, zaman içinde etkilerini karşılaştırmak am kullanılarak aynı anda CCCP ve seçim maddeleri eklemekultichannel pipet.
- Hemen plaka okuyucu için plaka dönüş ve floresan 10 dakika boyunca her 5 saniyede ölçüm devam etmektedir. İlave bir kontrol olarak, levha çıkarma ve çevresindeki tampon pH bakterilerin pH i denge sağlaması için bütün örneklerde 20 uM nigerisin ekleyin ve 5 dakika için okuyun.
- Arka plan floresan değerlerinin çıkarılmasından sonra her bir numune için floresans oranı hesaplamak. Kalibrasyon eğrisi her okuma için pH i sokmak.
Sonuçlar
Bütün deneyler için, bir numune ve her bir mevcut koşulları kümesi vardır. Bu nedenle, her bir izleme zaman içinde bakterilerin bütün bir nüfusun floresan yoğunluğu temsil etmektedir. Sonuçlar, muamele edilmiş numuneler ve muamele edilmemiş kontrollere flüoresansı arasında açık bir ayrım ile, iyi biçimde olmalıdır. Floresansta bir görülen değişim kinetiği ve lisans izlenen olay olası mekanizma ve kapsamı ile ilgili bilgi sağlayabilir.
Membran polarizasyonu keşfetmek, bakteriler tedaviden önce için sürekli bir azalma ve Şekil 1A floresan sonraki tesviye ile gösterildiği gibi, zar üzerinde boyanın dengeyi sağlamak için yaklaşık 40 dakika boyunca iki kere durulanmış ile inkübe edilmesi gerekir. Şekil 1B 'de gösterildiği gibi olan floresan sinyali, ilk 40 dakika inkübasyon, met boyunca sürekli olduğu için, PI, dengede gerektirmezDiBAC ile birlikte varlığını t kutupları eşzamanlı membran rüptürü izlemek için yararlıdır. Depolarizasyonu ve bakteri yırtılma hem boyalar, flüoresans yoğunluğunda bir artış ile gösterilir. Bu tür deterjanlar (sodyum deoksikolat 18), eşleşmeyenler veya ionofor (CCCP) ve depolarizasyon ve kopma yeteneğine sahip diğer maddeler, aynı zamanda, bu yöntemi kullanarak, bu olaylar göstermek için ilave edilebilir edilebilir.
Fura-2/AM, PBFI / AM ve BCECF / AM için iki floresan işaretin oranı hesaplanır ve bu oranın bir artış ya da azalma hücre içi Ca 2 + (Şekil 2) karşılık gelen, K + (Şekil 3 ) ve H +, sırasıyla (Şekil 4) konsantrasyonları. Kalsiyum iyonofor ionomisin ilavesi üzerine, Ca 2 + floresan oranında bir artış (Şekil 2) neden olan hücre içine akar. Valinomycin eklenmesi K neden tam tersi bir etkiye sahiptir+ Hücreden dışarı akar ve floresan oranında bir azalmaya (Şekil 3) ile işaret edilen hücre içi konsantrasyonunun, azaltmak için. BCECF bilinen ilk pH çeşitli tampon varlığında bir kalibrasyon eğrisi (Şekil 4A) oluşturarak hücre içi pH ölçümü sağlar. Proton gradyanı (Şekil 4B) çöker protonophores CCCP veya nigerisin, eklenmesi takip görüldüğü gibi, boyanın flüoresan oranında bir azalma, pH bir azalmaya karşılık gelir.

Şekil 1. Membran tedirginlikler İzleme. S. 40 dakika m üzerinde iki kere durulanmış ve dengeyi sağlamak için pneumoniae aynı anda (A) ile iki kere durulanmış ve (B) ile birlikte inkübe edildi PIzarı böylesine. Bu kuluçkalamadan (ok) sonunda, PBS (muamele edilmemiş) veya HAMLET (muamele edilmiş) ilave edildi ve numuneler, bir saat daha okunmuştur. büyük resim görüntülemek için.

Şekil 2. Hücre içi kalsiyum seviyelerinde değişiklik tespit edilmesi. Pnömokok Fura-2/AM ile yüklenir ve (işlenmemiş) PBS veya kalsiyum iyonofor ionomisin (pozitif kontrol) ile (ok) ile muamele edilmiştir. Fluoresan değerlerinin oranı sunulmaktadır. resmi büyütmek için buraya tıklayın.

Şekil 3,., Hücre içinde potasyum seviyelerindeki değişiklikleri tespit edilmesi. Pnömokok PBFI / AM ile yüklenir ve PBS (muamele edilmemiş) ya da potasyum iyonofor valinomycin (pozitif kontrol) ile (ok) ile muamele edilmiştir. Fluoresan değerlerinin oranı sunulmaktadır. resmi büyütmek için buraya tıklayın.
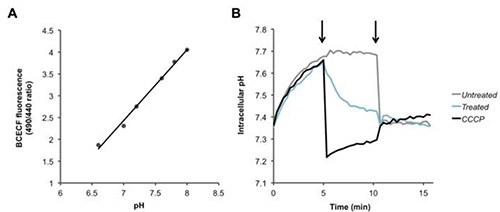
Şekil 4. Hücre içi proton seviyelerindeki değişiklikleri tespit. Hücre içi pH kalibrasyon için (A) standart eğrisi. (B) Pnömokok pH duyarlı boya BCECF-AM ile yüklü ve idiyıkandı ve PBS içinde yeniden süspansiyon haline glikoz +. Taban çizgisi ölçümleri kaydedildikten sonra, ilk olarak ok, PBS (siyah), protonophore CCCP (100 uM), veya HAMLET (100 ug / ml veya 6 uM), bakterilere ilave edildi ve floresan, zamana göre ölçüldü. İkinci ok nigerisin At (20 mcM) tamamen numunelerin tüm transmembran proton degrade dağıtmak eklendi. resmi büyütmek için buraya tıklayın.
Tartışmalar
Boyutu kutupluluk ve membran bakteri ve içinde iyon konsantrasyonlarında değişiklikler bütünlük değişiklikleri tespit etmek için klasik elektrofizyoloji yöntemler kullanılarak sunulur sınırlamaya rağmen, biz S. bu olayları ölçmek için bir yol tarif ettiğim pneumoniae floresan boyalar kullanılmıştır. Bizim protokolleri ve genel olarak pnömokok bakteri türleri için tarif edilen az biri için tarif edilen kendi türünün ilk vardır. Bir floresans saptama plaka okuyucusu kullanılarak, bu olaylar zamanla bakteri bireysel popülasyonundan tespit edilen floresan ile, bakteriler küçük, 200 ul hacim örneklerde ölçülebilir. Floresan yoğunluğundaki kinetiği ve niteliksel değişiklikleri polarite veya zar bütünlüğü ne olduğunu belirlemek için kullanılabilir, ya da olabilir Ca2 +, K + ya da bakteri içindeki H + seviyeleri. Kantitatif olarak, floresan yoğunluk değerleri de dep derecesinin hesaplanması için kullanılabilirolarization, rüptür, kalsiyum alımı, potasyum efflux veya pH değişikliği ilgi mekanizması hakkında önemli bilgiler veren, diğerine göre bir numunede gözlemlenen. Buna ek olarak, protokol bakteri türlerinin çeşitli diğer hücresel olayların çeşitli çalışma için izin veren, başka AM floresan boyalar yüklenmesi için bir başlangıç noktası olarak yararlı olacaktır. Zaten Staphylococcus aureus 21, bu protokollerin bir uygulama başarılı olmuştur.
AM boyaları kullanırken, kuluçkalama süresi yeterli boya yükleme ve bakteriler içinde hedef iyonları yanıt ve karşılık gelen değişiklikleri elde etmek üzere floresan boya için gerekli olan sonraki hidrolizi elde etmek için önemlidir. Yükleme kinetiği nedeniyle bakteriyel yüzey mimari farklılıklardan (akış pompa kapsül olması, zar akışkanlığı, durum, vs.) De dahil olmak üzere çeşitli faktörlere bağlı olarak ve kimyasal yapı o bakteriyel suşlar arasında değişebilirf boya. Kuluçka süresi, inkübasyon sıcaklığı, besin kullanılabilirlik, PowerLoad konsantrasyonu ve probenesid konsantrasyon: bakteri suşunun ve ilgi boya için maksimum yükleme elde etmek için, aşağıdakileri içeren modülasyonu gerektiren eden protokol birçok parametre vardır. Başarılı bir yükleme elde etmek için, floresans sinyali yoğunluğu bu ionofor eklenmesi, pozitif kontrol, doğru yönde ve / veya kalibrasyon eğrisinde doğrusallığını gösteren bir sinyal temin olduğunu gösteren daha az önemlidir. Bir boyanın ekstrüzyon önlemek için sıcaklığın düşürülmesi ve ardından bir PowerLoad artış ve Probenicide konsantrasyon yükleme iyi duruma getirmek için sinyal karışacağı hücre lekelemesi ile sonuçlanabilir boya konsantrasyonunun arttırılması için tercih edilir. Bizim protokollerin geliştirilmesi sırasında, başarıyla yabani tip kapsüllü pnömokok suşu D39 ve kapsüllenmemiş zorlanma R36A 25 hem de ilgi bizim boyalar yüklemek başardık.Bununla birlikte, 37 ° C inkübasyon sıcaklığı kullanılarak Fura-2 ve PBFI deneyler için R36A ile artan oranlarına yol açan floresan okumaları ile gösterildiği gibi, daha yüksek ve PowerLoad probenesid konsantrasyonları ile birlikte daha düşük bir inkübasyon sıcaklığı için daha iyi çalışırken, biz uygun yükleme elde olabilir bulundu D39 içine BCECF yükleme. Belirli sinyal yoğunluğu deneyler arasında değişebilir, ancak ölçümlerin rasyometrik doğası yüksek üretkenlik ve az yayılması ile sonuçlar vermiştir.
En gelişmiş plaka okura eşlik yazılımın kullanımı birkaç isim, algılama hızı, algılama hassasiyetini ve süresini okumak gibi algılama parametreleri, çeşitli ayarlamalar için izin numunelerinin floresan ölçümler için. Bu durum araştırmacı izlenmekte olan belirli bir olayın algılanması için en iyi hassasiyeti bulmak için olanak sağlar. Sonuçların optimal yorumlanması için kritik olduğunu florun istikrarlı tabançeşitli teda ve doğrusal standart eğriler, zar boyunca dengelenmiş mevcut olan boya miktarına, inter-değerlendirme varyasyonları olabilir gibi kurulan ya da bakterilerin içine yüklenir ve hidrolize edilmektedir. (3) tedavi öncesi bir stabilize edilmiş floresans seviyesine olanak sağlamak için DiBAC 4 kullanılıyorsa önce herhangi bir tedavi için bakteriyel zarı üzerinde boya dengelenmesi için zaman izin özellikle önemlidir. Test edilecek bakteriyel süspansiyona sokulur, katkı maddelerinin kendilerinin algılama belirli dalga boylarında autofluoresce veya spesifik olmayan bir floresan değiştirebilir Buna ek olarak, her bir analizinde uygun bütün kontrolleri de dahil olmak üzere, doğru veri analizi için önemlidir Gösterge doğrudan etkileşimler yoluyla boya.
Biz burada anlattığımız yöntemleri ile ilgili endişe birkaç potansiyel alanlarını tanımak. Karbosiyanin boya DiOC 2 (3), 4 DiBAC (aksine3) karbosiyanin boya hücre hacmindeki değişiklikler, DiBAC 4 (3) olamaz hesaba olurken böylece, rasyometrik olmayan bir bisoxonol boyadır. Bu nedenle, hücre hacmi değişikliklere karşılık gelen floresans seviyesinde değişiklikler olabilir. Pnömokok bakterileri yırtmadan hacminde önemli değişikliklere izin vermez sert bir hücre duvarına sahip olarak biz, ancak, bu önemli bir sorun olarak fark etmedi. Bakteriyel iyon akısı incelenmesi için, iyon duyarlı boyaların duyarlılığı ilgi iyon ve konsantrasyonu değişikliği derecesine bağlı olarak değişebilir. Buna ek olarak, floresan boyaların kullanılması gibi doğrudan deneysel radyoizotop kullanımı gibi bir yöntem değildir. Radyoizotop kullanımı ile ilgili hem mali ve güvenlikle ilgili kısıtlamaları dikkate alınırsa, ancak ilgi iyon bağlı olarak, floresan incelenmesi çok daha pratik bir seçenektir. Bu nedenle, bu yazıda anlatılan metodolojiler, yeni ve tutarlı bir yaklaşım sağlarDaha iyi çalışma membran kutupluluk, bütünlüğü ve ulaşım olaylara ve bakteriyel sistemlerde es.
Açıklamalar
Yazarlar bildirmek için hiçbir rakip mali çıkarları var.
Teşekkürler
Bu çalışma Bill ve Melinda Gates Vakfı (Grant 53085), JR Oishei Vakfı ve Amerikan Akciğer Derneği (Hibe RG-123721-N) APH için, ve EAC NIH (NIDCD) burs F31DC011218 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Todd-Hewitt broth | Bacto, BD Diagnostics | 249240 | |
| Yeast Extract | Bacto, BD Diagnostics | 212750 | |
| Phosphate Buffered Saline (PBS; pH 7.2) | Invitrogen (GIBCO) | ||
| Dimethyl sulfoxide | Sigma-Aldrich | D5879 | DMSO |
| DiBAC4(3) (bis-(1,3-dibutylbarbituric acid) trimethine oxonol) | Molecular Probes | B-438 | |
| Propidium Iodide | Sigma-Aldrich | P4170 | Make up in deionized water |
| D-(+)-Glucose | Sigma-Aldrich | ||
| PowerLoad | Molecular Probes | P10020 | 100x concentrate |
| Probenecid | Molecular Probes | P36400 | Make 100x stock by adding 1 ml of PBS to one 77 mg vial |
| Fura-2/AM | Molecular Probes | F1221 | Special packaging (50 µg aliquots) |
| PBFI/AM | Molecular Probes | P1267 | Special packaging (50 µg aliquots) |
| Nigericin | Sigma-Aldrich | N7143 | |
| KH2PO4 | JT Baker | 3246-01 | monobasic |
| NaOH | JT Baker | 5565-01 | |
| K2HPO4 | JT Baker | 4012-01 | dibasic |
| BCECF/AM | Molecular Probes | B1170 | Special packaging (50 µg aliquots) |
| CCCP | Sigma-Aldrich | Protonophore that causes an influx of H+ into the cytoplasm, dissipating the electrical potential and the H+ gradient. | |
| Culture tube | VWR | 53283-802 | Fits the Spectronic spectrophotometer; borosilicate glass |
| Spectrophotometer | Thermo Scientific | Spectronic 20D+ | |
| 15 ml Plastic conical tube | Corning | 430790 | |
| Clear 96-well polystyrene microtiter plate | Fisher Scientific | 12-565-501 | |
| Plate reader | BioTek | Synergy 2 Multi-Mode | |
| Gen5 software | BioTek | Gen5™ Software |
Referanslar
- Hakansson, A., Zhivotovsky, B., Orrenius, S., Sabharwal, H., Svanborg, C. Apoptosis induced by a human milk protein. Proc. Natl. Acad. Sci. U.S.A. 92 (17), 8064-8068 (1995).
- Hakansson, A., et al. A folding variant of alpha-lactalbumin with bactericidal activity against Streptococcus pneumoniae. Mol. Microbiol. 35 (3), 589-600 (2000).
- Hakansson, A. P., Roche-Hakansson, H., Mossberg, A. K., Svanborg, C. Apoptosis-Like Death in Bacteria Induced by HAMLET, a Human Milk Lipid-Protein Complex. PLoS One. 6 (3), (2011).
- Kohler, C., Gogvadze, V., Hakansson, A., Svanborg, C., Orrenius, S., Zhivotovsky, B. A folding variant of human alpha-lactalbumin induces mitochondrial permeability transition in isolated mitochondria. Eur. J. Biochem. 268 (1), 186-191 (2001).
- Ly, J. D., Grubb, D. R., Lawen, A. The mitochondrial membrane potential (Δψ m) in apoptosis; an update. Apoptosis. 8 (2), 115-128 (2003).
- Dominguez, D. C. Calcium signalling in bacteria. Mol. Microbiol. 54 (2), 291-297 (2004).
- Corratge-Faillie, C., Jabnoune, M., Zimmermann, S., Very, A. A., Fizames, C., Sentenac, H. Potassium and sodium transport in non-animal cells: the Trk/Ktr/HKT transporter family. Cell Mol. Life Sci. 67 (15), 2511-2532 (2010).
- Szabo, I., Petronilli, V., Zoratti, M. A patch-clamp study of Bacillus subtilis. Biochim. Biophys. Acta. 1112 (1), 29-38 (1992).
- Zoratti, M., Petronilli, V., Szabo, I. Stretch-activated composite ion channels in Bacillus subtilis. Biochem. Biophys. Res. Commun. 168 (2), 443-450 (1990).
- Novo, D., Perlmutter, N. G., Hunt, R. H., Shapiro, H. M. Accurate flow cytometric membrane potential measurement in bacteria using diethyloxacarbocyanine and a ratiometric technique. Cytometry. 35 (1), 55-63 (1999).
- Novo, D. J., Perlmutter, N. G., Hunt, R. H., Shapiro, H. M. Multiparameter flow cytometric analysis of antibiotic effects on membrane potential, membrane permeability, and bacterial counts of Staphylococcus aureus and Micrococcus luteus. Antimicrob. Agents Chemother. 44 (4), 827-834 (2000).
- Shapiro, H. M. Membrane potential estimation by flow cytometry. Methods. 21 (3), 271-279 (2000).
- Shapiro, H. M. Microbial analysis at the single-cell level: tasks and techniques. J. Microbiol. Methods. 42 (1), 3-16 (2000).
- Bashford, C. L., Chance, B., Smith, J. C., Yoshida, T. The behavior of oxonol dyes in phospholipid dispersions. Biophys. J. 25 (1), 63-85 (1979).
- Suzuki, H., Wang, Z. -Y., Yamakoshi, M., Kobayashi, M., Nozawa, T. Probing the transmembrane potential of bacterial cells by voltage-sensitive dyes. Anal. Sci. 19 (9), 1239-1242 (2003).
- Breeuwer, P., Abee, T. Assessment of the membrane potential, intracellular pH and respiration of bacteria employing fluorescence techniques. Mol. Microb. Ecol. Manual. 8, 1563-1580 (2004).
- Mortimer, F. C., Mason, D. J., Gant, V. A. Flow cytometric monitoring of antibiotic-induced injury in Escherichia coli using cell-impermeant fluorescent probes. Antimicrob. Agents Chemother. 44 (3), 676-681 (2000).
- Clementi, E. A., Marks, L. R., Duffey, M. E., Hakansson, A. P. A Novel Initiation Mechanism of Death in Streptococcus pneumoniae Induced by the Human Milk Protein-Lipid Complex HAMLET and Activated during Physiological Death. J. Biol. Chem. 287 (32), 27168-27182 (2012).
- Trombe, M. C., Laneelle, G., Sicard, A. M. Characterization of a Streptococcus pneumoniae mutant with altered electric transmembrane potential. J. Bacteriol. 158 (3), 1109-1114 (1984).
- Trombe, M. C. Characterization of a calcium porter of Streptococcus pneumoniae involved in calcium regulation of growth and competence. J. Gen. Microbiol. 139 (3), 433-439 (1993).
- Marks, L. R., Clementi, E. A., Hakansson, A. P. Sensitization of Staphylococcus aureus to Methicillin and Other Antibiotics In Vitro and In Vivo in the Presence of HAMLET. PLoS ONE. 8 (5), (2013).
- Futsaether, C. M., Johnsson, A. Using fura-2 to measure intracellular free calcium in Propionibacterium acnes. Can. J. Microbiol. 40 (6), 439-445 (1994).
- Tisa, L. S., Adler, J. Chemotactic properties of Escherichia coli mutants having abnormal Ca2+ content. J. Bacteriol. 177 (24), 7112-7118 (1995).
- Werthen, M., Lundgren, T. Intracellular Ca2+ mobilization and kinase activity during acylated homoserine lactone-dependent quorum sensing in Serratia liquefaciens. J. Biol. Chem. 276 (9), 6468-6472 (2001).
- Avery, O. T., MacLeod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types. Induction of transformation by a dexoxyribonuceic acid fraction isolated from pneumococcus type III. J. Exp. Med. 79, 137-158 (1944).
- Clementi, E. A., Wilhelm, K. R., Schleucher, J., Morozova-Roche, L. A., Hakansson, A. P. A Complex of Equine Lysozyme and Oleic Acid with Bactericidal Activity against. PLoS One. . 8, (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır