Method Article
Мониторинг изменения мембранного полярность, мембраны целостности и внутриклеточных концентрации ионов в
* Эти авторы внесли равный вклад
В этой статье
Резюме
В отличие от, что видели для эукариотов, существует нехватка исследований, которые подробно деполяризации мембраны и концентрации ионов изменения в бактериях, в первую очередь, как их небольшого размера делает традиционные методы измерения трудной. Здесь мы подробно протоколы для мониторинга таких событий в значительной грамположительных патогенов пневмококк использованием методов флуоресценции.
Аннотация
Деполяризации мембраны и ионные потоки события, которые были тщательно изучены в биологических системах в связи с их способностью глубоко повлиять клеточные функции, в том числе энергетики и сигнальных каскадов. Хотя оба люминесцентные и электрофизиологические методы, в том числе использования электрода и патч-зажим, были хорошо разработаны для измерения этих событий в эукариотических клетках, методология для измерения подобных событий в микроорганизмов оказались более сложным развивать учитывая их небольшой размер в сочетании с более сложным Наружная поверхность бактерий защитные мембраны. Во время наших исследований смертном посвящения в пневмококк (пневмококк), мы хотели выяснить роль мембранных событий, в том числе изменений в полярности, целостность и внутриклеточной концентрации ионов. Поиск литературу, мы обнаружили, что существует очень мало исследований. Другие исследователи проводили мониторинг поглощение радиоизотопный или равновесия для измерения ионного гриппРЭС и мембранный потенциал и ограниченное число исследований, в основном в грамотрицательных микроорганизмов, видел некоторый успех с помощью карбоцианиновых или oxonol флуоресцентных красителей для измерения мембранного потенциала, или загрузки бактерии с мобильного проникающий ацетоксиметил (AM) эфирные версии ионно-чувствительный флуоресцентные красители индикатор. Поэтому мы созданы и оптимизированы протоколы для измерения мембранного потенциала, разрыв, и ионно-транспорт в грамположительных организма С. пневмонии. Мы разработали протоколы с использованием бис-oxonol краситель DiBAC 4 (3) и йодид пропидия краситель клеток-impermeant измерить деполяризацию мембраны и разрыв, соответственно, а также методы, чтобы оптимально загрузить пневмококков с АМ сложных эфиров логометрических красителей Фура-2, PBFI и BCECF для обнаружения изменений в внутриклеточной концентрации Са 2 +, K +, и H +, соответственно, с использованием флуоресценции обнаружения планшетов. Эти протоколы являются первыми в своем роде для пневмококкаи большинство из этих красителей не были использованы в любых других видов бактерий. Хотя наши протоколы были оптимизированы для S. пневмонии, мы считаем, что эти подходы должны стать отличной отправной точкой для аналогичных исследований в других видов бактерий.
Введение
Наша лаборатория выявила комплекс белок-липидных от молоке имени Гамлет (для человека Альфа-лактальбумин Сделано смертельным для опухолевых клеток), который индуцирует апоптоз в опухолевых клетках, но также способен убить множество видов бактерий 1,2. Виды, которые были найдены, чтобы быть особенно чувствительны были те, которые нацелены на дыхательные пути, с пневмококк (пневмококк) отображения наибольшей чувствительностью и апоптоз, как фенотип смерти 2,3. Деполяризацию мембраны и конкретных ионов транспортных события хорошо описаны и важные события во время апоптоза в клетках эукариот, особенно в митохондрии, где радиоактивные ТЭС + ионы и флуоресцентные красители, включая JC-1 и TMRE были использованы для демонстрации деполяризацию мембраны митохондрий 3 -5. Таким образом, мы стремились узнать больше о влиянии деревушке на этих мембранных функций, связанных в пневмококка, как мы сосредоточили свои усилия наразвить лучшее понимание механических компонентов апоптоз-фенотип у бактерий, с большим потенциалом для выявления новых антибактериальные терапии или вакцин-кандидатов в процессе.
Стремясь установить протоколы для наших механистических исследований, мы обнаружили, что в отличие от хорошо описанной методологии в эукариотических системах, существует очень мало опубликованных исследований подробно электрофизиологии и переноса ионов механизмы бактериальной мембраны 6,7. Это в первую очередь связано с меньшим размером микроорганизмов и их поверхностной архитектуры, в частности наличие клеточной стенки, которая ограничивает доступ мембраны для использования обычных методов, таких как эукариотические фиксации потенциала, хотя некоторые исследования с использованием гигантских протопластов были выполнены с переменным успехом 8,9. Как работа с этими гигантскими протопластов не является идеальным или даже практический метод для большинства видов бактерий, так как требует мужчинуipulated бактерии в неестественном и неживой государства, ограниченные исследования бактериальной мембраны полярности, которые были выполнены уже в основном используется проточной цитометрии и использование цианиновых и oxonol флуоресцентных красителей 10-16.
Вместо проточной цитометрии, который собирает отдельные измерения флуоресценции от одной бактерии в одной точке времени, мы решили использовать планшет-ридера обнаружение флуоресценции для обнаружения интенсивности флуоресценции бактериальных суспензий в формате 96-луночного планшета с течением времени. Это дало нам возможность лечить население бактерий в различные моменты времени с гораздо большей простотой и легкостью, а также постоянно наблюдать кинетики флуоресценции всего населения в течение длительных периодов времени, которые трудно достичь с помощью проточной цитометрии. После тестирования широкий спектр потенциальных чувствительных флуоресцентных красителей (в том числе те, которые упомянуты выше, для применения с митохондриями), мы добились оптимального технического и практического успеха, используябис-oxonol краситель называется DiBAC 4 (3) (бис-(1,3-dibutylbarbituric кислота) trimethine oxonol) для мониторинга изменений в полярности.
Мы также обнаружили, что ценно для одновременно контролировать нарушения в целостности мембраны с помощью пропидий йодида (PI). Этот краситель флуоресцирует при связывании с нуклеиновой кислотой, но только в состоянии сделать это, когда целостность бактериальной мембраны находится под угрозой, что делает его популярным компонентом, используемым для обнаружения мертвых клеток в живых-мертвых окрашивания анализов. В дополнение к PI, Sytox зеленый и ТО-PRO-1 являются флуоресцентные красители, которые похожи в действии и были ранее использованы для бактерий через несколько исследований с использованием проточной цитометрии методов обнаружения 17. Мы решили использовать PI из-за его длины волны возбуждения, что позволило нам контролировать его флуоресценции одновременно с DiBAC в данном образце.
В наших исследованиях мы наблюдали, что Гамлет, а также еще один белок, связанный с содержанием липидов комплекс с бактерицидной активностиизвестный как ELOA, индуцированной деполяризации и разрыв бактериальной мембраны, как показано увеличение флуоресценции обоих красителей при лечении пневмококков 3,18,26. Для обоих комплексов, мы обнаружили, что интенсивность флуоресценции DiBAC 4 (3) увеличилось до увеличению интенсивности PI, указывая, что деполяризация имели место до разрыва и, следовательно, определенное событие, индуцированный наших бактерицидных белок-липидных комплексов интерес. Это различие важно, чтобы сделать, как разрыв мембраны может сам вызвать неспецифическую деполяризацию. Измерение и анализ как DiBAC 4 (3) и П. И. кинетики флуоресценции одновременно позволило нам изучить эту связь между двумя мембранных событий, что является дополнительным преимуществом использования флуорометрии вместо проточной цитометрии.
Для контроля потока бактериальный ионный, произошло некоторое предыдущий успех с помощью радиоизотопов, в том числе измерения поглощения45 Ca 2 + в пневмококка 19,20, который мы также использовали в наших последних исследований 18, 21. Однако, работая с этими радиоактивных ионов имеет несколько недостатков. Они могут быть дорогими, много времени, и грязный, а также может подвергать человека проведении эксперимента вредить, в зависимости от изотопа интерес. Кроме того, трудно контролировать быстрые изменения во времени. Таким образом, мы обратились к альтернативным методом измерения, которая использует ацетоксиметиловый (AM) эфирные версии ионных чувствительных красителей флуоресцентного индикатора. Сам по себе индикаторный краситель заряжен и не проходит через мембрану легко, но с добавлением липофильного сложноэфирной группы, теперь незаряженные молекулы могут проходить через мембрану бактерии. Войдя внутрь, бактериальные эстеразы расщеплять эфирную группу, оставляя краску бесплатно внутри клетки и платить еще раз, значительно замедляя его способность выйти из клетки и позволяя краситель то накапливаться внутри в течение долгого времени. Тем не менее, использование этих красителей эфирных только было описано в нескольких видов бактерий для обнаружения изменений в внутриклеточного Са 2 + 22-24 и H + 16, с разной методов погрузки, обнаружения, и успеха.
С желанием контролировать изменения внутриклеточного Ca 2 +, а также уровни К + и Н + в S. пневмонии при обработке Гамлет и других соединений, мы успешно создали протоколы для эффективной загрузки флуоресцентные красители индикатор в бактериальные клетки. Эффективная загрузка в бактерии, необходимых как пробенецид, который увеличивает задержку красителя, блокируя анион-перевозчиков и энергосети, фирменная соединения из Life Technologies, которая увеличивает эффективность загрузки. Fura-2/AM (обнаружения Са 2 +), PBFI / AM (обнаружения K +), и BCECF / AM (обнаружения H +) были успешно загружены в оба неинкапсулированного и инкапсулированном пневмококковой улдожди, позволяющие измерять полученных моделей флуоресценции после добавления ионофоров, таких как иономицином (Са 2 + разобщающим), валиномицина (K + разобщитель) и CCCP (H + разобщающим) с использованием планшет обнаружения флуоресценции читателя 18, 21.
протокол
1. Подготовка бактериальных культур
- Выращивание культуры для использования в экспериментах
- В 37 ° C нагревательный блок, оттепель замороженный Stock-пузырек S. пневмонии и добавить его содержание до 9 мл свежей, предварительно нагретой Тодд-Hewitt бульон с 0,5% дрожжевого экстракта (THY) при общем объеме 10 мл в стеклянной пробирку.
- Инкубировать статически при 37 ° С, пока культура не достигнет середины логарифмической фазы (ABS 600 нм ≈ 0,5-0,6).
2. Обнаружение деполяризации мембраны и разрывом
- Подготовка реагентов
- Подготовьте 50 мкм запас DiBAC 4 (3) в 100% ДМСО, и 2 мг / мл запас PI в DDH 2 O. DiBAC 4 (3) акции стабильным при температуре -20 ° С в течение не менее 6 месяцев. П.И. акции стабильным при 4 ° С в течение не менее 6 месяцев.
- Оберните запасы в фольгой для защиты от света.
- Загрузкабактерии
- Гранул бактериальных клеток с шага 1.2.2 центрифугированием при 2400 х г в течение 10 мин при комнатной температуре и мыть дважды удаления супернатанта ресуспендирования осадка в 10 мл 1х забуференный фосфатом физиологический раствор (PBS) и снова центрифуге при 2400 мкг в течение 10 мин.
- Удалить супернатант и ресуспендируют осадок в PBS до первоначального объема. Это обеспечит в течение приблизительно 10 8 колониеобразующих единиц бактерий на мл. Удалить 1 мл (достаточно для 5 образцов) промытым клеткам и поместить в микроцентрифужных трубки.
- Для этих клеток, добавить 25 мкл 1 М стерилизованным фильтрацией раствора глюкозы (полученного в DDH 2 O и фильтруют через 0,45 мкм фильтр) для конечной концентрации 25 мМ глюкозы, и инкубируют в нагревательном блоке 37 ° C В течение пятнадцати минут. ПРИМЕЧАНИЕ: Это обеспечивает энергию для всех АТФ-зависимых мембранных каналов и клеточных компонентов. Необходимость этой стадии, может изменяться в зависимости от эксперимента.
- Добавьте 5 мкл (3) наличии 50 мкМ DiBAC 4 и 10 мкл 2 мг / мл PI складе. Это обеспечивает конечных концентраций 250 нм и 20 мкг / мл, соответственно. Тщательно перемешать с помощью пипетки вверх и вниз несколько раз. Добавить 200 мкл этой клеточной суспензии на лунку каждого образца четкого 96-луночный планшет.
- Обнаружение флуоресценции
- Место пластины в нагретого (37 ° С) плиты обнаружения флуоресценции читателя.
- Убедитесь, что соответствующие фильтры находятся в месте для DiBAC 4 (3) (490 нм возбуждения, 516 нм излучения) и PI (возбуждение 535 нм, 617 нм излучения) обнаружения.
- Для обеспечения (и одновременно контролировать) уравновешивание DiBAC 4 (3) над мембраной, установить читателя принять измерения флуоресценции каждый мин в течение приблизительно 30-40 мин, или пока чтение не стабилизируется, это служит "предварительной обработки" чтения.
- Извлечь пластину и добавить экспериментальную агента выбора и IMMEDiately разместить тарелку у читателя продолжить мониторинг DiBAC 4 (3) и П. И. флуоресценции для желаемого промежутка времени. Если лечение несколько образцов одновременно, используя многоканальную пипетку может быть полезно добавить агента одновременно во все лунки.
- Экспорт показания к программе анализа данных, таких как Microsoft Excel. Участок флуоресценции с течением времени, чтобы оценить деполяризацию мембраны и разрыв. Увеличение флуоресценции DiBAC и PI показывает, что деполяризация и разрыв происходят.
3. Обнаружение изменения внутриклеточного Ca 2 + или K + концентраций
- Подготовка реагентов и загрузка буфера
- Подготовьте следующие реагенты: 5 мМ исходный ионного чувствительных флуоресцентного красителя (Fura-2/AM или PBFI / AM, добавить соответствующее количество ДМСО в пробирку, содержащую 50 мкг красителя), "100x" пробенецида (добавить 1 мл PBS до 77 мг флаконе). Солюбилизированныйкрасители могут быть заморожены при -20 ° C раз и стабильны в растворе в течение 3 месяцев, в то время как пробенецид стабилен в растворе при -20 ° С в течение 6 месяцев.
- Подготовка 1 мл 2x буфера для загрузки следующим образом: В нижней части 15 мл пластиковую коническую пробирку, обойтись 20 мкл 100-кратного концентрата энергосети (устойчивые при температуре 2-8 ° С в течение 6 месяцев), а затем 2 мкл 5 мМ иона чувствительных красителя непосредственно в энергосети. Кратко Vortex перемешать. Добавить 960 мкл PBS с последующим 20 мкл 100x пробенецид. Vortex смеси в последний раз. Оберните в фольгу для защиты от света.
- Загрузка бактерии с красителем
- Гранул и промывают середины логарифмической фазы бактериальную культуру, как описано в 2.2.1. Удалить супернатант и ресуспендируют осадок в 5 мл PBS, чтобы сделать "2x" клеточной суспензии.
- Добавить 1 мл клеточной суспензии 2х к 2х буфера для загрузки. Это обеспечит конечного объема 2 мл и окончательного концобъема из 1x энергосети, 5 мкм флуоресцентным красителем, и 1x пробенецида. ПРИМЕЧАНИЕ: Это подвеска обеспечивает достаточный объем для 10 образцов, так как каждый образец хорошо для измерения будет содержать 200 мкл.
- Выдержите в бане с температурой 37 ° воды в течение 75 мин, защищенном от света месте. ВНИМАНИЕ: краситель загружается в бактериальных клеток в отсутствие каких-либо подложках гликолитических и в присутствии пробенецида, чтобы минимизировать отток красителя.
- ВСГ 1: Гранул клетки центрифугированием при 2400 х г в течение 10 мин, удалить супернатант, и ресуспендируют в 2 мл PBS, содержащего 1x пробенецид. ВСГ 2, 3: Повторите шаг 3.2.4 2x. Инкубировать при 37 ° С в течение еще 30 мин. Это позволит время для бактериальных эстеразами для гидролиза сложноэфирной группы АМ от интернализированного флуоресцентных красителей.
- ВСГ 4: Гранул клетки центрифугированием при 2400 х г в течение 10 мин, удалить супернатант, и ресуспендируют в 2 мл PBS, содержащего 1x пробенецид. ПРИМЕЧАНИЕ: В зависимости от experimeнт, глюкоза может быть добавлен сюда, чтобы оживить бактерии.
- Обнаружение флуоресценции
- Prewarm по обнаружению флуоресценции пластина-читатель планшетов до 37 ° C.
- Для каждого желаемого образца, добавить 200 мкл загруженных клеток (из шага 3.2.8) в лунки 96-луночного планшета с. (Выполните следующие шаги к завершению в течение одного а / образец в то время).
- Чтобы установить базовые чтение для скважины, место пластины в обнаружении флуоресценции пластины-детектор, способный измерить флуоресценцию (возбуждение 340 нм / 510 нм выбросов для "Value 1" и 380 нм возбуждения / 510 нм излучения для "Value 2") в каждую секунду в течение одного мин.
- Извлечь пластину, добавьте методом выбора на этот скважины (в небольшом объеме примерно 5 мкл), быстро пипетки вверх и вниз несколько раз перемешать и сразу же поместить обратно в обнаружении флуоресценции пластины-ридер для чтения каждый сек для лучшего Продолжительность времени. (Если впроекторы, связанные с планшет-ридере доступны, они также могут быть использованы для легко добавить нужную обработку, что исключает необходимость остановить чтение и извлечь пластину).
- Экспорт показания к программе анализа данных, таких как Microsoft Excel. Рассчитайте соотношение значений флуоресценции для каждой временной точке путем деления Значение 1 по значению 2, и сюжет значения соотношения в графическом.
4. Обнаружение изменения внутриклеточного рН
- Подготовка реагентов и калибровочных буферы
- Подготовка следующие реагенты: 5 мМ запас BCECF / AM (. Добавить соответствующее количество ДМСО в пробирку, содержащую 50 мкг красителя Этот запас стабильна при -20 ° С в течение 3 месяцев); 100x пробенецид (добавить 1 мл PBS до 77 мг флаконе);. 1 мМ исходный подготовка нигерицина в этаноле (обязательно, чтобы уравновесить внутриклеточный рН (рН I) клеток в рН окружающей буфера Этот запас стаблица при -20 ° С в течение 6 месяцев);. 0,5 мМ запас карбонилцианид 3-хлорфенилгидразона (СССР) в ДМСО (протонофора расцепить протонного движущую силу Эта акция является стабильным при температуре -20 ° С в течение 6 месяцев)
- Подготовка 10 мл следующих высоких буферов калия: 135 мм КН 2 РО 4/20 мМ NaOH (одноосновный) и 110 мм K 2 HPO 4/20 мМ NaOH (двузамещенный). Фильтр стерилизовать с помощью 0,45 мкм фильтра. (Эти буферы могут храниться при температуре 4 ° С до использования).
- Смешайте высокие буферы калия в необходимой пропорции, чтобы создать высокие буферы калия, по крайней мере 5-6 значениях рН в пределах от 6,5 до 8,0.
- Подготовка 1 мл 2x буфера для загрузки следующим образом: В нижней части 15 мл пластиковую коническую пробирку, обойтись 40 мкл 100x энергосети, после чего 20 мкл 5 мМ ионно-чувствительный краситель непосредственно в энергосети. Кратко Vortex перемешать. Добавить 900 мкл PBS с последующим 40 мкл 100x пробенецид. Vortэкс смесь в последний раз. Оберните в фольгу для защиты от света.
- Загрузка бактерии с красителем
- Гранулы и мыть 8 мл в середины логарифмической фазы бактериальной культуры, как описано в 2.2.1. Удалить надосадочную, ресуспендируют осадок в 2 мл PBS, чтобы сделать "4x" суспензии клеток.
- Добавить 1 мл клеточной суспензии 4x к 2х буфера для загрузки. Это обеспечит конечного объема 2 мл и конечной концентрации клеток 2x, 2x энергосети, 50 мкМ флуоресцентным красителем, и 2x пробенецид.
- Инкубировать в бане с температурой 30 ° воды в течение 40 мин в защищенном от света. Примечание: краситель загружается в бактериальных клеток при более низкой температуре 30 ° С и при отсутствии любых подложках гликолитических чтобы свести к минимуму отток красителя.
- ВСГ 1: Пелле клетки центрифугированием при 2400 мкг в течение 10 мин, удалить супернатант, чтобы избавиться от лишнего красителя, и ресуспендируют в 4 мл PBS, содержащий 2x пробенецид Aй 1 мМ глюкозы (оживления бактерии). ВСГ 2, 3: Повторите шаг 4.2.7 дважды, с окончательной ресуспендирования в 4 мл PBS (для конечной концентрации клеток 1x), содержащим 2x пробенецид и 10 мМ глюкозы.
- Инкубировать при 37 ° С в течение 5 мин. Это позволит клеткам полностью активизировать и дать время для бактериальных эстеразами расщеплять эфирной группы АМ от интернализованной BCECF.
- Установление фоновой флуоресценции и в естественных условиях калибровочной кривой
- Prewarm по обнаружению флуоресценции пластина-читатель планшетов до 37 ° C.
- Для определения фоновой флуоресценции, фильтр-стерилизовать около 500 мкл загруженного и напряжением бактериальной суспензии (из шага 4.2.7), чтобы удалить бактерии, и добавить 200 мкл фильтрата в лунку 96-луночного планшета.
- Поместите пластину в обнаружении флуоресценции пластины-ридер для измерения флуоресценции (возбуждение 490 нм / 530 нм излучения для"Значение 1" и 440 нм возбуждения / 530 нм выбросов для "Value 2") в течение 1 мин. На этом фоне флуоресценции следует вычитать до расчете соотношений как для калибровочной кривой и экспериментальных образцов.
- Чтобы получить в естественных условиях калибровочной кривой, мыть 500 мкл аликвоты загруженных и напряжением клеток с шага 4.2.7 один раз и ресуспендируют в высоких буферов калия при различных значениях рН (в пределах от 6,5-8,0).
- Добавить 20 мкм нигерицин к образцам, чтобы уравновесить внутриклеточный рН клеток к рН окружающей буфера и инкубируют при 37 ° С в течение 5 мин. Добавить 200 мкл комбинаций бактерии / рН буфера в лунки 96-луночного планшета.
- Поместите пластину в детектирования флуоресценции пластины-ридера для измерения флуоресценции в течение нескольких минут, чтобы установить стабильных показаний для каждой лунки. Экспорт показания к программе анализа данных, таких как Microsoft Excel.
- После вычитания базначения флуоресценции ckground, рассчитать соотношение значений флуоресценции путем деления Значение 1 по значению 2. Участок значения соотношения для каждого буфера рН для создания калибровочной кривой. (Калибровочной кривой должны быть созданы для каждой новой партии загружалась клеток, а количество флуоресцентного красителя, который загружается в бактерии могут меняться каждый раз).
- Измерительные изменения в внутриклеточного рН
- Для каждого желаемого образца, добавьте 200 мкл загруженных и напряжением клеток (из стадии 4.2.7) в лунки 96-луночного планшета.
- Поместите пластину в детектирования флуоресценции пластины-ридера и измеряют флуоресценцию образцов каждые 5 секунд в течение 5 мин.
- Извлеките пластину и добавить 10 мкм CCCP в одну лунку (служит в качестве положительного контроля для снижения внутриклеточного рН) и экспериментальной агента (ов), представляющие интерес для других скважин. Чтобы точно сравнить их последствия в течение долгого времени, добавьте CCCP и агентов выбора в то же время, используя утраultichannel пипетки.
- Сразу вернуть пластину к пластине-ридера и продолжить измерения флуоресценции каждые 5 секунд в течение 10 мин. В качестве дополнительного контроля, извлечь пластину и добавить 20 мкм нигерицин для всех образцов, чтобы уравновесить рН I бактерий к рН окружающей буфера и читать в течение 5 мин.
- После вычитания флуоресценции значений фона, рассчитать коэффициенты флуоресценции для каждого образца. Интерполировать рН я за каждого чтения из калибровочной кривой.
Результаты
Для всех экспериментов, есть один образец и набор условий, присутствующих в каждую лунку. Таким образом, каждый отслеживания представляет собой интенсивность флуоресценции всей популяции бактерий с течением времени. Результаты должны быть легко интерпретировать, с четкого разграничения между флуоресценции обработанных образцов и что из необработанных контрольных. Кинетика и степень наблюдаемого изменения флуоресценции может предоставить информацию о возможном механизме и степени случае отслеживается.
При изучении мембраны полярность, бактерии должны быть инкубировали с DiBAC в течение примерно 40 мин, чтобы позволить для уравновешивания красителя через мембрану, как указано в устойчивое уменьшение и последующее выравнивание флуоресценции на фиг.1А до обработки. Как показано на рисунке 1b, П. И. не требует уравновешивания, так как его флуоресцентный сигнал устойчив в течение первых 40 мин инкубации, бут свое присутствие вместе с DiBAC полезно следить разрыв мембраны одновременно с полярностью. Деполяризации и разрыв бактерий указано повышением интенсивности флуоресценции обоих красителей. Другие агенты, способные деполяризации и разрыва, такие как моющие средства (дезоксихолат натрия, 18), разобщителей или ионофоров (СССР), могут быть также добавлены, чтобы продемонстрировать эти события с помощью этой методики.
Для Fura-2/AM, PBFI / AM, и BCECF / AM, отношение двух флуоресцентных сигналов вычисляется, и увеличение или уменьшение этого отношения соответствует внутриклеточной Са 2 + (рис. 2), К + (рис. 3 ), и Н + (рис. 4) концентрации, соответственно. При добавлении кальциевый ионофор иономицина, Ca 2 + поступает в клетку приводит к увеличению коэффициента флуоресценции (рис. 2). Добавление валиномицина имеет противоположный эффект, вызывая K+ Течь из клетки и уменьшить внутриклеточной концентрации, который указан в уменьшении коэффициента флуоресценции (рис. 3). BCECF позволяет для измерения внутриклеточного рН на первом создание калибровочной кривой (фиг.4А) в присутствии различных буферах известного рН. Уменьшение коэффициента флуоресценции красителя соответствует уменьшению рН, как показано следующее добавлением CCCP протонофоров или нигерицина, который разрушается протонный градиент (фиг.4В).

Рисунок 1. Мониторинг мембранные возмущения. С. пневмонии, инкубировали с (А) DiBAC и (б) PI одновременно в течение 40 мин, чтобы позволить для уравновешивания DiBAC м надembrane. В конце этой инкубации (стрелка), добавил PBS (без лечения) или Гамлет (лечение) и образцы были прочитаны в течение дополнительного часа. Кликните здесь, чтобы посмотреть увеличенное изображение.

Рисунок 2. Обнаружения изменений в внутриклеточных уровней кальция. Пневмококки были загружены Fura-2/AM и обрабатывали (стрелка) с PBS (необработанной) или кальциевый ионофор иономицином (положительный контроль). Отношение значений флуоресценции представлена. Кликните здесь, чтобы посмотреть увеличенное изображение.
Рисунок 3. Обнаружения изменений в внутриклеточных уровней калия. Пневмококки были загружены PBFI / AM и обрабатывали (стрелка) с PBS (необработанной) или ионофором калия валиномицина (положительный контроль). Отношение значений флуоресценции представлена. Кликните здесь, чтобы посмотреть увеличенное изображение.
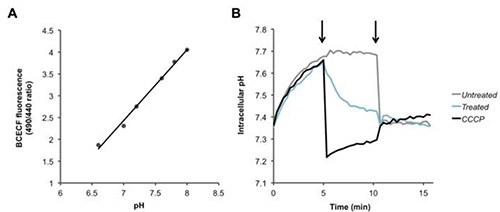
Рисунок 4. Обнаружение изменений в внутриклеточных уровней протонов. (A) Стандартное кривая для внутриклеточного калибровки рН. (В) Пневмококки были загружены с рН-чувствительного красителя BCECF-AM, и былипромывали и ресуспендировали в PBS + глюкозы. После записи исходных показаний, на первой стрелкой, PBS (черный), протонофора CCCP (100 мкМ) или HAMLET (100 мкг / мл или 6 мкМ), были добавлены к бактериям и измеряют флуоресценцию с течением времени. На втором стрелки нигерицина (20 мкМ) добавляли к полностью рассеять трансмембранный протонный градиент все образцы. Кликните здесь, чтобы посмотреть увеличенное изображение.
Обсуждение
Несмотря на ограничения, что размер представляет для использования классических методов электрофизиологии для обнаружения изменений в полярности и целостности мембраны и изменений в ионных концентраций в бактерии, мы описали способ измерить эти события в S. пневмонии с помощью флуоресцентных красителей. Наши протоколы являются первыми в своем роде описано для пневмококка и один из немногих, описано для видов бактерий в целом. С помощью планшет-ридера обнаружение флуоресценции, эти события могут быть измерены в небольших образцах 200 мкл объем бактерий, обнаруженных с флуоресценции от индивидуального популяции бактерий с течением времени. Кинетика и изменения в интенсивности флуоресценции могут быть использованы для качественно определить, что происходит с мембранными полярность или целостности, или уровни Ca 2 +, K +, H + или внутри бактерий. Количественно говоря, значения интенсивности флуоресценции также может быть использован для вычисления степени DEPolarization, разрыв, поглощение кальция, калия истечение или изменение рН наблюдали в одном образце по сравнению с другой, обеспечивая важную информацию о механизме интерес. Кроме того, наша протокол должен быть полезны в качестве отправной точки для погрузки других флуоресцентных красителей AM, позволяя при изучении различных других клеточных событий в различных видов бактерий. Мы уже успешно применяя некоторые из этих протоколов в золотистый стафилококк 21.
При использовании красителей AM, достаточно времени инкубации важно для красителем и достижения последующего гидролиза, необходимую для красителя реагировать на целевых ионов внутри бактерий и получением соответствующего изменения флуоресценции. Погрузка кинетика может варьироваться от бактериальных штаммов из-за нескольких факторов, включая различия в бактериальной архитектуры поверхности (наличие капсулы, текучесть мембран, наличие эффлюкса насосов и т.д.)., И в химической структуре Oе краситель. Для достижения максимального нагрузку для бактериального штамма и красителя интереса, есть несколько параметров нашего протокола, которые могут потребовать модуляции в том числе: продолжительность инкубационного, температуры инкубации, наличие питательных веществ, концентрации энергосети, и пробенецидом концентрации. Для получения успешной загрузки, интенсивность сигнала флуоресценции менее важна, чем показывает, что положительные элементы управления, такие как сложение ионофоров, обеспечивать сигнал в правильном направлении и / или показывая линейность в калибровочной кривой. Чтобы оптимизировать загрузку увеличение энергосети и концентрацию Probenicide а затем понижение температуры, чтобы избежать экструзии красителя предпочтительнее увеличении концентрации красителя, что может привести к внеклеточной окрашивания, которая будет смешивать сигнал. При разработке наших протоколов, мы смогли успешно загрузить наши красители, представляющие интерес как в дикого типа инкапсулированного пневмококковой D39 штамма и неинкапсулированного штамма R36A 25.Тем не менее, мы обнаружили, что мы могли бы достичь оптимальной загрузки, как указано люминесцентных показаний, ведущее к увеличению коэффициентов с использованием R36A для Фура-2 и PBFI экспериментов с использованием 37 ° C температуры инкубации, в то время как более низкая температура инкубации в сочетании с более высокой энергосети и Пробенецид концентрации работал лучше для загрузка BCECF в D39. Хотя удельная интенсивность сигнала может варьироваться в зависимости от экспериментов, пропорциональный характер измерений при условии результаты с высокой воспроизводимостью и небольшим распространения.
Для измерений флуоресценции образцов, использование программного обеспечения, сопровождающего самые передовые пластины читателей позволяет регулировок различных параметров обнаружения, включая скорость обнаружения, чувствительность обнаружения, и читать продолжительность, чтобы назвать несколько. Это позволяет исследователю найти оптимальную чувствительность для обнаружения конкретного события, который отслеживается. Для оптимальной интерпретации результатов, очень важно, что стабильные базовые линии фтораценции и линейный стандартные кривые установлены, поскольку могут быть вариации между анализами в количестве красителя, который присутствует, уравновешенную над мембраной, или загружается в бактерий и гидролизуют. Разрешение время для уравновешивания красителя над бактериальной мембраны до обработки любого рода особенно важно при использовании DiBAC 4 (3), чтобы обеспечить стабилизированного уровня флуоресценции до начала лечения. Кроме того, в том числе все надлежащие управления в каждом отдельном анализа имеет важное значение для точного анализа данных, а экспериментальные добавки, которые вводятся в бактериальной суспензии, подлежащего испытанию, могут сами autofluoresce на конкретных длинах волн обнаружения или могут неспецифически изменять флуоресценцию Индикатор красителя путем прямых взаимодействий.
Мы признаем, несколько потенциальных проблемных областей, связанных с методами, которые мы описали здесь. В отличие от карбоцианиновым красителем DIOC 2 (3), DiBAC 4 (3) является bisoxonol краситель, который не логометрический, поэтому в то время как карбоцианинового краситель может учитывать изменения в объеме клеток, DiBAC 4 (3) не может. Таким образом, может быть изменения в уровне флуоресценции, которые соответствуют изменениям в объеме клеток. Мы, однако, не заметить, что это будет серьезной проблемой, так как пневмококк имеет жесткую клеточную стенку, не допускающую существенных изменений в объеме без разрушения бактерии. Для изучения бактериальных потоков ионов, чувствительность ионно-чувствительный красителей могут варьироваться в зависимости от иона интереса и степени изменения его концентрации. Кроме того, использование флуоресцентных красителей экспериментально не как прямой метод, как использование радиоизотопов. Тем не менее, в зависимости от иона интереса, рассматривая флуоресценции является гораздо более практичным вариантом при рассмотрении как финансовые, так и связанные с безопасностью ограничения, связанные с использованием радиоизотопов. Таким образом, методики, описанные в этой рукописи обеспечить новый и последовательный подходэс, чтобы лучше исследование мембранного полярности, целостности и транспортных событий и в бактериальных системах.
Раскрытие информации
Авторы не имеют конкурирующие финансовые интересы, объявляющие.
Благодарности
Эта работа была поддержана Фондом Билла и Мелинды Гейтс (грант 53085), в JR Oishei фонда, а также Американской легочной ассоциации (грант RG-123721-N) к APH, и NIH (NIDCD) стипендий F31DC011218 к ВАС.
Материалы
| Name | Company | Catalog Number | Comments |
| Todd-Hewitt broth | Bacto, BD Diagnostics | 249240 | |
| Yeast Extract | Bacto, BD Diagnostics | 212750 | |
| Phosphate Buffered Saline (PBS; pH 7.2) | Invitrogen (GIBCO) | ||
| Dimethyl sulfoxide | Sigma-Aldrich | D5879 | DMSO |
| DiBAC4(3) (bis-(1,3-dibutylbarbituric acid) trimethine oxonol) | Molecular Probes | B-438 | |
| Propidium Iodide | Sigma-Aldrich | P4170 | Make up in deionized water |
| D-(+)-Glucose | Sigma-Aldrich | ||
| PowerLoad | Molecular Probes | P10020 | 100x concentrate |
| Probenecid | Molecular Probes | P36400 | Make 100x stock by adding 1 ml of PBS to one 77 mg vial |
| Fura-2/AM | Molecular Probes | F1221 | Special packaging (50 µg aliquots) |
| PBFI/AM | Molecular Probes | P1267 | Special packaging (50 µg aliquots) |
| Nigericin | Sigma-Aldrich | N7143 | |
| KH2PO4 | JT Baker | 3246-01 | monobasic |
| NaOH | JT Baker | 5565-01 | |
| K2HPO4 | JT Baker | 4012-01 | dibasic |
| BCECF/AM | Molecular Probes | B1170 | Special packaging (50 µg aliquots) |
| CCCP | Sigma-Aldrich | Protonophore that causes an influx of H+ into the cytoplasm, dissipating the electrical potential and the H+ gradient. | |
| Culture tube | VWR | 53283-802 | Fits the Spectronic spectrophotometer; borosilicate glass |
| Spectrophotometer | Thermo Scientific | Spectronic 20D+ | |
| 15 ml Plastic conical tube | Corning | 430790 | |
| Clear 96-well polystyrene microtiter plate | Fisher Scientific | 12-565-501 | |
| Plate reader | BioTek | Synergy 2 Multi-Mode | |
| Gen5 software | BioTek | Gen5™ Software |
Ссылки
- Hakansson, A., Zhivotovsky, B., Orrenius, S., Sabharwal, H., Svanborg, C. Apoptosis induced by a human milk protein. Proc. Natl. Acad. Sci. U.S.A. 92 (17), 8064-8068 (1995).
- Hakansson, A., et al. A folding variant of alpha-lactalbumin with bactericidal activity against Streptococcus pneumoniae. Mol. Microbiol. 35 (3), 589-600 (2000).
- Hakansson, A. P., Roche-Hakansson, H., Mossberg, A. K., Svanborg, C. Apoptosis-Like Death in Bacteria Induced by HAMLET, a Human Milk Lipid-Protein Complex. PLoS One. 6 (3), (2011).
- Kohler, C., Gogvadze, V., Hakansson, A., Svanborg, C., Orrenius, S., Zhivotovsky, B. A folding variant of human alpha-lactalbumin induces mitochondrial permeability transition in isolated mitochondria. Eur. J. Biochem. 268 (1), 186-191 (2001).
- Ly, J. D., Grubb, D. R., Lawen, A. The mitochondrial membrane potential (Δψ m) in apoptosis; an update. Apoptosis. 8 (2), 115-128 (2003).
- Dominguez, D. C. Calcium signalling in bacteria. Mol. Microbiol. 54 (2), 291-297 (2004).
- Corratge-Faillie, C., Jabnoune, M., Zimmermann, S., Very, A. A., Fizames, C., Sentenac, H. Potassium and sodium transport in non-animal cells: the Trk/Ktr/HKT transporter family. Cell Mol. Life Sci. 67 (15), 2511-2532 (2010).
- Szabo, I., Petronilli, V., Zoratti, M. A patch-clamp study of Bacillus subtilis. Biochim. Biophys. Acta. 1112 (1), 29-38 (1992).
- Zoratti, M., Petronilli, V., Szabo, I. Stretch-activated composite ion channels in Bacillus subtilis. Biochem. Biophys. Res. Commun. 168 (2), 443-450 (1990).
- Novo, D., Perlmutter, N. G., Hunt, R. H., Shapiro, H. M. Accurate flow cytometric membrane potential measurement in bacteria using diethyloxacarbocyanine and a ratiometric technique. Cytometry. 35 (1), 55-63 (1999).
- Novo, D. J., Perlmutter, N. G., Hunt, R. H., Shapiro, H. M. Multiparameter flow cytometric analysis of antibiotic effects on membrane potential, membrane permeability, and bacterial counts of Staphylococcus aureus and Micrococcus luteus. Antimicrob. Agents Chemother. 44 (4), 827-834 (2000).
- Shapiro, H. M. Membrane potential estimation by flow cytometry. Methods. 21 (3), 271-279 (2000).
- Shapiro, H. M. Microbial analysis at the single-cell level: tasks and techniques. J. Microbiol. Methods. 42 (1), 3-16 (2000).
- Bashford, C. L., Chance, B., Smith, J. C., Yoshida, T. The behavior of oxonol dyes in phospholipid dispersions. Biophys. J. 25 (1), 63-85 (1979).
- Suzuki, H., Wang, Z. -. Y., Yamakoshi, M., Kobayashi, M., Nozawa, T. Probing the transmembrane potential of bacterial cells by voltage-sensitive dyes. Anal. Sci. 19 (9), 1239-1242 (2003).
- Breeuwer, P., Abee, T. Assessment of the membrane potential, intracellular pH and respiration of bacteria employing fluorescence techniques. Mol. Microb. Ecol. Manual. 8, 1563-1580 (2004).
- Mortimer, F. C., Mason, D. J., Gant, V. A. Flow cytometric monitoring of antibiotic-induced injury in Escherichia coli using cell-impermeant fluorescent probes. Antimicrob. Agents Chemother. 44 (3), 676-681 (2000).
- Clementi, E. A., Marks, L. R., Duffey, M. E., Hakansson, A. P. A Novel Initiation Mechanism of Death in Streptococcus pneumoniae Induced by the Human Milk Protein-Lipid Complex HAMLET and Activated during Physiological Death. J. Biol. Chem. 287 (32), 27168-27182 (2012).
- Trombe, M. C., Laneelle, G., Sicard, A. M. Characterization of a Streptococcus pneumoniae mutant with altered electric transmembrane potential. J. Bacteriol. 158 (3), 1109-1114 (1984).
- Trombe, M. C. Characterization of a calcium porter of Streptococcus pneumoniae involved in calcium regulation of growth and competence. J. Gen. Microbiol. 139 (3), 433-439 (1993).
- Marks, L. R., Clementi, E. A., Hakansson, A. P. Sensitization of Staphylococcus aureus to Methicillin and Other Antibiotics In Vitro and In Vivo in the Presence of HAMLET. PLoS ONE. 8 (5), (2013).
- Futsaether, C. M., Johnsson, A. Using fura-2 to measure intracellular free calcium in Propionibacterium acnes. Can. J. Microbiol. 40 (6), 439-445 (1994).
- Tisa, L. S., Adler, J. Chemotactic properties of Escherichia coli mutants having abnormal Ca2+ content. J. Bacteriol. 177 (24), 7112-7118 (1995).
- Werthen, M., Lundgren, T. Intracellular Ca2+ mobilization and kinase activity during acylated homoserine lactone-dependent quorum sensing in Serratia liquefaciens. J. Biol. Chem. 276 (9), 6468-6472 (2001).
- Avery, O. T., MacLeod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types. Induction of transformation by a dexoxyribonuceic acid fraction isolated from pneumococcus type III. J. Exp. Med. 79, 137-158 (1944).
- Clementi, E. A., Wilhelm, K. R., Schleucher, J., Morozova-Roche, L. A., Hakansson, A. P. A Complex of Equine Lysozyme and Oleic Acid with Bactericidal Activity against. PLoS One. . 8, (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены