Method Article
Überwachen von Änderungen in Membran-Polarity, Membrane Integrity und intrazelluläre Ionenkonzentrationen in
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Anders als bei Eukaryonten zu sehen, gibt es nur wenig Untersuchungen, die detailliert Membrandepolarisation und Ionenkonzentrationsänderungen in Bakterien, in erster Linie ihrer geringen Größe macht herkömmliche Messverfahren schwierig. Hier haben wir ausführlich Protokolle zur Überwachung solcher Veranstaltungen in der deutlichen Gram-positive Erreger Streptococcus pneumoniae Verwendung Fluoreszenztechniken.
Zusammenfassung
Membran-Depolarisation und Ionenflüsse sind Ereignisse, die ausgiebig in biologischen Systemen aufgrund ihrer Fähigkeit, tiefgreifend beeinträchtigen Zellfunktionen, einschließlich Energetik und Signaltransduktion untersucht worden sind. Während beide Fluoreszenz-und elektrophysiologischen Methoden, einschließlich Elektrodenverbrauch und Patch-Clamp, sind gut für die Messung dieser Ereignisse in eukaryotischen Zellen entwickelt haben Methodik zur Messung von ähnlichen Veranstaltungen in Mikroorganismen schwieriger zu entwickeln, bewährt aufgrund ihrer geringen Größe in Kombination mit der immer komplexer äußeren Oberfläche von Bakterien Abschirmen der Membran. Während unserer Studien des Todes-Einweihung in Streptococcus pneumoniae (Pneumokokken), wollten wir die Rolle der Membran Ereignisse, einschließlich der Änderungen in der Polarität, Integrität und intrazellulären Ionenkonzentrationen aufzuklären. Suche in der Literatur fanden wir, dass nur sehr wenige Studien existieren. Andere Forscher hatten Radioisotop-Aufnahme oder Ionen-Gleichgewicht Grippe messen überwachtxes und Membranpotential und eine begrenzte Anzahl von Studien, vor allem in Gram-negative Organismen, hatte einige Erfolge gesehen mit Carbocyanin oder oxonol fluoreszierenden Farbstoffen Membranpotential zu messen, oder Laden Bakterien mit Zell-permeant acetoxymethyl (AM)-Ester-Versionen von ionensensitiven fluoreszierende Indikatorfarbstoffe. Wir haben deshalb festgelegt und optimierte Protokolle für die Messung Membranpotential, Bruch, und Ionentransport in der Gram-positiven Organismus S. pneumoniae. Wir entwickelten Protokollen unter Verwendung des Bis-Oxonol-Farbstoff DiBAC 4 (3) und der Zell-impermeante Farbstoff Propidiumiodid zu Membrandepolarisation und Bruch zu messen, die jeweils, ebenso wie Verfahren, um optimal die Pneumokokken mit den AM-Ester der ratiometrische Farbstoffe laden Fura-2, PBFI und BCECF um Veränderungen der intrazellulären Konzentration von Ca 2 +, K + und H +, jeweils zu erfassen, unter Verwendung eines Fluoreszenz-Plattenleseerfassungs. Diese Protokolle sind die ersten ihrer Art für die Pneumokokkenund die meisten dieser Farbstoffe nicht in andere Bakterienspezies verwendet wurde. Obwohl unsere Protokolle für S. optimiert pneumoniae, glauben wir, diese Ansätze sollten einen hervorragenden Ausgangspunkt für ähnliche Studien in anderen Bakterienarten bilden.
Einleitung
Unser Labor hat ein Protein-Lipid-Komplex aus menschlicher Milch namens Hamlet (für Menschen Alpha-Lactalbumin Aus tödlich Tumorzellen), die Apoptose in Tumorzellen induziert identifiziert, aber auch in der Lage, eine Vielzahl von Bakterienarten 1,2 töten. Die Arten, die sich als besonders sensitiv waren diejenigen, die die Atemwege zielen, mit Streptococcus pneumoniae (Pneumokokken) Anzeigen des größten Empfindlichkeit und ein Apoptose-ähnlichen Phänotyp Todes 2,3. Membrandepolarisation und spezifische Ionentransportereignisse sind gut beschrieben und entscheidenden Ereignisse während der Apoptose in eukaryotischen Zellen, insbesondere in den Mitochondrien, wo radioaktive TPP +-Ionen und Fluoreszenzfarbstoffe einschließlich JC-1 und TMRE wurden zur Depolarisation der Mitochondrienmembran 3 zeigen, -5. So haben wir versucht, mehr über die Wirkung von HAMLET auf diesen Membran-bezogene Funktionen in der Pneumokokken zu lernen, wie wir unsere Anstrengungen konzentrierenein besseres Verständnis der mechanistischen Komponenten des Apoptose-ähnlichen Phänotyps in Bakterien mit großem Potential zur Identifizierung neuer antibakterielle Therapien oder Impfstoffkandidaten in den Prozess.
In dem Bestreben, Protokolle für unsere mechanistische Untersuchungen zu schaffen, haben wir entdeckt, dass im Gegensatz zu den gut beschriebenen Methodik in eukaryontischen Systemen, gibt es sehr wenige veröffentlichte Studien Detaillierung Elektrophysiologie und Ionentransportmechanismen der bakteriellen Membran 6,7. Dies ist vor allem auf die kleinere Größe der Mikroorganismen und ihrer Oberflächenarchitektur, insbesondere die Anwesenheit von Zellwand beschränkt, dass die Zugänglichkeit der Membran für die Verwendung von herkömmlichen Methoden, wie eukaryontische Patch-Clamping, obwohl einige Studien mit riesigen Protoplasten wurden mit unterschiedlichem Erfolg durchgeführt worden zurückzuführen 8,9. Wie die Arbeit mit diesen riesigen Protoplasten ist keine ideale oder sogar praktische Methode für die meisten Bakterienarten, da es Menschen erfordertipulated Bakterien in einer unnatürlichen und abiotischen Zustand die begrenzte Studien der Bakterienmembran Polarität, die durchgeführt wurden in erster Linie verwendet Durchflusszytometrie und die Verwendung von Cyanin-und Oxonol-Farbstoffe fluoreszierende 10-16.
Statt der Durchflusszytometrie, welche einzelnen Fluoreszenzmesswerte zu einem einzigen Zeitpunkt Punkt sammelt von einem Bakterium, entschieden wir uns, eine Fluoreszenzdetektion Plattenlesegerät verwenden, um Fluoreszenzintensität der Bakteriensuspensionen in einer 96-Well-Plattenformat im Laufe der Zeit zu erkennen. Dies ermöglichte es uns, eine Population von Bakterien zu verschiedenen Zeitpunkten mit viel größerer Einfachheit und Leichtigkeit zu behandeln und überwachen kontinuierlich die Fluoreszenz-Kinetik der gesamten Bevölkerung für längere Zeit, die nur schwer mittels Durchflusszytometrie zu erreichen ist. Nach dem Testen eine Vielzahl der potentialsensitive Fluoreszenzfarbstoffe (einschließlich der oben zur Verwendung mit der genannten Mitochondrien) erzielten wir die besten technischen und praktischen Erfolg mit derBis-Oxonol-Farbstoff genannt DiBAC 4 (3) (Bis-(1,3-dibutylbarbituric Säure) Trimethinoxonol) auf Änderungen in der Polarität zu überwachen.
Wir fanden es auch wertvoll, um gleichzeitig Störungen in der Unversehrtheit der Membran unter Verwendung von Propidiumiodid (PI) zu überwachen. Dieser Farbstoff fluoresziert bei der Bindung an Nukleinsäure, ist aber nur in der Lage, dies zu tun, wenn die Integrität der Bakterienmembran beeinträchtigt wird, so dass es die beliebte Komponente verwendet, um tote Zellen zu erkennen im Live-tot-Färbung-Assays. Zusätzlich zu PI, SYTOX grün und TO-PRO-1 sind Fluoreszenzfarbstoffe, die eine ähnliche Wirkung besitzen und wurden zuvor für Bakterien in einigen Studien unter Verwendung der Durchflusszytometrie Nachweisverfahren 17 verwendet. Wir entschieden uns, PI wegen seiner Anregungswellenlänge, die uns zu seiner Fluoreszenz gleichzeitig mit DiBAC in einer gegebenen Probe zu überwachen erlaubt zu verwenden.
In unseren Studien haben wir, dass HAMLET, sowie ein weiteres verwandtes Protein-Lipid-Komplex mit der bakteriziden Aktivität beobachtetals Eloa induzierte Depolarisation und Bruch der Bakterienmembran bekannt, wie durch Zunahme der Fluoreszenz der beiden Farbstoffe bei der Behandlung der Pneumokokken 3,18,26 angegeben. Für beide Komplexe beobachteten wir, dass die Fluoreszenzintensität der DiBAC 4 (3) vor der Erhöhung der Intensität des PI erhöht, was anzeigt, daß die Depolarisation stattgefunden vor Bruch und ist daher ein bestimmtes Ereignis durch unsere bakterizide Protein-Lipid-Komplexen von induzierten Interesse. Diese Unterscheidung ist wichtig zu machen, als Bruch der Membran selbst verursachen unspezifische Depolarisation. Messung und Analyse sowohl DiBAC 4 (3) und PI-Fluoreszenz-Kinetik gleichzeitig erlaubt es uns, diese Beziehung zwischen den beiden Membran Ereignisse, die ein zusätzlicher Vorteil der Verwendung Fluorometrie statt Durchflusszytometrie ist zu prüfen.
Um bakterielle Ionenfluss zu überwachen, hat es einige bisherigen Erfolge mit der Verwendung von Radioisotopen, einschließlich der Aufnahme von Mess45 Ca 2 + in der Pneumokokken 19,20, die wir auch in unseren bisherigen Untersuchungen 18, 21 verwendet. , Die Arbeit mit diesen radioaktiven Ionen hat jedoch mehrere Nachteile. Sie können teuer, zeitaufwendig und schwierig, und auch die einzelnen aussetzen Durchführung des Experiments zu schaden, abhängig von der Isotopen von Interesse. Zusätzlich ist es schwierig, schnelle Änderungen im Laufe der Zeit zu überwachen. Somit Richtung einer alternativen Methode der Messung, die Acetoxymethyl-(AM)-ester Versionen von ionensensitiven Fluoreszenzindikatorfarbstoffe verwendet wandten wir. An sich ist der Indikatorfarbstoff gegeben und nicht durch die Membran leicht, aber mit der Zugabe des lipophilen Estergruppe kann die jetzt ungeladenes Molekül durch die Membran des Bakteriums geben. Beim Eintritt in den Innenraum, die Bakterien Esterasen spalten die Estergruppe, so dass der Farbstoff in der Zelle frei und wieder aufgeladen, deutlich verlangsamt seine Fähigkeit, die Zelle zu verlassen und so der Farbstoff to reichern sich über die Zeit. Jedoch ist die Verwendung dieser Ester Farbstoffe nur in einigen Bakterienspezies beschrieben worden, um Veränderungen der intrazellulären Ca 2 + + H 22-24 und 16 zu erkennen, mit unterschiedlichen Methoden der Beladung, Detektion und Erfolg.
Mit dem Wunsch, Änderungen der intrazellulären Ca 2 + zu überwachen und K + und H +-Konzentrationen in S. pneumoniae bei Behandlung mit HAMLET und andere Verbindungen, die wir erfolgreich erstellt Protokolle, um fluoreszierende Indikatorfarbstoffe in Bakterienzellen effizient zu laden. Effektive Laden in Bakterien erforderlich, die sowohl Probenecid Farbstoffretention erhöht durch die Blockierung Anionen-Transporter und Antriebsladung, eine proprietäre Verbindung von Life Technologies, die Beladungseffizienz erhöht. Fura-2/AM (Erfassungs Ca 2 +), PBFI / AM (Erfassungs K +) und BCECF / AM (Erfassungs H +) wurden erfolgreich in sowohl nicht eingekapselte und eingekapselt Pneumokokken st geladenRegen eine Messung der resultierenden Fluoreszenz-Muster nach der Zugabe von Ionophoren, wie Ionomycin (Ca 2 + Entkoppler) Valinomycin (K + Entkoppler) und CCCP (H + Entkoppler) unter Verwendung eines Fluoreszenz-Plattenleseerfassungs 18, 21.
Protokoll
1. Vorbereiten bakterielle Kulturen
- Wachsende Kultur für den Einsatz in Experimenten
- In einem 37 ° C Wärmeblock, eine gefrorene auftauen Lager-Fläschchen von S. pneumoniae und fügen den Inhalt in 9 ml frisches, vorgewärmtes Todd-Hewitt-Medium mit 0,5% Hefeextrakt (THY) für ein Gesamtvolumen von 10 ml in einem Glaskulturröhrchen.
- Inkubieren statisch bei 37 ° C, bis die Kultur die mittlere Log-Phase (Abs 600 nm ≈ 0,5-0,6) erreicht.
2. Erkennen Depolarisation der Membran und Rupture
- Vorbereiten Reagenzien
- Bereiten Sie eine 50 uM Lager von DiBAC 4 (3) in 100% DMSO und eine 2 mg / ml Stamm von PI in ddH 2 O. Die DiBAC 4 (3) stock ist bei -20 ° C stabil für mindestens 6 Monate. Der PI-Lager ist bei 4 ° C stabil für mindestens 6 Monate.
- Wickeln Sie Aktien in Folie aus dem Licht zu schützen.
- VerladungBakterien
- Pellet die Bakterienzellen aus Schritt 1.2.2 durch Zentrifugation bei 2.400 × g für 10 min bei Raumtemperatur und zweimal waschen durch Entfernen des Überstands, Resuspendieren des Pellets in 10 ml 1 × phosphatgepufferter Salzlösung (PBS), und erneut zentrifugieren bei 2.400 xg für 10 min.
- Überstand abnehmen und das Pellet erneut in PBS auf das ursprüngliche Volumen. Dies wird für etwa 10 8 koloniebildenden Einheiten von Bakterien pro ml ist. Entfernen 1 ml (ausreichend für 5 Proben) der Zellen gewaschen und in einen Mikrozentrifugenröhrchen.
- Diese Zellen werden 25 ul einer 1 M steril filtrierten Stammlösung von Glucose (in ddH 2 O hergestellt und durch einen 0,45 um Filter filtriert) für eine Endkonzentration von 25 mM Glucose inkubiert und in einem 37 ° C-Heizblock fünfzehn min. HINWEIS: Dieser liefert Energie für alle ATP-abhängigen Membrankanäle und zellulären Komponenten. Die Notwendigkeit für diesen Schritt kann je nach Experiment.
- In 5 ul der 50 uM DiBAC 4 (3) Lager und 10 ul der 2 mg / ml PI Lager. Dies sorgt für eine Endkonzentration von 250 nM und 20 &mgr; g / ml. Gründlich durch und Abpipettieren mehrmals. In 200 ul dieser Zellsuspension zu jeder Probe und einer klaren 96-Well-Platte.
- Detektieren der Fluoreszenz
- Legen Sie die Platte in einem vorgewärmten (37 ° C) Fluoreszenzdetektion Plattenlesegerät.
- Stellen Sie sicher, dass geeignete Filter sind im Ort für DiBAC 4 (3) (490 nm Anregung, 516 nm Emission) und PI (535 nm Anregung, 617 nm Emission)-Erkennung.
- Um (und gleichzeitig zu überwachen) Ausgleich der DiBAC 4 (3) über die Membran, setzen Sie den Leser auf Fluoreszenzmessungen für ca. 30-40 min dauern jeden min oder bis Messwert stabilisiert erlauben, dies dient als "Vorbehandlung" Lesen.
- Werfen Platte und fügen Sie die experimentellen Mittel der Wahl und immediately legen die Platte wieder in den Leser weiter überwachen DiBAC 4 (3) und PI-Fluoreszenz für die gewünschte Länge der Zeit. Wenn die Behandlung mehrere Proben auf einmal, mit einer Mehrkanalpipette kann hilfreich sein, um den Agenten gleichzeitig in alle Vertiefungen hinzuzufügen.
- Exportieren Sie die Messwerte mit einer Datenanalyseprogramm wie Microsoft Excel. Plot Fluoreszenz über die Zeit zu Depolarisation der Membran und Bruch zu evaluieren. Steigende Fluoreszenz DiBAC und PI zeigt, dass Depolarisation und Bruch auftreten.
3. Erfassen von Änderungen in der intrazellulären Ca 2 +-oder K +-Konzentrationen
- Vorbereiten Reagenzien und Ladepuffer
- Bereiten Sie die folgenden Reagenzien: 5 mM Stamm der ionensensitiven Fluoreszenzfarbstoff (Fura-2/AM oder PBFI / AM, fügen Sie die entsprechende Menge an DMSO in ein Röhrchen mit 50 ug der Farbstoff), "100x" Probenecid (1 hinzufügen ml PBS auf eine 77 mg Ampulle). Das gelösteFarbstoffe können bei -20 ° C eingefroren und einmal in Lösung für 3 Monate stabil, wohingegen die Probenecid in Lösung stabil bei -20 ° C für 6 Monate.
- Herstellung von 1 ml 2 × Ladepuffer wie folgt: In den Boden eines 15 ml konischen Kunststoffrohr verzichten 20 ul 100x Konzentrat Antriebsladung (bei 2-8 ° C für 6 Monate), gefolgt von 2 ul 5 mM Ionen empfindlichen Farbstoff direkt in die Antriebsladung. Vortex kurz mischen. In 960 ul PBS, gefolgt von 20 ul 100x Probenecid. Mischen Sie die Mischung ein letztes Mal. In Folie wickeln, um vor Licht zu schützen.
- Laden der Bakterien, die mit Farbstoff
- Pellet und waschen Sie den mittleren logarithmischen Phase Bakterienkultur wie in 2.2.1 beschrieben. Überstand entfernen und Pellet erneut in 5 ml PBS, eine "2x" Zellsuspension zu machen.
- 1 ml der Zellsuspension 2x auf das 2x Ladepuffer. Dies wird für ein Endvolumen von 2 ml, und letzte Konzentr bereitzustellenErwartungen über 1x Antriebsladung, 5 uM Fluoreszenzfarbstoff und 1x Probenecid. HINWEIS: Diese Suspension bietet genügend Volumen für 10 Proben, da jede Probe auch für die Messung werden 200 ul enthalten.
- Inkubation in einem 37 ° C Wasserbad für 75 min, vor Licht geschützt. HINWEIS: Der Farbstoff wird in die Bakterienzellen in der Abwesenheit von glykolytischen Substraten und in Gegenwart von Probenecid zu Efflux des Farbstoffs zu minimieren geladen.
- WASH 1: Pellet die Zellen durch Zentrifugation bei 2.400 × g für 10 min, zu entfernen Standes und Resuspension in 2 ml PBS, 1x Probenecid. WASH 2, 3: Wiederholen Sie Schritt 3.2.4 2x. Inkubieren bei 37 ° C für weitere 30 min. Dies ermöglicht es Zeit für bakterielle Esterasen, die Estergruppe Uhr von den verinnerlichten Fluoreszenzfarbstoffe hydrolysieren.
- WASH 4: Pellet die Zellen durch Zentrifugation bei 2.400 × g für 10 min, zu entfernen Standes und Resuspension in 2 ml PBS, 1x Probenecid. HINWEIS: Je nach experiment, Glucose kann wieder hier, um neue Energie zu tanken die Bakterien aufgenommen werden.
- Detektieren der Fluoreszenz
- Vorwärmen die Fluoreszenzdetektion Plattenleser Plattenlesegerät auf 37 ° C
- Für jede gewünschte Probe, 200 ul der beladenen Zellen (aus Schritt 3.2.8) in die Vertiefungen einer 96-Well-Platte. (Führen Sie die folgenden Schritte bis zur Fertigstellung für ein gut / Probe zu einem Zeitpunkt).
- Um eine Basislektüre für einen Brunnen, Platz Platte in der Fluoreszenzdetektion Plattenleser, um die Fluoreszenz (340 nm Anregung / 510 nm Emissions für "Wert 1" und 380 nm Anregung / 510 nm Emissions für "Wert 2") am messen sollen jede Sekunde für eine min.
- Werfen Platte, fügen Sie die Therapie der Wahl zu diesem auch (in einem kleinen Volumen von ca. 5 ul), schnell zu pipettieren, oben und unten ein paar Mal, um zu mischen und sofort wieder auf das in der Fluoreszenz-Detektionsplatte-Leser, jeden sec für die gewünschte lesen Dauer. (Wenn die inProjektoren mit dem Plattenlesegerät zugeordnet sind, diese könnten auch verwendet werden, um nahtlos fügen Sie die gewünschte Behandlung, wodurch die Notwendigkeit, um den Lese Auswerfen der Platte).
- Exportieren Sie die Messwerte mit einer Datenanalyseprogramm wie Microsoft Excel. Berechnen Sie das Verhältnis der Fluoreszenzwerte für jede Zeitpunkt berechnet, indem ein Wert von Wert 2, und zeichnen Sie die Verhältniswerte in einer Grafik.
4. Erfassen von Änderungen in der intrazellulären pH-Wert
- Vorbereiten Reagenzien und Puffer Kalibrierung
- Bereiten Sie die folgenden Reagenzien: 5 mM Stamm BCECF / AM (. Fügen Sie die entsprechende Menge DMSO in ein Röhrchen mit 50 ug des Farbstoffs Dieser Bestand ist bei -20 ° C 3 Monate haltbar), 100x Probenecid (1 ml PBS auf eine 77-mg-Durchstechflasche). 1 mM Stoffaufbereitung Nigericin in Ethanol (erforderlich, um den intrazellulären pH-Wert (pH-Wert ins Gleichgewicht i) der Zellen auf den pH-Wert der umgebenden Puffer Dieser Bestand ist sTabelle bei -20 ° C für 6 Monate);. 0,5 mM Stamm von Carbonyl Cyanid 3-chlorphenylhydrazon (CCCP) in DMSO (protonophore die Protonenantriebskraft entkoppeln Dieser Bestand ist bei -20 ° C stabil für 6 Monate)
- Vorbereitung 10 ml der folgenden hohen Kalium Puffer: 135 mM KH 2 PO 4/20 mm NaOH (einbasischen) und 110 mM K 2 HPO 4/20 mm NaOH (dibasischen). Filter sterilisieren unter Verwendung eines 0,45 um-Filter. (Diese Puffer können bei 4 ° C bis zur Verwendung gelagert werden.)
- Mischen der hohen Kaliumpuffer in den notwendigen Mengen, um hohe Kaliumpuffer mit mindestens 5-6 pH-Werten im Bereich von 6,5 bis 8,0 zu schaffen.
- Herstellung von 1 ml 2 × Ladepuffer wie folgt: In den Boden eines 15 ml konischen Kunststoffrohr verzichten 40 ul 100x Antriebsladung, gefolgt von 20 ul 5 mM ionenempfindlichen Farbstoff direkt in die Antriebsladung. Vortex kurz mischen. In 900 ul PBS, gefolgt von 40 ul 100x Probenecid. VortEx die Mischung ein letztes Mal. In Folie wickeln, um vor Licht zu schützen.
- Laden der Bakterien, die mit Farbstoff
- Pellet und waschen Sie die 8 ml der mittleren logarithmischen Phase Bakterienkultur wie in 2.2.1 beschrieben. Überstand entfernen, Pellet erneut in 2 ml PBS, eine "4x" Zellsuspension zu machen.
- 1 ml der Zellsuspension 4x an den 2x Ladepuffer. Dies wird für ein Endvolumen von 2 ml, und Endkonzentrationen von Zellen 2x, 2x Antriebsladung 50 um Fluoreszenzfarbstoff und 2x Probenecid bereitzustellen.
- Inkubation in einem 30 ° C Wasserbad für 40 min, vor Licht geschützt. HINWEIS: Der Farbstoff wird in die Bakterienzelle bei der niedrigeren Temperatur von 30 ° C und in Abwesenheit von glykolytischen Substrate Efflux des Farbstoffs zu minimieren geladen.
- WASH 1: Pellet die Zellen durch Zentrifugation bei 2.400 xg für 10 min Überstand zu entfernen, um überschüssige Farbe zu entfernen, und resuspendieren in 4 ml PBS, enthaltend 2x Probenecid einnd 1 mM Glukose (Kraft zu tanken, um die Bakterien). WASH 2, 3: Wiederholen Sie Schritt 4.2.7 zweimal mit endgültigen Resuspension in 4 ml PBS (für eine Endkonzentration von 1x Zellen) enthält, 2x Probenecid und 10 mM Glucose.
- Inkubieren bei 37 ° C für 5 min. Dadurch können die Zellen vollständig mit Energie zu versorgen und damit Zeit für die bakterielle Esterasen, um die Uhr Estergruppe vom verinnerlicht BCECF spalten.
- Gründung Hintergrundfluoreszenz und in vivo Eichkurve
- Vorwärmen die Fluoreszenzdetektion Plattenleser Plattenlesegerät auf 37 ° C
- Zu bestimmen, die Hintergrundfluoreszenz, Filter-sterilisiert etwa 500 ul der belasteten und erregt bakteriellen Suspension (aus Schritt 4.2.7), um die Bakterien zu entfernen, und mit 200 &mgr; l Filtrat nach der Vertiefung der 96-Well-Platte.
- Zeigen Platte in der Fluoreszenzdetektion Plattenleser, um die Fluoreszenz zu messen (490 nm Anregung / Emission 530 nm für"Wert 1" und 440 nm Anregung / 530 nm Emissions für "Wert 2") für 1 min. Dieses Hintergrundfluoreszenz sollte vor der Berechnung der Verhältnisse sowohl für die Eichkurve und die experimentellen Proben abgezogen.
- Um eine in vivo-Eichkurve zu erhalten, waschen Sie 500 ul Aliquots der geladenen und energiegeladen Zellen aus Schritt 4.2.7 und resuspendieren einmal in hohen Kalium-Puffer bei verschiedenen pH-Werten (im Bereich von 6,5 bis 8,0).
- Mit 20 &mgr; M Nigericin zu den Proben, um den intrazellulären pH-Wert der Zellen, den pH-Wert der umgebenden Puffer äquilibriert und bei 37 ° C für 5 min. Gib 200 ul Bakterien / pH Pufferkombinationen in die Vertiefungen einer 96-Well-Platte.
- Zeigen Platte in der Fluoreszenzdetektion Plattenleser, um die Fluoreszenz für ein paar Minuten zu messen, um eine stetige Lektüre für jeden gut zu etablieren. Exportieren Sie die Messwerte mit einer Datenanalyseprogramm wie Microsoft Excel.
- Nach Abzug der background Fluoreszenzwerte, berechnen Sie das Verhältnis der Fluoreszenzwerte durch Division von Wert 1 Wert 2. Zeichnen Sie die Ratio-Werte für jede pH-Puffer, um die Eichkurve zu erstellen. (Eine Eichkurve sollte für jede neue Charge des beladenen Zellen erzeugt werden, wie die Menge an Fluoreszenzfarbstoff, der in den Bakterien beladen ist, kann jedes Mal variieren).
- Messen von Veränderungen der intrazellulären pH-Wert
- Für jede gewünschte Probe, 200 ul der belasteten und erregten Zellen (aus Schritt 4.2.7) in die Vertiefungen einer 96-Well-Platte.
- Zeigen Platte in der Fluoreszenzdetektion Plattenleser und messen die Fluoreszenz der Proben alle 5 Sekunden für 5 min.
- Werfen Sie die Platte, und fügen Sie 10 uM CCCP, um ein gut (dient als positive Kontrolle für die Verringerung der intrazellulären pH-Wert) und der Versuchsmittel (n) von Interesse für den anderen Brunnen. Um deren Auswirkungen genau zu vergleichen mit der Zeit, fügen Sie die CCCP und Mittel der Wahl in der gleichen Zeit mit Uhrultichannel Pipette.
- Sofort die Platte zurück auf die Platte-Leser und weiter Fluoreszenzmessung alle 5 Sekunden für 10 min. Als zusätzliche Kontrolle, werfen Sie die Platte und mit 20 uM Nigericin für alle Proben, um den pH i der Bakterien auf den pH-Wert der umgebenden Puffer ins Gleichgewicht, und lesen für 5 min.
- Nach Subtraktion der Hintergrund-Fluoreszenz-Werte berechnen die Verhältnisse der Fluoreszenz für jede Probe. Interpolieren des pH i für jede Messung aus der Eichkurve.
Ergebnisse
Bei allen Experimenten, gibt es eine Reihe von Proben und in jeder Vertiefung vorhanden Bedingungen. Somit wird jedes Verfolgung stellt die Fluoreszenzintensität einer gesamten Bakterienpopulation im Laufe der Zeit. Die Ergebnisse sollten leicht zu interpretieren sein, mit einer klaren Unterscheidung zwischen der Fluoreszenz der behandelten Proben und die der unbehandelten Kontrollen. Die Kinetik und der Grad eines beobachteten Fluoreszenzänderung kann Informationen über die möglichen Mechanismus und das Ausmaß des Ereignisses überwacht wird.
Bei der Erkundung Membran Polarität, müssen die Bakterien mit DiBAC für etwa 40 min inkubiert, um die Gleichgewichtseinstellung des Farbstoffs über die Membran zu ermöglichen, wie durch die stetige Abnahme und anschließende Nivellierung der Fluoreszenz in 1A vor der Behandlung angegeben. Wie in 1B gezeigt, hat PI nicht erforderlich Äquilibrierung als Fluoreszenzsignal ist während der ersten 40 min der Inkubation bu stationärent seine Präsenz zusammen mit DiBAC ist hilfreich, um Blasensprung gleichzeitig mit Polarität zu überwachen. Depolarisation und Aufbrechen der Bakterien wird durch einen Anstieg der Fluoreszenzintensität der beiden Farbstoffe angegeben. Andere Mittel, die zur Depolarisation und Bruch, wie Detergenzien (Natriumdesoxycholat 18) Entkoppler, oder Ionophoren (CCCP), können auch hinzugefügt werden, um diese Ereignisse unter Verwendung dieser Methode zu demonstrieren.
Für Fura-2/AM, PBFI / AM und BCECF / AM, wird das Verhältnis der beiden Fluoreszenzsignale berechnet, und eine Zunahme oder Abnahme dieses Verhältnisses entspricht der intrazellulären Ca 2 + (2) + K (Fig. 3 ) und H + (4)-Konzentrationen auf. Nach Zugabe des Calcium-Ionophor Ionomycin, Ca 2 + in die Zelle fließt, was einen Anstieg in der Fluoreszenzverhältnis (Fig. 2). Zugabe von Valinomycin die gegenteilige Wirkung, was K+ Aus der Zelle herausfließen und die intrazelluläre Konzentration zu verringern, die durch eine Abnahme in der Fluoreszenzverhältnis (Fig. 3) angedeutet ist. BCECF ermöglicht die Messung des intrazellulären pH-Wert, indem zunächst eine Eichkurve (Figur 4A) in Gegenwart von verschiedenen Puffern von bekannten pH-Wert. Eine Abnahme der Fluoreszenzverhältnis des Farbstoffes entspricht einer Abnahme des pH-Werts, als nach der Zugabe des oder der CCCP Protonophoren Nigericin, die die Protonen-Gradienten (Fig. 4B) kollabiert gesehen.

Fig. 1 ist. Überwachung Membran Störungen. S. pneumoniae wurde mit (A) und DiBAC (B) PI gleichzeitig inkubiert für 40 min zur Gleichgewichtseinstellung über den DiBAC m ermöglichenembrane. Am Ende dieser Inkubation (Pfeil), PBS (unbehandelt) oder HAMLET (behandelt) wurde zugegeben, und die Proben wurden für eine weitere Stunde zu lesen. Klicken Sie hier für eine größere Ansicht.

2. Erfassen von Änderungen der intrazellulären Kalziumspiegel. Pneumokokken wurden mit Fura-2/AM geladen und behandelt (Pfeil) mit PBS (unbehandelt) oder dem Calcium-Ionophor Ionomycin (positive Kontrolle). Das Verhältnis der Fluoreszenzwerte vorgestellt. Klicken Sie hier für eine größere Ansicht.

3. Erfassen von Änderungen in der intrazellulären Kaliumspiegel. Pneumokokken wurden mit PBFI / AM beladen und behandelt (Pfeil) mit PBS (unbehandelt) oder Kalium-Ionophor Valinomycin (positive Kontrolle). Das Verhältnis der Fluoreszenzwerte vorgestellt. Klicken Sie hier für eine größere Ansicht.
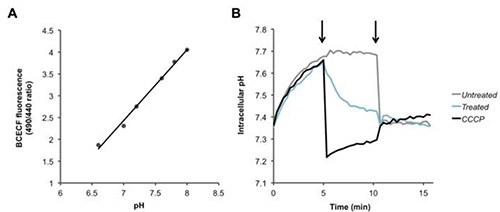
4. Erkennen von Veränderungen der intrazellulären Protonen Ebenen. (A) Standard-Kurve für den intrazellulären pH-Kalibrierung. (B) Pneumokokken wurden mit dem pH-sensitiven Farbstoff BCECF-AM beladen und warengewaschen und in PBS + Glucose resuspendiert. Nach Aufzeichnung Ausgangswerte, um den ersten Pfeil, PBS (schwarz), die protonophore CCCP (100 &mgr; M) oder WEILER (100 ug / ml oder 6 &mgr; M) wurden zu den Bakterien gegeben und die Fluoreszenz wurde über die Zeit gemessen. Am zweiten Pfeil Nigericin (20 uM) wurde hinzugefügt, um die Trans Protonengradienten aller Proben vollständig zu zerstreuen. Klicken Sie hier für eine größere Ansicht.
Diskussion
Trotz der Einschränkung, dass Größe stellt für die Verwendung von klassischen Methoden der Elektrophysiologie, Änderungen in der Polarität und der Unversehrtheit der Membran und Änderungen der Ionenkonzentration in Bakterien zu detektieren, haben wir einen Weg, um diese Ereignisse zu messen beschrieben in S. pneumoniae Verwendung von Fluoreszenzfarbstoffen. Unsere Protokolle sind die ersten ihrer Art für die Pneumokokken und einer der wenigen, für die Bakterienarten im Allgemeinen beschrieben wird. Durch die Verwendung eines Fluoreszenz-Detektion Plattenlesegerät, können diese Ereignisse in kleinen, 200 ul Volumen Proben von Bakterien gemessen werden, mit Fluoreszenz von einzelnen Bakterienpopulation im Laufe der Zeit festgestellt. Die Kinetik und die Änderungen der Fluoreszenzintensität kann verwendet werden, um qualitativ zu bestimmen, was geschieht, die Polarität oder die Integrität Membran oder Ebenen von Ca 2 +, K + oder H + innerhalb der Bakterien. Quantitativ ausgedrückt können die Fluoreszenzintensität Werte auch verwendet, um den Grad der dep berechnenolarization, Bruch-, Calcium-Aufnahme-, Kalium-Ausstrom oder pH-Änderung in einer Probe beobachtet im Vergleich zu anderen, die Bereitstellung kritischer Informationen zu einem Mechanismus von Interesse. Zusätzlich sollte unser Protokoll als ein Ausgangspunkt zum Laden von anderen AM Fluoreszenzfarbstoffe sein, so dass für die Untersuchung einer Vielzahl anderer zellulärer Ereignisse in einer Vielzahl von Bakterienarten. Wir haben bereits erfolgreich bei der Anwendung einige dieser Protokolle in 21 Staphylococcus aureus.
Bei Verwendung der AM-Farbstoffe, reichlich Inkubationszeit wichtig für Farbstoffbeladung und die Erreichung der anschließende Hydrolyse notwendig für den Farbstoff an die Zielionen in den Bakterien reagieren und ergeben die entsprechenden Fluoreszenzänderungen. Die Lade Kinetik zwischen Bakterienstämme auf mehrere Faktoren einschließlich Unterschieden in Bakterienoberfläche Architektur (Kapsel-Präsenz, die Fluidität der Membran, die Anwesenheit von Efflux-Pumpen, etc.) Und in der chemischen Struktur o variierenf den Farbstoff. Um eine maximale Beladung für den Bakterienstamm und Farbstoff von Interesse zu erreichen, gibt es mehrere Parameter unserer Protokoll, einschließlich Modulation erfordern: Inkubationsdauer, Inkubationstemperatur, Nährstoffverfügbarkeit, Antriebsladung Konzentration, Konzentration und Probenecid. Um das erfolgreiche Laden zu erhalten, ist die Fluoreszenzsignalintensität weniger wichtig als die zeigen, dass positive Kontrollen, wie die Zugabe von Ionophore, ein Signal in die richtige Richtung und / oder zeigen Linearität der Eichkurve. Zur Optimierung Laden einer Zunahme der Antriebsladung und Probenicide Konzentration, gefolgt von einer Absenkung der Temperatur der Extrusion des Farbstoffs zu vermeiden, ist bevorzugt, Erhöhung der Farbstoffkonzentration in der extrazellulären Färbung, die das Signal verwechselt werden führen kann. Bei der Entwicklung unserer Protokolle, waren wir in der Lage, unsere Farbstoffe von Interesse sowohl in der Wildtyp gekapselt Pneumokokken-Stamm D39 und dem nicht eingekapselten Stamm R36A 25 erfolgreich zu laden.Allerdings fanden wir, dass wir die optimale Beladung erreichen könnte als durch Fluoreszenz-Messungen führt zu einer erhöhten Verhältnisse mit R36A für Fura-2 und PBFI Experimente mit 37 ° C Bruttemperatur angegeben, während eine niedrigere Inkubationstemperatur gekoppelt mit höheren Antriebsladung und Probenecid Konzentrationen besser gearbeitet Laden von BCECF in D39. Obwohl spezifische Signalintensität zwischen den Experimenten variieren, die ratiometrisch Natur der Messungen vorgesehen Ergebnisse mit hoher Reproduzierbarkeit und wenig verbreitet.
Für Fluoreszenzmessungen von Proben, die Verwendung der begleitenden modernsten Plattenlesesoftware ermöglicht Anpassungen von einer Vielzahl von Detektionsparametern, einschließlich Detektionsgeschwindigkeit, Erfassungsempfindlichkeit und Zeitdauer ausgelesen, um nur einige zu nennen. Dies ermöglicht es dem Forscher, um die optimale Empfindlichkeit für den Nachweis der jeweiligen Veranstaltung, die überwacht wird finden. Für eine optimale Auslegung der Ergebnisse ist es entscheidend, dass eine stabile Basislinie Fluorescence und lineare Standardkurven festgelegt, wie es auch Inter-Assay-Variationen in der Menge an Farbstoff, die vorhanden ist, über die Membran ins Gleichgewicht gebracht werden, oder in die Bakterien geladen und hydrolysiert. So dass genügend Zeit für die Farbstoffgleichgewichtseinstellung über die Bakterienmembran vor der Behandlung jeglicher Art ist besonders wichtig, wenn Sie DiBAC 4 (3), die für eine stabilisierte Fluoreszenzniveau vor der Behandlung zu ermöglichen. Zusätzlich einschließlich aller entsprechenden Kontrollen in jedem einzelnen Analyse ist unerlässlich für eine genaue Datenanalyse, wie die experimentellen Zusatzstoffe, die in die Bakteriensuspension getestet werden eingeführt werden, können sich bei den jeweiligen Wellenlängen des Detektionsautofluoreszenz oder unspezifisch die Fluoreszenz des ändern Indikatorfarbstoff durch direkte Interaktionen.
Wir erkennen ein paar potenzielle Problembereiche mit den Methoden, die wir hier beschrieben verbunden. Im Gegensatz zu der Carbocyaninfarbstoff DiOC 2 (3), DiBAC 4 (3) ist ein bisoxonol Farbstoff, der nicht ratiometrischen, so dass während der Carbocyaninfarbstoff können für Änderungen des Zellvolumens, DiBAC 4 (3) kann es nicht erklären. Somit kann es Änderungen in der Höhe der Fluoreszenz, die auf Änderungen des Zellvolumens entsprechen. Wir aber habe nicht bemerkt, dass dies ein großes Problem sein, da die Pneumokokken hat eine starre Zellwand, die nicht wesentliche Änderungen in Lautstärke ohne Aufbrechen der Bakterien nicht zulässt. Für die Prüfung bakteriellen Ionenflüsse, kann die Empfindlichkeit der ionensensitive Farbstoffe in Abhängigkeit von der Ionen von Interesse und dem Grad der Veränderung in der Konzentration variieren. Darüber hinaus ist die Verwendung von Fluoreszenzfarbstoffen experimentell nicht als direkte Verfahren wie die Verwendung von Radioisotopen. , Abhängig von der Ionen von Interesse, die Prüfung Fluoreszenz ist jedoch viel mehr praktische Option, wenn man sowohl finanzielle und sicherheitsrelevante Einschränkungen bei der Verwendung von Radioisotopen beteiligt. So sind die in diesem Manuskript beschrieben Methoden neue und konsistenten Ansatzes zu einer besseren Studien Membran Polarität, Integrität und Transportereignisse und in bakteriellen Systemen.
Offenlegungen
Die Autoren haben keine finanziellen Interessen im Wettbewerb zu erklären.
Danksagungen
Diese Arbeit wurde von der Bill-und-Melinda-Gates-Stiftung (Projekt 53085), der JR Oishei Foundation und der American Lung Association (Förder RG-123721-N) zu APH und NIH (NIDCD) F31DC011218 Gemeinschaft EAC unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Todd-Hewitt broth | Bacto, BD Diagnostics | 249240 | |
| Yeast Extract | Bacto, BD Diagnostics | 212750 | |
| Phosphate Buffered Saline (PBS; pH 7.2) | Invitrogen (GIBCO) | ||
| Dimethyl sulfoxide | Sigma-Aldrich | D5879 | DMSO |
| DiBAC4(3) (bis-(1,3-dibutylbarbituric acid) trimethine oxonol) | Molecular Probes | B-438 | |
| Propidium Iodide | Sigma-Aldrich | P4170 | Make up in deionized water |
| D-(+)-Glucose | Sigma-Aldrich | ||
| PowerLoad | Molecular Probes | P10020 | 100x concentrate |
| Probenecid | Molecular Probes | P36400 | Make 100x stock by adding 1 ml of PBS to one 77 mg vial |
| Fura-2/AM | Molecular Probes | F1221 | Special packaging (50 µg aliquots) |
| PBFI/AM | Molecular Probes | P1267 | Special packaging (50 µg aliquots) |
| Nigericin | Sigma-Aldrich | N7143 | |
| KH2PO4 | JT Baker | 3246-01 | monobasic |
| NaOH | JT Baker | 5565-01 | |
| K2HPO4 | JT Baker | 4012-01 | dibasic |
| BCECF/AM | Molecular Probes | B1170 | Special packaging (50 µg aliquots) |
| CCCP | Sigma-Aldrich | Protonophore that causes an influx of H+ into the cytoplasm, dissipating the electrical potential and the H+ gradient. | |
| Culture tube | VWR | 53283-802 | Fits the Spectronic spectrophotometer; borosilicate glass |
| Spectrophotometer | Thermo Scientific | Spectronic 20D+ | |
| 15 ml Plastic conical tube | Corning | 430790 | |
| Clear 96-well polystyrene microtiter plate | Fisher Scientific | 12-565-501 | |
| Plate reader | BioTek | Synergy 2 Multi-Mode | |
| Gen5 software | BioTek | Gen5™ Software |
Referenzen
- Hakansson, A., Zhivotovsky, B., Orrenius, S., Sabharwal, H., Svanborg, C. Apoptosis induced by a human milk protein. Proc. Natl. Acad. Sci. U.S.A. 92 (17), 8064-8068 (1995).
- Hakansson, A., et al. A folding variant of alpha-lactalbumin with bactericidal activity against Streptococcus pneumoniae. Mol. Microbiol. 35 (3), 589-600 (2000).
- Hakansson, A. P., Roche-Hakansson, H., Mossberg, A. K., Svanborg, C. Apoptosis-Like Death in Bacteria Induced by HAMLET, a Human Milk Lipid-Protein Complex. PLoS One. 6 (3), (2011).
- Kohler, C., Gogvadze, V., Hakansson, A., Svanborg, C., Orrenius, S., Zhivotovsky, B. A folding variant of human alpha-lactalbumin induces mitochondrial permeability transition in isolated mitochondria. Eur. J. Biochem. 268 (1), 186-191 (2001).
- Ly, J. D., Grubb, D. R., Lawen, A. The mitochondrial membrane potential (Δψ m) in apoptosis; an update. Apoptosis. 8 (2), 115-128 (2003).
- Dominguez, D. C. Calcium signalling in bacteria. Mol. Microbiol. 54 (2), 291-297 (2004).
- Corratge-Faillie, C., Jabnoune, M., Zimmermann, S., Very, A. A., Fizames, C., Sentenac, H. Potassium and sodium transport in non-animal cells: the Trk/Ktr/HKT transporter family. Cell Mol. Life Sci. 67 (15), 2511-2532 (2010).
- Szabo, I., Petronilli, V., Zoratti, M. A patch-clamp study of Bacillus subtilis. Biochim. Biophys. Acta. 1112 (1), 29-38 (1992).
- Zoratti, M., Petronilli, V., Szabo, I. Stretch-activated composite ion channels in Bacillus subtilis. Biochem. Biophys. Res. Commun. 168 (2), 443-450 (1990).
- Novo, D., Perlmutter, N. G., Hunt, R. H., Shapiro, H. M. Accurate flow cytometric membrane potential measurement in bacteria using diethyloxacarbocyanine and a ratiometric technique. Cytometry. 35 (1), 55-63 (1999).
- Novo, D. J., Perlmutter, N. G., Hunt, R. H., Shapiro, H. M. Multiparameter flow cytometric analysis of antibiotic effects on membrane potential, membrane permeability, and bacterial counts of Staphylococcus aureus and Micrococcus luteus. Antimicrob. Agents Chemother. 44 (4), 827-834 (2000).
- Shapiro, H. M. Membrane potential estimation by flow cytometry. Methods. 21 (3), 271-279 (2000).
- Shapiro, H. M. Microbial analysis at the single-cell level: tasks and techniques. J. Microbiol. Methods. 42 (1), 3-16 (2000).
- Bashford, C. L., Chance, B., Smith, J. C., Yoshida, T. The behavior of oxonol dyes in phospholipid dispersions. Biophys. J. 25 (1), 63-85 (1979).
- Suzuki, H., Wang, Z. -Y., Yamakoshi, M., Kobayashi, M., Nozawa, T. Probing the transmembrane potential of bacterial cells by voltage-sensitive dyes. Anal. Sci. 19 (9), 1239-1242 (2003).
- Breeuwer, P., Abee, T. Assessment of the membrane potential, intracellular pH and respiration of bacteria employing fluorescence techniques. Mol. Microb. Ecol. Manual. 8, 1563-1580 (2004).
- Mortimer, F. C., Mason, D. J., Gant, V. A. Flow cytometric monitoring of antibiotic-induced injury in Escherichia coli using cell-impermeant fluorescent probes. Antimicrob. Agents Chemother. 44 (3), 676-681 (2000).
- Clementi, E. A., Marks, L. R., Duffey, M. E., Hakansson, A. P. A Novel Initiation Mechanism of Death in Streptococcus pneumoniae Induced by the Human Milk Protein-Lipid Complex HAMLET and Activated during Physiological Death. J. Biol. Chem. 287 (32), 27168-27182 (2012).
- Trombe, M. C., Laneelle, G., Sicard, A. M. Characterization of a Streptococcus pneumoniae mutant with altered electric transmembrane potential. J. Bacteriol. 158 (3), 1109-1114 (1984).
- Trombe, M. C. Characterization of a calcium porter of Streptococcus pneumoniae involved in calcium regulation of growth and competence. J. Gen. Microbiol. 139 (3), 433-439 (1993).
- Marks, L. R., Clementi, E. A., Hakansson, A. P. Sensitization of Staphylococcus aureus to Methicillin and Other Antibiotics In Vitro and In Vivo in the Presence of HAMLET. PLoS ONE. 8 (5), (2013).
- Futsaether, C. M., Johnsson, A. Using fura-2 to measure intracellular free calcium in Propionibacterium acnes. Can. J. Microbiol. 40 (6), 439-445 (1994).
- Tisa, L. S., Adler, J. Chemotactic properties of Escherichia coli mutants having abnormal Ca2+ content. J. Bacteriol. 177 (24), 7112-7118 (1995).
- Werthen, M., Lundgren, T. Intracellular Ca2+ mobilization and kinase activity during acylated homoserine lactone-dependent quorum sensing in Serratia liquefaciens. J. Biol. Chem. 276 (9), 6468-6472 (2001).
- Avery, O. T., MacLeod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types. Induction of transformation by a dexoxyribonuceic acid fraction isolated from pneumococcus type III. J. Exp. Med. 79, 137-158 (1944).
- Clementi, E. A., Wilhelm, K. R., Schleucher, J., Morozova-Roche, L. A., Hakansson, A. P. A Complex of Equine Lysozyme and Oleic Acid with Bactericidal Activity against. PLoS One. . 8, (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten