Method Article
Acompanhamento da evolução das Membrane Polaridade, integridade de membrana e intracelulares Ion concentrações no
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Ao contrário do que a observada para eucariotos, há uma escassez de estudos que despolarização detalhes membrana e concentração de íons mudanças nas bactérias, principalmente como seu pequeno tamanho faz com que os métodos convencionais de medição difícil. Aqui, os protocolos de detalhe para monitoramento de tais eventos no patógeno Gram-positivo significativo Streptococcus pneumoniae utilizando técnicas de fluorescência.
Resumo
Despolarização da membrana e de iões de fluxos são eventos que têm sido extensivamente estudadas em sistemas biológicos, devido à sua capacidade de influenciar profundamente as funções celulares, incluindo a energética e transduções de sinal. Embora ambos os métodos fluorescentes e eletrofisiológicos, incluindo o uso de eletrodos e patch-fixação, foram bem desenvolvidos para medir esses eventos em células eucarióticas, a metodologia para a medição de eventos semelhantes em microorganismos têm se mostrado mais desafiador para desenvolver dada a sua pequena dimensão, em combinação com o mais complexo a superfície exterior de bactérias blindagem da membrana. Durante nossos estudos de morte-iniciação em Streptococcus pneumoniae (pneumococo), queríamos para elucidar o papel dos eventos de membrana, incluindo mudanças na polaridade, integridade e concentrações de íons intracelulares. Pesquisando na literatura, encontramos que existem poucos estudos. Outros pesquisadores haviam monitorado captação do radioisótopo ou equilíbrio para medir gripe íonxes e potencial de membrana e um número limitado de estudos, principalmente em organismos gram-negativos, já tinha visto algum sucesso usando carbocianina ou oxonol corantes fluorescentes para medir o potencial de membrana, ou carregar bactérias com acetoximetílico célula-permeante (AM) versões de éster de íon sensível corantes fluorescentes indicadores. Nós, portanto, estabelecido e otimizado protocolos para medir o potencial de membrana, ruptura e íon-transporte no organismo Gram-positivas S. pneumoniae. Desenvolvemos protocolos utilizando o corante de bis-oxonol DiBAC 4 (3) e o iodeto de propídio corante célula-impermeabilizante para medir a despolarização da membrana e de ruptura, respectivamente, bem como os métodos para carregar de forma optimizada os pneumococos com os ésteres de AM dos corantes raciométrica Fura-2, PBFI, e BCECF para detectar alterações nas concentrações intracelulares de Ca 2 +, K + e H +, respectivamente, utilizando um leitor de placas de detecção de fluorescência. Estes protocolos são o primeiro de seu tipo para o pneumococoe a maioria dos corantes não têm sido utilizados em todas as outras espécies bacterianas. Apesar de nossos protocolos foram otimizados para S. pneumoniae, acreditamos que essas abordagens devem constituir um excelente ponto de partida para estudos similares em outras espécies bacterianas.
Introdução
O nosso laboratório identificou um complexo proteína-lípido a partir de leite humano chamado ALDEOLA (por alfa-lactalbumina humana Feito letal para as células de tumor), que induz a apoptose em células tumorais, mas também é capaz de matar uma variedade de espécies bacterianas 1,2. As espécies que se verificou serem particularmente sensíveis eram os que visam o aparelho respiratório, com o Streptococcus pneumoniae (pneumococos), exibindo a maior sensibilidade e um fenótipo semelhante a apoptose de morte 2,3. Eventos de transporte de despolarização da membrana e de iões específica são bem descritas e eventos cruciais durante a apoptose em células eucarióticas, em particular nas mitocôndrias, onde iões radioactivos + TPP e corantes fluorescentes incluindo JC-1 e TMRE têm sido utilizados para demonstrar a despolarização da membrana mitocondrial 3 -5. Assim, buscou-se saber mais sobre o efeito de HAMLET sobre esses recursos relacionados à membrana no pneumococo como nós nos concentramos nossos esforços parapromover uma melhor compreensão dos componentes mecanicistas do fenótipo de apoptose como em bactérias, com grande potencial para a identificação de novas terapias anti-bacterianos ou vacinas candidatas no processo.
Ao procurar estabelecer protocolos para os nossos estudos mecanicistas, descobrimos que, em contraste com a metodologia bem descrito em sistemas eucariotas, existem muito poucos estudos que detalham electrofisiologia e transporte de iões de mecanismos de 6,7 a membrana bacteriana. Isto é atribuído principalmente ao menor tamanho de microorganismos e sua arquitetura de superfície, em particular a presença de paredes celulares, que limita a acessibilidade da membrana para a utilização de métodos convencionais, como eucarióticos patch clamping, embora alguns estudos com protoplastos gigantes foram realizados com sucesso misturado 8,9. Como trabalho com esses protoplastos gigantes não é um método ideal ou mesmo prático para a maioria das espécies de bactérias, uma vez que requer que o homemipulated bactérias num estado anormal e abiótico, os estudos limitados de polarização da membrana bacteriana que tenham sido efectuados empregaram principalmente de citometria de fluxo e a utilização de cianina e corantes fluorescentes oxonol 10-16.
Em vez de citometria de fluxo, que reúne as leituras de fluorescência individuais de uma bactéria a um único ponto de tempo, optou-se por utilizar um leitor de placas de detecção de fluorescência para detectar a intensidade de fluorescência de suspensões bacterianas, em um formato de placa de 96 poços ao longo do tempo. Isto permitiu-nos para tratar uma população de bactérias em vários momentos com muito mais simplicidade e facilidade, e monitorar continuamente a cinética de fluorescência de toda a população por longos períodos de tempo, o que é difícil de conseguir por citometria de fluxo. Depois de testar uma grande variedade de corantes fluorescentes sensíveis potenciais (incluindo aqueles acima mencionados para utilização com as mitocôndrias), que obteve o melhor sucesso técnico e prático utilizando ocorante bis-oxonol chamado DiBAC 4 (3) (bis-(ácido 1,3-dibutylbarbituric) oxonol trimethine) para monitorar mudanças na polaridade.
Encontramos também é valioso para monitorar simultaneamente interrupções na integridade da membrana utilizando iodeto de propídio (PI). Este corante fluorescente por ligação a ácido nucleico, mas é apenas capaz de fazer isso, quando a integridade da membrana bacteriana é comprometida, o que torna o componente popular usado para detectar células mortas em ensaios de coloração vivos mortos. Além PI, SYTOX verde e TO-PRO-1 são corantes fluorescentes que são semelhantes em acção e que tenham sido previamente utilizados para as bactérias em alguns estudos de citometria de fluxo, utilizando métodos de detecção 17. Optamos por usar PI devido a seu comprimento de onda de excitação que nos permitiu acompanhar a sua fluorescência em simultâneo com DiBAC em uma dada amostra.
Em nossos estudos, observamos que HAMLET, bem como um outro complexo protéico-lipídica relacionada com a atividade bactericidaconhecido como ELOA, a despolarização induzida e ruptura da membrana bacteriana, tal como indicado por um aumento na fluorescência de ambos os corantes sobre o tratamento dos pneumococos 3,18,26. Para ambos os complexos, observou-se que a intensidade de fluorescência de DiBAC 4 (3) um aumento em relação ao aumento da intensidade de PI, indicando que a despolarização ocorreu antes da ruptura e é, por conseguinte, um evento específico induzida pelos nossos complexos proteína-lípido de bactericidas interesse. Esta distinção é importante para fazer, como ruptura da membrana pode-se causar despolarização inespecífica. Cinética de medição e análise, tanto DiBAC 4 (3) e PI fluorescência simultaneamente nos permitiu analisar essa relação entre os dois eventos de membrana, o que é uma vantagem adicional do uso fluorometria em vez de citometria de fluxo.
Para monitorar o fluxo de íons bacteriana, tem havido algum sucesso anterior com o uso de radioisótopos, incluindo medição de absorção de45 Ca 2 + no pneumococo 19,20, que também têm utilizado em nossos estudos recentes 18, 21. No entanto, trabalhar com esses íons radioativos tem vários inconvenientes. Eles podem ser caro, demorado e complicado, e pode também expor o indivíduo realizando a experiência de prejudicar, dependendo do isótopo de interesse. Além disso, é difícil controlar as rápidas mudanças ao longo do tempo. Assim, voltou-se para um método alternativo de medição que utiliza versões acetoximetílico (AM) de éster de corantes indicador fluorescente sensível ao íon. Por si só, o corante indicador é carregada e não passar facilmente através da membrana, mas com a adição do grupo de éster lipofílico, a molécula não carregada pode agora passar através da membrana da bactéria. Ao entrar no interior, as esterases bacterianas clivar o grupo éster, deixando o corante livre no interior da célula e novamente carregado, diminuindo significativamente a sua capacidade para sair da célula e permitindo que o corante to acumular dentro ao longo do tempo. No entanto, o uso desses corantes éster só foi descrito em algumas espécies bacterianas para detectar alterações no Ca2 + intracelular e 22-24 H + 16, com diferentes métodos de carregamento, detecção, e sucesso.
Com o desejo de monitorar mudanças na Ca 2 + intracelular e também os níveis de K + e H + em S. pneumoniae após tratamento com ALDEOLA e outros compostos, que criado com sucesso protocolos para carregar eficientemente corantes indicadores fluorescentes em células bacterianas. Carregamento eficaz em bactérias necessárias tanto probenecida que aumenta a retenção de corante, bloqueando ânion-transportadores e carga de potência, um composto proprietário da Life Technologies, que aumenta a eficiência de carregamento. Fura-2/AM (detecção de Ca 2 +), PBFI / AM (detecção de K +), e BCECF / AM (detecção de H +) foram carregados com êxito em ambos não encapsulada e encapsulado pneumocócica ruachuvas que permitem a medição dos padrões de fluorescência resultante após adição de ionóforo, tais como ionomicina (Ca 2 + desacoplador), valinomicina (K + desacoplador) e CCCP (H + desacoplador) utilizando um leitor de placas de detecção de fluorescência 18, 21.
Protocolo
1. Preparando culturas bacterianas
- Cultivo de cultura para utilização em experiências
- Em um bloco de aquecimento 37 ° C, descongelar um estoque congelado-frasco de S. pneumoniae e adicionar o seu conteúdo para 9 ml de fresco, pré-aquecido o caldo de Todd-Hewitt com extracto de levedura 0,5% (THY) para um volume total de 10 ml para um tubo de cultura de vidro.
- Incubar estaticamente a 37 ° C até a cultura atingir a fase mid-log (Abs 600 nm ≈ 0,5-0,6).
2. Detectando despolarização da membrana e ruptura
- Preparar reagentes
- Prepare um estoque de 50 mM de DiBAC 4 (3) em 100% DMSO, e um mg / ml 2 de PI em DDH 2 O. O DiBAC 4 (3) estoque é estável a -20 ° C durante pelo menos 6 meses. O estoque PI é estável a 4 ° C durante pelo menos 6 meses.
- Enrole ações em papel alumínio para proteger da luz.
- Carregamentobactérias
- Agregar as células bacterianas a partir do passo 1.2.2 por centrifugação a 2400 xg durante 10 min à temperatura ambiente e lava-se duas vezes, removendo o sobrenadante, ressuspender o sedimento em 10 ml de 1x com fosfato tamponado salino (PBS), e centrifuga-se novamente a 2.400 xg durante 10 min.
- Remover o sobrenadante e ressuspender o pellet em PBS no volume original. Isto irá fornecer durante cerca de 10 8 unidades formadoras de colônias de bactérias por ml. Remover 1 ml (suficiente para cinco amostras) de células lavadas e colocar num tubo de microcentrífuga.
- Para estas células, adicionar 25 ul de uma solução 1 M esterilizado por filtro de estoque de glicose (preparado em ddH2O e filtrada através de um filtro de 0,45 um) para uma concentração final de glicose 25 mM, e incubar em um bloco de aquecimento de 37 ° C por quinze minutos. NOTA: Este fornece energia para todos os canais de membrana ATP-dependentes e componentes celulares. A necessidade para esta etapa podem variar, dependendo da experiência.
- Adicionar 5 mL de 50 mM DiBAC 4 (3) estoque e 10 mL do estoque 2 mg / ml PI. Isto proporciona uma concentração final de 250 nM e 20 ug / ml, respectivamente. Misture bem por pipetagem cima e para baixo várias vezes. Adicionar 200 ul desta suspensão de células a cada poço de amostra de um claro placa de 96 poços.
- A detecção de fluorescência
- Colocar a placa num pré-aquecido (37 ° C), leitor de placas de detecção de fluorescência.
- Certifique-se de que os filtros apropriados estão em vigor para DiBAC 4 (3) (490 nm de excitação, emissão 516 nm) e PI (535 nm de excitação, emissão 617 nm).
- Para permitir (e ao mesmo tempo monitorar) equilíbrio de DiBAC 4 (3) sobre a membrana, defina o leitor a tomar medidas de fluorescência a cada min por cerca de 30-40 minutos, ou até que a leitura se estabilize, o que serve como uma leitura "pré-tratamento".
- Ejetar placa e adicionar o agente experimental de escolha e immediately colocar a placa de volta na leitora para continuar a monitorizar DiBAC 4 (3) e fluorescência de PI para o período de tempo desejado. Se o tratamento de várias amostras de uma vez, usando uma pipeta de canais múltiplos pode ser útil adicionar o agente ao mesmo tempo para todos os poços.
- Exportar as leituras de um programa de análise de dados, como o Microsoft Excel. Gráfico de fluorescência ao longo do tempo para avaliar a despolarização da membrana e ruptura. O aumento de fluorescência de DiBAC e PI indica que a despolarização e ruptura ocorrem.
3. Detecção de alterações no intracelular de Ca 2 + ou K + Concentrações
- Preparar os reagentes e tampão de carregamento
- Preparar os seguintes reagentes: 5 mM de estoque do corante fluorescente sensível aos iões (Fura-2/AM ou PBFI / AM, adicionar a quantidade apropriada de DMSO para um tubo contendo 50 mg de corante), "100X" probenecida (adicionar 1 ml de PBS para um frasco de 77 mg). O solubilizadoCorantes podem ser congeladas a -20 ° C uma vez e são estáveis em solução durante 3 meses, ao passo que a probenecida é estável em solução a -20 ° C durante 6 meses.
- Prepare 1 ml de 2x tampão de carregar como se segue: Na parte inferior de um tubo de 15 ml de plástico, dispensar 20 ul de carga de potência 100X concentrado (estável a 2-8 ° C durante 6 meses), seguido de 2 ul de 5 mM de ião sensível corante diretamente na carga de potência. Vortex brevemente para misturar. Adicionar 960 ul de PBS, seguido de 20 ul de 100x probenecida. Vortex da mistura uma última vez. Embrulhe em papel alumínio para proteger da luz.
- Colocação das bactérias com corante
- Agregar e lavar a cultura bacteriana fase mid-log, conforme descrito no ponto 2.2.1. Remover o sobrenadante e ressuspender o sedimento em 5 ml de PBS para fazer uma suspensão de células "2x".
- Adicionar 1 ml de suspensão de células para a 2x 2x Carregando Buffer. Isto irá fornecer para um volume final de 2 ml, e concentr finaisções de 1x carga de potência, 5 uM de corante fluorescente, e 1x probenecida. NOTA: Esta suspensão fornece o volume suficiente para 10 amostras, já que cada poço da amostra para medição conterá 200 mL.
- Incubar em C num banho de água a 37 ° durante 75 minutos, ao abrigo da luz. NOTA: O corante é carregado para dentro das células bacterianas, na ausência de quaisquer substratos glicolíticas e na presença de probenecida para minimizar o efluxo do corante.
- LAVAGEM 1: Agregar as células por centrifugação a 2400 xg durante 10 min, remover o sobrenadante e ressuspender em 2 ml de PBS contendo probenecid 1x. LAVAGEM 2, 3: Repita o passo 3.2.4 2x. Incubar a 37 ° C durante mais 30 min. Isto irá permitir que o tempo para as esterases bacterianas para hidrolisar o grupo éster AM longe dos corantes fluorescentes internalizadas.
- LAVAGEM 4: Agregar as células por centrifugação a 2400 xg durante 10 min, remover o sobrenadante e ressuspender em 2 ml de PBS contendo probenecid 1x. NOTA: Dependendo do experiment, a glicose pode ser adicionado de volta aqui para re-energizar as bactérias.
- A detecção de fluorescência
- Pré-aquecer o leitor de placas de leitor de placas de detecção de fluorescência a 37 ° C.
- Para cada amostra desejada, adicionar 200 ul de células carregadas (a partir do passo 3.2.8) para os poços de uma placa de 96 poços. (Siga os seguintes passos para a conclusão de um poço / amostra de cada vez).
- Para estabelecer uma base de leitura para um poço, colocar a placa na placa-reader detecção de fluorescência para medir a fluorescência (340 nm de excitação / emissão de 510 nm para "Valor 1" e 380 nm de excitação / emissão de 510 nm para "Valor 2") em a cada segundo por um min.
- Ejetar prato, adicione o tratamento de escolha para que o bem (em um pequeno volume de aproximadamente 5 mL), rapidamente pipeta cima e para baixo algumas vezes para misturar e coloque imediatamente de volta ao leitor de placa de detecção de fluorescência para ler a cada segundo por desejado comprimento de tempo. (Se o emjectors associadas com o leitor de placas estão disponíveis, estes também pode ser utilizados para adicionar continuamente o tratamento desejado, eliminando a necessidade de parar a leitura e ejectar a placa).
- Exportar as leituras de um programa de análise de dados, como o Microsoft Excel. Calcula-se a razão dos valores de fluorescência para cada ponto de tempo dividindo um valor pelo valor 2, e representar os valores da relação de um gráfico.
4. Detectar mudanças em pH intracelular
- Preparar reagentes e tampões de calibração
- Preparar os seguintes reagentes: 5 mM de estoque de BCECF / AM (. Adicionar a quantidade apropriada de DMSO para um tubo contendo 50 ug do corante Este estoque é estável a -20 ° C durante 3 meses); 100x probenecida (adicionar 1 ml de PBS a um frasco de 77 mg);. uma preparação de estoque mM de nigericina em etanol (necessária para equilibrar o pH intracelular (pH i) das células para o pH do tampão circundante Este estoque é stabela a -20 ° C durante 6 meses);. estoque 0,5 mM de cianeto de carbonilo 3-clorofenilhidrazona (CCCP) em DMSO (protonophore para desacoplar a força motriz de protões Este estoque é estável a -20 ° C durante 6 meses)
- Preparar 10 ml das seguintes tampões elevados de potássio: NaOH 135 mM de KH 2 PO 4/20 mM (monobásico) e 110 mM de NaOH K 2 HPO 4/20 mM (dibásico). Filtro esterilizar utilizando um filtro de 0,45 um. (Estes tampões podem ser armazenadas a 4 ° C até utilização).
- Misturar os buffers elevados de potássio nas proporções necessárias para criar amortecedores elevados de potássio com pelo menos 5-6 valores de pH variando entre 6,5 e 8,0.
- Prepare 1 ml de 2x tampão de carregar como se segue: Na parte inferior de um tubo de 15 ml de plástico, dispensar 40 ul de carga de potência de 100x, seguido de 20 ul de corante sensível aos iões 5 mM directamente na carga de potência. Vortex brevemente para misturar. Adicionar 900 ul de PBS, seguido de 40 ul de 100x probenecida. Vortex a mistura de uma última vez. Embrulhe em papel alumínio para proteger da luz.
- Colocação das bactérias com corante
- Pellet e lavar os 8 ml da cultura bacteriana de fase mid-log, como descrito em 2.2.1. Remover o sobrenadante, ressuspender sedimento em 2 ml de PBS para fazer uma suspensão de células "4x".
- Adicionar 1 ml de suspensão de células a 4x ao carregar 2x Tampão. Isto irá proporcionar um volume final de 2 ml, e concentrações finais de células 2x, 2x carga de potência, 50 uM de corante fluorescente, e 2x probenecida.
- Incubar em C num banho de água a 30 ° durante 40 minutos, ao abrigo da luz. NOTA: O corante é carregado para dentro das células bacterianas na temperatura mais baixa, de 30 ° C e na ausência de quaisquer substratos glicolíticas para minimizar o efluxo do corante.
- WASH 1: Pellet células por centrifugação a 2400 xg por 10 minutos, retire o sobrenadante para se livrar do excesso de corante, e ressuspender em 4 ml de PBS contendo 2x probenecida umnd 1 mM de glicose (reenergize as bactérias). LAVAGEM 2, 3: Repetir o passo 4.2.7, duas vezes, com a ressuspensão final em 4 ml de PBS (para uma concentração final de células 1x) contendo probenecid 2x e 10 mM de glucose.
- Incubar a 37 ° C durante 5 min. Isto irá permitir que as células completamente para energizar e permitir tempo para as esterases bacterianas para clivar o grupo de éster AM distante do BCECF internalizado.
- Estabelecimento de fluorescência de fundo e em curva de calibração vivo
- Pré-aquecer o leitor de placas de leitor de placas de detecção de fluorescência a 37 ° C.
- Para determinar a fluorescência de fundo, filtro-esterilizar a cerca de 500 ul da suspensão bacteriana carregada e energizada (a partir do passo 4.2.7) para remover as bactérias, e adicionar 200 mL de filtrado para o poço da placa de 96 poços.
- Coloque a placa no leitor de placa de detecção de fluorescência para medir a fluorescência (490 nm de excitação / emissão de 530 nm para"Valor 1" e 440 nm de excitação / emissão de 530 nm para "Valor 2") para 1 min. Esta fluorescência de fundo deve ser subtraído antes do cálculo das proporções tanto para a curva de calibração e as amostras experimentais.
- Para obter uma curva de calibração in vivo, lavar alíquotas de 500 ul de células carregadas e desligado a partir do passo 4.2.7 vez e ressuspender em tampões elevados de potássio em diferentes valores de pH (desde 6,5-8,0).
- Adicionar 20 uM nigericina para as amostras a equilibrar o pH intracelular das células para o pH do tampão circundante e incubar a 37 ° C durante 5 min. Adicionar 200 ul de tampão de combinações de bactérias / pH para os poços de uma placa de 96 poços.
- Coloque a placa no leitor de placa de detecção de fluorescência para medir a fluorescência por alguns minutos para estabelecer uma leitura estável para cada poço. Exportar as leituras de um programa de análise de dados, como o Microsoft Excel.
- Depois de subtrair o baOs valores de fluorescência ckground, calcular a razão entre os valores da fluorescência, dividindo pelo valor 1 Valor 2. Plotar os valores da relação de cada tampão de pH para criar a curva de calibração. (Uma curva de calibração deve ser gerado para cada novo lote de células carregadas, como a quantidade de corante fluorescente, que é carregado na bactéria pode variar de cada vez).
- Medidas de mudanças no pH intracelular
- Para cada amostra desejada, adicionar 200 ul de células carregadas e tensão (a partir do passo 4.2.7) para os poços de uma placa de 96 poços.
- Coloque a placa no leitor de placas de detecção de fluorescência e medir a fluorescência das amostras a cada 5 segundos durante 5 minutos.
- Ejectar a placa e adicionar 10 mM de CCCP a uma cavidade (serve como o controlo positivo para a diminuição do pH intracelular) e o agente experimental (s) de interesse para as outras cavidades. Para comparar com precisão os seus efeitos ao longo do tempo, adicione o CCCP e agentes de escolha ao mesmo tempo usando amultichannel pipeta.
- Retornar imediatamente a placa para o leitor de placas e medir a fluorescência de continuar a cada 5 segundos durante 10 minutos. Como um controle adicional, ejectar a placa e adiciona-se 20 uM Nigericina para todas as amostras a equilibrar a i das bactérias pH ao pH do tampão circundante, e lido por 5 min.
- Depois de se subtrair os valores da fluorescência de fundo, calcular as proporções de fluorescência para cada amostra. Interpolar o i pH para cada leitura a partir da curva de calibração.
Resultados
Para todas as experiências, há uma amostra e um conjunto de condições presentes em cada poço. Assim, cada traçado representa a intensidade de fluorescência de uma população inteira de bactérias ao longo do tempo. Os resultados devem ser facilmente interpretável, com uma clara distinção entre a fluorescência das amostras tratadas e que os controles não tratados. A cinética eo grau de uma mudança observada na fluorescência poderia fornecer informações sobre o possível mecanismo e extensão do evento que está sendo monitorado.
Ao explorar a polarização da membrana, as bactérias devem ser incubadas com DiBAC durante cerca de 40 minutos para permitir o equilíbrio do corante através da membrana, como indicado pela diminuição constante e nivelamento subsequente da fluorescência na Figura 1A, antes do tratamento. Como demonstrado na Figura 1B, a PI não requerem equilíbrio, tal como o seu sinal fluorescente é constante ao longo do primeiro 40 min de incubação, but a sua presença, juntamente com DiBAC é útil para monitorizar a ruptura da membrana ao mesmo tempo com a polaridade. Despolarização e ruptura das bactérias é indicado por um aumento na intensidade de fluorescência de ambos os corantes. Outros agentes capazes de despolarização e de ruptura, tais como detergentes (deoxicolato de sódio 18), desacopladores, ou ionóforos (CCCP), pode também ser adicionado para demonstrar estes eventos utilizando esta metodologia.
Para Fura-2/AM, PBFI / AM, BCECF e / AM, a razão entre dois sinais de fluorescência é calculada, e um aumento ou uma diminuição desse índice corresponde ao Ca 2 + intracelular (Figura 2), K + (Figura 3 ), e as concentrações de H + (Figura 4), respectivamente. Depois da adição do ionóforo de cálcio ionomicina, Ca 2 + flui para dentro da célula, causando um aumento na taxa de fluorescência (Figura 2). A adição de valinomicina tem o efeito oposto, fazendo com que K+ A fluir para fora da célula e reduzir a concentração intracelular, o que é indicado por uma diminuição na taxa de fluorescência (Figura 3). BCECF permite a medição de pH intracelular, em primeiro lugar a criação de uma curva de calibração (Figura 4A) na presença de vários tampões de pH conhecido. Um decréscimo na taxa de fluorescência do corante corresponde a uma diminuição do pH, como pode ser visto a seguir à adição de CCCP ou nigericina protonophores, que recolhe o gradiente de protão (Figura 4B).

Figura 1. Monitoramento perturbações membrana. S. pneumoniae foi incubado com (A) e DiBAC (B) PI, simultaneamente, durante 40 min para permitir o equilíbrio de DiBAC sobre o membrane. No final desta incubação (seta), PBS (sem tratamento) ou ALDEOLA (tratada) foi adicionado e as amostras foram lidas por uma hora adicional. clique aqui para ampliar.

Figura 2. Detectando mudanças nos níveis de cálcio intracelular. Pneumococos foram carregados com Fura-2/AM e tratada (seta) com PBS (sem tratamento) ou ionomicina a ionóforo de cálcio (controlo positivo). A proporção de valores de fluorescência é apresentada. Clique aqui para ver imagem ampliada.

Figura 3. Detectando mudanças nos níveis de potássio intracelular. Pneumococos foram carregados com PBFI / AM e tratada (seta) com PBS (sem tratamento) ou a valinomicina ionóforo de potássio (controlo positivo). A proporção de valores de fluorescência é apresentada. Clique aqui para ver imagem ampliada.
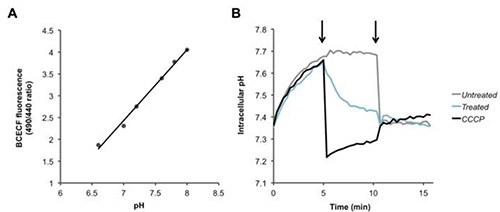
Figura 4. Detectar alterações nos níveis de prótons intracelulares. (A) curva padrão para calibração de pH intracelular. (B) Os pneumococos foram carregados com o pH sensível corante BCECF-AM, e foramlavadas e novamente suspensas em PBS + glucose. Depois de registar as leituras da linha de base, na primeira seta, PBS (branco), o CCCP protonophore (100 uM), ou ALDEOLA (100 ug / ml ou 6 uM), adicionaram-se às bactérias e a fluorescência foi medida ao longo do tempo. Na segunda nigericina seta (20 uM) foi adicionado a dissipar completamente o gradiente transmembranar de protões de todas as amostras. clique aqui para ampliar.
Discussão
Apesar da limitação que o tamanho apresenta para a utilização de métodos clássicos de eletrofisiologia para detectar mudanças na polaridade e integridade da membrana e as mudanças na concentração de íons dentro de bactérias, descrevemos uma forma de medir esses eventos em S. pneumoniae utilizando corantes fluorescentes. Nossos protocolos são os primeiros de sua espécie descrita para o pneumococo e um dos poucos descritos para espécies de bactérias em geral. Utilizando um leitor de placas de detecção de fluorescência, estes acontecimentos podem ser medidos em amostras pequenas, de 200 mL de volume de bactérias, com fluorescência detectada a partir da população individual de bactérias ao longo do tempo. A cinética e as alterações na intensidade de fluorescência pode ser utilizada para determinar qualitativamente o que se passa para a membrana polaridade ou integridade, ou os níveis de Ca 2 +, K +, H + ou no interior da bactéria. Em termos quantitativos, os valores da intensidade de fluorescência pode também ser usada para calcular o grau de depolarization, a ruptura, a absorção de cálcio, o efluxo de potássio, ou alteração do pH observada em uma amostra em relação ao outro, fornecendo informações importantes sobre um mecanismo de interesse. Para além disso, o nosso protocolo deve ser útil como um ponto de partida para o carregamento de outros corantes fluorescentes AM, permitindo o estudo de uma grande variedade de outros eventos celulares em uma variedade de espécies bacterianas. Nós já foram bem sucedidos na aplicação de alguns destes protocolos em Staphylococcus aureus 21.
Ao utilizar os corantes AM, um amplo tempo de incubação é importante para o carregamento de corante e alcançar a hidrólise subsequente necessário para o corante para responder aos iões alvo dentro das bactérias e produzir as correspondentes alterações de fluorescência. A cinética de carga pode variar entre linhagens bacterianas devido a vários fatores, incluindo diferenças na arquitetura superfície bacteriana (presença de cápsula, a fluidez da membrana, presença de bombas de efluxo, etc.) E na estrutura química of o corante. Para atingir a carga máxima para a estirpe bacteriana e corante de interesse, há diversos parâmetros de nosso protocolo que pode exigir modulação, incluindo: a duração de incubação, a temperatura de incubação, a disponibilidade de nutrientes, a concentração de carga de potência, e concentração probenecida. Para obter o carregamento bem sucedido, a intensidade do sinal de fluorescência é menos importante do que o que mostra que os controlos positivos, tais como os ionóforos, fornecer um sinal na direcção e / ou exibindo linearidade na curva de calibragem correcta. Para optimizar o carregamento de um aumento na carga de potência e concentração Probenicide seguido de um abaixamento da temperatura para evitar a extrusão do corante é preferível aumentar a concentração de corante, que pode resultar numa coloração extracelular que vai confundir o sinal. Durante o desenvolvimento dos nossos protocolos, fomos capazes de carregar com êxito nossos corantes de interesse, tanto no tipo selvagem encapsulado D39 cepa de pneumococo e da estirpe unencapsulated R36A 25.No entanto, descobrimos que poderíamos alcançar carga ideal, conforme indicado por leituras fluorescentes que levam ao aumento dos índices utilizando R36A para Fura-2 e PBFI experimentos utilizando 37 ° C temperatura de incubação, enquanto que uma temperatura de incubação menor juntamente com uma maior carga de potência e concentrações probenecida funcionou melhor para carregamento de BCECF em D39. Embora a intensidade do sinal específico pode variar entre os experimentos, a natureza raciométrica das medições forneceram resultados com alta reprodutibilidade e pouco difundido.
Para medições de fluorescência das amostras, o uso do software que acompanha leitores de placas mais avançadas permite ajustes de uma variedade de parâmetros de detecção, incluindo a velocidade de detecção, sensibilidade de detecção e leitura de duração, para citar alguns. Isso permite que o pesquisador para encontrar a sensibilidade ideal para detecção do evento particular que está sendo monitorado. Para melhor interpretação dos resultados, é essencial que as linhas de base estáveis de flúorescence curvas padrão lineares e são estabelecidos, como pode haver variações inter-ensaio na quantidade de corante que está presente, equilibrado sobre a membrana, ou carregados nas bactérias e hidrolisado. Permitindo que o tempo para a tintura de equilíbrio através da membrana bacteriana, antes do tratamento de qualquer tipo é particularmente importante quando se utiliza DiBAC 4 (3) para permitir um nível de fluorescência estabilizado antes do tratamento. Adicionalmente, incluindo todos os controlos apropriados em cada análise individual é essencial para a análise de dados precisos, como os aditivos experimentais que são introduzidos na suspensão bacteriana a ser testado podem eles próprios autofluoresce aos comprimentos de onda particulares de detecção ou pode alterar a fluorescência não específica do indicador corante por meio de interações diretas.
Reconhecemos algumas áreas potenciais de preocupação associados com os métodos que descrevemos aqui. Ao contrário do corante de carbocianina DIOC 2 (3), 4 DiBAC (3) é um corante bisoxonol que não é raciométrica, por isso, enquanto o corante de carbocianina podem ser responsáveis por alterações no volume celular, DiBAC 4 (3) não pode. Assim, pode haver mudanças no nível de fluorescência que correspondem a alterações no volume das células. Nós, contudo, não se notar que este é um problema significativo, já que o pneumococo tem uma parede celular rígida que não permite alterações significativas no volume sem romper as bactérias. Para examinar fluxos de iões bacterianas, a sensibilidade dos corantes sensíveis aos iões pode variar dependendo do ião de interesse e o grau de alteração da sua concentração. Além disso, a utilização de corantes fluorescentes não é experimentalmente como um método directo como a utilização de radioisótopos. No entanto, dependendo do ião de interesse, examinando a fluorescência é uma opção muito mais prático quando consideradas as limitações financeiras e relacionadas com a segurança envolvidas com a utilização de radioisótopos. Assim, as metodologias descritas neste manuscrito fornecer abordagem nova e consistentees para melhor polaridade membrana estudo, integridade e eventos de transporte e em sistemas bacterianos.
Divulgações
Os autores não têm concorrentes interesses financeiros a declarar.
Agradecimentos
Este trabalho foi financiado pela Fundação Bill e Melinda Gates (Grant 53085), a Fundação JR Oishei, e The American Lung Association (Grant RG-123721-N) para APH e NIH (NIDCD) comunhão F31DC011218 a EAC.
Materiais
| Name | Company | Catalog Number | Comments |
| Todd-Hewitt broth | Bacto, BD Diagnostics | 249240 | |
| Yeast Extract | Bacto, BD Diagnostics | 212750 | |
| Phosphate Buffered Saline (PBS; pH 7.2) | Invitrogen (GIBCO) | ||
| Dimethyl sulfoxide | Sigma-Aldrich | D5879 | DMSO |
| DiBAC4(3) (bis-(1,3-dibutylbarbituric acid) trimethine oxonol) | Molecular Probes | B-438 | |
| Propidium Iodide | Sigma-Aldrich | P4170 | Make up in deionized water |
| D-(+)-Glucose | Sigma-Aldrich | ||
| PowerLoad | Molecular Probes | P10020 | 100x concentrate |
| Probenecid | Molecular Probes | P36400 | Make 100x stock by adding 1 ml of PBS to one 77 mg vial |
| Fura-2/AM | Molecular Probes | F1221 | Special packaging (50 µg aliquots) |
| PBFI/AM | Molecular Probes | P1267 | Special packaging (50 µg aliquots) |
| Nigericin | Sigma-Aldrich | N7143 | |
| KH2PO4 | JT Baker | 3246-01 | monobasic |
| NaOH | JT Baker | 5565-01 | |
| K2HPO4 | JT Baker | 4012-01 | dibasic |
| BCECF/AM | Molecular Probes | B1170 | Special packaging (50 µg aliquots) |
| CCCP | Sigma-Aldrich | Protonophore that causes an influx of H+ into the cytoplasm, dissipating the electrical potential and the H+ gradient. | |
| Culture tube | VWR | 53283-802 | Fits the Spectronic spectrophotometer; borosilicate glass |
| Spectrophotometer | Thermo Scientific | Spectronic 20D+ | |
| 15 ml Plastic conical tube | Corning | 430790 | |
| Clear 96-well polystyrene microtiter plate | Fisher Scientific | 12-565-501 | |
| Plate reader | BioTek | Synergy 2 Multi-Mode | |
| Gen5 software | BioTek | Gen5™ Software |
Referências
- Hakansson, A., Zhivotovsky, B., Orrenius, S., Sabharwal, H., Svanborg, C. Apoptosis induced by a human milk protein. Proc. Natl. Acad. Sci. U.S.A. 92 (17), 8064-8068 (1995).
- Hakansson, A., et al. A folding variant of alpha-lactalbumin with bactericidal activity against Streptococcus pneumoniae. Mol. Microbiol. 35 (3), 589-600 (2000).
- Hakansson, A. P., Roche-Hakansson, H., Mossberg, A. K., Svanborg, C. Apoptosis-Like Death in Bacteria Induced by HAMLET, a Human Milk Lipid-Protein Complex. PLoS One. 6 (3), (2011).
- Kohler, C., Gogvadze, V., Hakansson, A., Svanborg, C., Orrenius, S., Zhivotovsky, B. A folding variant of human alpha-lactalbumin induces mitochondrial permeability transition in isolated mitochondria. Eur. J. Biochem. 268 (1), 186-191 (2001).
- Ly, J. D., Grubb, D. R., Lawen, A. The mitochondrial membrane potential (Δψ m) in apoptosis; an update. Apoptosis. 8 (2), 115-128 (2003).
- Dominguez, D. C. Calcium signalling in bacteria. Mol. Microbiol. 54 (2), 291-297 (2004).
- Corratge-Faillie, C., Jabnoune, M., Zimmermann, S., Very, A. A., Fizames, C., Sentenac, H. Potassium and sodium transport in non-animal cells: the Trk/Ktr/HKT transporter family. Cell Mol. Life Sci. 67 (15), 2511-2532 (2010).
- Szabo, I., Petronilli, V., Zoratti, M. A patch-clamp study of Bacillus subtilis. Biochim. Biophys. Acta. 1112 (1), 29-38 (1992).
- Zoratti, M., Petronilli, V., Szabo, I. Stretch-activated composite ion channels in Bacillus subtilis. Biochem. Biophys. Res. Commun. 168 (2), 443-450 (1990).
- Novo, D., Perlmutter, N. G., Hunt, R. H., Shapiro, H. M. Accurate flow cytometric membrane potential measurement in bacteria using diethyloxacarbocyanine and a ratiometric technique. Cytometry. 35 (1), 55-63 (1999).
- Novo, D. J., Perlmutter, N. G., Hunt, R. H., Shapiro, H. M. Multiparameter flow cytometric analysis of antibiotic effects on membrane potential, membrane permeability, and bacterial counts of Staphylococcus aureus and Micrococcus luteus. Antimicrob. Agents Chemother. 44 (4), 827-834 (2000).
- Shapiro, H. M. Membrane potential estimation by flow cytometry. Methods. 21 (3), 271-279 (2000).
- Shapiro, H. M. Microbial analysis at the single-cell level: tasks and techniques. J. Microbiol. Methods. 42 (1), 3-16 (2000).
- Bashford, C. L., Chance, B., Smith, J. C., Yoshida, T. The behavior of oxonol dyes in phospholipid dispersions. Biophys. J. 25 (1), 63-85 (1979).
- Suzuki, H., Wang, Z. -. Y., Yamakoshi, M., Kobayashi, M., Nozawa, T. Probing the transmembrane potential of bacterial cells by voltage-sensitive dyes. Anal. Sci. 19 (9), 1239-1242 (2003).
- Breeuwer, P., Abee, T. Assessment of the membrane potential, intracellular pH and respiration of bacteria employing fluorescence techniques. Mol. Microb. Ecol. Manual. 8, 1563-1580 (2004).
- Mortimer, F. C., Mason, D. J., Gant, V. A. Flow cytometric monitoring of antibiotic-induced injury in Escherichia coli using cell-impermeant fluorescent probes. Antimicrob. Agents Chemother. 44 (3), 676-681 (2000).
- Clementi, E. A., Marks, L. R., Duffey, M. E., Hakansson, A. P. A Novel Initiation Mechanism of Death in Streptococcus pneumoniae Induced by the Human Milk Protein-Lipid Complex HAMLET and Activated during Physiological Death. J. Biol. Chem. 287 (32), 27168-27182 (2012).
- Trombe, M. C., Laneelle, G., Sicard, A. M. Characterization of a Streptococcus pneumoniae mutant with altered electric transmembrane potential. J. Bacteriol. 158 (3), 1109-1114 (1984).
- Trombe, M. C. Characterization of a calcium porter of Streptococcus pneumoniae involved in calcium regulation of growth and competence. J. Gen. Microbiol. 139 (3), 433-439 (1993).
- Marks, L. R., Clementi, E. A., Hakansson, A. P. Sensitization of Staphylococcus aureus to Methicillin and Other Antibiotics In Vitro and In Vivo in the Presence of HAMLET. PLoS ONE. 8 (5), (2013).
- Futsaether, C. M., Johnsson, A. Using fura-2 to measure intracellular free calcium in Propionibacterium acnes. Can. J. Microbiol. 40 (6), 439-445 (1994).
- Tisa, L. S., Adler, J. Chemotactic properties of Escherichia coli mutants having abnormal Ca2+ content. J. Bacteriol. 177 (24), 7112-7118 (1995).
- Werthen, M., Lundgren, T. Intracellular Ca2+ mobilization and kinase activity during acylated homoserine lactone-dependent quorum sensing in Serratia liquefaciens. J. Biol. Chem. 276 (9), 6468-6472 (2001).
- Avery, O. T., MacLeod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types. Induction of transformation by a dexoxyribonuceic acid fraction isolated from pneumococcus type III. J. Exp. Med. 79, 137-158 (1944).
- Clementi, E. A., Wilhelm, K. R., Schleucher, J., Morozova-Roche, L. A., Hakansson, A. P. A Complex of Equine Lysozyme and Oleic Acid with Bactericidal Activity against. PLoS One. . 8, (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados