Method Article
Monitoraggio dei cambiamenti di polarità membrana, membrana integrità e intracellulare di ioni concentrazioni in
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
A differenza di quanto osservato per eucarioti, c'è una scarsità di studi che dettaglio depolarizzazione della membrana e concentrazione di ioni cambiamenti nei batteri, principalmente come loro piccole dimensioni lo metodi convenzionali di misura difficile. Qui, i protocolli di dettaglio per il monitoraggio di tali eventi nel significativa Gram-positivi patogeno Streptococcus pneumoniae utilizzando tecniche di fluorescenza.
Abstract
Depolarizzazione della membrana e flussi ionici sono eventi che sono stati studiati ampiamente nei sistemi biologici a causa della loro capacità di influire profondamente funzioni cellulari, tra cui l'energetica e trasduzione del segnale. Mentre entrambi i metodi fluorescenti ed elettrofisiologici, incluso l'impiego dell'elettrodo e patch-bloccaggio, sono stati ben sviluppati per misurare questi eventi in cellule eucariotiche, una metodologia per misurare eventi simili a microrganismi hanno dimostrato più impegnativo per sviluppare in loro piccole dimensioni in combinazione con il più complesso superficie esterna dei batteri schermanti membrana. Durante i nostri studi di morte-iniziazione Streptococcus pneumoniae (pneumococco), abbiamo voluto chiarire il ruolo degli eventi di membrana, compresi i cambiamenti di polarità, l'integrità e la concentrazione di ioni intracellulari. Ricerca della letteratura, abbiamo scoperto che esistono pochissimi studi. Altri ricercatori hanno monitorato radioisotopo captazione o di equilibrio per misurare l'influenza di ionixes e potenziale di membrana e un numero limitato di studi, soprattutto negli organismi Gram-negativi, avevano visto un certo successo con carbocyanine o oxonol coloranti fluorescenti per misurare il potenziale di membrana, oppure caricare i batteri con acetossimetilico cellula-permeabile (AM) versioni estere di ione-sensibile coloranti indicatori fluorescenti. Abbiamo quindi stabilito e ottimizzato i protocolli per la misura del potenziale di membrana, la rottura, e ionico trasporto nell'organismo Gram-positivi S. pneumoniae. Abbiamo sviluppato protocolli usando il colorante bis-oxonol DiBAC 4 (3) e il colorante propidio ioduro cellula-impermeant per misurare depolarizzazione della membrana e la rottura, rispettivamente, così come i metodi per caricare in modo ottimale la pneumococchi con gli esteri AM dei coloranti raziometrici Fura-2, PBFI, e BCECF per rilevare cambiamenti nella concentrazione intracellulare di Ca 2 +, K +, H + e, rispettivamente, utilizzando un lettore di piastre a fluorescenza di rilevamento. Questi protocolli sono i primi nel loro genere per il pneumococcoe la maggioranza di questi coloranti non sono stati utilizzati in altre specie batteriche. Anche se sono stati ottimizzati i nostri protocolli per S. pneumoniae, crediamo che questi approcci dovrebbero costituire un ottimo punto di partenza per studi simili in altre specie batteriche.
Introduzione
Il nostro laboratorio ha identificato un complesso proteico-lipidico del latte umano di nome HAMLET (for Human Alpha-lattoalbumina Fatto letale per le cellule tumorali) che induce apoptosi nelle cellule tumore, ma è anche in grado di uccidere una grande varietà di specie batteriche 1,2. Le specie che sono stati trovati per essere particolarmente sensibile erano quelli che colpiscono le vie respiratorie, con Streptococcus pneumoniae (pneumococco) visualizzando la massima sensibilità e un fenotipo simile all'apoptosi di morte 2,3. Depolarizzazione della membrana e di ioni specifici eventi di trasporto sono ben descritti e eventi cruciali durante l'apoptosi nelle cellule eucariotiche, particolari nei mitocondri, dove sono stati utilizzati radioattive + ioni TPP e coloranti fluorescenti, tra cui JC-1 e TMRE per dimostrare depolarizzazione della membrana mitocondriale 3 -5. Così, abbiamo cercato di saperne di più circa l'effetto di HAMLET su queste caratteristiche di membrana correlate in pneumococco, come abbiamo concentrato i nostri sforzi persviluppare una migliore comprensione dei componenti meccanicistiche del fenotipo simile all'apoptosi nei batteri, con un grande potenziale per identificare terapie antibatteriche o di nuovi vaccini candidati nel processo.
Nel cercare di stabilire protocolli per i nostri studi meccanicistici, abbiamo scoperto che, contrariamente alla metodologia ben descritto in sistemi eucariotici, ci sono pochi studi pubblicati che descrivono elettrofisiologia e meccanismi di trasporto ionico della membrana batterica 6,7. Questo è principalmente attribuito alla dimensione più piccola di microrganismi e la loro architettura superficie, in particolare la presenza di parete cellulare, che limita l'accessibilità della membrana per uso di metodi convenzionali come eucariotiche Patch di serraggio, anche se alcuni studi con protoplasti giganti sono stati eseguiti con successo mista 8,9. Come lavoro con questi protoplasti giganti non è un metodo ideale o anche pratico per la maggior parte delle specie batteriche poiché richiede uomobatteri ipulated in uno stato innaturale e abiotico, gli studi limitati di membrana batterica polarità che sono stati eseguiti hanno principalmente impiegato citofluorimetria e l'uso di coloranti fluorescenti cianina e oxonol 10-16.
Invece di citometria a flusso, che raccoglie le letture della fluorescenza singoli da un batterio ad un unico punto di tempo, abbiamo scelto di utilizzare un lettore di piastra di rilevamento di fluorescenza per rilevare l'intensità di fluorescenza delle sospensioni batteriche in un formato a 96 pozzetti nel tempo. Questo ci ha consentito di trattare una popolazione di batteri in vari momenti con maggiore semplicità e facilità, e monitorare la cinetica di fluorescenza di tutta la popolazione per lunghi periodi di tempo, che è difficile da ottenere in citometria a flusso. Dopo aver testato una grande varietà di coloranti fluorescenti potenziali sensibili (fra cui quelli citati per l'uso con i mitocondri), abbiamo ottenuto il miglior successo tecnico e pratico usando l'bis-oxonol colorante chiamato DiBAC 4 (3) (bis-(acido 1,3-dibutylbarbituric) trimethine oxonol) per monitorare i cambiamenti di polarità.
Abbiamo anche trovato prezioso per monitorare contemporaneamente interruzioni nella integrità della membrana con ioduro di propidio (PI). Questo colorante fluorescente in seguito al legame di acido nucleico, ma è solo in grado di fare in modo che quando l'integrità della membrana batterica è compromessa, il che rende il componente popolare utilizzato per rilevare le cellule morte in saggi di colorazione vivi-morti. Oltre a PI, Sytox verde e TO-PRO-1 sono coloranti fluorescenti che sono simili in azione e sono stati precedentemente utilizzati per i batteri in pochi studi in citometria a flusso metodi di rilevamento 17. Abbiamo scelto di usare PI a causa della sua lunghezza d'onda di eccitazione che ci ha permesso di monitorare la propria fluorescenza in concomitanza con DiBAC in un dato campione.
Nei nostri studi, abbiamo osservato che AMLETO, così come un altro complesso proteina-lipide correlata con attività battericidanoto come Eloa, depolarizzazione indotta e rottura della membrana batterica come indicato dall'aumento nel fluorescenza di entrambi i coloranti in seguito al trattamento del pneumococchi 3,18,26. Per entrambi i complessi, abbiamo osservato che l'intensità di fluorescenza di DiBAC 4 (3) aumentata prima dell 'aumento di intensità di PI, indicando che depolarizzazione verificato prima della rottura ed è, quindi, un evento specifico indotta dai nostri complessi proteina-lipide battericida dei interesse. Questa distinzione è importante fare, come rottura della membrana stessa può causare depolarizzazione aspecifica. Cinetica misurare ed analizzare sia DiBAC 4 (3) e PI fluorescenza contemporaneamente ci ha permesso di esaminare questo rapporto tra i due eventi membrana, che è un ulteriore vantaggio di utilizzare fluorometria invece di citometria a flusso.
Per monitorare flusso di ioni batterica, c'è stato qualche successo precedente con l'utilizzo di radioisotopi misura incluso l'assorbimento di45 Ca 2 + nel pneumococco 19,20, che abbiamo usato anche nei nostri recenti studi 18, 21. Tuttavia, lavorando con questi ioni radioattivi ha diversi svantaggi. Possono essere costoso, richiede tempo, e disordinato, e può anche esporre la persona che esegue l'esperimento a danneggiare, a seconda della isotopo di interesse. Inoltre, è difficile controllare rapidi cambiamenti nel tempo. Così, ci siamo rivolti verso un metodo alternativo di misura che utilizza le versioni acetossimetilico (AM) estere di indicatore fluorescente coloranti ionici sensibili. Di per sé, il colorante indicatore è carico e non passa attraverso la membrana facilmente, ma con l'aggiunta del gruppo estere lipofilo, la molecola ora uncharged può passare attraverso la membrana del batterio. Entrando interni, i esterasi batteriche fendere il gruppo estere lasciando colorante libero all'interno della cellula e di nuovo caricato, rallentando significativamente la sua capacità per uscire dalla cella e consentendo il colorante to accumularsi all'interno nel tempo. Tuttavia, l'uso di questi coloranti estere è stata descritta solo in alcune specie batteriche per rilevare variazioni di Ca2 + intracellulare 22-24 e H + 16, con diversi metodi di carico, rilevamento, e il successo.
Con il desiderio di monitorare i cambiamenti in intracellulare di Ca 2 + e anche i livelli di K + e H + in S. pneumoniae in seguito al trattamento con Amleto e altri composti, abbiamo creato con successo i protocolli di caricare in modo efficiente coloranti indicatori fluorescenti in cellule batteriche. Loading efficace nei batteri necessari sia probenecid che aumenta la ritenzione di colorante bloccando anioni-trasportatori e PowerLoad, un composto brevettato da Life Technologies che aumenta l'efficienza di carico. Fura-2/AM (rilevazione Ca 2 +), PBFI / AM (rilevamento K +), e BCECF / AM (rilevamento H +) sono stati caricati con successo in entrambi unencapsulated e incapsulato pneumococco stpiogge che consentono la misurazione delle risultanti pattern di fluorescenza dopo l'aggiunta di ionofori, come ionomicina (Ca 2 + disaccoppiatore), valinomicina (K + disaccoppiatore) e CCCP (H + disaccoppiatore) utilizzando un lettore di piastra di rilevamento di fluorescenza 18, 21.
Protocollo
1. Preparazione di colture batteriche
- Crescente cultura per l'uso negli esperimenti
- In un blocco di riscaldamento a 37 ° C, scongelare un gelato di stock fiala di S. pneumoniae e aggiungere il contenuto di 9 ml di fresco, preriscaldata Todd-Hewitt brodo con estratto di lievito 0,5% (THY) per un volume totale di 10 ml in una provetta di coltura di vetro.
- Incubare staticamente a 37 ° C fino a che la coltura raggiunga fase mid-log (Abs 600nm ≈ 0.5-0.6).
2. Rilevamento depolarizzazione della membrana e rottura
- Reagenti Preparazione
- Preparare uno stock di 50 micron di DiBAC 4 (3) in 100% DMSO, e 2 mg / ml magazzino di PI in DDH 2 O. Il DiBAC 4 (3) stock è stabile a -20 ° C per almeno 6 mesi. Il PI azione è stabile a 4 ° C per almeno 6 mesi.
- Avvolgere le scorte in fogli per proteggere dalla luce.
- Caricamentobatteri
- Agglomerare le cellule batteriche dal punto 1.2.2 mediante centrifugazione a 2400 xg per 10 min a temperatura ambiente e lavata due volte eliminando il surnatante, risospendere il pellet in 10 ml di 1x tampone fosfato salino (PBS), e centrifugare nuovamente a 2.400 xg per 10 min.
- Rimuovere il surnatante e risospendere pellet in PBS al volume originale. Ciò fornirà per circa 10 8 unità formanti colonia di batteri per ml. Rimuovere 1 ml (sufficiente per 5 campioni) delle cellule lavate e posto in una provetta.
- Per queste cellule, aggiungere 25 ml di una soluzione 1 M sterilizzata per filtrazione magazzino di glucosio (preparata in DDH 2 O e filtrato attraverso un filtro da 0,45 micron) per una concentrazione finale di 25 mM di glucosio, e incubare una piastra riscaldante a 37 ° C per quindici minuti. NOTA: Questo fornisce energia per tutti i canali di membrana ATP-dipendenti e componenti cellulari. La necessità di questo passaggio può variare, a seconda dell'esperimento.
- Aggiungere 5 ml di 50 mM DiBAC 4 (3) stock e 10 ml di 2 mg / ml PI magazzino. Questo prevede concentrazioni finali di 250 Nm e 20 mcg / ml, rispettivamente. Mescolare accuratamente pipettando su e giù parecchie volte. Aggiungere 200 ml di questa sospensione cellulare a ciascun pozzetto di una chiara piastra a 96 pozzetti.
- Rilevamento della fluorescenza
- Posto piatto in un (37 ° C) lettore di piastre di rilevazione di fluorescenza preriscaldata.
- Assicurarsi che i filtri siano in atto adeguate per DiBAC 4 (3) (490 nm di eccitazione, emissione 516 nm) e PI (535 nm di eccitazione, emissione 617 nm) di rilevamento.
- Per consentire (e contemporaneamente monitorare) equilibratura di DiBAC 4 (3) sopra la membrana, impostare il lettore a prendere misure di fluorescenza ogni min circa 30-40 minuti, o fino a quando la lettura si stabilizza, questo serve come una lettura "pretrattamento".
- Espellere piastra e aggiungere l'agente sperimentale di scelta e immediately posizionare la piastra posteriore nel lettore a continuare a monitorare DiBAC 4 (3) e PI fluorescenza per il tempo desiderato. Se il trattamento di diversi campioni alla volta, usando una pipetta multicanale può essere utile aggiungere l'agente simultaneamente a tutti i pozzetti.
- Esportare le letture di un programma di analisi dati, ad esempio Microsoft Excel. Fluorescenza Plot nel corso del tempo per valutare depolarizzazione della membrana e la rottura. L'aumento di fluorescenza di DiBAC e PI indica che la depolarizzazione e la rottura si verificano.
3. Rilevamento Variazioni intracellulare Ca 2 + o K + concentrazioni
- Preparazione dei reagenti e tampone di caricamento
- Preparare i seguenti reagenti: 5 stock mM del colorante fluorescente sensibile agli ioni (Fura-2/AM o PBFI / AM, aggiungere la giusta quantità di DMSO ad una provetta contenente 50 mg del colorante), "100x" probenecid (aggiungere 1 ml di PBS per una fiala 77 mg). Il solubilizzatocoloranti possono essere congelati a -20 ° C una volta e sono stabili in soluzione per 3 mesi, mentre il probenecid è stabile in soluzione a -20 ° C per 6 mesi.
- Preparare 1 ml di 2x Loading Buffer come segue: Nel fondo di una provetta di plastica da 15 ml, 20 ml di dispensare 100x PowerLoad concentrato (stabili a 2-8 ° C per 6 mesi), seguiti da 2 microlitri dello ione 5 mM sensibile colorante direttamente nel PowerLoad. Vortex brevemente per mescolare. Aggiungere 960 ml di PBS seguita da 20 ml di 100x probenecid. Agitare la miscela un'ultima volta. Avvolgere nella pellicola per proteggerlo dalla luce.
- Caricamento dei batteri con la tintura
- Pellet e lavare la coltura batterica fase di mid-log, come descritto al punto 2.2.1. Rimuovere il surnatante e risospendere pellet in 5 ml di PBS per ottenere una sospensione cellulare "2x".
- Aggiungere 1 ml di sospensione cellulare 2x alla 2x Loading Buffer. Ciò fornirà un volume finale di 2 ml e Concentrazione finalezioni di 1x PowerLoad, 5 micron colorante fluorescente, e 1x probenecid. NOTA: Questa sospensione fornisce abbastanza volume per 10 campioni poiché ogni bene campione per la misura conterrà 200 ml.
- Incubare in un bagno d'acqua a 37 ° per 75 min, al riparo dalla luce. NOTA: Il colorante viene caricato in cellule batteriche in assenza di substrati glicolitico e in presenza di probenecid per minimizzare efflusso del colorante.
- LAVAGGIO 1: agglomerare le cellule per centrifugazione a 2.400 xg per 10 min, rimuovere il surnatante e risospendere in 2 ml di PBS contenente probenecid 1x. WASH 2, 3: Ripetere il passaggio 3.2.4 2x. Incubare a 37 ° C per altri 30 minuti. Questo consentirà di avere tempo per esterasi batteriche di idrolizzare il gruppo estere AM lontano dai coloranti fluorescenti interiorizzati.
- LAVAGGIO 4: agglomerare le cellule per centrifugazione a 2.400 xg per 10 min, rimuovere il surnatante e risospendere in 2 ml di PBS contenente probenecid 1x. NOTA: A seconda del experiment, il glucosio può essere aggiunto di nuovo qui per ri-energizzare i batteri.
- Rilevamento della fluorescenza
- Preriscaldare il lettore di piastre piastra-reader rivelazione di fluorescenza a 37 ° C.
- Per ogni campione desiderata, aggiungere 200 microlitri di cellule caricate (dal punto 3.2.8) ai pozzetti di una piastra a 96 pozzetti. (Eseguire le seguenti operazioni per il completamento di un bene / campione alla volta).
- Per stabilire una linea di base per la lettura di un pozzo, piastra posto nella rilevazione della fluorescenza piastra-reader per misurare la fluorescenza (340 nm di eccitazione / 510 nm di emissione per il "Valore 1" e 380 nm di eccitazione / emissione 510 nm per "Valore 2") a ogni secondo per un min.
- Espellere piatto, aggiungere il trattamento di scelta per tale bene (in un piccolo volume di circa 5 ml), in modo rapido pipetta su e giù un paio di volte per mescolare, e subito mettere di nuovo nella rilevazione della fluorescenza piastra-reader per leggere ogni sec per lo desideri lunghezza di tempo. (Se l'ininiettori associati al lettore di piastre sono disponibili, essi potrebbero essere utilizzati anche per aggiungere perfettamente il trattamento desiderato, eliminando la necessità di interrompere la lettura ed espellere la piastra).
- Esportare le letture di un programma di analisi dati, ad esempio Microsoft Excel. Calcolare il rapporto dei valori di fluorescenza per ogni time-point dividendo valore 1 per Valore 2, e riportare i valori del rapporto su un grafico.
4. Cambiamenti Rilevamento a pH intracellulare
- Preparazione dei reagenti e tamponi di calibrazione
- Preparare i seguenti reagenti: 5 stock mM di BCECF / AM (. Aggiungere la giusta quantità di DMSO ad una provetta contenente 50 mg del colorante stock è stabile a -20 ° C per 3 mesi); 100x probenecid (aggiungere 1 ml di PBS a un 77 mg fiala);. 1 stock mM preparazione di nigericin in etanolo (obbligatorio per equilibrare il pH intracellulare (pH i) delle cellule al pH del tampone circostante stock è sTavolo a -20 ° C per 6 mesi);. 0,5 magazzino mM di carbonile cianuro 3 chlorophenylhydrazone (CCCP) in DMSO (protonophore per disaccoppiare la forza motrice protonica stock è stabile a -20 ° C per 6 mesi)
- Preparare 10 ml delle seguenti buffer di potassio: NaOH 135 mM KH 2 PO 4/20 mm (monobasico) e 110 K mM NaOH 2 HPO 4/20 mm (bibasico). Filtro sterilizzare usando un filtro di 0,45 micron. (Questi tamponi possono essere conservati a 4 ° C fino al momento dell'uso).
- Mescolare i buffer di potassio in quantità necessaria per creare buffer di potassio con almeno 5-6 valori di pH variabili 6,5-8,0.
- Preparare 1 ml di 2x Loading Buffer come segue: Nel fondo di una provetta di plastica da 15 ml, 40 ml di dispensare 100x PowerLoad, seguiti da 20 ml di 5 mM colorante sensibile agli ioni direttamente nel PowerLoad. Vortex brevemente per mescolare. Aggiungere 900 ml di PBS seguita da 40 ml di 100x probenecid. Vortex miscela un'ultima volta. Avvolgere nella pellicola per proteggerlo dalla luce.
- Caricamento dei batteri con la tintura
- Pellet e lavare gli 8 ml di coltura batterica fase di mid-log come descritto al punto 2.2.1. Rimuovere il surnatante, risospendere pellet in 2 ml di PBS per ottenere una sospensione cellulare "4x".
- Aggiungere 1 ml di sospensione cellulare 4x a 2x Loading Buffer. Ciò fornirà un volume finale di 2 ml e concentrazioni finali di cellule 2x, 2x PowerLoad, 50 pm colorante fluorescente e 2x probenecid.
- Incubare in un bagno d'acqua a 30 ° per 40 minuti, al riparo dalla luce. NOTA: Il colorante viene caricato nelle cellule batteriche alla temperatura inferiore di 30 ° C e in assenza di substrati glicolitici per minimizzare efflusso del colorante.
- WASH 1: Pellet le cellule per centrifugazione a 2400 xg per 10 minuti, rimuovere il surnatante per sbarazzarsi di un eccesso di colorante, e risospendere in 4 ml di PBS contenente 2x probenecid unglucosio mM nd 1 (a rivitalizzare i batteri). LAVAGGIO 2, 3: Ripetere passaggio 4.2.7 due volte, con risospensione finale in 4 ml di PBS (per una concentrazione finale di cellule 1x) contenente 2x probenecid e glucosio 10 mM.
- Incubare a 37 ° C per 5 min. Ciò consentirà alle cellule di eccitare completamente e consentire il tempo per esterasi batteriche per fendere il gruppo estere AM lontano dal BCECF interiorizzato.
- Stabilire fluorescenza di fondo e in curva di calibrazione vivo
- Preriscaldare il lettore di piastre piastra-reader rivelazione di fluorescenza a 37 ° C.
- Per determinare la fluorescenza, filtro-sterilizzare circa 500 microlitri della sospensione batterica caricato e eccitato (dal punto 4.2.7) per rimuovere i batteri, e aggiungere 200 ml di filtrato al pozzetto della piastra a 96 pozzetti.
- Posizionare placca nella rivelazione di fluorescenza piastra-reader per misurare la fluorescenza (eccitazione 490 nm / 530 nm di emissione per"Valore 1" e 440 nm di eccitazione / emissione 530 nm per "Valore 2") per 1 min. Questa fluorescenza di fondo deve essere sottratto prima del calcolo dei coefficienti sia per la curva di calibrazione ei campioni sperimentali.
- Per ottenere una curva di calibrazione in vivo, lavare 500 microlitri aliquote delle cellule caricati e alimentati dal punto 4.2.7 volta e risospendere in buffer di potassio a diversi valori di pH (che vanno 6,5-8,0).
- Aggiungere 20 mM nigericin ai campioni per equilibrare il pH intracellulare delle cellule al pH del tampone circostante e incubare a 37 ° C per 5 min. Aggiungere 200 ml di combinazioni tampone batteri / pH ai pozzetti di una piastra a 96 pozzetti.
- Posizionare placca nella rivelazione di fluorescenza piastra-reader per misurare la fluorescenza per pochi minuti per stabilire una lettura stabile per ciascun pozzetto. Esportare le letture di un programma di analisi dati, ad esempio Microsoft Excel.
- Dopo aver sottratto il bavalori di fluorescenza SFONDO, calcolare il rapporto dei valori di fluorescenza dividendo valore 1 per Valore 2. Tracciare i valori del rapporto per ciascun tampone pH per creare la curva di calibrazione. (Una curva di calibrazione deve essere generato per ogni nuovo lotto di cellule caricate, come la quantità di colorante fluorescente che viene caricato nei batteri può variare ogni volta).
- Variazioni di misura di pH intracellulare
- Per ogni campione desiderato, aggiungere 200 ml di cellule caricate e tensione (dal punto 4.2.7) per i pozzetti di una piastra a 96 pozzetti.
- Posizionare placca nella rivelazione di fluorescenza piastra-reader e misurare la fluorescenza dei campioni ogni 5 secondi per 5 min.
- Estrarre la piastra e aggiungere 10 pM CCCP ad un pozzetto (serve come controllo positivo per la diminuzione del pH intracellulare) e l'agente sperimentale (s) di interesse per gli altri pozzetti. Per confrontare con precisione i loro effetti nel corso del tempo, aggiungere la CCCP e agenti di scelta allo stesso tempo utilizzando amultichannel pipetta.
- Restituire immediatamente la piastra alla piastra-reader e continua a misurare la fluorescenza ogni 5 secondi per 10 min. Come controllo aggiuntivo, espellere la piastra e aggiungere 20 pM Nigericina a tutti i campioni per equilibrare l'i pH dei batteri al pH del tampone circostante, e leggere per 5 min.
- Dopo sottraendo i valori di fluorescenza di fondo, calcolare i rapporti di fluorescenza per ciascun campione. Interpolare la i pH per ogni lettura dalla curva di calibrazione.
Risultati
Per tutti gli esperimenti, c'è un campione e insieme di condizioni presenti in ciascun pozzetto. Così, ogni tracciato rappresenta l'intensità di fluorescenza di un'intera popolazione di batteri nel tempo. I risultati dovrebbero essere facilmente interpretabile, con una netta distinzione tra la fluorescenza dei campioni trattati e quella dei controlli non trattati. La cinetica e gradi di un cambiamento osservato in fluorescenza potrebbero fornire informazioni sul possibile meccanismo e la portata dell'evento monitorato.
Quando esplorando membrana polarità, i batteri devono essere incubate con DiBAC per circa 40 min per permettere di equilibramento del colorante sulla membrana, come indicato dalla diminuzione costante e successivo livellamento fluorescenza in Figura 1A prima del trattamento. Come mostrato nella Figura 1B, PI non richiede equilibrazione, come segnale fluorescente è costante durante i primi 40 minuti di incubazione, but la sua presenza insieme a DiBAC è utile per monitorare la rottura della membrana in concomitanza con la polarità. Depolarizzazione e rottura dei batteri è indicato da un aumento di intensità di fluorescenza di entrambi i coloranti. Altri agenti capaci di depolarizzazione e di rottura, come i detersivi (sodio desossicolato 18), uncouplers o ionofori (CCCP), possono anche essere aggiunti per dimostrare questi eventi utilizzando questa metodologia.
Per Fura-2/AM, PBFI / AM, e BCECF / AM, il rapporto tra due segnali fluorescenti viene calcolato, e un aumento o diminuzione di tale rapporto corrisponde al Ca2 + intracellulare (Figura 2), K + (Figura 3 ), e H + (Figura 4) le concentrazioni rispettivamente. Dopo l'aggiunta del ionomicina ionoforo del calcio, Ca 2 + fluisce nella cellula provocando un aumento del rapporto di fluorescenza (Figura 2). L'aggiunta di valinomicina ha l'effetto opposto, causando K+ A fluire fuori dalla cellula e diminuire la concentrazione intracellulare, che è indicata da una diminuzione del rapporto di fluorescenza (Figura 3). BCECF consente la misura di pH intracellulare creando dapprima una curva calibrazione (Figura 4A) in presenza di vari buffer di pH noti. Una diminuzione del rapporto di fluorescenza del colorante corrisponde a una diminuzione del pH, come si è visto in seguito aggiunta del CCCP protonophores o nigericin, che collassa gradiente protonico (Figura 4B).

Figura 1. Monitoraggio perturbazioni membrana. S. pneumoniae è stata incubata con (A) DiBAC e contemporaneamente (B) PI per 40 min per permettere di equilibramento del DiBAC sul membrane. Al termine di questa incubazione (freccia), PBS (non trattato) o AMLETO (trattato) è stata aggiunta ed i campioni sono stati letti per un'ora supplementare. Clicca qui per vedere l'immagine ingrandita.

Figura 2. Rilevare cambiamenti nei livelli di calcio intracellulare. Pneumococchi sono stati caricati con Fura-2/AM e trattata (freccia) con PBS (non trattato) o il ionomicina ionoforo del calcio (controllo positivo). Il rapporto tra valori di fluorescenza è presentato. Clicca qui per vedere l'immagine ingrandita.

Figura 3. Rilevare cambiamenti nei livelli di potassio intracellulari. Pneumococchi sono stati caricati con PBFI / AM e trattata (freccia) con PBS (non trattato) o il valinomicina ionoforo potassio (controllo positivo). Il rapporto tra valori di fluorescenza è presentato. Clicca qui per vedere l'immagine ingrandita.
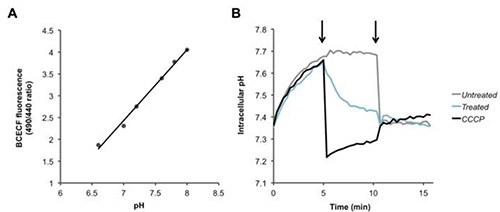
Figura 4. Rilevare cambiamenti nei livelli di protoni intracellulari. (A) curva standard per la calibrazione pH intracellulare. (B) pneumococchi sono stati caricati con il colorante sensibile al pH BCECF-AM, ed eranolavate e risospese in PBS + glucosio. Dopo aver registrato valori basali, alla prima freccia, PBS (nero), il CCCP protonophore (100 mM), o AMLETO (100 pg / ml o 6 mM), sono stati aggiunti i batteri e la fluorescenza è stata misurata nel tempo. Alla seconda freccia nigericin (20 micron) è stato aggiunto per dissipare completamente i gradiente transmembrana di protoni di tutti i campioni. Clicca qui per vedere l'immagine ingrandita.
Discussione
Nonostante la limitazione che presenta dimensioni per elettrofisiologia con metodi classici per rilevare variazioni di polarità e l'integrità della membrana e variazioni nelle concentrazioni di ioni all'interno batteri, abbiamo descritto un modo per misurare questi eventi in S. pneumoniae utilizzando coloranti fluorescenti. I nostri protocolli sono i primi nel loro genere descritto per il pneumococco e uno dei pochi descritto per specie batteriche in generale. Utilizzando un lettore di piastra di rilevamento di fluorescenza, questi eventi possono essere misurati in piccoli campioni di volume 200 ml di batteri, con fluorescenza rilevata dalla popolazione individuale di batteri nel tempo. La cinetica e cambiamenti di intensità di fluorescenza possono essere utilizzati per determinare qualitativamente cosa sta succedendo a membrana polarità o l'integrità, o livelli di Ca 2 +, K +, H + o nei batteri. Quantitativamente parlando, i valori di intensità di fluorescenza possono anche essere utilizzati per calcolare il livello di depolarization, rottura, assorbimento del calcio, efflusso di potassio, o cambiamento di pH osservati in un campione rispetto a un altro, fornire informazioni critiche relative ad un meccanismo di interesse. Inoltre, il protocollo dovrebbe essere utile come punto di partenza per il caricamento di altri coloranti fluorescenti AM, consentendo lo studio di una varietà di altri eventi cellulari in una varietà di specie batteriche. Abbiamo già avuto successo nell'applicare alcuni di questi protocolli in Staphylococcus aureus 21.
Quando si utilizzano i coloranti AM, ampio tempo di incubazione è importante per tinture carico e raggiungere la successiva idrolisi necessaria per la tintura di rispondere alle ioni target all'interno dei batteri e dare il corrispondente cambiamento di fluorescenza. La cinetica di carico può variare tra i ceppi batterici causa di diversi fattori tra cui le differenze nell'architettura superficie batterica (presenza capsula, fluidità di membrana, presenza di pompe di efflusso, ecc.) E nella struttura chimica of il colorante. Per raggiungere il carico massimo per il ceppo batterico e tintura di interesse, esistono diversi parametri di nostro protocollo che può richiedere modulazione compresi: durata dell'incubazione, temperatura di incubazione, disponibilità di nutrienti, concentrazione PowerLoad, e concentrazione probenecid. Per ottenere loading successo, intensità del segnale di fluorescenza è meno importante mostra che controlli positivi, come l'addizione di ionofori, forniscono un segnale nella direzione e / o mostrando linearità della curva di calibrazione corretto. Per ottimizzare il caricamento di un aumento della concentrazione Probenicide PowerLoad e seguita da un abbassamento della temperatura per evitare estrusione del colorante è preferibile aumentare la concentrazione di colorante che possono provocare macchie extracellulare che confondere il segnale. Durante lo sviluppo dei nostri protocolli, siamo stati in grado di caricare correttamente i nostri coloranti di interesse sia nel tipo selvatico incapsulato D39 ceppo pneumococco e il ceppo non incapsulata R36A 25.Tuttavia, abbiamo trovato che potremmo raggiungere il carico ottimale come indicato da letture fluorescenti con conseguente aumento rapporti utilizzando R36A per Fura-2 e PBFI esperimenti usando 37 ° C temperatura di incubazione, mentre una temperatura di incubazione inferiore accoppiata con maggiore PowerLoad e concentrazioni probenecid funzionato meglio per caricamento di BCECF in D39. Anche se l'intensità del segnale specifico può variare tra esperimenti, la natura raziometrico delle misurazioni ha fornito i risultati con elevata riproducibilità e poco diffuso.
Per le misure di fluorescenza di campioni, l'uso del software che accompagna lettori di piastre più avanzate consente regolazioni di una varietà di parametri di rilevazione, tra cui la velocità di rilevamento, sensibilità di rilevazione, e leggere la durata, per citarne alcuni. Questo consente al ricercatore di trovare la sensibilità ottimale per il rilevamento del particolare evento che viene monitorato. Per l'interpretazione ottimale dei risultati, è fondamentale che le linee di base stabili di Fluorescence standard e lineare delle curve sono stabiliti, in quanto ci possono essere variazioni inter-saggio nella quantità di colorante che è presente, equilibrata sopra la membrana, o caricati in batteri e idrolizzato. Dando il tempo di equilibrazione colorante sulla membrana batterica prima del trattamento di qualsiasi tipo è particolarmente importante quando si utilizzano DiBAC 4 (3) per consentire un livello di fluorescenza stabilizzato prima del trattamento. Inoltre, compresi tutti i controlli appropriati in ogni singolo analisi è essenziale per l'analisi di dati accurati, come gli additivi sperimentali che vengono introdotti nella sospensione batterica da testare possono essi stessi autofluorescenza alle particolari lunghezze d'onda di rilevamento o possono aspecifico modificare la fluorescenza del colorante indicatore attraverso interazioni dirette.
Riconosciamo alcune potenziali aree di interesse connessi con i metodi che abbiamo descritto qui. A differenza del colorante carbocyanine Dioc 2 (3), DiBAC 4 (3) è un colorante bisoxonol che non è raziometrica, così mentre il colorante carbocyanine può spiegare le variazioni di volume delle cellule, DiBAC 4 (3) non possono. Così, ci possono essere cambiamenti nel livello di fluorescenza che corrispondono a variazioni di volume delle cellule. Noi, però, non ho notato che questo è un problema rilevante, in quanto il pneumococco ha una parete cellulare rigida che non permette cambiamenti significativi nel volume senza rompersi i batteri. Per esaminare flussi ionici batteriche, la sensibilità dei coloranti ionoselettivi può variare a seconda dello ione di interesse e il grado di variazione nella sua concentrazione. Inoltre, l'uso di coloranti fluorescenti non è sperimentalmente come un metodo diretto come l'uso di radioisotopi. Tuttavia, a seconda dello ione di interesse, esaminando fluorescenza è un'opzione molto più pratico quando considerando sia limitazioni finanziarie e relative alla sicurezza insiti nell'uso di radioisotopi. Così, le metodologie descritte in questo manoscritto forniscono approccio nuovo e coerentees per meglio polarità membrana studio, l'integrità e eventi di trasporto e nei sistemi batterici.
Divulgazioni
Gli autori non hanno concorrenti interessi finanziari da dichiarare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Fondazione Bill e Melinda (Grant 53.085), la Fondazione JR Oishei, e The American Lung Association (Grant RG-123721-N) per APH, e NIH (NIDCD) borsa di studio F31DC011218 di EAC.
Materiali
| Name | Company | Catalog Number | Comments |
| Todd-Hewitt broth | Bacto, BD Diagnostics | 249240 | |
| Yeast Extract | Bacto, BD Diagnostics | 212750 | |
| Phosphate Buffered Saline (PBS; pH 7.2) | Invitrogen (GIBCO) | ||
| Dimethyl sulfoxide | Sigma-Aldrich | D5879 | DMSO |
| DiBAC4(3) (bis-(1,3-dibutylbarbituric acid) trimethine oxonol) | Molecular Probes | B-438 | |
| Propidium Iodide | Sigma-Aldrich | P4170 | Make up in deionized water |
| D-(+)-Glucose | Sigma-Aldrich | ||
| PowerLoad | Molecular Probes | P10020 | 100x concentrate |
| Probenecid | Molecular Probes | P36400 | Make 100x stock by adding 1 ml of PBS to one 77 mg vial |
| Fura-2/AM | Molecular Probes | F1221 | Special packaging (50 µg aliquots) |
| PBFI/AM | Molecular Probes | P1267 | Special packaging (50 µg aliquots) |
| Nigericin | Sigma-Aldrich | N7143 | |
| KH2PO4 | JT Baker | 3246-01 | monobasic |
| NaOH | JT Baker | 5565-01 | |
| K2HPO4 | JT Baker | 4012-01 | dibasic |
| BCECF/AM | Molecular Probes | B1170 | Special packaging (50 µg aliquots) |
| CCCP | Sigma-Aldrich | Protonophore that causes an influx of H+ into the cytoplasm, dissipating the electrical potential and the H+ gradient. | |
| Culture tube | VWR | 53283-802 | Fits the Spectronic spectrophotometer; borosilicate glass |
| Spectrophotometer | Thermo Scientific | Spectronic 20D+ | |
| 15 ml Plastic conical tube | Corning | 430790 | |
| Clear 96-well polystyrene microtiter plate | Fisher Scientific | 12-565-501 | |
| Plate reader | BioTek | Synergy 2 Multi-Mode | |
| Gen5 software | BioTek | Gen5™ Software |
Riferimenti
- Hakansson, A., Zhivotovsky, B., Orrenius, S., Sabharwal, H., Svanborg, C. Apoptosis induced by a human milk protein. Proc. Natl. Acad. Sci. U.S.A. 92 (17), 8064-8068 (1995).
- Hakansson, A., et al. A folding variant of alpha-lactalbumin with bactericidal activity against Streptococcus pneumoniae. Mol. Microbiol. 35 (3), 589-600 (2000).
- Hakansson, A. P., Roche-Hakansson, H., Mossberg, A. K., Svanborg, C. Apoptosis-Like Death in Bacteria Induced by HAMLET, a Human Milk Lipid-Protein Complex. PLoS One. 6 (3), (2011).
- Kohler, C., Gogvadze, V., Hakansson, A., Svanborg, C., Orrenius, S., Zhivotovsky, B. A folding variant of human alpha-lactalbumin induces mitochondrial permeability transition in isolated mitochondria. Eur. J. Biochem. 268 (1), 186-191 (2001).
- Ly, J. D., Grubb, D. R., Lawen, A. The mitochondrial membrane potential (Δψ m) in apoptosis; an update. Apoptosis. 8 (2), 115-128 (2003).
- Dominguez, D. C. Calcium signalling in bacteria. Mol. Microbiol. 54 (2), 291-297 (2004).
- Corratge-Faillie, C., Jabnoune, M., Zimmermann, S., Very, A. A., Fizames, C., Sentenac, H. Potassium and sodium transport in non-animal cells: the Trk/Ktr/HKT transporter family. Cell Mol. Life Sci. 67 (15), 2511-2532 (2010).
- Szabo, I., Petronilli, V., Zoratti, M. A patch-clamp study of Bacillus subtilis. Biochim. Biophys. Acta. 1112 (1), 29-38 (1992).
- Zoratti, M., Petronilli, V., Szabo, I. Stretch-activated composite ion channels in Bacillus subtilis. Biochem. Biophys. Res. Commun. 168 (2), 443-450 (1990).
- Novo, D., Perlmutter, N. G., Hunt, R. H., Shapiro, H. M. Accurate flow cytometric membrane potential measurement in bacteria using diethyloxacarbocyanine and a ratiometric technique. Cytometry. 35 (1), 55-63 (1999).
- Novo, D. J., Perlmutter, N. G., Hunt, R. H., Shapiro, H. M. Multiparameter flow cytometric analysis of antibiotic effects on membrane potential, membrane permeability, and bacterial counts of Staphylococcus aureus and Micrococcus luteus. Antimicrob. Agents Chemother. 44 (4), 827-834 (2000).
- Shapiro, H. M. Membrane potential estimation by flow cytometry. Methods. 21 (3), 271-279 (2000).
- Shapiro, H. M. Microbial analysis at the single-cell level: tasks and techniques. J. Microbiol. Methods. 42 (1), 3-16 (2000).
- Bashford, C. L., Chance, B., Smith, J. C., Yoshida, T. The behavior of oxonol dyes in phospholipid dispersions. Biophys. J. 25 (1), 63-85 (1979).
- Suzuki, H., Wang, Z. -Y., Yamakoshi, M., Kobayashi, M., Nozawa, T. Probing the transmembrane potential of bacterial cells by voltage-sensitive dyes. Anal. Sci. 19 (9), 1239-1242 (2003).
- Breeuwer, P., Abee, T. Assessment of the membrane potential, intracellular pH and respiration of bacteria employing fluorescence techniques. Mol. Microb. Ecol. Manual. 8, 1563-1580 (2004).
- Mortimer, F. C., Mason, D. J., Gant, V. A. Flow cytometric monitoring of antibiotic-induced injury in Escherichia coli using cell-impermeant fluorescent probes. Antimicrob. Agents Chemother. 44 (3), 676-681 (2000).
- Clementi, E. A., Marks, L. R., Duffey, M. E., Hakansson, A. P. A Novel Initiation Mechanism of Death in Streptococcus pneumoniae Induced by the Human Milk Protein-Lipid Complex HAMLET and Activated during Physiological Death. J. Biol. Chem. 287 (32), 27168-27182 (2012).
- Trombe, M. C., Laneelle, G., Sicard, A. M. Characterization of a Streptococcus pneumoniae mutant with altered electric transmembrane potential. J. Bacteriol. 158 (3), 1109-1114 (1984).
- Trombe, M. C. Characterization of a calcium porter of Streptococcus pneumoniae involved in calcium regulation of growth and competence. J. Gen. Microbiol. 139 (3), 433-439 (1993).
- Marks, L. R., Clementi, E. A., Hakansson, A. P. Sensitization of Staphylococcus aureus to Methicillin and Other Antibiotics In Vitro and In Vivo in the Presence of HAMLET. PLoS ONE. 8 (5), (2013).
- Futsaether, C. M., Johnsson, A. Using fura-2 to measure intracellular free calcium in Propionibacterium acnes. Can. J. Microbiol. 40 (6), 439-445 (1994).
- Tisa, L. S., Adler, J. Chemotactic properties of Escherichia coli mutants having abnormal Ca2+ content. J. Bacteriol. 177 (24), 7112-7118 (1995).
- Werthen, M., Lundgren, T. Intracellular Ca2+ mobilization and kinase activity during acylated homoserine lactone-dependent quorum sensing in Serratia liquefaciens. J. Biol. Chem. 276 (9), 6468-6472 (2001).
- Avery, O. T., MacLeod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types. Induction of transformation by a dexoxyribonuceic acid fraction isolated from pneumococcus type III. J. Exp. Med. 79, 137-158 (1944).
- Clementi, E. A., Wilhelm, K. R., Schleucher, J., Morozova-Roche, L. A., Hakansson, A. P. A Complex of Equine Lysozyme and Oleic Acid with Bactericidal Activity against. PLoS One. . 8, (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon