Method Article
Vigilar los cambios en la polaridad de la membrana, membrana Integridad, e intracelular de iones concentraciones en
* Estos autores han contribuido por igual
En este artículo
Resumen
A diferencia de la observada para eucariotas, hay una escasez de estudios que despolarización detalle de la membrana y la concentración de iones cambios en las bacterias, principalmente como su pequeño tamaño hace que los métodos convencionales de medición de difícil. En este sentido, los protocolos de detalle para el seguimiento de estos eventos en el Gram-positivas patógeno significativo Streptococcus pneumoniae utilizando técnicas de fluorescencia.
Resumen
Despolarización de la membrana y de iones flujos son eventos que han sido estudiados ampliamente en los sistemas biológicos debido a su capacidad para afectar profundamente las funciones celulares, incluyendo la energética y transducciones de señal. Aunque ambos métodos fluorescentes y electrofisiológicos, que incluyen el uso de electrodo y el parche de sujeción-, han sido bien desarrollado para la medición de estos eventos en células eucariotas, la metodología para la medición de eventos similares en microorganismos han demostrado ser más difícil de desarrollar dado su pequeño tamaño en combinación con el más complejo la superficie externa de las bacterias de blindaje de la membrana. Durante nuestros estudios de la muerte a la iniciación en el Streptococcus pneumoniae (neumococo), hemos querido dilucidar el papel de los eventos de membrana, incluidos los cambios en la polaridad, la integridad, y las concentraciones de iones intracelulares. Buscando en la literatura, encontramos que existen muy pocos estudios. Otros investigadores habían supervisado la captación de radioisótopos o de equilibrio para medir la gripe ionxes y potencial de membrana y un número limitado de estudios, en su mayoría en los organismos Gram-negativos, habían visto un cierto éxito utilizando carbocianina o oxonol tintes fluorescentes para medir el potencial de membrana, o la carga de bacterias con acetoximetil-célula permeable (AM) versiones de ésteres de sensible a los iones colorantes indicadores fluorescentes. Por lo tanto, establecimos y optimizado los protocolos para medir el potencial de membrana, ruptura, y el transporte de iones en el organismo Gram-positiva S. pneumoniae. Hemos desarrollado protocolos utilizando el colorante de bis-oxonol DiBAC 4 (3) y el yoduro de propidio tinte-células impermeable para medir la despolarización de la membrana y ruptura, respectivamente, así como los métodos para cargar de manera óptima los neumococos con los ésteres de AM de los colorantes ratiometric Fura-2, PBFI, y BCECF para detectar cambios en las concentraciones intracelulares de Ca 2 +, K +, y H +, respectivamente, utilizando un lector de placas de detección de fluorescencia. Estos protocolos son los primeros de su tipo para el neumococoy la mayoría de estos tintes no se han utilizado en otras especies bacterianas. Aunque nuestros protocolos han sido optimizados para S. pneumoniae, creemos que estos enfoques deben ser un excelente punto de partida para estudios similares en otras especies bacterianas.
Introducción
Nuestro laboratorio ha identificado un complejo de lípido-proteína de la leche humana llamada Hamlet (para la alfa-lactoalbúmina Hecho letal para las células tumorales) que induce la apoptosis en las células tumorales, sino que también es capaz de matar a una variedad de especies bacterianas 1,2. Las especies que se han encontrado para ser particularmente sensibles fueron aquellos que se dirigen a las vías respiratorias, con Streptococcus pneumoniae (neumococo) que muestra la mayor sensibilidad y un fenotipo de apoptosis como de la muerte 2,3. Eventos de transporte despolarización de la membrana y de iones específicos son bien descritos y acontecimientos cruciales durante la apoptosis en células eucariotas, en particular en las mitocondrias, donde se han utilizado radiactivos TPP + iones y colorantes fluorescentes como JC-1 y TMRE para demostrar la despolarización de la membrana mitocondrial 3 -5. Por lo tanto, tratamos de obtener más información sobre el efecto de la aldea en estas funciones relacionadas con la membrana en el neumococo como nos hemos centrado nuestros esfuerzos paradesarrollar una mejor comprensión de los componentes mecánicos del fenotipo de la apoptosis como en las bacterias, con un gran potencial para la identificación de nuevas terapias antibacterianas o vacunas candidatas en el proceso.
Al tratar de establecer protocolos para nuestros estudios sobre el mecanismo, hemos descubierto que, en contraste con la metodología bien descrita en los sistemas eucariotas, existen muy pocos estudios publicados que detallan los mecanismos de electrofisiología y de transporte de iones del 6,7 membrana bacteriana. Esto se atribuye principalmente al menor tamaño de los microorganismos y su arquitectura de la superficie, en particular la presencia de la pared celular, que restringe la accesibilidad de la membrana para el uso de métodos convencionales como eucariotas patch clamp, aunque algunos estudios utilizando protoplastos gigantes se han realizado con éxito mixto 8,9. Como el trabajo con estos protoplastos gigantes no es un método ideal o incluso práctico para la mayoría de especies bacterianas, ya que requiere que el hombrebacterias ipulated en un estado antinatural y abiótico, los estudios limitados de la polaridad de la membrana bacteriana que se han realizado han empleado principalmente citometría de flujo y el uso de cianina y oxonol colorantes fluorescentes 10-16.
En lugar de la citometría de flujo, que recoge lecturas de fluorescencia individuales de una bacteria a un solo punto de tiempo, se optó por utilizar un lector de placas de detección de fluorescencia para detectar la intensidad de fluorescencia de las suspensiones bacterianas en un formato de placa de 96 pocillos con el tiempo. Esto nos permitió para tratar una población de bacterias en diversos puntos temporales con mucha mayor simplicidad y facilidad, y supervisar continuamente la cinética de fluorescencia de toda la población durante largos períodos de tiempo, lo cual es difícil de lograr usando citometría de flujo. Después de probar una amplia variedad de los colorantes fluorescentes de potencial sensible (incluyendo los mencionados anteriormente para su uso con la mitocondria), hemos logrado el mejor éxito técnico y práctico utilizando latinte bis-oxonol llamado DiBAC 4 (3) (bis-(ácido 1,3-dibutylbarbituric) oxonol trimetina) para monitorear los cambios en la polaridad.
También nos pareció valioso para supervisar simultáneamente las interrupciones en la integridad de la membrana utilizando yoduro de propidio (PI). Este colorante emite fluorescencia al unirse al ácido nucleico, pero sólo es capaz de hacerlo cuando está en peligro la integridad de la membrana bacteriana, por lo que es el componente popular que se usa para detectar células muertas en los ensayos de tinción vivos muertos. Además de PI, SYTOX verde y TO-PRO-1 son colorantes fluorescentes que son similares en la acción y se han utilizado previamente para las bacterias en unos pocos estudios de citometría de flujo utilizando métodos de detección 17. Hemos elegido utilizar PI debido a su longitud de onda de excitación que nos permitió monitorear su fluorescencia simultáneamente con DiBAC en una muestra dada.
En nuestros estudios, hemos observado que Hamlet, así como otro complejo lípido-proteína relacionada con la actividad bactericidaconocido como ELOA, la despolarización inducida y de la ruptura de la membrana bacteriana como se indica por el aumento de la fluorescencia de ambos colorantes tras el tratamiento de los neumococos 3,18,26. Para ambos complejos, se observó que la intensidad de fluorescencia de DiBAC 4 (3) aumentó antes del aumento en la intensidad de la PI, lo que indica que la despolarización se produjo antes de la ruptura y es, por lo tanto, un evento específico inducido por nuestros complejos lípido-proteína de bactericidas interés. Esta distinción es importante hacer, como la ruptura de la membrana puede causar en sí despolarización inespecífica. Cinética de la medición y análisis tanto DiBAC 4 (3) y de fluorescencia PI simultáneamente nos permitió examinar esta relación entre los dos eventos de membrana, lo cual es una ventaja adicional del uso de fluorometría lugar de la citometría de flujo.
Para controlar el flujo de iones bacteriana, ha habido cierto éxito anterior con el uso de radioisótopos, incluyendo la medición de la absorción de45 Ca 2 + en el neumococo 19,20, lo que también hemos utilizado en nuestros estudios recientes 18, 21. Sin embargo, el trabajo con estos iones radiactivos tiene varios inconvenientes. Pueden ser costoso, consume tiempo, y desordenado, y también puede exponer a la persona que realiza el experimento para dañar, dependiendo del isótopo de interés. Además, es difícil controlar los cambios rápidos en el tiempo. Por lo tanto, se volvió hacia un método alternativo de medición que emplea versiones acetoximetilo (AM) de éster de indicador fluorescente colorantes sensibles a iones. Por sí mismo, el colorante indicador está cargado y no pasa a través de la membrana fácilmente, pero con la adición del grupo éster lipófilo, la molécula no cargada ahora puede pasar a través de la membrana de la bacteria. Al entrar en el interior, las esterasas bacterianas escindir el grupo éster, dejando el colorante libre dentro de la célula y otra vez cargada, ralentizando significativamente su capacidad para salir de la celda y permitir que el tinte to se acumulan en el interior a través del tiempo. Sin embargo, el uso de estos colorantes de éster sólo se ha descrito en unas pocas especies bacterianas para detectar cambios en el Ca2 + intracelular 22-24 y H + 16, con diferentes métodos de carga, la detección, y el éxito.
Con el deseo de controlar los cambios en intracelulares de Ca 2 + y también los niveles de K + y H + en S. pneumoniae tras el tratamiento con Hamlet y otros compuestos, que creado con éxito protocolos para cargar de manera eficiente colorantes indicadores fluorescentes en las células bacterianas. Carga eficaz en bacterias necesarias tanto probenecid que aumenta la retención de colorante mediante el bloqueo de los transportadores aniónicos y PowerLoad, un compuesto patentado de Life Technologies que aumenta la eficiencia de carga. Fura-2/AM (detección de Ca 2 +), PBFI / AM (detección de K +), y BCECF / AM (detección de H +) se cargaron con éxito en tanto no encapsulado y encapsulado neumocócica stlluvias que permiten la medición de los patrones de fluorescencia resultantes después de la adición de ionóforos, tales como ionomicina (Ca 2 + desacoplador), valinomicina (K + desacoplador) y CCCP (H + desacoplador) usando un lector de placas de detección de fluorescencia 18, 21.
Protocolo
1. Preparación de los cultivos bacterianos
- Creciendo cultura para su uso en experimentos
- En un bloque de calentamiento de 37 ° C, descongelar una congelados en acciones vial de S. pneumoniae y añadir su contenido a 9 ml de fresco, precalentado caldo de Todd-Hewitt con extracto de levadura al 0,5% (TU) para un volumen total de 10 ml en un tubo de cultivo de vidrio.
- Incubar estáticamente a 37 ° C hasta que el cultivo alcanzó la fase semilogarítmica (600nm Abs ≈ 0,5-0,6).
2. La detección de despolarización de la membrana y la Ruptura
- Reactivos Preparación
- Preparar un balance de 50 M DiBAC 4 (3) en DMSO al 100% y un mg / ml 2 del PI en ddH 2 O. El DiBAC 4 (3) de valores es estable a -20 ° C durante al menos 6 meses. El stock de PI es estable a 4 ° C durante al menos 6 meses.
- Envuelva las existencias en papel de aluminio para protegerlo de la luz.
- Loadingbacterias
- Sedimentar las células bacterianas de la etapa 1.2.2 por centrifugación a 2400 xg durante 10 min a temperatura ambiente y lavar dos veces por eliminar el sobrenadante, resuspender el precipitado en 10 ml de 1x solución salina tamponada con fosfato (PBS), y se centrifuga de nuevo a 2400 xg durante 10 min.
- Eliminar el sobrenadante y resuspender el sedimento en PBS hasta el volumen original. Esto proporcionará aproximadamente 10 8 unidades formadoras de colonias de bacterias por ml. Retire 1 ml (suficiente para 5 muestras) de las células lavadas y colocarlo en un tubo de microcentrífuga.
- Para estas células, añadir 25 l de una solución 1 M esterilizada por filtración de stock de glucosa (preparado en ddH2O y se filtró a través de un filtro de 0,45 micras) para una concentración final de 25 mM de glucosa, y se incuban en un bloque de calentamiento 37 ° C durante quince minutos. NOTA: Esto proporciona la energía para todos los canales de la membrana dependientes de ATP y componentes celulares. La necesidad de este paso puede variar, dependiendo del experimento.
- Añadir 5 l de la (3) stock 50 mM DiBAC 4 y 10 l de la población de 2 mg / ml PI. Esto proporciona para concentraciones finales de 250 nM y 20 g / ml, respectivamente. Mezcle bien con la pipeta hacia arriba y abajo varias veces. Añadir 200 l de esta suspensión celular a cada pocillo de muestra de una placa de 96 pocillos clara.
- La detección de la fluorescencia
- Colocar la placa en un (37 ° C) lector de placas de detección de fluorescencia precalentado.
- Asegúrese de que los filtros adecuados estén en su lugar para DiBAC 4 (3) (490 nm de excitación, 516 nm de emisión) y PI (535 nm de excitación, 617 nm de emisión) de detección.
- Para tener en cuenta (y al mismo tiempo vigilar) equilibrio de DiBAC 4 (3) a través de la membrana, establezca el lector a tomar medidas de fluorescencia cada minuto durante aproximadamente 30-40 minutos, o hasta que la lectura se estabilice, lo que sirve como una lectura "pretratamiento".
- Expulsar plato y añadir el agente experimental de elección y immedcolocar iately la placa posterior en el lector para continuar el seguimiento de DiBAC 4 (3) y la fluorescencia PI para el período de tiempo deseado. Si el tratamiento de varias muestras a la vez, usando una pipeta multicanal puede ser útil añadir el agente de forma simultánea a todos los pocillos.
- Exportar las lecturas a un programa de análisis de datos, como Microsoft Excel. Parcela fluorescencia con el tiempo para evaluar despolarización de la membrana y ruptura. El aumento de la fluorescencia de DiBAC y PI indica que la despolarización y la ruptura se están produciendo.
3. Detectar cambios en intracelulares de Ca 2 + o K + Concentraciones
- Preparar reactivos y tampón de carga
- Preparar los siguientes reactivos: 5 mM de stock del tinte fluorescente sensible a iones (fura-2/AM o PBFI / AM; añadir la cantidad apropiada de DMSO a un tubo que contiene 50 g del colorante), "100x" probenecid (añadir 1 ml de PBS a un vial de 77 mg). El solubilizadocolorantes pueden congelarse a -20 ° C una vez y son estables en solución durante 3 meses, mientras que el probenecid es estable en solución a -20 ° C durante 6 meses.
- Preparar 1 ml de 2x tampón de carga de la siguiente manera: En la parte inferior de un tubo cónico de plástico de 15 ml, dispensar 20 l de 100x PowerLoad concentrado (estables a 2-8 ° C durante 6 meses), seguido de 2 l de 5 mM de ion sensibles de tinte directamente en el PowerLoad. Vortex brevemente para mezclar. Añadir 960 l de PBS seguido de 20 l de 100x probenecid. Agite la mezcla por última vez. Envuelva en papel de aluminio para protegerlo de la luz.
- Colocación de las bacterias con el tinte
- Se precipitan y se lava el cultivo bacteriano en fase logarítmica media como se describe en 2.2.1. Aspirar el sobrenadante y pellet se resuspende en 5 ml de PBS para hacer una "2x" suspensión celular.
- Añadir 1 ml de la suspensión celular a la 2x 2x tampón de carga de. Esto proporcionará para un volumen final de 2 ml, y Concentr definitivaciones de 1x PowerLoad, 5 mM colorante fluorescente, y 1x probenecid. NOTA: Esta suspensión proporciona un volumen suficiente para 10 muestras desde cada pocillo de la muestra para la medición contendrá 200 l.
- Incubar en un 37 ° C baño de agua durante 75 min, protegido de la luz. NOTA: El colorante se carga en las células bacterianas en ausencia de cualquier sustratos glicolíticas y en presencia de probenecid para reducir al mínimo flujo de salida del colorante.
- LAVADO 1: sedimentar las células por centrifugación a 2400 xg durante 10 min, eliminar el sobrenadante, y se resuspende en 2 ml de PBS que contenía probenecid 1x. LAVADO 2, 3: Repita el paso 3.2.4 2x. Incubar a 37 ° C durante otros 30 min. Esto le dará tiempo para esterasas bacterianas para hidrolizar el grupo éster AM lejos de los tintes fluorescentes internalizados.
- LAVADO 4: sedimentar las células por centrifugación a 2400 xg durante 10 min, eliminar el sobrenadante, y se resuspende en 2 ml de PBS que contenía probenecid 1x. NOTA: Dependiendo del experiment, la glucosa se puede agregar de nuevo aquí para revitalizar las bacterias.
- La detección de la fluorescencia
- Precalentar la detección por fluorescencia lector de placas de lector de placas a 37 ° C.
- Para cada muestra se desea, añadir 200 l de las células cargadas (de la etapa 3.2.8) a los pocillos de una placa de 96 pocillos. (Lleve a cabo los siguientes pasos para la finalización de un pozo / muestra a la vez).
- Establecer una línea de base para la lectura de un pozo, lugar de placa en la detección de fluorescencia lector de placas para medir la fluorescencia (340 nm de excitación / emisión de 510 nm para "Valor 1" y 380 nm de excitación / emisión de 510 nm para "Valor 2") en cada segundo durante un minuto.
- Expulsar plato, añadir el tratamiento de elección para que así (en un pequeño volumen de aproximadamente 5 l), pipetear rápidamente arriba y abajo varias veces para mezclar y colocar inmediatamente de nuevo en la detección de fluorescencia lector de placas para leer cada segundo durante deseada longitud de tiempo. (Si el eninyectores asociados con el lector de placas están disponibles, estos también podrían utilizarse para añadir a la perfección el tratamiento deseado, la eliminación de la necesidad de detener la lectura y expulsar la placa).
- Exportar las lecturas a un programa de análisis de datos, como Microsoft Excel. Calcular la relación entre los valores de fluorescencia para cada punto de tiempo dividiendo Valor 1 Valor por 2, y representar los valores de la relación en un gráfico.
4. Detectar cambios en el pH intracelular
- Preparar reactivos y tampones de calibración
- Prepare los siguientes reactivos: mM almacén 5 de BCECF / AM (. Añadir la cantidad apropiada de DMSO a un tubo que contiene 50 g del colorante Esta población es estable a -20 ° C durante 3 meses); 100x probenecid (añadir 1 ml de PBS a un vial de 77 mg);. 1 mM de preparación de stock de nigericina en etanol (requerido para equilibrar el pH intracelular (pH i) de las células a la pH del tampón circundante Esta acción es stabla a -20 ° C durante 6 meses);. mM del carbonilo cianuro de 3 clorofenilhidrazona (CCCP) en DMSO (protonóforo para desacoplar la fuerza motriz de protones 0,5 Esta población es estable a -20 ° C durante 6 meses)
- Prepare 10 ml de los siguientes tampones altos de potasio: NaOH 135 mM KH 2 PO 4/20 mM (monobásico) y 110 mM K 2 HPO mM NaOH 4/20 (dibásico). Filtro de esterilizar utilizando un filtro de 0,45 micras. (Estos tampones se pueden almacenar a 4 ° C hasta su uso).
- Mezclar los buffers altos de potasio en la proporción necesaria para crear buffers altos de potasio con al menos 5-6 valores de pH comprendidos entre 6,5 y 8,0.
- Preparar 1 ml de 2x tampón de carga de la siguiente manera: En la parte inferior de un tubo cónico de plástico de 15 ml, dispensar 40 l de 100x PowerLoad, seguido por 20 l de colorante sensible a iones, 5 mM directamente en el PowerLoad. Vortex brevemente para mezclar. Añadir 900 l de PBS seguido de 40 l de 100x probenecid. Vortex la mezcla por última vez. Envuelva en papel de aluminio para protegerlo de la luz.
- Colocación de las bacterias con el tinte
- Pellet y lavar las 8 ml del cultivo bacteriano fase semilogarítmica como se describe en el punto 2.2.1. Aspirar el sobrenadante, resuspender pellet en 2 ml de PBS para hacer una "4x" suspensión celular.
- Añadir 1 ml de la suspensión celular 4x a la 2x tampón de carga de. Esto proporcionará para un volumen final de 2 ml, y concentraciones finales de las células 2x, 2x PowerLoad, 50 mM colorante fluorescente, y 2x probenecid.
- Incubar en un 30 ° C baño de agua durante 40 min, protegido de la luz. NOTA: El colorante se carga en las células bacterianas a la temperatura inferior de 30 ° C y en ausencia de cualquier sustratos glicolíticas para reducir al mínimo flujo de salida del colorante.
- WASH 1: Pellet las células por centrifugación a 2400 xg durante 10 minutos, retire el sobrenadante para eliminar el exceso de tinte, y resuspender en 4 ml de PBS que contenía 2x probenecid unglucosa o 1 mM (para revitalizar las bacterias). LAVADO 2, 3: Repetir el paso 4.2.7 dos veces, con resuspensión final en 4 ml de PBS (para una concentración final de células de 1x) que contiene probenecid 2x y glucosa 10 mM.
- Incubar a 37 ° C durante 5 min. Esto permitirá que las células se energizan completamente y permiten tiempo para esterasas bacterianas para escindir el grupo éster de AM alejada del BCECF internalizado.
- El establecimiento de la fluorescencia de fondo y en la curva de calibración in vivo
- Precalentar la detección por fluorescencia lector de placas de lector de placas a 37 ° C.
- Para determinar la fluorescencia de fondo, filtro-esterilizar aproximadamente 500 l de la suspensión bacteriana cargado y lleno de energía (de la etapa 4.2.7) para eliminar las bacterias, y añadir 200 l de filtrado para el pocillo de la placa de 96 pocillos.
- Coloque la placa en la detección de fluorescencia lector de placas para medir la fluorescencia (490 nm de excitación / emisión de 530 nm para"Valor 1" y 440 nm de excitación / emisión de 530 nm para "Valor 2") durante 1 min. Esta fluorescencia de fondo se debe restar antes del cálculo de los ratios, tanto para la curva de calibración y las muestras experimentales.
- Para obtener una curva de calibración in vivo, lavar 500 ml de alícuotas de las células cargadas y con energía procedente de la etapa 4.2.7 una vez y resuspender en tampones altos de potasio a diferentes valores de pH (que van desde 6,5 hasta 8,0).
- Añadir 20 M nigericina a las muestras para equilibrar el pH intracelular de las células para el pH del tampón circundante y se incuba a 37 ° C durante 5 min. Añadir 200 l de combinaciones de tampones bacterias / pH a los pocillos de una placa de 96 pocillos.
- Coloque la placa en la detección de fluorescencia lector de placas para medir la fluorescencia durante unos minutos para establecer una lectura constante para cada pozo. Exportar las lecturas a un programa de análisis de datos, como Microsoft Excel.
- Después de restar la bavalores de fluorescencia ckground, calcular la relación de los valores de fluorescencia por dividir el valor 1 por valor 2. Grafica los valores de la relación de cada tampón de pH para crear la curva de calibración. (Una curva de calibración debe ser generado para cada nuevo lote de células cargadas, como la cantidad de colorante fluorescente que se carga en las bacterias puede variar cada vez).
- Medición de los cambios en el pH intracelular
- Para cada muestra se desea, añadir 200 l de las células cargadas y energizadas (desde el paso 4.2.7) a los pocillos de una placa de 96 pocillos.
- Coloque la placa en la detección de fluorescencia lector de placas y medir la fluorescencia de las muestras cada 5 s durante 5 min.
- Extraiga el plato y añadir 10 mM CCCP a un pocillo (sirve como control positivo de la disminución del pH intracelular) y el agente experimental (s) de interés para los demás pozos. Para comparar con precisión sus efectos en el tiempo, añadir el CCCP y agentes de elección al mismo tiempo utilizando ampipeta ultichannel.
- Devolver inmediatamente la placa al lector de placas y continuar midiendo la fluorescencia de cada 5 s durante 10 min. Como un control adicional, expulse la placa y añadir 20 mM Nigericina a todas las muestras para equilibrar el pH i de las bacterias al pH del tampón circundante, y leer durante 5 min.
- Después de restar los valores de fluorescencia de fondo, calcular los cocientes de fluorescencia para cada muestra. Interpolar el pH i para cada lectura de la curva de calibración.
Resultados
Para todos los experimentos, hay una muestra y conjunto de condiciones presentes en cada pocillo. Por lo tanto, cada rastreo representa la intensidad de fluorescencia de toda una población de bacterias en el tiempo. Los resultados deben ser fácilmente interpretables, con una clara distinción entre la fluorescencia de las muestras tratadas y la de los controles no tratados. La cinética y el grado de un cambio observado en la fluorescencia podrían proporcionar información sobre el posible mecanismo y la magnitud del evento que se supervisa.
Cuando la exploración de la polaridad de la membrana, las bacterias necesitan ser incubadas con DiBAC durante aproximadamente 40 min a permitir el equilibrio del colorante sobre la membrana, como se indica por la disminución constante y posterior nivelación de la fluorescencia en la Figura 1A antes del tratamiento. Como se demuestra en la Figura 1B, el PI no requiere de equilibrado, como su señal fluorescente es constante a lo largo de la primera 40 min de incubación, BUt su presencia junto con DiBAC es útil para vigilar la rotura de membranas simultáneamente con la polaridad. La despolarización y la ruptura de las bacterias se indica mediante un aumento de la intensidad de fluorescencia de ambos colorantes. Otros agentes capaces de despolarización y la ruptura, tales como detergentes desoxicolato de sodio (18), desacopladores, o ionóforos (CCCP), también se pueden añadir a demostrar estos eventos utilizando esta metodología.
Para fura-2/AM, PBFI / AM, y BCECF / AM, se calcula la relación de dos señales fluorescentes, y un aumento o disminución en esta relación corresponde a la intracelular de Ca 2 + (Figura 2), K + (Figura 3 ), y las concentraciones de H + (Figura 4), respectivamente. Tras la adición de ionomicina el ionóforo de calcio, Ca 2 + fluye en la célula causando un aumento en la proporción de fluorescencia (Figura 2). La adición de valinomicina tiene el efecto contrario, haciendo que K+ A fluir fuera de la célula y disminuir la concentración intracelular, que se indica por una disminución en la proporción de fluorescencia (Figura 3). BCECF permite la medición del pH intracelular mediante la creación primero una curva de calibración (Figura 4A) en presencia de diversos tampones de pH conocido. Una disminución en la proporción de fluorescencia del colorante corresponde a una disminución en el pH, como se ve después de la adición del CCCP o nigericina protonóforos, que se derrumba el gradiente de protones (Figura 4B).

Figura 1. Supervisión de perturbaciones de membrana. S. pneumoniae se incubó con (A) DiBAC y (B) PI simultáneamente durante 40 min para permitir el equilibrio de DiBAC sobre el membrane. Al final de esta incubación (flecha), (sin tratar) o HAMLET (tratado) se añadió PBS y las muestras fueron leídas durante una hora más. Haga clic aquí para ver la imagen más grande.

Figura 2. La detección de los cambios en los niveles de calcio intracelulares. S. pneumoniae se carga con fura-2/AM y tratado (flecha) con PBS (sin tratamiento) o el ionóforo de calcio ionomicina (control positivo). Se presenta la relación de los valores de fluorescencia. Haga clic aquí para ver la imagen más grande.

Figura 3. Detectar cambios en los niveles de potasio intracelular. S. pneumoniae se carga con PBFI / AM y tratado (flecha) con PBS (sin tratamiento) o la valinomicina ionóforo de potasio (control positivo). Se presenta la relación de los valores de fluorescencia. Haga clic aquí para ver la imagen más grande.
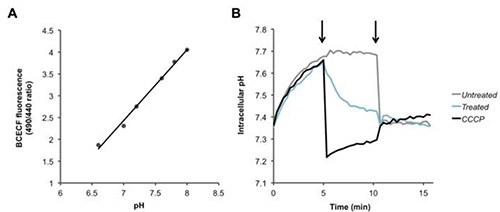
Figura 4. La detección de cambios en los niveles intracelulares de protones. (A) Curva estándar para la calibración pH intracelular. (B) Los neumococos se cargaron con el colorante sensible al pH BCECF-AM, y fueronlavaron y se resuspendieron en PBS + glucosa. Después de grabar las lecturas de línea de base, en la primera flecha, PBS (negro), el CCCP protonóforo (100 mM), o Hamlet (100 g / ml o 6 M), se añadieron a las bacterias y la fluorescencia se midió con el tiempo. En la segunda flecha nigericina (20 M) se añadió a disiparse por completo el gradiente de protones transmembrana de todas las muestras. Haga clic aquí para ver la imagen más grande.
Discusión
A pesar de la limitación de que el tamaño presenta para el uso de métodos clásicos de electrofisiología para detectar cambios en la polaridad y la integridad de la membrana y los cambios en las concentraciones de iones dentro de las bacterias, hemos descrito una forma de medir estos eventos en S. pneumoniae usando colorantes fluorescentes. Nuestros protocolos son los primeros de su tipo descrito para el neumococo y uno de los pocos que se ha descrito para especies bacterianas en general. Mediante el uso de un lector de placas de detección de fluorescencia, estos eventos se pueden medir en muestras pequeñas, 200 l de volumen de bacterias, con la fluorescencia detectada a partir de la población individual de bacterias con el tiempo. La cinética y los cambios en la intensidad de fluorescencia se pueden utilizar para determinar cualitativamente lo que está sucediendo a la membrana polaridad o la integridad, o los niveles de Ca2 +, K +, o H + dentro de las bacterias. En términos cuantitativos, los valores de intensidad de fluorescencia también se pueden utilizar para calcular el grado de DEPolarization, ruptura, la absorción de calcio, salida de potasio, o cambio de pH observados en una muestra en comparación con otro, proporcionando información crítica sobre un mecanismo de interés. Además, nuestro protocolo debe ser útil como punto de partida para la carga de otros tintes fluorescentes AM, lo que permite el estudio de una variedad de otros eventos celulares en una variedad de especies bacterianas. Ya hemos tenido éxito en la aplicación de algunos de estos protocolos en Staphylococcus aureus 21.
Cuando se usan los colorantes AM, amplio tiempo de incubación es importante para la carga de colorante y el logro de la posterior hidrólisis necesaria para el colorante para responder a los iones objetivo dentro de la bacteria y producir los correspondientes cambios de fluorescencia. La cinética de carga puede variar entre cepas bacterianas debido a varios factores, incluyendo diferencias en la arquitectura de la superficie bacteriana (presencia de la cápsula, fluidez de la membrana, la presencia de bombas de eflujo, etc.) Y en la estructura química of colorante. Para alcanzar la carga máxima para la cepa bacteriana y el colorante de interés, hay varios parámetros de nuestro protocolo que puede requerir la modulación incluyendo: la duración de incubación, temperatura de incubación, la disponibilidad de nutrientes, la concentración PowerLoad, y la concentración de probenecid. Para obtener una carga exitosa, intensidad de la señal de fluorescencia es menos importante que lo que demuestra que los controles positivos, como la adición de ionóforos, proporcionan una señal en dirección y / o mostrar la linealidad de la curva de calibración correcta. Para optimizar la carga de un aumento en PowerLoad y la concentración Probenicide seguido por un descenso de la temperatura para evitar la extrusión del colorante es preferible aumentar la concentración de colorante que puede resultar en la tinción extracelular que confundir la señal. Durante el desarrollo de nuestros protocolos, hemos sido capaces de cargar con éxito nuestros tintes de interés, tanto en el tipo salvaje encapsulado D39 cepa de neumococo y la cepa no encapsulada R36A 25.Sin embargo, hemos encontrado que podemos lograr de carga óptimo como se indica por las lecturas fluorescentes que conducen a un aumento de proporciones utilizando R36A para Fura-2 y PBFI experimentos con 37 ° C de temperatura de incubación, mientras que una temperatura de incubación inferior junto con concentraciones más altas probenecid PowerLoad y trabajó mejor para carga de BCECF en D39. Aunque la intensidad de la señal específica puede variar entre los experimentos, la naturaleza radiométrica de las mediciones proporcionan resultados con alta reproducibilidad y poco difundida.
Para las mediciones de fluorescencia de las muestras, el uso del software que acompaña a los lectores de placas más avanzadas permite ajustes de una variedad de parámetros de detección, como la velocidad de detección, la sensibilidad de detección, y leer duración, para nombrar unos pocos. Esto permite que el investigador para encontrar la sensibilidad óptima para la detección de la evento en particular que se está supervisando. Para la interpretación óptima de los resultados, es fundamental que las líneas de base estables de fluorEscence y estándar lineal curvas se establecen, ya que puede haber variaciones inter-ensayo en la cantidad de tinte que está presente, equilibrada sobre la membrana, o cargados en la bacteria y hidrolizados. Permitir que el tiempo para el tinte de equilibrado sobre la membrana bacteriana antes del tratamiento de cualquier tipo es particularmente crucial cuando se utiliza DiBAC 4 (3) para permitir un nivel de fluorescencia estabilizado antes del tratamiento. Además, incluyendo todos los controles adecuados en cada análisis individual es esencial para el análisis de datos precisa, como los aditivos experimentales que se introducen en la suspensión bacteriana a ensayar pueden ellos mismos autofluoresce en las longitudes de onda particulares de detección o pueden modificar la fluorescencia no específica de la indicador de tinte a través de interacciones directas.
Reconocemos algunas áreas potenciales de preocupación relacionados con los métodos que hemos descrito aquí. A diferencia del colorante de carbocianina DIOC 2 (3), DiBAC 4 (3) es un colorante bisoxonol que no es radiométrica, así que mientras el tinte carbocianina puede dar cuenta de los cambios en el volumen celular, DiBAC 4 (3) no pueden. Por lo tanto, puede haber cambios en el nivel de fluorescencia que corresponden a los cambios en el volumen celular. Nosotros, sin embargo, no se dio cuenta que se trata de un problema importante, ya que el neumococo tiene una pared celular rígida que no permite cambios significativos en el volumen sin ruptura de las bacterias. Para el examen de los flujos de iones bacterianas, la sensibilidad de los colorantes sensibles a iones puede variar en función del ión de interés y el grado de cambio en su concentración. Además, el uso de colorantes fluorescentes no es directa experimentalmente como un método como el uso de radioisótopos. Sin embargo, dependiendo del ión de interés, el examen de la fluorescencia es una opción mucho más práctico cuando se consideran tanto las limitaciones financieras y de seguridad implicados con el uso de radioisótopos. Por lo tanto, las metodologías descritas en este manuscrito proporcionan nueva y consistente enfoquees mejor a la polaridad de la membrana de estudio, la integridad, y los eventos de transporte y en los sistemas bacterianos.
Divulgaciones
Los autores no tienen intereses financieros en competencia para declarar.
Agradecimientos
Este trabajo fue apoyado por la Fundación Bill y Melinda Gates (Grant 53.085), la Fundación JR Oishei, y la Asociación Americana del Pulmón (Grant RG-123721-N) para APH, y NIH (NIDCD) Becas F31DC011218 a EAC.
Materiales
| Name | Company | Catalog Number | Comments |
| Todd-Hewitt broth | Bacto, BD Diagnostics | 249240 | |
| Yeast Extract | Bacto, BD Diagnostics | 212750 | |
| Phosphate Buffered Saline (PBS; pH 7.2) | Invitrogen (GIBCO) | ||
| Dimethyl sulfoxide | Sigma-Aldrich | D5879 | DMSO |
| DiBAC4(3) (bis-(1,3-dibutylbarbituric acid) trimethine oxonol) | Molecular Probes | B-438 | |
| Propidium Iodide | Sigma-Aldrich | P4170 | Make up in deionized water |
| D-(+)-Glucose | Sigma-Aldrich | ||
| PowerLoad | Molecular Probes | P10020 | 100x concentrate |
| Probenecid | Molecular Probes | P36400 | Make 100x stock by adding 1 ml of PBS to one 77 mg vial |
| Fura-2/AM | Molecular Probes | F1221 | Special packaging (50 µg aliquots) |
| PBFI/AM | Molecular Probes | P1267 | Special packaging (50 µg aliquots) |
| Nigericin | Sigma-Aldrich | N7143 | |
| KH2PO4 | JT Baker | 3246-01 | monobasic |
| NaOH | JT Baker | 5565-01 | |
| K2HPO4 | JT Baker | 4012-01 | dibasic |
| BCECF/AM | Molecular Probes | B1170 | Special packaging (50 µg aliquots) |
| CCCP | Sigma-Aldrich | Protonophore that causes an influx of H+ into the cytoplasm, dissipating the electrical potential and the H+ gradient. | |
| Culture tube | VWR | 53283-802 | Fits the Spectronic spectrophotometer; borosilicate glass |
| Spectrophotometer | Thermo Scientific | Spectronic 20D+ | |
| 15 ml Plastic conical tube | Corning | 430790 | |
| Clear 96-well polystyrene microtiter plate | Fisher Scientific | 12-565-501 | |
| Plate reader | BioTek | Synergy 2 Multi-Mode | |
| Gen5 software | BioTek | Gen5™ Software |
Referencias
- Hakansson, A., Zhivotovsky, B., Orrenius, S., Sabharwal, H., Svanborg, C. Apoptosis induced by a human milk protein. Proc. Natl. Acad. Sci. U.S.A. 92 (17), 8064-8068 (1995).
- Hakansson, A., et al. A folding variant of alpha-lactalbumin with bactericidal activity against Streptococcus pneumoniae. Mol. Microbiol. 35 (3), 589-600 (2000).
- Hakansson, A. P., Roche-Hakansson, H., Mossberg, A. K., Svanborg, C. Apoptosis-Like Death in Bacteria Induced by HAMLET, a Human Milk Lipid-Protein Complex. PLoS One. 6 (3), (2011).
- Kohler, C., Gogvadze, V., Hakansson, A., Svanborg, C., Orrenius, S., Zhivotovsky, B. A folding variant of human alpha-lactalbumin induces mitochondrial permeability transition in isolated mitochondria. Eur. J. Biochem. 268 (1), 186-191 (2001).
- Ly, J. D., Grubb, D. R., Lawen, A. The mitochondrial membrane potential (Δψ m) in apoptosis; an update. Apoptosis. 8 (2), 115-128 (2003).
- Dominguez, D. C. Calcium signalling in bacteria. Mol. Microbiol. 54 (2), 291-297 (2004).
- Corratge-Faillie, C., Jabnoune, M., Zimmermann, S., Very, A. A., Fizames, C., Sentenac, H. Potassium and sodium transport in non-animal cells: the Trk/Ktr/HKT transporter family. Cell Mol. Life Sci. 67 (15), 2511-2532 (2010).
- Szabo, I., Petronilli, V., Zoratti, M. A patch-clamp study of Bacillus subtilis. Biochim. Biophys. Acta. 1112 (1), 29-38 (1992).
- Zoratti, M., Petronilli, V., Szabo, I. Stretch-activated composite ion channels in Bacillus subtilis. Biochem. Biophys. Res. Commun. 168 (2), 443-450 (1990).
- Novo, D., Perlmutter, N. G., Hunt, R. H., Shapiro, H. M. Accurate flow cytometric membrane potential measurement in bacteria using diethyloxacarbocyanine and a ratiometric technique. Cytometry. 35 (1), 55-63 (1999).
- Novo, D. J., Perlmutter, N. G., Hunt, R. H., Shapiro, H. M. Multiparameter flow cytometric analysis of antibiotic effects on membrane potential, membrane permeability, and bacterial counts of Staphylococcus aureus and Micrococcus luteus. Antimicrob. Agents Chemother. 44 (4), 827-834 (2000).
- Shapiro, H. M. Membrane potential estimation by flow cytometry. Methods. 21 (3), 271-279 (2000).
- Shapiro, H. M. Microbial analysis at the single-cell level: tasks and techniques. J. Microbiol. Methods. 42 (1), 3-16 (2000).
- Bashford, C. L., Chance, B., Smith, J. C., Yoshida, T. The behavior of oxonol dyes in phospholipid dispersions. Biophys. J. 25 (1), 63-85 (1979).
- Suzuki, H., Wang, Z. -. Y., Yamakoshi, M., Kobayashi, M., Nozawa, T. Probing the transmembrane potential of bacterial cells by voltage-sensitive dyes. Anal. Sci. 19 (9), 1239-1242 (2003).
- Breeuwer, P., Abee, T. Assessment of the membrane potential, intracellular pH and respiration of bacteria employing fluorescence techniques. Mol. Microb. Ecol. Manual. 8, 1563-1580 (2004).
- Mortimer, F. C., Mason, D. J., Gant, V. A. Flow cytometric monitoring of antibiotic-induced injury in Escherichia coli using cell-impermeant fluorescent probes. Antimicrob. Agents Chemother. 44 (3), 676-681 (2000).
- Clementi, E. A., Marks, L. R., Duffey, M. E., Hakansson, A. P. A Novel Initiation Mechanism of Death in Streptococcus pneumoniae Induced by the Human Milk Protein-Lipid Complex HAMLET and Activated during Physiological Death. J. Biol. Chem. 287 (32), 27168-27182 (2012).
- Trombe, M. C., Laneelle, G., Sicard, A. M. Characterization of a Streptococcus pneumoniae mutant with altered electric transmembrane potential. J. Bacteriol. 158 (3), 1109-1114 (1984).
- Trombe, M. C. Characterization of a calcium porter of Streptococcus pneumoniae involved in calcium regulation of growth and competence. J. Gen. Microbiol. 139 (3), 433-439 (1993).
- Marks, L. R., Clementi, E. A., Hakansson, A. P. Sensitization of Staphylococcus aureus to Methicillin and Other Antibiotics In Vitro and In Vivo in the Presence of HAMLET. PLoS ONE. 8 (5), (2013).
- Futsaether, C. M., Johnsson, A. Using fura-2 to measure intracellular free calcium in Propionibacterium acnes. Can. J. Microbiol. 40 (6), 439-445 (1994).
- Tisa, L. S., Adler, J. Chemotactic properties of Escherichia coli mutants having abnormal Ca2+ content. J. Bacteriol. 177 (24), 7112-7118 (1995).
- Werthen, M., Lundgren, T. Intracellular Ca2+ mobilization and kinase activity during acylated homoserine lactone-dependent quorum sensing in Serratia liquefaciens. J. Biol. Chem. 276 (9), 6468-6472 (2001).
- Avery, O. T., MacLeod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types. Induction of transformation by a dexoxyribonuceic acid fraction isolated from pneumococcus type III. J. Exp. Med. 79, 137-158 (1944).
- Clementi, E. A., Wilhelm, K. R., Schleucher, J., Morozova-Roche, L. A., Hakansson, A. P. A Complex of Equine Lysozyme and Oleic Acid with Bactericidal Activity against. PLoS One. . 8, (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados