Method Article
STA-PUT Hız Sedimentasyon kullanma spermatogenic Hücre Tiplerinin Ayrılması
Bu Makalede
Özet
STA-PUT yöntem büyüklüğü ve yoğunluğuna bağlı olarak spermatojenik farklı hücre popülasyonlarının ayrılması sağlar.
Özet
Memeli spermatogenezis testislerin seminifer tübüllerde çeşitli aşamalardan oluşan karmaşık bir farklılaşma süreçtir. Şu anda, in vitro spermatojenik farklılaşması için izin veren güvenilir bir hücre kültür sistemi olup, spermatojenik hücrelerin çoğunun biyolojik çalışmalar, fare ve sıçan gibi hayvan modellerinde doku hasat gerektirir. Non-spermatojenik (Leydig, sertoli, miyeloid ve epitel hücreleri) ve spermatogenetik hem (spermatogonium spermatositler, yuvarlak spermatidlerin, spermatidlerin ve sperm yoğuşmalı) - - testis sayıda hücre tiplerini içerir çünkü spermatogenezde katılan biyolojik mekanizmaların çalışmalar izolasyonu gerektiren ve bu farklı hücre tiplerinin zenginleştirme. Bu durumda, testis - - lineer gradyan BSA ile STA-PUT yöntem hücre heterojen bir popülasyonunun ayrılması sağlar. Bireysel hücre tipleri ce göre farklı çökelme hızı ile tortull büyüklüğü ve farklı hücre tipleri için zenginleştirilmiş fraksiyonlar toplanmış ve daha fazla analizlerde kullanılabilir. STA-PUT yöntem, belirli hücre ayırma yöntemleri ile elde edilebilir, örneğin hücre tipleri son derece saf fraksiyonları, neden etmese de, bu, her bir parça halinde toplam hücrelerin çok daha yüksek bir verim sağlamaktadır
(7-8 x 10 8, bir başlangıç hücre popülasyonundan ~ 1 x 10 8 hücre / spermatojenik hücre tipi). Bu yüksek verim yöntem yalnızca uzman cam gerektirir ve bir floresan aktif hücre ayırıcı (FACS) veya elutriatörü gibi özel ekipmana sınırlı erişimi laboratuarları için ideal bir yöntem yapma, herhangi bir soğuk oda veya büyük buzdolabı yapılabilir.
Giriş
Memeli spermatogenezis testislerin 1 seminifer tübüllerde çeşitli aşamalardan oluşan karmaşık bir farklılaşma süreçtir. Kısaca, seminifer tübül bölünmenin epiteli yakınında ikamet spermatogonium gibi-kök ve daha sonra mayozdaki bölünmeler geçmesi spermatositlerin, içine ayırt. Mayoz tamamlandıktan sonra, elde edilen haploid hücreleri ya da yuvarlak spermatid, Spermiyogenez, sitoplazma ile çekirdek kompaksiyon saçılmasını içeren bir farklılaşma sürecine tabi tutulur. Spermatidlere yavaş yavaş, sırasıyla, bir kamçılı geliştirmek ve çekirdeğin uzamasını ve yoğunlaşmasını geçmesi, uzatma ve ardından yoğuşmalı spermatidlerin üreten. Son ürünler seminiferous tübül ve sonuçta daha olgun epididimis lümeni içine salınır spermatozoa vardır.
Spermatogenez süreci içinde özel hormonal ve moleküler koşullarına dayandığındantestisler, spermatogenez tüm süreç için güvenilir bir in vitro kültür sistemi henüz 2,3 geliştirilmiş değil. Kültür yöntemleri kök hücrelerden "primordial germ hücresi benzeri hücreler" ve haploid, "yuvarlak spermatid-benzeri hücreler" oluşturmak için geliştirilmiştir, ancak bu yöntemler henüz bu hücrelerin çok sayıda oluşturmak ve daha sonra spermatogenetik hücre üretmek için başarısız mümkün değildir türleri 4,5. Neyse ki, spermatojenik hücre tipleri, bir sıvı gradyanı ile ayrılması için bütün testisler elde edilen tek bir hücre süspansiyonu için izin veren, boyut olarak önemli ölçüde farklıdır. STA-PUT yöntemi, burada gösterdiği, büyüklüğü ve kitle 6-9 dayalı spermatojenik hücreleri ayırmak için bir doğrusal BSA degrade ve basit sedimantasyon kullanır.
FACS ve sivili ayrıştırma 10-13: STA-PUT yöntem spermatojenik hücre tipleri ayırmak için diğer iki en yaygın olarak kullanılan yöntemlere göre bazı avantajları vardır. STA-PUT aparatı onl gerektirirözel cam y birkaç adet soğuk oda veya büyük buzdolabı monte. Bu nedenle, bir hücre ayırıcıyla ya da elutriatörü kullanarak daha az pahalıdır. Her bir hücre popülasyonunun saflığı FACS 11 ile elde edilen kadar yüksek olmasa da STA-PUT yöntem olup, hücre tipi ve karşılaştırılabilir bir zaman dilimi içinde FACS ile sıralanabilir daha testis başına hücre yüksek miktarda elde edilir. Hücre (manyetik aktif hücre sıralama, MACS) son zamanlarda başarılı bir karma testiküler hücre nüfus spermatogonyumlarda zenginleştirilmesi için istihdam edildiğini, ancak 14 işaretleyicileri uygun yüzeyinin bilgi eksikliği nedeniyle spermatositlerin veya spermatidlerin ayırmak için şu anda uygun olan manyetik boncuklar kullanarak sıralama. FACS ya da MACS fazla STA-PUT yönteminin ilave bir avantajı, FACS protokolleri aksine, herhangi bir DNA ya da boyama diğer türleri gerektirmez, çünkü daha sonra kültür için uygun olan canlı hücreleri izole etmek için yeteneğidir. L gerekli çalışmalar içinSpermatogenik hücreleri türleri arge verimleri ~% 90 saflıkta, STA-PUT ideal bir yöntemdir.
Protokol
STA-PUT protokol üç aşamadan oluşur: 1) cihaz ve reaktiflerin Set up, bütün testis hücre süspansiyonu 2) hazırlanması, ve 3) Hücre yükleme, sedimantasyon ve fraksiyon toplama. İki araştırmacı bir ekip tarafından gerçekleştirildiğinde, protokol ortalama sekiz saat sürer.
1.. STA-PUT Aparatı ayarlama (Şekil 1)
Toplama bu yöntem tercih edilir *** STA-PUT aygıtı olup, bir 4 ° C büyük buzdolabı ya da bir kısım toplayıcısı kalabileceği soğuk bir odaya yerleştirilir.
- Önce (ya da en azından bir kaç saat önce), yöntemini gerçekleştirmek gece, tüm ekipman (özellikle cam ve boru) yıkayın ve% 70 etanol ile sterilize. Tam olarak Şekil 1 'de gösterildiği gibi, düzenek monte edilmeden önce ekipman kuru olsun.
- İki 2 L silindiri (Şekil 1 B ve C) ve hücre yükleme odasının (edin Şekil 1A) üst platforma ve boru kelepçeleri ile boru iki küçük parçalar ile tüm bağlayın. Kelepçe bütün tüpler kapalı. En sağdaki 2 L silindir üzerinde ağzı kapatılmalıdır.
- Hücre yükleme odası içinde küçük bir karıştırma çubuğu (Şekil 1A) ve% 2 BSA içerir sol-en 2 L silindir daha büyük bir karıştırma çubuğu (Şekil 1 B) yerleştirin.
- Platformu (Şekil 1D) 2 L sedimantasyon odasına yerleştirin. Doğrudan sedimantasyon odasının (Şekil 1D) altındaki açıklığın üstündeki metal bölmesini (Şekil 1F) yerleştirin. Bölme fraksiyon toplama sırasında hücre degrade sıvı ve bozulma vorteks engeller gibi bu önemlidir. Sedimantasyon odasının üst kapağı yerleştirin.
- Üç yollu vana (Şekil 1G) buzlu cam eklemli vakum yağ çok az miktarda uygulandıktan sonra, se dibine musluğunu kelepçedimentation odası, vana ve sedimantasyon odasının buzlu cam eklem bağlantı.
- Boru takımı ile birlikte vana doğru çıkışına hücre yükleme odası (Şekil 1A) takın. Musluğu kapatın.
- Musluğu sol çıkışına hücre parçalanması boru takın. Fraksiyonlama boru açık olan ucuna bağlı bir cam Pasteur pipeti ile bir boru parçasını içerir. Daha küçük delik boru parçası cam pipet dar ucuna takılır. Dar pipet fraksiyon toplama sırasında hücre süspansiyonu akışını kısıtlar. Çok altındaki bu küçük tüp kelepçe.
- 2 L Krebs hazırlayın (1x) deneyi (Tablo 1) gün tampon. Daha sonra, 1 x 550 ml Krebs 2% BSA, 1 x 550 ml Krebs% 4 BSA ve 1x Krebs 50 mi% 0.5 BSA hazırlar. Filtre edin ve 4 ° C'ye kadar, bu çözüm soğuk
- Doğru 2 L silindir (Şekil 1C) 'de% 4 BSA çözeltisi ve% 2 BSA dökünSol 2 L silindir (Şekil 1 B) çözelti. Emin bu silindirler bağlayan boru içinde hiçbir büyük baloncuklar olmadığından emin olun.
- Bu degrade rahatsız olabilir gibi, hücre yükleme odasına Krebs tampon dökün ve emin hiçbir büyük kabarcıklar vardır yapma, sedimantasyon odasının bu odayı birbirine bağlayan boru doldurun. Sıkma veya boru flicking yavaşça kabarcıklarını çıkarmak için yardımcı olur. Krebs tampon her tüp içinde olup hücre odası içinde olduğundan emin olun.
- Krebs tampon küçük bir miktar, sedimantasyon odasının içine akar ve daha sonra tüpün doldurulması ve herhangi bir büyük kabarcıklarını çıkarmak amacıyla hücre ayırma boru içine hemen hemen tüm tampon boşalmasına izin verin.
- Doğrudan sedimantasyon odasının altında kısım toplayıcısı yerleştirin. Tüm fraksiyon tüpler yerdesiniz ve kirlenmesini önlemek için plastik örtü ile kaplı olduğundan emin olun.
2. Tüm Testislerin gelen spermatogenic Hücreleri Ayırma
- Ca 12 yetişkin farelerin (tercihen en az sekiz haftalık) ve oda sıcaklığında Krebs tampon yerinde herhangi bir kirlenmesine malzemeyi yıkayın Testisler ayır. Gösterilmediği Bu protokol laboratuvar farelerin kullanımını gerektirir ve Pennsylvania Kurumsal Hayvan Bakım ve Kullanım Komitesi Üniversitesi kurallarına uygun idam edildi.
- Eğer seminifer tübüller eklemek niyetinde hemen önce konik bir tüp içinde 50 ml Krebs tampon 45 mg kollajenaz ekleyin. Bu çözelti bir kaç dakika boyunca 33 ° C'ye kadar ısınmasına izin vermeyin. Iki adet 50 ml konik tüpler içine eşit olarak bölünür.
- Tunika albuginea atarak ve seminifer tübüller bırakmadan, 8 ml Krebs tampon içeren ayrı bir tabak içinde testisler açarlar. Tunika albuginea seminifer tübüller çevreleyen ince bir zardır. Tübüller kolayca tunika albuginea ayırmak gerekir. Bunu yapmak için, tunika albuginea bir kesi yapmak, bir pai ile bu membran tutunforseps r ve uzak forseps başka bir çift ile zardan dışarı tübüllerini itin.
- Kolajenaz çözeltisi 25 ml içeren, her konik tüp tübülleri içeren 4 ml Krebs tamponu ilave edin ve 10 dakika boyunca 33 ° C 'de, çalkalama, inkübe edilir. Sonunda, tübüllerin bir "spagetti-benzeri" bir görünüme sahip olmalıdır.
- Tübüller tüpün altına ~ 5 dakika boyunca çökmesine izin verilmektedir. Süpernatantı dökerek tübüller tüpün dibine her oturuşmaya bırakılmış, (oda sıcaklığında) 25 ml Krebs tampon maddesi içinde 2 x yıkayın. Her bir tüp içinde ~ 5 ml Krebs tamponu bırakın.
- Yıkama, sen seminifer tübüller eklemek niyetinde hemen önce bir şahin tüp 50 ml Krebs tampon 30 mg tripsin eklemek iken. Bu çözelti bir kaç dakika boyunca 33 ° C'ye kadar ısınmasına izin vermeyin. Iki adet 50 ml konik tüpler içine eşit olarak bölünür.
- 25 ml tübülleri içeren iki tüpün her birine tripsin solüsyonu ekleyin. Hücre önlemek için her bir tüpe 3 ug DNAz (1 μg/10ml) eklemetopaklanma s. 10 dakika boyunca 33 ° C 'de, çalkayalarak kuluçkalayın.
- Yaklaşık 10x ve onları pipetleme, tübüllerini içeren çözümü kışkırtmak için geniş bir delik pipet kullanın. Çözüm daha tek bir hücre süspansiyonu gibi aramaya başlamalıdır.
- Ilave bir 10 dakika boyunca 33 ° C 'de, çalkayalarak kuluçkalayın. Yaklaşık 25x ve onları pipetleme, tek bir hücre süspansiyonu içine tübülleri dağıtmak için, geniş bir delik pipet kullanın. Hala tübüller veya hücre kümeleri çok görürseniz, pipet ile daha dağıtmak ve / veya her bir tüpe başka 3 ug DNAz (çift başlangıç konsantrasyon) ekleyin.
- Bir 100 um gözenekli bir hücre süzgecinden (30 mi hücre süspansiyonu her bir tüp için bir tane) ile tek bir hücre süspansiyonu filtre. Hücre süspansiyonları birleştirin ve hücrelerin toplam sayısı (8 ila 10 x 7-8 arası hücre olmalıdır) sayılır. *** Degrade üzerine FAZLA 800000000 hücreleri yüklemeyin.
- Adım 2.10 'de elde edilen hücre sayısı göre, appropr peletiate 5 dakika boyunca 450 RCF süzüldü hücre ve 30 ml Krebs tamponu ile yıkayın. Tekrarlayın. *** Genellikle 22 testisler daha 800.000.000 hücreleri verecektir, ancak bu hücre sayısından daha fazla yük yok.
- Dikkatle kabarcıklar yaratmadan (hücre topaklanma derecesine bağlı olarak) DNAse ug 2.5 ile 5 içeren 25 mi% 0.5 BSA içinde tekrar süspansiyon hücreleri. Hücreler kümelenir yok emin olun. 100 mikron gözenekli hücre süzgecinden tek bir hücre süspansiyonu filtre. Hücreler artık yüklemeye hazırız. Tüpü birkaç kez ters yüz edilerek yüklemeden önce iyice karıştırın.
3. Hücre Yükleme ve sedimantasyon
- Emin musluk kapalıdır, ancak sıvı, sedimantasyon odasının (Şekil 1D) içine hücre bölmesi (Şekil 1A) akmasını sağlayacak konumda yapın.
- Düşük ayarda karıştırma çubukları sürekli hareket sağlamak için (yaklaşık 70 rpm) hem karıştırma çubuğu tabak kapatın, ama yavaş yavaş.
- Hücre odası (Şekil 1A) içine hücre süspansiyonu dökün ve hücreler, 10 ml / dk (Şekil 1D) 'lik bir oranda, sedimantasyon odasının içine yavaş yavaş akması, böylece musluğunu açın. Musluğu kapatın. Akış hızı, sedimantasyon odasının üzerinde hacim aralıkları işaretleyerek belirlenebilir.
- Hücre odasına% 0.5 BSA çözeltisi 5 ml dökün ve 10 ml / dak 'lık bir hızda, sedimantasyon odasının içine boşaltın. Musluğu kapatın. Bu adım, hücre odasından dışarı hücrelerini yıkar. 4x tekrarlayın.
- Gradyan hazırlayın: hücre bölmesi (Şekil 1A) ve iki 2 L silindir (Şekil 1B, C) arasındaki kelepçeler açın ve 40 ml / dk 'lık bir oranda (Şekil 1D) de sedimantasyon odasının içine sıvı drenaj başlar hemen. Bu sedimantasyon odasına BSA gradyanı yüklemek için yaklaşık 20-30 dakika sürer, böylece akış hızını ayarlayın. Üstüne yalan hücrelerin ince, rahatsız tabakaBSA degrade görünür olmalıdır. BSA en yüklendikten sonra, musluğunu kapatın ve sıvı ayırma tüpüne sedimantasyon odasından akmasını sağlayacak konuma çevirin.
- Heyecan tabak kapatın.
- Hücrelerin bir saat ve 45 dakika süre ile çöktürmek için izin verin. BU DÖNEMDE CİHAZI RAHATSIZ ETMEYİN. Herhangi bir mekanik ajitasyon degrade rahatsız olabilir.
4. Kesirler Fraksiyonu ve Analizi
Eğer aşağıdaki adımları gerçekleştirmek gibi ***, degrade rahatsız etmemek için dikkatli olun. BSA degrade rahatsız edilirse, yordam çalışmaz!
- Hücreler çökeltilir sonra, yavaş yavaş 50 ml konik tüp içine sedimantasyon odasından 50 ml drenaj ve kenara. Bu fraksiyon genellikle hücreleri ve enkaz istenmeyen kümeleri içerir.
- Fraksiyon toplayıcı için kesir tüp takın. *** Bu elle fraksiyonların toplanması da mümkündür, bir fraksiyon collector kullanılamaz.
- Fraksiyonları toplamak: 10 ml (bir toplama tüpü doldurmak) her 45 san toplanır, böylece vana ile akış hızını ayarlayın.
- Fraksiyon toplama tüpleri Cap ve 4 ° C'de 450 RCF 5 dakika boyunca dönmeye , Yavaşça Süpernatantı dökün kalan sıvı süspansiyon hücrelerin, ve buz üzerinde hücre tutmak.
- Tüm fraksiyonlar toplanır sonra, mikroskobik olarak farklı hücre popülasyonları için fraksiyonlar analiz. Farklı hücre tipleri, hücre boyutu ve nükleer morfolojisi 8,15 göre ayırt edilebilir. 2 (a) ve öz değişmesine ait somatik hücreleri ve spermatogonia için zenginleştirilmiş üç birleştirilmiş fraksiyonlardan için "temsili sonuçlar", (b) yuvarlak spermatidler ve göstermektedir Şekil (c) uzatılması ve spermatidlerin yoğuşmalı.
- Bir spermatogonium Tip 12-14μm ca vardır. çapında ve kromatin kompozisyonunda homojen yuvarlak çekirdekleri var.
- B Tipi spermatogonium 8-9μm ca vardır. çapı olan ve RounNükleer çevresi boyunca daha yoğun heterokromatine göstermek d çekirdekler.
- Pre-leptoten spermatosit 7,5-8.2μm ca. çapı, B Tipi spermatogonia az sitoplazma ve B Tipi spermatogonyumlarda olanlara benzer çekirdekleri var.
- Leptoten birincil spermatosit 8-10 mikron ca vardır. çapında ve ön leptoten spermatositlerin olanlara benzer, ancak nükleer membran daha yoğun kromatin kazanmak gibi çekirdekleri var.
- Zigoten birincil spermatosit 10-12 mikron ca vardır. çaplı ve leptoten primer spermatositlerde kişilerce benzer çekirdeği vardır.
- Pachytene spermatosit yerde 12-18 mikron ca vardır. çapı ve büyük bir çekirdeği çevreleyen sitoplazma ince bir kenar oluşur. Daha yoğun kromatin kümeleri çekirdeğinde görülebilir.
- Yuvarlak Spermatidler 10 mikron ca vardır. çaplı ve ortasında bir yoğun-boyama chromocenter yuvarlak bir çekirdeği vardır.
- Artıkorganları çapı 6.5 mikron, yuvarlak ve çekirdeği eksikliği ~ vardır.
- Uzatma ve yoğuşmalı Spermatidler spermatidlerin yuvarlak boyutu benzer, ancak benzersiz, orak şeklinde çekirdek var.
- Fraksiyonu 15 ile başlayın ve 85 kadar her beş kesirler analiz. Genellikle, altı 15 fraksiyonlar çok karışık ve clumpy olacak ve 85 yukarıda parçacıklar herhangi bir kullanılabilir hücrelere az içerir.
- Fraksiyon toplama tüpü (hücreler, santrifüj işleminden sonra yeniden süspansiyon haline getirilmiş edilmiş bir defa) sıvının 5ul almak ve Krebs tamponu içinde% 8 formaldehit 5ul eklemek, bir fraksiyon analiz etmek. Sabit Hücreler, beş dakika boyunca oda sıcaklığında bekletin.
- Sabit hücreleri% 0.1 Triton ve DAPI (5 μ / ml Krebs tampon) 5ul ekleyin. Hücreler, 5 dakika boyunca oda sıcaklığında bekletin.
- , Bir slayt üzerine elde edilen solüsyon 10 ul koyun örtücü bir kılıfla kapak ve her bir fraksiyonun saflığı belirlemek için flöresanlı bir mikroskop ile analiz edin.
- Mayotik ve somatik hücreler diploid, yuvarlak spermatidlerin ve uzatma / yoğuşmalı spermatidlerin: boyutu ve nükleer morfoloji benzer hücrelerin aşağıdaki popülasyonları oluşturmak için ("Temsilci Sonuçları" bakın) kesirler birleştirin.
Sonuçlar
STA-PUT prosedür ideal bir sonuç hücre boyutu ve yoğunluğuna bağlı olarak testis hücrelerinin oldukça fark ayrılıktır. Testis izole hücreler BSA gradyanı ile çöktürülmesi olsa da, hücrelerin birkaç farklı bantları gözlenebilir. Hücrelerin herhangi kümeleri degrade dibine çöker ve diğer fraksiyonların kontamine olmaz eğilimindedir. Biraz daha degrade kadar büyük somatik ve mayozdaki hücreler olacaktır. Uzak degrade kadar hala küçük yuvarlak Spermatidler olacaktır. Degrade üst spermatidlerin, sperm ve kırmızı kan hücrelerini kirlenmesine yoğun olacak de (bu bir çekirdek olmadan, küçük yuvarlak hücreler olarak görünür).
Fraksiyonlar bir ışık ve floresan mikroskobu bir arada (Şekil 2) 15 kullanılarak hızlı bir şekilde analiz edilebilir. Mayotik spermatogonial ve somatik hücreler diploid testislerde bulunan en büyük hücrelerdir ve büyük çekirdeklere o leke relati içerecektirvely homojen DAPI. Yuvarlak Spermatidler genellikle parlak boyama chromocenter ile küçük yuvarlak çekirdekleri ile daha küçük hücrelerdir. Elongating / Yoğuşmalı Spermatidler küçük bir kuyruk oluşturan sanki genellikle dikdörtgen bakmak küçük hücrelerdir. Bu hücreler DAPI ile parlak leke ve bir orak şeklinde olan küçük, kompakt çekirdekleri vardır. Hücre fraksiyonları birleştirilir sonra, saflık bundan başka, hücre lizatlarının Western blot analizi (Şekil 3) ile tespit edilebilir. Öz değişmesine ait hücre ortak işaretleyicileri synaptonemal karmaşık 1 proteinlerinin Scp1 Sycp2 ve 16 bulunmaktadır. Spermatidlerin yoğunlaştırıldığı ortak belirteçleri geçiş proteinler (örneğin, TP1) veya protaminler 17 bulunmaktadır.
Her STA-PUT işletilen farklı olmasına rağmen, genellikle mayotik hücreleri, spermatogonium ve somatik hücreler diploid kesirler yuvarlak Spermatidler ca. 55-65. Kesirler ca de 25-40 bulundu olacak ve kesirler ca de spermatidlerin uzayarak / yoğuşmalı.Somatik / mayotik hücreleri ve yuvarlak spermatidler arasında boyut olarak daha küçük bir farkı nedeniyle 65-75, kesirler. 45-50 sıklıkla somatik / miyoza hücreleri ve yuvarlak spermatidlerin daha yüzdesi var ca. DAPI ile boyama, bu iki hücre popülasyonları ayırmak için yardımcı olacaktır. Daha az yuvarlak spermatid bir örtüşme nedeniyle, bu iki hücre popülasyonu arasındaki boyutta büyük farkı spermatid kesirler uzayarak / yoğuşmalı vardır. Genellikle, 15'in altında fraksiyonlar 85 yukarıda hücreleri ve fraksiyonların birçok büyük yığınları içerecek birkaç hücre ve birçok kalıntı organları veya spermatidler tarafından döken membran-bağlı stoplazmalı içerecektir.
~ 22 testis hücreleri STA-PUT prosedürü fraksiyonlanır Genellikle, bu ca verir. / Spermatojenik hücre tipi (miyoza / somatik hücreler diploid, yuvarlak spermatid ve uzatma / yoğuşmalı Spermatidler) 10 8 hücreleri. Hücrelerin son nüfus oluşturmak için birleştirilir fraksiyonlar az olmalıdırSöz konusu hücre türüne göre% 80 saf. Eğer veya daha yüksek saflıkta bu derece görmüyorsanız, hücre ayırma veya BSA degrade ile bir sorun olabilir. Ayrıca, az ilk 20 kesirler hücreleri ve kesirler hücre bolluğu varsa 80 +, ya da orada hücrelerin bir bereket ilk 20 kesirler ve neredeyse hiç kesirler 70 +, sedimantasyon zaman daha fazla olması gerekiyorsa optimize edilmiş. Nasıl sorun çekmek önerileri için Tartışma bakınız.

Şekil 1. STA-PUT aletinin şematik ve gerçek görüntü gösterilir: STA-PUT Aparatı kurma. Bütün cam fraksiyon kolektörü için cihaz bağlayan boru ihtiva eden plastik boru ile bağlanır. Oklar kelepçeler yerini göstermektedir. A) Hücre yükleme odası, bir karıştırma çubuğu içeriyor; B) 2 L silindir % 2 BSA için, bir karıştırma çubuğu içeriyor;% 4 BSA C) 2 L silindir; D) Çökme odası; E) Stir plakaları; F) Baffle;. G) Musluk büyük resmi görebilmek için buraya tıklayın .
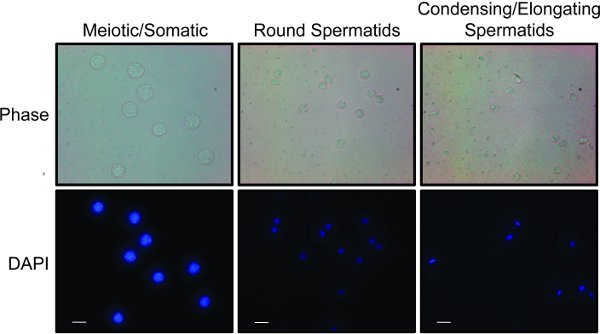
Şekil 2. STA-PUT elde edilen hücre popülasyonları: mayoz ve somatik hücreler, yuvarlak spermatidler ve spermatidlerin yoğunlaştırılması ve uzatma: Fraksiyonlar üç farklı hücre popülasyonlarında birleştirilmiştirler. Her nüfus nükleer büyüklüğü ve morfolojisi farklılıkları göstermek için DAPI ile boyandı. Faz kontrast görüntüleme hücre boyutu ve şekli arasındaki farklar taşır. Beyaz bar 10 mikron temsil eder. resmi büyütmek için buraya tıklayın .
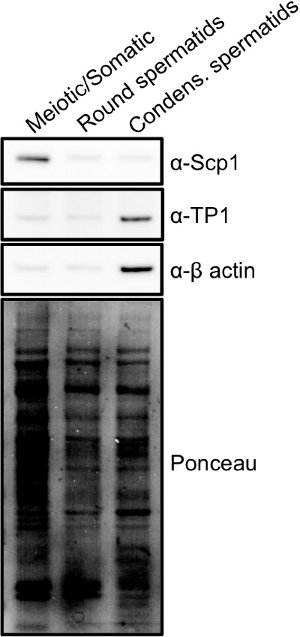
Şekil 3,. STA-PUT elde edilen farklı hücre popülasyonlarının işaretleri: tüm hücre ekstraktları, Şekil 1 'de gösterilen her bir hücre popülasyonundan yapılan ve western blot analizi, her bir nüfus için protein sentezleme farklılıkları göstermek için gerçekleştirildi.. Synaptonemal kompleks protein 1 (Scp1) bir protein meiosis özel olarak ifade edilen ve yoğunlaştırılması spermatid fraksiyon geçiş protein 1 (TP1) için zenginleştirilmiştir ise, öz değişmesine ait fraksiyonlar içinde zenginleştirilmiş bulunan, geç Spermiyogenezin olarak ifade edilen bir protein. büyük görüntülemek için görüntü .
Tartışmalar
Güvenilir bir hücre kültür sistemi henüz tüm spermatogenik hücre tiplerini 3 üretmek için yok gibi spermetogenez çalışma yapanlar, spermatojenik hücre örnekleri için hayvan modellerinde güveniyor. Spermatojenik hücreleri kolayca bütün testis toplanan rağmen, sadece karışık bir nüfus sonuçlanır. Bu tür mayotik hücreleri, yuvarlak spermatidler ve yoğuşmalı spermatidler gibi bu hücrelerin belirli alt tipleri, incelemek isteyenler için bir sorun teşkil etmektedir. Üç farklı yöntemler şu anda spermatojenik hücrelerin bu alttiplerini ayırmak için kullanılır: STA-PUT, FACS ve elutrasyon 6-13. Sırasıyla bir hücre sıralayıcı ve elutriatörü: Bu son iki yöntem pahalı ekipman parçaları erişim gerektirir. FACS metodu farklı spermatojenik hücre tipleri, yüksek saflıkta elde edilir popülasyonlarının da, işlem altı saat sürer ve 2-3 testisler 11 her bir hücre tipi için sadece 0,5-2,0 x 10 6 hücre elde edilir. STA-PUT meth gibi elutriyasyon,od, büyüklüğüne ve yoğunluğuna göre hücreleri ayıran, ancak STA-PUT aparatı daha pahalı bir elutriatörü, erişim gerektirir.
STA-PUT prosedürü (~ 22 testis başına ~ 10 8 hücre / nüfus) oldukça yüksek verim ile farklı boyutlarda spermatojenik hücreleri ayırmak için basit bir BSA degrade kullanır. FACS yöntemlere kıyasla, STA-PUT prosedürü daha fazla hücre / testis verir ve hücre türlerini ayırmak için çok daha az zaman alır. FACS ve ayırımı ile karşılaştırıldığında, STA-PUT işlemi nispeten basit ve ucuzdur. STA-PUT bir hücre sıralayıcı veya elutriatörü erişimi olmayan laboratuarlar için ideal bir yöntem yapmak, sadece bir soğuk oda veya büyük buzdolabı ve özel cam bir dizi gerektirir. Düzgün yapıldığında, STA-PUT yuvarlak spermatidler veya yoğuşmalı spermatidlerin yaklaşık% 90 saf nüfus sağlayabilir.
STA-PUT yöntemi çok kullanışlıdır, ancak birkaç farklı aşamada optimizasyonu, özellikle s gerektiriredimentation. Hücre tipleri alt-optimal ayrılması, birkaç farklı sorunları en BSA gradyanı ile neden olabilir. Uygun bir gradyan yapmak için, hücre yükleme odası içinde karıştırma çubukları ve gradyan oluştururken% 2 BSA tutan 2 L silindir açın. Ayrıca, kabarcıklar, tüm boru açık ve hücreleri yüklemeden önce sedimantasyon odasının yerinde bölmesini koydu. Içine veya sedimantasyon odasının dışarı BSA akış oranının azaltılması yardımcı olabilir. En önemlisi, STA-PUT aparatı gradyan, sedimantasyon veya fraksiyon toplama oluşturulması sırasında rahatsız edilmemelidir.
Sub-optimal hücre verimleri testislerin yeterli sayıda / büyüklüğü, kollajenaz / tripsin tedavisi sırasında yetersiz hücre ayrılması ve hücre topaklanma sonucu olabilir. Biri nedeniyle Spermatogenik cel az sayıda üretmek yenidoğan farelerin veya genotipleri kullanımına bu STA-PUT protokol için hücrelerin uygun sayısını elde edememesi durumundals, bu STA-PUT başına daha fazla hayvan kullanımı veya (ProScience edinilebilir) daha küçük hacimli ve cep numaraları için optimize edilmiş bir STA-PUT cam kiti 18 sipariş için gerekli olabilir. Hücrelerin optimal sayısını (700-800.000.000) elde etmek için, ideal olarak en az 8-9 haftalık üreme yaşı en az 11 erkek fareler kullanın. Ancak, 800 milyon fazla hücreleri bir STA-PUT içine yüklenmiş olması gerekir. Hücreler, tripsin muamelesi sonra tek bir hücre süspansiyonu içine ayrılamaz varsa, DNAse konsantrasyon 1 ug / ml solüsyon 5 kadar arttırılabilir. DNAse dondurma / çözülme ve her zaman tek bir hücre süspansiyonu içine tübül daha etkili bir dağılım sonuçlanır taze DNAz ile döngüleri tekrar duyarlıdır. Bir örgü süzülmeden önce hücre kümeleri parçalayın yardımcı olmak için geniş bir delik pipet kullanın.
Optimizasyon gerektirir STA-PUT yönteminin bir yönü, hücrelerin BSA gradyanı ile çökeltmek için izin verilen zaman miktarıdır. Bir saatve 45 dk genellikle iyi çalışır, ancak bu kez laboratuardan laboratuara farklılık gösterebilir. Genellikle, farklı hücre katmanları BSA gradyanı boyunca görsel olarak görülebilir. Birkaç toplanan ilk 20 kesirler hücreler ve fraksiyonlar 80 + hücrelerin bir bolluk varsa, sedimantasyon süresi uzatılabilir gerekebilir. Çok sayıda hücreler toplanmış, ilk 20 fraksiyon olarak bulunmaktadır ve hücre tiplerinin ayrılması yetersiz olması durumunda, sedimantasyon süresi düşürülebilir gerekebilir.
STA-PUT prosedürü ile elde edilen hücreler, deneylerin birçok farklı türleri için kullanılabilir. Büyük ölçekli biyokimya deneyler farklı STA-PUT çalışan malzeme birleştirme gerekebilir, ancak STA-PUT, western blot analizi, immünofloresan ve RNA analizleri için yeterli malzeme sağlar. Diğer hücre tiplerinden ayrı olduğunda, haploid spermatidler daha kolay olabilir, en fazla üç gün boyunca kültürlenmiştir ve in vitro moleküler manipülasyona tabi tutulabilir In vivo bir tedavi ya da bir nakavt hayvan 19 yaratır. Anlatılan STA-PUT protokol ile elde edilen hücreler kirlenme belirgin işaretler olmadan bir gün boyunca kültür edilmiş, ancak daha uzun hücreler hücre kültür deneyleri için kullanılacak ise, ekipman etanol ile sterilize edilmelidir, bütün çözeltiler süzülerek sterilize edilmiş ve tüm olmalıdır hücre yükleme öncesi ve fraksiyon toplama sonrası adımlar, bir doku kültürü kaputu yapılmalıdır. Buna ek olarak, antibiyotik ihtiva eden kültür ortamı kullanılmalıdır. STA-PUT yöntemi hücre tespiti gerektiren olmadığı gerçeği canlı hücreleri gerektiren deneyler için ideal bir prosedür yapar.
Açıklamalar
Yazarlar, hiçbir rakip mali çıkarlarını olmadığını beyan ederim. Gösterilmediği Bu protokol laboratuvar farelerin kullanımını içerir ve tüm ilgili kurallar, düzenlemeler ve düzenleyici kurumlar ile uyum içinde idam edildi. Bu protokolde kullanılan Hayvanlar Pennsylvania Kurumsal Hayvan Bakım ve Kullanım Komitesi Üniversitesi (IACUC protokolü # 804284) rehberliği ve onayı altında tutulur.
Teşekkürler
Bu araştırma NIH hibe SLB için GM055360 ve RGM için U54HD068157 tarafından desteklenmiştir. JMB Pennsylvania Üniversitesi (GM008216) de T32 Genetik Eğitim Grant tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BSA | Affymetrix/USB | 10857 100MG | Alternate can be used. |
| 0.5%, 2%, and 4% BSA solutions | Dissolve 0.25 g, 11 g, and 22 g (respectively) in total volumes of 50 ml, 550 ml, and 550 ml of 1x KREBS (respectively). | To be made day of the STA-PUT procedure. Filter sterilize. | |
| KREBS (10x) | 3.26 g KH2PO4 + 139.5 g NaCl +5.89 g MgSO4/7H20 + 40 g Dextrose + 3.78 g CaCl2/2H20 + 7.12 g KCl, bring to 2 L with ddH20 | Autoclave/filter and store at 4 °C for several months. | |
| KREBS (1x) | Dissolve 4.24 g NaHCO3 in 100 ml ddH20. Add 200 ml 10x KREBS. Bring to 2 L with ddH20. | To be made day of the STA-PUT procedure. Filter sterilize. | |
| Collagenase | Sigma | C9891-1G | |
| DNAse | Sigma | DNEP-5MG | |
| Trypsin | Sigma | T9201-1G | |
| DAPI | Preference of researcher | ||
| Triton-X100 | Preference of researcher | ||
| Formaldehyde (~37%) | Preference of researcher | ||
| TABLE 2: EQUIPMENT | |||
| Equipment | Company | Catalog # | Comments |
| Complete STA-PUT apparatus | ProScience Glass Shop | STA-PUT (this procedure uses the standard sedimentation chamber: Cat. No. 56700-500) | Includes all glassware and equipment for the apparatus. Alternate glassware is available for performing STA-PUT with smaller cell numbers. |
| 10 μm mesh filter | Fisherbrand | 22363549 | |
| Mouse dissection tools | Preference of researcher | ||
| 14 ml round bottom fraction collection tubes with caps | Preference of researcher | ||
| Need approximately 100 tubes | |||
| Fraction collector | GE Healthcare Life Sciences | Model: Frac-920, Product code: 18-1177-40 | Alternate can be used. |
| Microscope slides, cover glass | Preference of researcher | ||
| Light/Fluorescent Microscope | Preference of researcher |
Referanslar
- Wistuba, J., Stukenborg, J., Luetjens, C. M. Mammalian Spermatogenesis. Funct. Dev. Embryol. 1, 99-117 (2007).
- Hess, R. A., Cooke, P. S., Hofmann, M. C., Murphy, K. M. Mechanistic insights into the regulation of the spermatogonial stem cell niche. Cell Cycle. 5, 1164-1170 (2006).
- Dores, C., Alpaugh, W., Dobrinski, I. From in vitro culture to in vivo models to study testis development and spermatogenesis. Cell Tissue Res. 349, 691-702 (2012).
- Hayashi, K., Ohta, H., Kurimoto, K., Aramaki, S., Saitou, M. Reconstitution of the mouse germ cell specification pathway in culture by pluripotent stem cells. Cell. 146, 519-532 (2011).
- Easley, C. A., et al. Direct differentiation of human pluripotent stem cells into haploid spermatogenic cells. Cell Rep. 2, 440-446 (2012).
- Bellve, A. R. Purification, culture, and fractionation of spermatogenic cells. Methods Enzymol. 225, 84-113 (1993).
- Meistrich, M. L., Bruce, W. R., Clermont, Y. Cellular composition of fractions of mouse testis cells following velocity sedimentation separation. Exp. Cell Res. 79, 213-227 (1973).
- Romrell, L. J., Bellve, A. R., Fawcett, D. W. Separation of mouse spermatogenic cells by sedimentation velocity. A morphological characterization. Dev. Biol. 49, 119-131 (1976).
- Miller, R. G., Phillips, R. A. Separation of cells by velocity sedimentation. J. Cell Physiol. 73, 191-201 (1969).
- Bastos, H., et al. Flow cytometric characterization of viable meiotic and postmeiotic cells by Hoechst 33342 in mouse spermatogenesis. Cytometry A. 65, 40-49 (2005).
- Getun, I. V., Torres, B., Bois, P. R. Flow cytometry purification of mouse meiotic cells. J. Vis. Exp. (50), e2602 (2011).
- Grabske, R. J., Lake, S., Gledhill, B. L., Meistrich, M. L. Centrifugal elutriation: separation of spermatogenic cells on the basis of sedimentation velocity. J. Cell Physiol. 86, 177-189 (1975).
- Meistrich, M. L., Trostle, P. K. Separation of mouse testis cells by equilibrium density centrifugation in renografin gradients. Exp. Cell Res. 92, 231-244 (1975).
- Gassei, K., Ehmcke, J., Schlatt, S. Efficient enrichment of undifferentiated GFR alpha 1+ spermatogonia from immature rat testis by magnetic activated cell sorting. Cell Tissue Res. 337, 177-183 (2009).
- Bellve, A. R., et al. Spermatogenic cells of the prepuberal mouse. Isolation and morphological characterization. J. Cell Biol. 74, 68-85 (1977).
- Handel, M. A., Schimenti, J. C. Genetics of mammalian meiosis: regulation, dynamics and impact on fertility. Nat. Rev. Genet. 11, 124-136 (2010).
- Zhao, M., Shirley, C. R., Mounsey, S., Meistrich, M. L. Nucleoprotein transitions during spermiogenesis in mice with transition nuclear protein Tnp1 and Tnp2 mutations. Biol. Reprod. 71, 1016-1025 (2004).
- Manku, G., Mazer, M., Culty, M. Neonatal testicular gonocytes isolation and processing for immunocytochemical analysis. Methods Mol. Biol. 825, 17-29 (2012).
- Dehnugara, T., Dhar, S., Rao, M. R. An in vitro, short-term culture method for mammalian haploid round spermatids amenable for molecular manipulation. Mol. Reprod. Dev. 79, 19-30 (1002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır