Method Article
الفصل بين أنواع الخلايا المنوية عن طريق STA-PUT سرعة الترسيب
In This Article
Summary
يسمح أسلوب STA-PUT للفصل بين مجموعات مختلفة من الخلايا المنوية على أساس الحجم والكثافة.
Abstract
الحيوانات المنوية لدى الثدييات هو عملية التمايز المعقدة التي تحدث في مراحل عدة في الأنابيب المنوية من الخصيتين. حاليا، لا يوجد نظام موثوق زراعة الخلايا مما يسمح لتمايز المنوية في المختبر، وتتطلب معظم الدراسات البيولوجية للخلايا المنوية الحصاد الأنسجة من النماذج الحيوانية مثل الماوس والفئران. لأن الخصية يحتوي على العديد من أنواع الخلايا - على حد سواء غير المنوية (ايديغ، سيرتولي، النخاعي، والخلايا الظهارية) والمنوية (أمهات المني، الخلايا المنوية، طلائع منوية الجولة، التكثيف طلائع منوية والحيوانات المنوية) - دراسات الآليات البيولوجية المعنية في الحيوانات المنوية تتطلب العزلة وإثراء هذه أنواع مختلفة من الخلايا. يسمح أسلوب STA-PUT لفصل السكان غير متجانسة من الخلايا - في هذه الحالة، من الخصيتين - من خلال BSA الانحدار الخطي. أنواع الخلايا الفردية الرواسب مع مختلف سرعة الترسيب وفقا لمحجم ليرة لبنانية، والكسور المخصب لأنواع مختلفة من الخلايا التي يمكن جمعها والاستفادة منها في إجراء المزيد من التحليلات. في حين أن طريقة STA-PUT لا يؤدي إلى كسور نقية للغاية من أنواع الخلايا، على سبيل المثال كما يمكن الحصول مع بعض أساليب الخلية والفرز، وأنها لا توفر عائدات أعلى بكثير من مجموع الخلايا في كل جزء
(~ 1 × 10 8 خلايا / نوع من الخلايا المنوية من السكان بدءا من 7-8 × 10 8 خلايا). يتطلب هذا الأسلوب عالية الغلة الأواني الزجاجية المتخصصة فقط ويمكن القيام بها في أي غرفة باردة أو ثلاجة كبيرة، مما يجعلها وسيلة مثالية للمختبرات التي لديها محدودية فرص الحصول على المعدات المتخصصة مثل مضان تنشيط فارز الخلية (نظام مراقبة الأصول الميدانية) أو elutriator.
Introduction
الحيوانات المنوية لدى الثدييات هو عملية التمايز المعقدة التي تحدث في مراحل عدة في الأنابيب المنوية من الخصيتين 1. لفترة وجيزة، وقف مثل أمهات المني الموجودة بالقرب من ظهارة نبيب الفجوة المنوية وتفرق في الخلايا المنوية، التي تخضع ثم الانقسامات الانتصافي. بعد الانقسام الاختزالي كاملة، وخلايا فرداني الناتجة عن ذلك، أو طلائع منوية الجولة، الخضوع لتكون النطاف، وهي عملية التمايز التي تنطوي على سفك السيتوبلازم والضغط من النواة. طلائع منوية تتطور تدريجيا السوط والخضوع استطالة والتكثيف من نواة، وإنتاج التمطيط ثم التكثيف طلائع منوية، على التوالي. المنتجات النهائية هي الحيوانات المنوية، والتي تم إصدارها في تجويف أنبوب صغير المنوية ومنه إلى البربخ حيث تنضج أخرى.
لأن عملية تكوين الحيوانات المنوية يعتمد على الظروف الهرمونية والجزيئية الخاصة فيالخصيتين، لم يتم حتى الآن وضع نظام موثوق الثقافة في المختبر لكامل عملية تكوين الحيوانات المنوية 2،3. وقد تم تطوير أساليب لخلق ثقافة "الجرثومية البدائية خلايا تشبه الخلايا" و "الخلايا مثل أرومة النطفة الجولة" فرداني، من الخلايا الجذعية، ولكن هذه الأساليب ليست قادرة على توليد أعداد كبيرة من هذه الخلايا وتفشل في إنتاج الخلايا المنوية في وقت لاحق بعد أنواع 4،5. لحسن الحظ، وأنواع الخلايا المنوية تختلف اختلافا كبيرا في الحجم، والذي يسمح لنظام التعليق وحيدة الخلية التي تم الحصول عليها من الخصيتين كله أن تكون مفصولة مع التدرج السائل. طريقة STA-PUT، تظاهر هنا، يستخدم الانحدار الخطي BSA والترسيب بسيطة لفصل الخلايا المنوية على أساس الحجم والكتلة 6-9.
طريقة STA-PUT ديها العديد من المزايا أكثر من غيرها من الأساليب الأكثر استخداما على نطاق واسع لفصل أنواع الخلايا المنوية: نظام مراقبة الأصول الميدانية وتصويل 10-13. جهاز STA-PUT يتطلب قلذ عدة قطع من الأواني الزجاجية المتخصصة تجميعها في غرفة باردة أو ثلاجة كبيرة. وبالتالي، فمن أقل تكلفة من استخدام فارز الخلية أو elutriator. طريقة STA-PUT ينتج كميات أكبر من الخلايا لكل نوع من الخلايا والخصية مما يمكن الفرز حسب نظام مراقبة الأصول الميدانية في إطار زمني مشابه، على الرغم من نقاء كل السكان الخلية ليست عالية مثل تلك التي حصلت مع نظام مراقبة الأصول الميدانية 11. فرز الخلايا باستخدام الخرز المغناطيسي (المغناطيسية الفرز الخلية تفعيلها، MACS) مؤخرا استخدمت بنجاح لتخصيب أمهات المني من السكان الخلية الخصية مختلطة، لكنه غير مناسب حاليا لفصل الخلايا المنوية أو طلائع منوية بسبب الافتقار إلى المعرفة السطحية المناسبة علامات 14. ميزة إضافية للأسلوب STA-PUT على نظام مراقبة الأصول الميدانية أو MACS هو القدرة على عزل خلايا قابلة للحياة مناسبة لاحقة لأن الثقافة، وعلى النقيض من معظم بروتوكولات نظام مراقبة الأصول الميدانية، أنها لا تتطلب أي الحمض النووي أو أنواع أخرى من تلطيخ. للدراسات التي تتطلب لغلة الدو من أنواع الخلايا المنوية في ~ 90٪ النقاء، وSTA-PUT هو الأسلوب الأمثل.
Protocol
ويشمل البروتوكول STA-PUT ثلاث مراحل: 1) إعداد لأجهزة والكواشف، 2) إعداد تعليق خلية من الخصيتين كله، و 3) التحميل الخليوي، والترسيب، وجمع الكسر. عندما أجريت من قبل فريق من اثنين من الباحثين، وبروتوكول يأخذ ثماني ساعات في المتوسط.
1. إنشاء جهاز STA-PUT (الشكل 1)
*** يجب وضع جهاز STA-PUT في ثلاجة كبيرة 4 درجة مئوية أو غرفة باردة التي يمكن أيضا استيعاب جزء جامع، إذا ويفضل أن طريقة جمع.
- في الليلة السابقة (أو على الأقل قبل بضع ساعات) إجراء الأسلوب، ويغسل جميع المعدات (وخاصة الأواني الزجاجية والأنابيب) وتعقيم مع الايثانول 70٪. دعونا المعدات جافة تماما قبل تجميع الجهاز كما هو موضح في الشكل 1.
- تأمين اثنين 2 L اسطوانات (الأرقام 1B و C) وغرفة تحميل الخلية ( الشكل 1A) إلى منصة أعلى وربط جميع مع اثنين من قطع صغيرة من الأنابيب مع المشابك الأنبوب. المشبك أغلقت جميع الأنابيب. ختم صنبور على اسطوانة L أقصى اليمين 2.
- وضع بقضيب صغير في غرفة تحميل الخلية (الشكل 1A) وبقضيب أكبر في معظم اليسار 2 L اسطوانة (الشكل 1B) التي سوف تحتوي على 2٪ BSA.
- وضع غرفة الترسيب 2 L على منصة (1D الشكل). وضع يربك المعادن (الشكل 1F) مباشرة على الجزء العلوي من فتحة في الجزء السفلي من الغرفة الترسيب (الشكل 1D). هذا أمر بالغ الأهمية، كما يمنع يربك vortexing لمن السائل وتعطيل التدرج الخلية أثناء جمع الكسر. وضع غطاء على رأس غرفة الترسيب.
- بعد تطبيق كمية صغيرة جدا من الشحوم فراغ إلى أرض مشتركة الزجاج ثلاثي محبس (الشكل 1G)، المشبك محبس لأسفل حد ذاتهغرفة dimentation، وربط المفاصل الزجاج الأرضي من محبس وغرفة الترسيب.
- ربط الغرفة خلية التحميل (الشكل 1A) للمخرج حق محبس مع الأنابيب. إغلاق محبس.
- إرفاق أنابيب تجزئة الخلية إلى منفذ اليسرى من محبس. يضم أنابيب تجزئة قطعة من الأنابيب مع ماصة باستير الزجاج متصلة نهاية مفتوحة. وترد قطعة من أصغر تجويف أنابيب إلى نهاية ضيقة من ماصة الزجاج. ماصة ضيق يحد من تدفق تعليق خلية خلال جمع الكسر. المشبك هذا أنبوب صغير في أسفل جدا.
- إعداد 2 L كريبس (1X) العازلة يوم من التجربة (الجدول 1). ثم، وإعداد 550 مل 2٪ BSA في 1X كريبس، 550 مل 4٪ BSA في 1X كريبس، و 50 مل 0.5٪ BSA في 1X كريبس. تصفية وتبريد هذه الحلول إلى 4 درجات مئوية.
- صب الحل BSA 4٪ في L اسطوانة الحق 2 (الشكل 1C) وجيش صرب البوسنة 2٪الحل في ترك L 2 اسطوانة (الشكل 1B). تأكد من عدم وجود فقاعات كبيرة في الأنبوب الذي يربط هذه الاسطوانات.
- صب العازلة كريبس في غرفة التحميل الخلية وملء الأنابيب التي تربط هذه الغرفة مع غرفة الترسيب، والتأكد من عدم وجود فقاعات كبيرة، وهذه يمكن أن تعكر صفو التدرج. الضغط أو التحريك الأنبوب يساعد بلطف لإزالة الفقاعات. تأكد من أن جميع من المخزن المؤقت كريبس هو في الأنبوب وليس في غرفة الخلية.
- السماح لكمية صغيرة من العازلة كريبس في التدفق إلى غرفة الترسيب وثم تصفى تقريبا كل المخزن المؤقت في أنابيب تجزئة الخلية من أجل ملء الأنبوب وإزالة أي فقاعات كبيرة.
- وضع جامع الكسر مباشرة تحت غرفة الترسيب. التأكد من أن جميع الأنابيب جزء في مكان ومغطاة التفاف البلاستيك لمنع التلوث.
2. عزل الخلايا المنوية من الخصية الجامعة
3. تحميل الخلية والترسيب
- تأكد من أن يتم إغلاق محبس، ولكن في الموقف من شأنها أن تسمح لتدفق السائل من الغرفة الخلية (الشكل 1A) في غرفة الترسيب (الشكل 1D).
- بدوره على حد سواء لوحات بقضيب إلى إعداد منخفض (حوالي 70 دورة في الدقيقة) للسماح القضبان ضجة للتحرك بشكل مستمر، ولكن ببطء.
- صب تعليق خلية في غرفة الخلية (الشكل 1A) وفتح محبس بحيث تتدفق الخلايا ببطء الى غرفة الترسيب بمعدل 10 مل / دقيقة (الشكل 1D). إغلاق محبس. يمكن تحديد معدل التدفق عن طريق وضع علامة على فترات حجم الغرفة الترسيب.
- صب 5 مل من محلول 0.5٪ BSA في غرفة الخلية وتصب في غرفة الترسيب بمعدل 10 مل / دقيقة. إغلاق محبس. وهذه الخطوة غسل الخلايا من الغرفة الخلية. تكرار 4X.
- إعداد التدرج: فتح المشابك بين غرفة الخلية (الشكل 1A) واثنين من اسطوانات 2 L (الشكل 1B و C)، وتبدأ في استنزاف السائل الى غرفة الترسيب بمعدل 40 مل / دقيقة (الشكل 1D) على الفور. ضبط معدل تدفق لذلك يستغرق حوالي 20-30 دقيقة لتحميل التدرج BSA في غرفة الترسيب. رقيقة، وطبقة من الخلايا دون عائق الكذب على رأسوينبغي أن يكون BSA التدرج مرئية. مرة واحدة يتم تحميل معظم BSA، إغلاق محبس وتحويله إلى موقف من شأنها أن تسمح لاستنزاف السائل من غرفة الترسيب في أنبوب تجزئة.
- إيقاف لوحات ضجة.
- تسمح للخلايا أن الرواسب لمدة ساعة و 45 دقيقة. لا تخل الجهاز خلال هذه الفترة. أي الانفعالات الميكانيكية يمكن أن تعكر صفو التدرج.
4. تجزئة وتحليل الكسور
*** كما يمكنك تنفيذ الخطوات التالية، يجب الحرص على عدم تعكير صفو التدرج. إذا اختل التدرج BSA، فإن الإجراء لا يعمل!
- مرة واحدة وقد الرسوبية الخلايا، واستنزاف ببطء 50 مل من غرفة الترسيب في أنبوب مخروطي 50 مل وتوضع جانبا. هذا الكسر عادة ما تحتوي على كتل من الخلايا غير المرغوب فيها والحطام.
- نعلق الأنبوب جزء إلى جزء جامع. *** ومن الممكن أيضا لجمع الكسور باليد إذا كان جزء كوليالمنشئ غير متوفر.
- جمع الكسور: ضبط معدل التدفق مع محبس بحيث 10 مل (ملء أنبوب مجموعة واحدة) يتم جمعها كل 45 ثانية.
- سقف أنابيب جمع جزء وتدور لمدة 5 دقائق في 450 إطار التعاون الإقليمي في 4 درجات مئوية. تخلصي من طاف بلطف، والخلايا resuspend في السائل المتبقي، والحفاظ على الخلايا على الجليد.
- مرة واحدة يتم جمع جميع الكسور وتحليل مجهريا الكسور لصالح السكان مختلفة من الخلايا. ويمكن التمييز بين أنواع مختلفة من الخلايا استنادا إلى حجم الخلية ومورفولوجيا النووية 8،15 الشكل 2 يوضح "نتائج ممثلة" عن كسور المجمعة الثلاثة التي يتم إثراء للخلايا (أ) الجسمية والانتصافي وأمهات المني، (ب) طلائع منوية الجولة، و (ج) التمطيط والتكثيف طلائع منوية.
- اكتب A أمهات المني هي 12-14μm كاليفورنيا. في قطر ولها نواة جولة التي هي متجانسة في تكوينها لونين.
- نوع B أمهات المني هي 8 9μm كاليفورنيا. في قطر، وقد rounد نوى التي تظهر المغاير أكثر كثافة على طول محيط النووية.
- الخلايا المنوية قبل مرحلة ترقق الصبغيات هي 7.5 8.2μm كاليفورنيا. في القطر، ويكون السيتوبلازم أقل من النوع (ب) أمهات المني، ولها نوى التي تبدو مماثلة لتلك التي في النوع (ب) أمهات المني.
- الخلايا المنوية الأولية هي مرحلة ترقق الصبغيات 8-10 ميكرون كاليفورنيا. في قطر ولها نوى التي تبدو مشابهة لتلك الخلايا المنوية قبل مرحلة ترقق الصبغيات، ولكن يبدو للحصول على لونين أكثر كثافة في الغشاء النووي.
- دور الاقتبال الخلايا المنوية الأولية هي 10-12 ميكرومتر كاليفورنيا. في قطر ولها نوى التي تبدو مشابهة لتلك الخلايا المنوية الأولية مرحلة ترقق الصبغيات.
- الخلايا المنوية طور التثخن في أي مكان 12-18 ميكرومتر كاليفورنيا. في قطر، وتتألف من حافة رقيقة من السيتوبلازم المحيطة نواة كبيرة. ويمكن رؤية أكثر من لونين كتل كثيفة في النواة.
- طلائع منوية الجولة هي 10 ميكرومتر كاليفورنيا. في قطر ولها نواة مستديرة مع جسيم نووي المكتظة تلطيخ في الوسط.
- المتبقيالهيئات هي ~ 6.5 ميكرون في القطر، هي الجولة، وتفتقر إلى النواة.
- التمطيط والتكثيف طلائع منوية هي مماثلة في الحجم لجولة طلائع منوية، ولكن لديها فريدة من نوعها، على شكل المنجل النواة.
- تبدأ مع جزء 15 وتحليل كل خمس كسور يصل إلى 85. عادة، سوف الكسور أقل من 15 تكون مختلطة جدا وملتف، وسوف كسور فوق 85 تحتوي على عدد قليل من أي خلايا قابلة للاستخدام.
- لتحليل جزء صغير، واتخاذ 5UL من السائل من أنبوب جمع جزء (مرة واحدة وقد تم معلق الخلايا بعد الطرد المركزي) وإضافة إلى 5UL من 8٪ الفورمالديهايد في المخزن كريبس. تسمح للخلايا ثابتة للجلوس في درجة حرارة الغرفة لمدة خمس دقائق.
- إضافة 5UL من 0.1٪ تريتون ودابي (5 μ / مل العازلة كريبس) إلى الخلايا الثابتة. تسمح للخلايا للجلوس في درجة حرارة الغرفة لمدة 5 دقائق.
- وضع 10 ميكرولتر من الحل الناتج على شريحة، وتغطي مع انزلاق الغطاء، وتحليل مع المجهر مضان لتحديد نقاء كل جزء.
- الجمع بين الكسور التي تتشابه في الحجم والتشكل النووي (انظر "نتائج الممثل") لإنشاء السكان التالية من الخلايا: الخلايا مضاعفا الانتصافي والجسدية، طلائع منوية الجولة، والتكثيف / التمطيط طلائع منوية.
النتائج
نتيجة مثالية من الإجراء STA-PUT هو فصل ملحوظ نسبيا من الخلايا من الخصيتين يعتمد على حجم الخلية وكثافة. في حين أن الخلايا المعزولة من الخصيتين والمترسبة من خلال التدرج BSA، يمكن ملاحظة عدة نطاقات مميزة من الخلايا. أي كتل من الخلايا تميل إلى تنزل الى قاع الانحدار ولن تلوث الكسور الأخرى. مزيد قليلا حتى التدرج سيكون جسدية كبيرة والخلايا الانتصافي. أبعد ما يصل التدرج لا تزال وسوف تكون الجولة طلائع منوية صغيرة. سيتم مكثف في الجزء العلوي من التدرج طلائع منوية، الحيوانات المنوية، وتلويث خلايا الدم الحمراء (ويبدو أن هذه الخلايا مستديرة صغيرة بدون نواة).
الكسور يمكن تحليلها بسرعة باستخدام مزيج من الضوء والمجهر الفلورسنت (الشكل 2) 15. الانتصافي، النطفة، والخلايا مضاعفا الجسدية هي أكبر الخلايا الموجودة في الخصيتين وسوف تحتوي نوى الكبيرة التي relati صمة عارvely متجانس مع دابي. طلائع منوية الجولة هي خلايا صغيرة مع نواة مستديرة أصغر، وعموما مع تلطيخ جسيم نووي الزاهية. التكثيف / التمطيط طلائع منوية هي الخلايا الصغيرة التي غالبا ما تبدو مستطيل، كما لو ذيل صغير يتشكل. هذه الخلايا لديها، نوى المدمجة الصغيرة التي وصمة عار الزاهية مع دابي وتتشكل مثل المنجل. مرة واحدة يتم الجمع بين الكسور الخلية، والنقاء يمكن تحديد المزيد من خلال تحليل لطخة غربية من الخلية لست] (الشكل 3). علامات مشتركة من الخلايا الانتصافي هي معقدة المشبكي الخيطي 1 البروتينات Scp1 وSycp2 16. علامات مشتركة من التكثيف طلائع منوية هي بروتينات التحول (على سبيل المثال TP1) أو protamines 17.
على الرغم من كل تشغيل STA-PUT يمكن أن تكون مختلفة، سيتم العثور على خلايا عادة الانتصافي، أمهات المني والخلايا الجسدية مضاعفا في الكسور كاليفورنيا. 25-40، طلائع منوية جولة في الكسور كاليفورنيا. 55-65، والتكثيف / التمطيط طلائع منوية في الكسور كاليفورنيا.65-75 نظرا لفارق أصغر في الحجم بين الخلايا الانتصافي / الجسدية وطلائع منوية الجولة، والكسور كاليفورنيا. 45-50 في كثير من الأحيان حتى نسبة الخلايا الانتصافي / الجسدية وطلائع منوية الجولة. سوف تلطيخ مع دابي تساعد على التمييز بين هؤلاء السكان اثنين من الخلايا. هناك تداخل أقل من أرومة النطفة جولة والتكثيف / التمطيط الكسور أرومة النطفة نظرا إلى اختلاف أكبر في الحجم بين هؤلاء السكان اثنين من الخلايا. عادة، سوف الكسور أقل من 15 تحتوي على العديد من كتل كبيرة من الخلايا والكسور فوق 85 سوف تحتوي على عدد قليل من الخلايا والعديد من الهيئات المتبقية، أو السيتوبلازم غشاء محدد الذي سفك من قبل طلائع منوية.
عموما، عندما الخلايا من ~ 22 الخصيتين هي مجزأة مع الإجراء STA-PUT، فإنه ينتج كاليفورنيا. 8 10 خلية / نوع الخلية المنوية (الخلايا مضاعفا الجسدية / الانتصافي، طلائع منوية الجولة، والتكثيف / التمطيط طلائع منوية). يجب أن يتم الجمع بين الكسور لخلق السكان النهائي من الخلايا تكون على الاقل80٪ نقية لنوع من الخلايا في السؤال. إذا كنت لا ترى هذه الدرجة من النقاء أو أعلى، قد تكون هناك مشكلة مع فصل الخلايا أو التدرج BSA. أيضا، إذا كان هناك عدد قليل من الخلايا في الكسور 20 الأولى وفرة من الخلايا في الكسور 80 +، أو إذا كان هناك وفرة من الخلايا في الكسور 20 الأولى ويكاد أي كسور في 70 +، الترسيب الوقت يحتاج إلى مزيد من الأمثل. يرجى الاطلاع على مناقشة للحصول على اقتراحات حول كيفية تبادل لاطلاق النار المتاعب.

الشكل 1. إنشاء جهاز STA-PUT: وتظهر صورة التخطيطي والفعلي للجهاز STA-PUT. يتم توصيل جميع الأواني الزجاجية بواسطة أنابيب بلاستيكية، بما في ذلك الأنبوب الذي يربط الجهاز إلى جامع الكسر. السهام تشير إلى موقع المشابك. A) غرفة تحميل خلية، ويحتوي على بقضيب؛ B) 2 اسطوانة L ل2٪ BSA، ويحتوي على بقضيب؛ C) 2 L اسطوانة ل4٪ BSA؛ D) غرفة الترسيب؛ E) لوحات تحريك؛ F) يربك؛. G) محبس اضغط هنا لمشاهدة صورة بشكل اكبر .
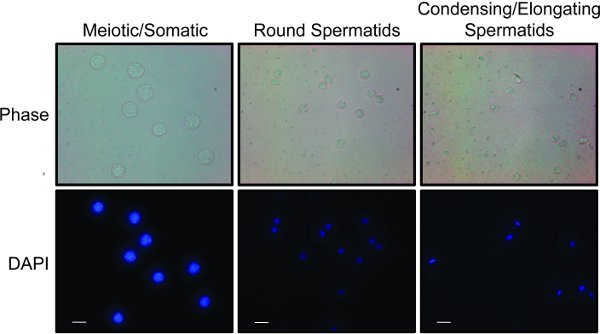
الشكل 2. تم الجمع بين الكسور إلى ثلاثة السكان منفصلة من الخلايا: السكان الخلية التي تم الحصول عليها من STA-PUT الخلايا الانتصافي والجسدية، طلائع منوية الجولة، والتكثيف والتمطيط طلائع منوية. اتسخت كل السكان مع دابي لإظهار الاختلافات في حجم النووية والتشكل. التصوير النقيض من المرحلة ينقل الاختلافات في حجم الخلية وشكلها. يمثل شريط أبيض 10 ميكرومتر. اضغط هنا لمشاهدة صورة بشكل اكبر .
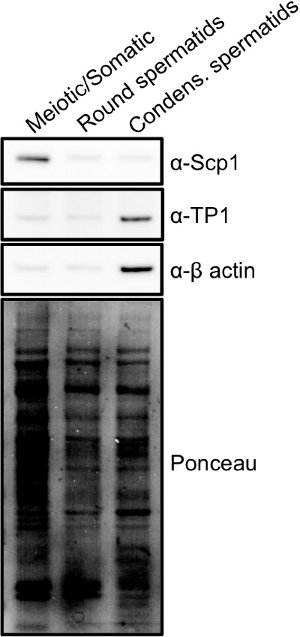
الرقم 3. وقدمت مقتطفات خلية كاملة من كل السكان الخلية هو مبين في الشكل (1) وأجري تحليل لطخة غربية لإظهار الاختلافات تعبير البروتين لكل السكان: علامات من السكان مختلفة من الخلايا التي تم الحصول عليها من STA-PUT. بروتين معقد المشبكي الخيطي 1 (Scp1) هو بروتين أعرب حصرا أثناء الانقسام الاختزالي وتم العثور المخصب في الكسور الانتصافي، بينما أثرى التكثيف أرومة النطفة جزء للبروتين الانتقالية 1 (TP1)، وهو بروتين أعرب في وقت متأخر من تكون النطاف. انقر هنا لعرض أكبر الصورة .
Discussion
أولئك الذين يدرسون الحيوانات المنوية الاعتماد على النماذج الحيوانية لعينات الخلايا المنوية، كنظام ثقافة الخلية موثوق بها لا وجود لها حتى الآن طريقة لتوليد كل أنواع الخلايا المنوية 3. على الرغم من أن الخلايا المنوية يتم جمعها بسهولة من الخصيتين كله، النتائج فقط من السكان مختلطة. هذا يطرح مشكلة بالنسبة لأولئك الذين يرغبون في دراسة فرعية معينة من هذه الخلايا، مثل الخلايا الانتصافي، طلائع منوية الجولة، وطلائع منوية التكثيف. وتستخدم ثلاث طرق مختلفة حاليا لفصل هذه الأنواع الفرعية من الخلايا المنوية: STA-PUT، نظام مراقبة الأصول الميدانية، وتصويل 6-13. طريقتين الأخيرة تتطلب الوصول إلى قطعة من المعدات باهظة الثمن: فارز الخلية وelutriator، على التوالي. على الرغم من أن طريقة نظام مراقبة الأصول الميدانية تعطي السكان نقية للغاية من مختلف أنواع الخلايا المنوية، أن هذه العملية تستغرق ست ساعات وينتج فقط 0.5-2.0 × 10 6 خلايا لكل نوع من الخلايا في 02:58 الخصيتين 11. تصويل، مثل ميث STA-PUTالتطوير التنظيمي، يفصل الخلايا استنادا إلى حجم وكثافة، ولكن يتطلب الوصول إلى elutriator، والتي هي أكثر تكلفة من جهاز STA-PUT.
يستخدم الإجراء STA-PUT التدرج BSA بسيطة لفصل الخلايا المنوية من مختلف الأحجام مع تحقيق عائد مرتفع نسبيا (~ 10 8 خلايا / السكان في ~ 22 الخصيتين). بالنسبة إلى أساليب نظام مراقبة الأصول الميدانية، وإجراء STA-PUT ينتج المزيد من الخلايا / الخصية ويستغرق وقتا أقل بكثير لفصل أنواع الخلايا. بالمقارنة مع نظام مراقبة الأصول الميدانية وتصويل، الإجراء STA-PUT بسيطة وغير مكلفة نسبيا. وSTA-PUT يتطلب سوى غرفة باردة أو ثلاجة كبيرة ومجموعة من الأواني الزجاجية المتخصصة، مما يجعلها وسيلة مثالية للمختبرات دون الوصول إلى فارز الخلية أو elutriator. عندما يقوم بشكل صحيح، يمكن أن STA-PUT توفير السكان نقية ما يقرب من 90٪ من طلائع منوية مستديرة أو طلائع منوية التكثيف.
طريقة STA-PUT مفيد جدا، ولكن يتطلب التحسين في العديد من الخطوات المختلفة، وخاصة لياليedimentation. يمكن أن يكون سبب الانفصال دون المستوى الأمثل من أنواع الخلايا عدة قضايا مختلفة، تتعلق معظم التدرج BSA. لجعل التدرج السليم، بدوره على القضبان ضجة في الغرفة التحميل الخلية والاسطوانة 2 L عقد BSA 2٪ بينما تقوم بإنشاء التدرج. مسح أيضا كل من أنابيب فقاعات ووضع يربك في مكان في غرفة الترسيب قبل تحميل الخلايا. خفض معدل تدفق BSA داخل أو خارج غرفة الترسيب قد تساعد. الأهم من ذلك، لا ينبغي أن تكون منزعجة جهاز STA-PUT خلال إنشاء التدرج، الترسيب، أو جمع الكسر.
دون المستوى الأمثل عائدات الخليوي يمكن أن يكون نتيجة لعدم كفاية عدد / حجم الخصيتين، وعدم كفاية فصل الخلايا أثناء العلاج كولاجيناز / التربسين، والتثاقل الخلية. إذا كان أحد غير قادر على الحصول على العدد المناسب من الخلايا لهذا البروتوكول STA-PUT بسبب استخدام الفئران حديثي الولادة أو المورثات التي تنتج أعداد صغيرة من سل المنويةليرة سورية، فإنه قد يكون من الضروري استخدام أكثر الحيوانات في STA-PUT أو لأجل مجموعة STA طرح الأواني الزجاجية الأمثل لأحجام أصغر وأرقام الهواتف المحمولة (متوفر من ProScience) 18. للحصول على العدد الأمثل من الخلايا (700-800٬000٬000)، استخدم ما لا يقل عن 11 الفئران الذكور في سن الإنجاب، من الناحية المثالية على الأقل 8-9 أسابيع من العمر. ومع ذلك، يجب أن يتم تحميل أي أكثر من 800 مليون خلية في واحد STA-PUT. إذا لم نأت الخلايا في تعليق خلية واحدة بعد التربسين العلاج، ويمكن زيادة تركيز الدناز تصل إلى 1 ميكروغرام / 5 مل الحل. الدناز حساسة لتكرار دورات تجميد / الذوبان، واستخدام الدناز جديدة في كل مرة سوف يؤدي إلى التشتت أكثر فعالية من الأنابيب في تعليق خلية واحدة. يمكن للمرء أن استخدام ماصة واسعة تتحمل لمساعدة تحطيم كتل الخلية قبل الترشيح من خلال شبكة.
جانب واحد من الأسلوب STA-PUT التي تتطلب الأمثل هو مقدار الوقت يسمح لخلايا الرواسب من خلال التدرج BSA. ساعة واحدةو45 دقيقة عادة ما يعمل بشكل جيد، ولكن هذه المرة قد تختلف من مختبر لمختبر. عادة، طبقات مختلفة من الخلايا ويمكن رؤية البصر في جميع أنحاء التدرج BSA. إذا كان هناك عدد قليل من الخلايا في الكسور 20 الأولى جمعها وفرة من الخلايا في الكسور 80 +، قد نحتاج لبعض الوقت الترسيب لتمديدها. إذا كان هناك عدد كبير جدا من الخلايا في الكسور 20 الأولى جمعها وهناك فصل كافية من أنواع الخلايا، قد نحتاج لبعض الوقت ليتم الترسيب خفضت.
الخلايا المكتسبة مع الإجراء STA-PUT يمكن استخدامها لكثير من أنواع مختلفة من التجارب. يوفر STA-PUT مادة وفيرة للتحليل لطخة غربية، المناعي، وتحليل الحمض النووي الريبي، على الرغم من أن التجارب الكيمياء الحيوية على نطاق واسع قد تتطلب الجمع بين المواد المختلفة من عدة أشواط STA-PUT. عندما فصل من أنواع الخلايا الأخرى، طلائع منوية فرداني يمكن تربيتها وتعرض للتلاعب في المختبر الجزيئي لمدة تصل إلى ثلاثة أيام، والتي يمكن أن يكون أسهل من في الجسم الحي العلاج أو خلق حيوان خروج المغلوب 19. وقد تم استزراع الخلايا التي تم الحصول عليها مع بروتوكول STA-PUT وصف ليوم واحد دون علامات واضحة للتلوث، ولكن إذا الخلايا لاستخدامها لفترة أطول تجارب زراعة الخلايا، ويجب تعقيم المعدات مع الإيثانول، جميع الحلول يجب تصفية تعقيمها، وجميع خطوات قبل التحميل الخلية وبعد جمع جزء يجب أن يؤديها في نسيج الثقافة هود. بالإضافة إلى ذلك، تحتوي على مضادات حيوية سائل الإعلام والثقافة التي ينبغي استخدامها. حقيقة أن طريقة STA-PUT لا تتطلب تثبيت الخلية يجعلها مثالية لإجراء التجارب التي تتطلب خلايا قابلة للحياة.
Disclosures
يعلن الكتاب أنه ليس لديهم مصالح مالية المتنافسة. هذا البروتوكول يتم شرحها ينطوي على استخدام الفئران المختبرية وأعدم في الامتثال لجميع المبادئ التوجيهية واللوائح والوكالات التنظيمية ذات الصلة. تتم المحافظة على الحيوانات المستخدمة في هذا البروتوكول بتوجيه وموافقة من جامعة جنة رعاية الحيوان واستخدام المؤسسية ولاية بنسلفانيا (IACUC بروتوكول # 804284).
Acknowledgements
وأيد هذا البحث من قبل المعاهد الوطنية للصحة منح GM055360 إلى SLB وU54HD068157 لRGM. وأيد JMB من التدريب غرانت T32 علم الوراثة في جامعة ولاية بنسلفانيا (GM008216).
Materials
| Name | Company | Catalog Number | Comments |
| BSA | Affymetrix/USB | 10857 100MG | Alternate can be used. |
| 0.5%, 2%, and 4% BSA solutions | Dissolve 0.25 g, 11 g, and 22 g (respectively) in total volumes of 50 ml, 550 ml, and 550 ml of 1x KREBS (respectively). | To be made day of the STA-PUT procedure. Filter sterilize. | |
| KREBS (10x) | 3.26 g KH2PO4 + 139.5 g NaCl +5.89 g MgSO4/7H20 + 40 g Dextrose + 3.78 g CaCl2/2H20 + 7.12 g KCl, bring to 2 L with ddH20 | Autoclave/filter and store at 4 °C for several months. | |
| KREBS (1x) | Dissolve 4.24 g NaHCO3 in 100 ml ddH20. Add 200 ml 10x KREBS. Bring to 2 L with ddH20. | To be made day of the STA-PUT procedure. Filter sterilize. | |
| Collagenase | Sigma | C9891-1G | |
| DNAse | Sigma | DNEP-5MG | |
| Trypsin | Sigma | T9201-1G | |
| DAPI | Preference of researcher | ||
| Triton-X100 | Preference of researcher | ||
| Formaldehyde (~37%) | Preference of researcher | ||
| TABLE 2: EQUIPMENT | |||
| Equipment | Company | Catalog # | Comments |
| Complete STA-PUT apparatus | ProScience Glass Shop | STA-PUT (this procedure uses the standard sedimentation chamber: Cat. No. 56700-500) | Includes all glassware and equipment for the apparatus. Alternate glassware is available for performing STA-PUT with smaller cell numbers. |
| 10 μm mesh filter | Fisherbrand | 22363549 | |
| Mouse dissection tools | Preference of researcher | ||
| 14 ml round bottom fraction collection tubes with caps | Preference of researcher | ||
| Need approximately 100 tubes | |||
| Fraction collector | GE Healthcare Life Sciences | Model: Frac-920, Product code: 18-1177-40 | Alternate can be used. |
| Microscope slides, cover glass | Preference of researcher | ||
| Light/Fluorescent Microscope | Preference of researcher |
References
- Wistuba, J., Stukenborg, J., Luetjens, C. M. Mammalian Spermatogenesis. Funct. Dev. Embryol. 1, 99-117 (2007).
- Hess, R. A., Cooke, P. S., Hofmann, M. C., Murphy, K. M. Mechanistic insights into the regulation of the spermatogonial stem cell niche. Cell Cycle. 5, 1164-1170 (2006).
- Dores, C., Alpaugh, W., Dobrinski, I. From in vitro culture to in vivo models to study testis development and spermatogenesis. Cell Tissue Res. 349, 691-702 (2012).
- Hayashi, K., Ohta, H., Kurimoto, K., Aramaki, S., Saitou, M. Reconstitution of the mouse germ cell specification pathway in culture by pluripotent stem cells. Cell. 146, 519-532 (2011).
- Easley, C. A., et al. Direct differentiation of human pluripotent stem cells into haploid spermatogenic cells. Cell Rep. 2, 440-446 (2012).
- Bellve, A. R. Purification, culture, and fractionation of spermatogenic cells. Methods Enzymol. 225, 84-113 (1993).
- Meistrich, M. L., Bruce, W. R., Clermont, Y. Cellular composition of fractions of mouse testis cells following velocity sedimentation separation. Exp. Cell Res. 79, 213-227 (1973).
- Romrell, L. J., Bellve, A. R., Fawcett, D. W. Separation of mouse spermatogenic cells by sedimentation velocity. A morphological characterization. Dev. Biol. 49, 119-131 (1976).
- Miller, R. G., Phillips, R. A. Separation of cells by velocity sedimentation. J. Cell Physiol. 73, 191-201 (1969).
- Bastos, H., et al. Flow cytometric characterization of viable meiotic and postmeiotic cells by Hoechst 33342 in mouse spermatogenesis. Cytometry A. 65, 40-49 (2005).
- Getun, I. V., Torres, B., Bois, P. R. Flow cytometry purification of mouse meiotic cells. J. Vis. Exp. (50), e2602 (2011).
- Grabske, R. J., Lake, S., Gledhill, B. L., Meistrich, M. L. Centrifugal elutriation: separation of spermatogenic cells on the basis of sedimentation velocity. J. Cell Physiol. 86, 177-189 (1975).
- Meistrich, M. L., Trostle, P. K. Separation of mouse testis cells by equilibrium density centrifugation in renografin gradients. Exp. Cell Res. 92, 231-244 (1975).
- Gassei, K., Ehmcke, J., Schlatt, S. Efficient enrichment of undifferentiated GFR alpha 1+ spermatogonia from immature rat testis by magnetic activated cell sorting. Cell Tissue Res. 337, 177-183 (2009).
- Bellve, A. R., et al. Spermatogenic cells of the prepuberal mouse. Isolation and morphological characterization. J. Cell Biol. 74, 68-85 (1977).
- Handel, M. A., Schimenti, J. C. Genetics of mammalian meiosis: regulation, dynamics and impact on fertility. Nat. Rev. Genet. 11, 124-136 (2010).
- Zhao, M., Shirley, C. R., Mounsey, S., Meistrich, M. L. Nucleoprotein transitions during spermiogenesis in mice with transition nuclear protein Tnp1 and Tnp2 mutations. Biol. Reprod. 71, 1016-1025 (2004).
- Manku, G., Mazer, M., Culty, M. Neonatal testicular gonocytes isolation and processing for immunocytochemical analysis. Methods Mol. Biol. 825, 17-29 (2012).
- Dehnugara, T., Dhar, S., Rao, M. R. An in vitro, short-term culture method for mammalian haploid round spermatids amenable for molecular manipulation. Mol. Reprod. Dev. 79, 19-30 (1002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved