Method Article
Die Trennung der Spermatogenese Zelltypen Mit STA-PUT Velocity Sedimentation
In diesem Artikel
Zusammenfassung
Die STA-PUT Verfahren ermöglicht die Trennung der verschiedenen Populationen von Zellen spermatogenic basierend auf Größe und Dichte.
Zusammenfassung
Säugetier Spermatogenese ist ein komplexer Prozess, der Differenzierung in den Samenkanälchen der Hoden in mehreren Stufen erfolgt. Derzeit gibt es keine zuverlässigen Zellkultursystem, das für die Spermatogenese in vitro Differenzierung, und die meisten biologischen Untersuchungen der Spermatogenese Zellen benötigen Ernte Gewebe aus Tiermodellen, wie Maus und Ratte. Da die Hoden enthält zahlreiche Zelltypen - sowohl nicht-Spermatogenese (Leydig, Sertoli, myeloische und Epithelzellen) und Spermatogenese (Spermatogonien, Spermatozyten, runde Spermatiden, Brenn Spermatiden und Spermatozoen) - Studien über die biologischen Mechanismen der Spermatogenese beteiligt erfordern die Isolation und Anreicherung dieser verschiedenen Zelltypen. Die STA-PUT Verfahren ermöglicht die Trennung einer heterogenen Population von Zellen - in diesem Fall aus den Hoden - durch einen linearen Gradienten BSA. Einzelne Zelltypen mit unterschiedlichen sedimentieren Sedimentationsgeschwindigkeit nach cell Größe und Fraktionen für verschiedene Zelltypen angereichert können gesammelt und in weitere Analysen genutzt werden. Während der STA-PUT Verfahren nicht in hochreiner Fraktionen von Zelltypen, wie z. B. mit bestimmten Zellsortierverfahren erreicht werden ergeben, liefert es eine wesentlich höhere Ausbeute an Gesamtzellen in jeder Fraktion
(~ 1 × 10 8 Zellen / Spermatogenese Zelltyp aus einer Anfangspopulation von 7-8 x 10 8 Zellen). Diese hohe Ausbeute Methode erfordert nur Glaswaren spezialisiert und kann in jeder kalten Raum oder großer Kühlschrank durchgeführt werden, so dass es eine ideale Methode für Labors, die nur begrenzten Zugang zu spezialisierten Geräten wie einem Fluoreszenz-aktivierten Zellsortierer (FACS) oder Elutriator haben.
Einleitung
Säugetier Spermatogenese ist ein komplexer Prozess, der Differenzierung in den Samenkanälchen der Hoden ein in mehreren Stufen erfolgt. Kurz gesagt, wie Stammzellen-Spermatogonien, die in der Nähe des Epithels der Samenkanälchen Kluft wohnen und differenzieren sich in Spermatozyten, die dann meiotischen Teilungen zu unterziehen. Nach Abschluss der Meiose ist die resultierenden haploiden Zellen oder runden Spermatiden, Spermiogenese unterziehen, eine Differenzierung, die den Abbau von Zytoplasma und Verdichtung der Kern beinhaltet. Spermatiden schrittweise ein Flagellum und Dehnung und Kondensation des Kerns unterzogen, wodurch verlängert und dann Kondensieren Spermatiden sind. Die Endprodukte sind Spermatozoen, die in das Lumen des Tubulus und schließlich in den Nebenhoden, wo sie weiter reifen freigesetzt.
Da der Prozess der Spermatogenese sieht spezielle hormonelle und Molekularbedingungendie Hoden, eine zuverlässige in vitro-Kultursystem für den gesamten Prozess der Spermatogenese wurde noch nicht entwickelt worden ist 2,3. Kultur Methoden für die Erstellung von "Ur-Keimzellen-ähnlichen Zellen" und haploid, "rund Spermatide-ähnliche Zellen" aus Stammzellen entwickelt worden, aber diese Methoden sind noch nicht in der Lage, eine große Anzahl dieser Zellen zu erzeugen und nicht zu später spermatogenen Zelle erzeugen 4,5 Typen. Glücklicherweise unterscheiden sich die Spermatogenese Zelltypen deutlich in der Größe, die für eine aus ganzen Hoden mit einer Flüssigkeit Gradienten getrennt werden, erhalten Einzelzellsuspension ermöglicht. Die STA-PUT-Methode, hier gezeigt, verwendet einen linearen Gradienten BSA und einfache Sedimentation spermatogenen Zellen zu trennen, basierend auf Größe und Masse 9.6.
Die STA-PUT-Methode hat mehrere Vorteile gegenüber den anderen beiden am häufigsten verwendeten Methoden, um spermatogenen Zelltypen zu trennen: FACS und Elutriation 10-13. Die STA-PUT Gerät erfordert only mehrere Stücke von Glaswaren spezialisiert in einem kalten Raum oder großer Kühlschrank montiert. Somit ist es weniger teuer als die Verwendung eines Zellsortierer oder eine Elutriator. Die STA-PUT Verfahren ergibt höhere Mengen an Zellen pro Zelltyp und Testis, als durch FACS in einer vergleichbaren Zeitspanne sortiert werden, wobei die Reinheit jeder Zellpopulation ist nicht so hoch wie die mit FACS-11 erhalten. Zellsortierung Verwendung magnetische Kügelchen (magnetisch aktivierten Zellsortierung, MACS) wurde kürzlich erfolgreich für die Anreicherung von Spermatogonien aus einer gemischten Zellpopulation Hoden beschäftigt, aber es ist derzeit für die Trennung Spermatozyten oder Spermatiden aufgrund mangelnder Kenntnisse der entsprechenden Oberfläche Marker 14 ungeeignet ist. Ein zusätzlicher Vorteil der STA-PUT Verfahren über FACS oder MACS ist die Fähigkeit, lebensfähige Zellen für die nachfolgende Kultur zu isolieren, weil im Gegensatz zu den meisten FACS Protokolle sie keine DNA oder andere Arten der Färbung erforderlich. Für Studien, die l erfordernarge Ausbeuten der Spermatogenese Zelltypen bei ~ 90% Reinheit, ist der STA-PUT eine ideale Methode.
Protokoll
Die STA-PUT-Protokoll in drei Stufen: 1) aus dem Gerät und Reagenzien Set, 2) Herstellung der Zellsuspension aus ganzen Hoden, und 3) für Zellen, Sedimentation und Fraktionssammlung. Wenn von einem Team von zwei Forschern durchgeführt wird, nimmt das Protokoll 8 Stunden im Durchschnitt.
1. Einrichten der STA-PUT-Apparat (Abbildung 1)
*** STA-PUT-Geräte sollten im 4 ° C großen Kühlschrank oder einem kühlen Raum, der auch einen Fraktionssammler aufnehmen kann gestellt werden, wenn das Verfahren der Sammlung wird bevorzugt.
- In der Nacht vor (oder zumindest ein paar Stunden vor) Sie das Verfahren durchzuführen, waschen alle Geräte (vor allem die Glaswaren und Schläuche) und sterilisieren mit 70% Ethanol. Lassen Sie Geräte vollständig trocknen, bevor die Montage der Vorrichtung, wie in Abbildung 1 dargestellt.
- Befestigen Sie die beiden L 2 Zylindern (1B und C) und die Zelle Laderaum ( 1A) auf der oberen Plattform und verbinden alle mit zwei kleinen Schlauchstücke mit Schlauchschellen. Klemmen Sie alle Röhren geschlossen. Verschließen Sie den Auslauf auf der rechten höchstens 2 L Zylinder.
- Setzen Sie einen kleinen Rührstab in der Zelle Ladekammer (Abbildung 1A) und eine größere Rührstab in der am weitesten links L 2 Zylinder (1B), die die 2% BSA enthalten wird.
- Legen Sie die 2 L Sedimentation Kammer auf der Plattform (1D). Legen Sie die Metallprall (1F) direkt auf die Öffnung in der Unterseite der Sedimentation Kammer (1D). Dies ist kritisch, da die Ablenkplatte verhindert Verwirbelung der Flüssigkeit und der Zerstörung der Zell Gradienten während Fraktionssammlung. Setzen Sie den Deckel auf der Oberseite der Kammer Sedimentation.
- Nach der Anwendung einer sehr kleinen Menge von Vakuumfett auf den Schliff des Dreiwegehahn (Fig. 1G), spannen das Sperrventil zum Boden des SEdimentation Kammer, welche die Glasschliffe der Hahn und der Sedimentation Kammer.
- Verbinden des Mobilladekammer (1A) auf der rechten Auslass des Absperrventils mit Schlauch. Schließen Sie den Wasserhahn.
- Befestigen Sie die Zellfraktionierung Schlauch an der linken Ausgang der Hahn. Die Fraktionierung Schlauch umfasst eine Rohrstück mit einer Glaspasteurpipette mit dem offenen Ende verbunden ist. Ein Stück der kleineren Bohrungsschlauch ist mit dem schmalen Ende der Glaspipette befestigt. Der schmale Pipetten die Strömung der Zellsuspension während Fraktion sammeln. Klemmen Sie dieses kleine Rohr ganz unten.
- Herstellung von 2 L Krebs (1x) puffern den Tag des Experiments (Tabelle 1). Dann bereiten 550 ml 2% BSA in 1x Krebs, 550 ml 4% BSA in 1x Krebs, und 50 ml 0,5% BSA in 1x Krebs. Filtern und zu kühlen, diese Lösungen auf 4 ° C
- Gießen Sie die 4% BSA-Lösung in die richtige L 2 Zylinder (1C) und der 2% BSALösung in der linken Zylinder L 2 (Fig. 1B). Stellen Sie sicher, es gibt keine großen Blasen in der Rohrleitung, die diese Zylinder verbindet.
- Gießen Sie Krebs-Puffer in die Zelle Ladekammer und füllen Sie den Schlauch Anschluss dieses Kammer mit der Sedimentation Kammer, um sicherzustellen, gibt es keine großen Luftblasen, da diese das Gefälle zu stören. Quetschen oder schnippte den Schlauch hilft sanft um die Blasen zu entfernen. Sicherzustellen, dass alle von dem Krebs-Puffer ist in dem Rohr und in der Zellkammer.
- Lassen Sie eine kleine Menge von Krebs-Puffer in die Sedimentation Kammer strömen und dann abtropfen lassen fast alle den Puffer in die Zelle Fraktionierung Schlauch, um die Röhre zu füllen und entfernen Sie alle großen Blasen.
- Setzen Sie den Fraktionssammler direkt unter der Sedimentation Kammer. Stellen Sie sicher, dass alle Bruchrohre vorhanden sind und mit Plastikfolie abgedeckt, um eine Kontamination zu verhindern.
2. Trenn spermatogenen Zellen aus Voll Hoden
- Dissect Hoden ab ca. 12 erwachsenen Mäusen (vorzugsweise mindestens acht Wochen alt) und in Krebs-Puffer bei Raumtemperatur zu waschen Sie die Gefährdungs Material. Dieses Protokoll demonstriert beinhaltet die Verwendung von Labormäusen und wurde in Übereinstimmung mit den Richtlinien der Universität von Pennsylvania Institutional Animal Care und Verwenden Ausschuss ausgeführt.
- In 45 mg Kollagenase zu 50 ml Krebs-Puffer in einem konischen Rohr rechts, bevor Sie beabsichtigen, die Samenkanälchen hinzufügen. Ermöglichen diese Lösung zu erwärmen auf 33 ° C für wenige Minuten. Split gleichmäßig in zwei 50 ml konischen Röhrchen.
- Entkapseln die Hoden in einer separaten Platte mit 8 ml Krebs-Puffer, das Verwerfen der Tunica albuginea und Lösen der Samenkanälchen. Die Tunica albuginea ist die dünne Membran, die die Samenleiter umgibt. Die Röhrchen sollten leicht lösen sich von der Tunica albuginea. Um dies zu tun, einen Einschnitt in der Tunica albuginea, halten Sie diese Membran mit einem pair der Zange, und drücken Sie die Tubuli aus und weg von der Membran mit einer anderen Pinzette.
- 4 ml Krebs-Puffer, die die Tubuli zu jeder konischen Röhrchen mit 25 ml Kollagenase-Lösung und Inkubation unter Schütteln bei 33 ° C für 10 min. Am Ende sollten die Tubuli ein "Spaghetti-like" Aussehen haben.
- Lassen Sie die Röhrchen für ca. 5 Min. auf den Boden des Röhrchens zu begleichen. Gießen Sie den Überstand und waschen 2x in 25 ml Krebs-Puffer (bei Raumtemperatur), so dass die Röhrchen auf den Boden der Röhre jedes Mal zu begleichen. Lassen ~ 5 ml Krebs-Puffer in jedes Röhrchen.
- Beim Waschen, fügen Sie 30 mg Trypsin zu 50 ml Krebs-Puffer in einem Falcon-Röhrchen rechts, bevor Sie beabsichtigen, die Samenkanälchen hinzufügen. Ermöglichen diese Lösung zu erwärmen auf 33 ° C für wenige Minuten. Split gleichmäßig in zwei 50 ml konischen Röhrchen.
- 25 ml Trypsin-Lösung zu jedem der beiden Rohre, die die Tubuli. In 3 ug DNAse (1 μg/10ml) in jedes Röhrchen zu Zelle verhinderns aus verklumpen. Inkubiere unter Schütteln bei 33 ° C für 10 min.
- Verwenden Sie eine breite Bohrung Pipette, um die Lösung, die die Tubuli agitieren, in und aus dem Pipettieren sie ca. 10x. Die Lösung sollte beginnen, mehr wie eine Einzelzellsuspension zu suchen.
- Inkubiere unter Schütteln bei 33 ° C für weitere 10 min. Verwenden Sie eine breite Bohrung Pipette, um die Tubuli in eine Einzelzellsuspension zu zerstreuen, in und aus dem Pipettieren sie ca. 25x. Wenn Sie immer noch eine Menge von Tubuli oder Zellklumpen, zerstreuen mehr mit der Pipette und / oder fügen Sie eine weitere 3 ug DNAse zu jedem Rohr (Doppelausgangskonzentration).
- Filtern der Einzelzellsuspension durch ein 100 &mgr; m-Mesh-Zellsieb (eine für jedes Rohr von 30 ml Zellsuspension). Vereinige die Zellsuspensionen und zählen die Gesamtzahl der Zellen (sollte zwischen 7-8 × 10 8 Zellen). *** VERBOTEN MEHR ALS 800 Millionen Zellen auf der Steigung.
- Basierend auf der Zellzahl in Schritt 2.10 erhalten, das Pellet appropriate Volumen von gefilterten Zellen bei 450 rcf für 5 Minuten und wäscht mit 30 ml Krebs-Puffer. Wiederholen. 22 *** Normalerweise Hoden wird mehr als 800 Millionen Zellen ergeben, aber nicht mehr als diese Anzahl von Zellen zu laden.
- Die Zellen vorsichtig in 25 ml 0,5% BSA enthält, zwischen 2,5 und 5 ug DNAse (je nach dem Grad der Zell-Verklumpungen) ohne Blasen. Stellen Sie sicher, dass die Zellen, die nicht verklumpen. Filtern Sie die Einzelzellsuspension durch ein 100 um Maschen Zellsieb. Die Zellen sind nun bereit, zu laden. Gut mischen vor dem Laden durch Umdrehen des Röhrchens ein paar mal.
3. Handy laden und Sedimentation
- Sicherstellen, dass der Hahn geschlossen ist, aber in der Lage, durch die Flüssigkeit aus der Zellkammer (1A) in die Absetzkammer (1D) fließt.
- Schalten Sie beide Rührstab Platten auf einer niedrigen Einstellung (ca. 70 min), damit die Rührstäbe, um kontinuierlich zu bewegen, aber langsam.
- Gießen Sie die Zellsuspension in die Zellkammer (Abbildung 1A), und öffnen Sie den Wasserhahn, so dass die Zellen fließen langsam in die Sedimentation Kammer bei einer Rate von 10 ml / min (1D). Schließen Sie den Wasserhahn. Durchflussmenge kann durch Markieren Volumen Abständen auf der Sedimentation Kammer bestimmt werden.
- Pour 5 ml 0,5% BSA-Lösung in die Zellkammer anschließen und in der Sedimentationskammer mit einer Rate von 10 ml / min. Schließen Sie den Wasserhahn. Dieser Schritt wird die Zellen aus der Zellkammer waschen. Wiederholen 4x.
- Vorbereitung der Gradient: Öffnen der Klammern zwischen der Zellkammer (1A) und zwei 2 l Zylinder (1B und C), und beginnt, die Flüssigkeit in der Absetzkammer mit einer Rate von 40 ml / min (Fig. 1D) Drain sofort. Die Durchflussmenge so dauert es ca. 20-30 Minuten, bis die BSA-Gradienten in der Sedimentationskammer laden. Eine dünne Schicht von Zellen ungestört oben auf die LiegeBSA-Gradienten sichtbar sein soll. Nachdem die meisten der BSA geladen ist, schließen Sie den Wasserhahn und schalten Sie ihn in die Position, dass die Flüssigkeit aus der Sedimentation Kammer in die Fraktionierung Rohr ablaufen wird.
- Schalten Sie die Platten für Aufsehen.
- Lassen Sie die Zellen für eine Stunde und 45 Minuten sedimentieren. Bitte nicht stören DAS GERÄT während dieser Zeit. Jede mechanische Bewegung könnte den Verlauf zu stören.
4. Fraktionierung und Analyse der Fraktionen
*** Wie Sie die folgenden Schritte durchführen, achten Sie darauf, um den Verlauf zu stören. Wenn die BSA-Gradienten gestört ist, wird das Verfahren nicht funktionieren!
- Sobald die Zellen sedimentiert, langsam abfließen 50 ml von der Sedimentation Kammer in eine 50 ml konischen Röhrchen und beiseite stellen. Diese Fraktion enthält in der Regel unerwünschte Zellklumpen und Trümmer.
- Befestigen Sie die Rohrbruchteil auf die Fraktion Sammler. *** Es ist auch möglich, um die Fraktionen mit der Hand zu sammeln, wenn ein Bruch collector ist nicht verfügbar.
- Sammeln Fraktionen: Die Durchflussrate mit dem Hahn, so dass 10 ml (Füllung ein Sammelrohr) wird alle 45 Sekunden gesammelt.
- Verschließen Sie die Fraktionssammelrohre und Spin für 5 min bei 450 rcf bei 4 ° C Überstand abgießen vorsichtig resuspendieren Zellen im verbleibenden Flüssigkeit und Zellen auf Eis halten.
- Nachdem alle Fraktionen gesammelt werden, mikroskopisch analysieren die Fraktionen für die verschiedenen Zellpopulationen. Verschiedene Zelltypen können auf der Grundlage der Zellgröße und Zellkernmorphologie 8,15 unterscheiden. Fig. 2 zeigt "repräsentative Ergebnisse" für die drei gepoolten Fraktionen, die (a) und somatische Zellen und meiotische Spermatogonien angereichert sind, (b) runden Spermatiden und (c) verlängert und Brenn Spermatiden.
- Typ A Spermatogonien sind 12-14 um ca. im Durchmesser und haben runde Kerne, die homogen in der Chromatin-Zusammensetzung sind.
- Typ B Spermatogonien sind 8-9 um ca. Durchmesser und haben round Kerne, die dichter Heterochromatin an der Kernperipherie zu zeigen.
- Pre-Leptotän Spermatozyten sind 7.5-8.2μm ca. Durchmesser von weniger als Cytoplasma Typ B-Spermatogonien und haben Kerne, die ähnlich denen in Typ B-Spermatogonien aussehen.
- Leptotän primären Spermatozyten sind um ca. 10.08. Durchmesser und haben Kerne, die ähnlich denen der vorge Leptotän Spermatozyten aussehen, scheinen aber dichter Chromatin in der Kernmembran zu erhalten.
- Zygotän primären Spermatozyten sind ca. 10-12 um. Durchmesser und haben Kerne, die ähnlich denjenigen der primären Spermatozyten Leptotän aussehen.
- Pachytän Spermatozyten sind überall um ca. 12-18. im Durchmesser und bestehen aus einer dünnen Rand Zytoplasma rund um einen großen Zellkern. Mehr Klumpen von dichten Chromatins im Zellkern zu erkennen.
- Runden Spermatiden sind ca. 10 um. Durchmesser und einen runden Kern mit einem dicht Färbung Chromozentrum in der Mitte.
- RestKörper ~ 6,5 &mgr; m im Durchmesser, sind rund, und keinen Kern.
- Dehnen und Brenn Spermatiden sind ähnlich groß wie runden Spermatiden, aber haben eine einzigartige, sichelförmigen Kern.
- Beginnen Sie mit der Fraktion 15 und alle fünf Fraktionen bis zu 85 zu analysieren. Normalerweise werden Fraktionen unter 15 gemischt und zu klumpig sein und Fraktionen über 85 werden nur wenige bis gar keine brauchbare Zellen enthalten.
- Um eine Fraktion zu analysieren, nehmen 5UL von Flüssigkeit aus dem Fraktionssammelrohr (einmal Zellen nach Zentrifugation resuspendiert wurde) und in den 5 ul 8% Formaldehyd in Krebs-Puffer. Ermöglichen die fixierten Zellen bei Raumtemperatur für fünf Minuten sitzen.
- Hinzufügen von 5 ul 0,1% Triton und DAPI (5 μ / ml Krebs-Puffer) zu den fixierten Zellen. Lassen Sie die Zellen bei Raumtemperatur 5 min stehen lassen.
- Platz 10 ul der resultierenden Lösung auf eine Folie, Deckel mit einem Deckglas und Analyse mit einem Fluoreszenzmikroskop, um die Reinheit jeder Fraktion zu bestimmen.
- Kombinieren Fraktionen, die in Größe und Kernmorphologie sind (siehe "Repräsentative Ergebnisse"), um die folgenden Populationen von Zellen zu schaffen: Meiose und somatischen diploiden Zellen, runden Spermatiden, und Kondensations / Verlängern Spermatiden.
Ergebnisse
Die ideale Ergebnis der STA-PUT Verfahren ist ein recht bemerkbar Trennung von Zellen aus den Hoden, basierend auf Zellgröße und Dichte. Während Zellen aus dem Hoden isoliert werden durch die BSA-Gradienten sedimentieren, können mehrere verschiedene Bands von Zellen beobachtet werden. Irgendwelche Klumpen von Zellen dazu neigen, auf den Boden des Gradienten sinken und wird nicht verunreinigen die anderen Fraktionen. Ein wenig weiter oben in der Steigung wird die große somatischen und meiotischen Zellen sein. Weiter oben wird die Steigung noch kleineren runden Spermatiden sein. An der Spitze des Gradienten wird kondensiert werden Spermatiden, Sperma, und verunreinigen roten Blutkörperchen (scheinen diese kleinen runden Zellen ohne Zellkern).
Fraktionen können schnell unter Verwendung einer Kombination von Licht-und Fluoreszenzmikroskopie (Fig. 2) 15 analysiert werden. Meiotische, Spermatogonien, und somatischen diploiden Zellen sind die größten Zellen in den Hoden gefunden und werden große Kerne, die Fleck relati enthaltenVely homogen mit DAPI. Runden Spermatiden sind kleinere Zellen mit kleineren runden Kernen, in der Regel mit einem hell-Färbung Chromozentrum. Brenn / Verlängern Spermatiden sind kleine Zellen, die suchen oft länglich, als ob ein kleiner Schwanz bilden. Diese Zellen haben kleinere, kompakte Kerne mit DAPI, die hell färben und wie eine Sichel geformt. Sobald Zellfraktionen werden vereinigt, kann die Reinheit weiter durch Western-Blot-Analyse von Zell-Lysaten (Fig. 3) bestimmt werden. Gemeinsame Markierungen der meiotischen Zellen sind die synaptischen Komplexes 1-Proteine und Scp1 Sycp2 16. Gemeinsame Marker der Kondensation Spermatiden sind Übergangs Proteine (zB TP1) oder Protamine 17.
Obwohl jeder STA-PUT-Lauf kann unterschiedlich sein, wird in der Regel meiotischen Zellen, Spermatogonien und somatische diploiden Zellen in Fraktionen gefunden werden ca. 25-40, runden Spermatiden in den Fraktionen 55-65 ca., Und Kondensations / Verlängern Spermatiden in Bruch ca.65-75 Aufgrund eines geringeren Unterschied in der Größe zwischen somatischen / meiotischen Zellen und runden Spermatiden, Fraktionen. 45-50 haben oft eine noch ca Prozentsatz der somatischen / meiotischen Zellen und runden Spermatiden. Die Färbung mit DAPI wird dazu beitragen, diese zwei Populationen von Zellen zu unterscheiden. Es gibt weniger Überlappung der runden Spermatiden und Kondensieren / Verlängern Spermatiden Fraktionen durch die größere Differenz in der Größe zwischen den beiden Zellpopulationen. Normalerweise werden Fraktionen unter 15 viele große Klumpen von Zellen und Fraktionen über 85 enthalten, werden einige Zellen und viele Rest Körper oder membrangebundene Zellplasma, das von Spermatiden vergossen wird enthalten.
Im Allgemeinen, wenn Zellen von ~ 22 Hoden fraktioniert mit dem STA-PUT-Prozedur sind, ergibt es ca. 10 8 Zellen / spermatogenen Zelltyp (Meiose / somatischen diploiden Zellen, runden Spermatiden, und Kondensations / Verlängern Spermatiden). Fraktionen, die kombiniert werden, um die endgültige Population von Zellen zu schaffen sollte mindestens80% rein nach der Art der fraglichen Zelle. Wenn Sie nicht sehen, dieses Maß an Reinheit oder höher, kann es ein Problem mit Zelltrennung oder der BSA-Gradienten sein. Auch wenn es nur wenige Zellen in den ersten 20 Fraktionen und eine Fülle von Zellen in den Fraktionen 80 +, oder wenn es eine Fülle von Zellen in den ersten 20 Fraktionen und kaum in den Fraktionen 70 +, muss die Sedimentation Zeit weiter zu sein optimiert. Bitte beachten Sie die Diskussion für Vorschläge, wie man Probleme zu schießen.

Fig. 1 ist. Einrichten der STA-PUT-Gerät: Eine schematische und Ist-Bild der STA-PUT-Gerät angezeigt werden. Alle Glaswaren wird durch einen Kunststoffschlauch, wie die Röhre, die die Vorrichtung in den Fraktionssammler verbindet. Die Pfeile zeigen die Lage der Schellen. A) Zellladekammer enthält einen Rührstab, B) 2 L Zylinder für 2% BSA enthält einen Rührstab, C) 2 L Zylinder 4% BSA; D) Sedimentation Kammer; E) Stir Platten, F) Baffle;. G) Absperrhahn Klicken Sie hier für eine größere Ansicht .
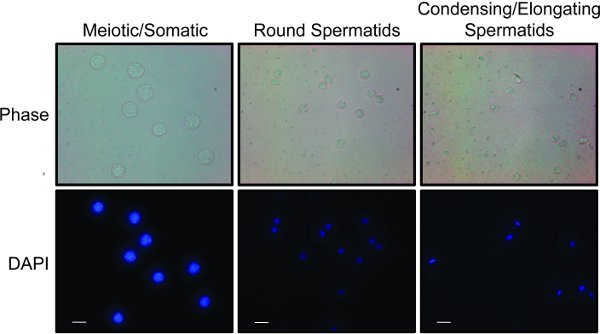
2. Zellpopulationen aus dem STA-PUT erhalten: Meiose und somatischen Zellen, runden Spermatiden und Kondensieren und verlängert Spermatiden: Die Fraktionen wurden in drei separate Populationen von Zellen kombiniert. Jede Bevölkerung mit DAPI gefärbt, um Unterschiede in der Kern Größe und Morphologie zu zeigen. Phasenkontrast-Abbildung vermittelt Unterschiede in der Zellgröße und-form. Weiße Balken stellt 10 um. Klicken Sie hier für eine größere Ansicht .
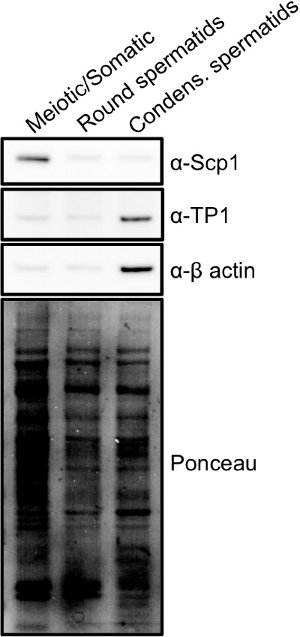
3. Marker in verschiedenen Zellpopulationen aus dem STA-PUT erhalten: Ganzzellextrakte wurden aus jeder Zellpopulation in Fig. 1 gezeigt hergestellt und Western-Blot-Analyse wurde durchgeführt, um die Proteinexpressionsunterschiede für jede Population zeigen.. Synaptonemal komplexes Protein 1 (Scp1) ist ein Protein ausschließlich während der Meiose exprimiert und gefunden in den meiotischen Fraktionen angereichert, während die Kondensations Spermatide Fraktion wird für den Übergang protein 1 (TP1) angereichert, ein Protein spät Spermiogenese ausgedrückt. Klicken Sie hier, um zu vergrößern Bild .
Diskussion
Diejenigen, die Spermatogenese studieren verlassen sich auf Tiermodelle für die Spermatogenese Zellproben, wie eine zuverlässige Zellkultursystem noch nicht zur Erzeugung spermatogenen alle Zelltypen 3 existieren. Obwohl spermatogenen Zellen leicht aus ganzen Hoden gesammelt, führt nur eine gemischte Bevölkerung. Dies stellt ein Problem für diejenigen, die auf bestimmte Subtypen dieser Zellen, wie meiotischen Zellen, runden Spermatiden, und Kondensations Spermatiden studieren möchten. Drei verschiedene Methoden werden derzeit verwendet, um diese Subtypen der Spermatogenese Zellen zu trennen: STA-PUT, FACS, und Elutriation 13.06. Die beiden letztgenannten Methoden erfordern Zugriff auf teure Teile der Ausrüstung: einen Zellsortierer und eine Elutriator sind. Obwohl der FACS-Methode liefert sehr reine Populationen der verschiedenen Zelltypen der Spermatogenese, der Prozess dauert 6 Stunden und ergibt nur 0,5 bis 2,0 x 10 6 Zellen pro Zelltyp je zwei vor drei Hoden 11. Elutriations, wie die STA-PUT Method trennt Zellen, basierend auf Größe und Dichte, sondern erfordert den Zugriff auf einen Elutriator, der teurer als der STA-PUT Vorrichtung ist.
Die STA-PUT Verfahren verwendet eine einfache BSA-Gradienten spermatogenen Zellen in verschiedenen Größen mit einem ziemlich hohen Ausbeute (~ 10 8 Zellen / Einwohner pro ~ 22 Hoden) zu trennen. Bezogen auf FACS-Methoden ergibt die STA-PUT-Prozedur mehr Zellen / Hoden und nimmt viel weniger Zeit, um Zelltypen zu trennen. Verglichen mit FACS und Schlämmen, die STA-PUT Verfahren relativ einfach und kostengünstig. Die STA-PUT benötigt nur einen kalten Raum oder großer Kühlschrank und eine Reihe von Spezialglaswaren, so dass es eine ideale Methode für Labore, ohne Zugang zu einem Zellsortierer oder Elutriator. Wenn sie richtig durchgeführt wird, kann die STA-PUT eine etwa 90% rein Bevölkerung von runden Spermatiden oder Kondensations Spermatiden bieten.
Die STA-PUT Verfahren ist sehr nützlich, aber sie erfordert die Optimierung an verschiedenen Stufen, insbesondere sedimentation. Unter optimale Trennung von Zelltypen können mit verschiedenen Themen, die meisten im Zusammenhang mit der BSA-Gradienten verursacht werden. Um eine richtige Steigung zu machen, schalten Sie die Rührstäbe in der Zelle Ladekammer und der L 2 Zylinder die 2% BSA während der Erstellung des Gradienten werden. Auch klar, alle Schläuche von Blasen und setzen Sie den Prall an Ort und Stelle bei der Sedimentation Kammer vor dem Laden der Zellen. Reduzieren der Strömungsrate des BSA in die oder aus der Sedimentationskammer kann helfen. Am wichtigsten ist, sollte die STA-PUT-Gerät nicht während der Erstellung des Gradienten, Sedimentation oder Fraktionssammlung gestört werden.
Suboptimale Zellausbeuten können die Folge von unzureichenden Anzahl / Größe der Hoden, unzureichende Zellseparation während Kollagenase / Trypsin-Behandlung und Zellklumpenbildung sein. Wenn man nicht in der Lage, die entsprechende Anzahl von Zellen für diese STA-PUT-Protokoll aufgrund der Verwendung von neugeborenen Mäusen oder Genotypen, die eine kleine Anzahl von Spermatogenese cel erzeugen zu erhaltenls, kann es notwendig sein, mehr Tiere pro STA-PUT verwenden oder eine STA-PUT Glassatz für kleinere Volumina und Zellzahlen optimiert (von ProScience) 18 bestellen. Um eine optimale Anzahl von Zellen (700-800000000) zu erhalten, verwenden mindestens 11 männlichen Mäusen im gebärfähigen Alter, idealerweise mindestens 8-9 Wochen alt. Allerdings sollte nicht mehr als 800 Millionen Zellen in einem STA-PUT geladen werden. Wenn Zellen nicht in einer Einzelzellsuspension nach Trypsinbehandlung dissoziiert, kann die DNase-Konzentration bis zu 1 &mgr; g / 5 ml Lösung erhöht werden. DNAse zu Zyklen von Einfrieren / Auftauen und mit frischen DNAse jedes Mal wird in einer effektiveren Streuung der Tubuli in eine Einzelzellsuspension führen wiederholen empfindlich. Man kann eine große Bohrung Pipette verwenden, um auseinander zu brechen Zellklumpen vor der Filterung durch Mesh.
Ein Aspekt der STA-PUT Verfahren, die eine Optimierung erforderlich ist, wird die Zeitdauer werden die Zellen erlaubt, durch den BSA-Gradienten sedimentieren. Eine Stundeund 45 min funktioniert in der Regel gut, aber dieses Mal kann von Labor zu Labor unterschiedlich sein. Gewöhnlich können verschiedene Schichten von Zellen visuell während der BSA-Gradienten gesehen werden. Wenn es wenige Zellen in den ersten 20 Fraktionen gesammelt und eine Fülle von Zellen in den Fraktionen 80 + kann die Sedimentationszeit müssen verlängert werden. Wenn es zu viele Zellen in den ersten 20 Fraktionen gesammelt und unzureichender Trennung von Zelltypen, muss der Sedimentation Zeit abgesenkt werden.
Für viele verschiedene Arten von Experimenten können die mit dem STA-PUT Verfahren erworben Zellen verwendet werden. Die STA-PUT bietet reichlich Material für Western-Blot-Analyse, Immunfluoreszenz-und RNA-Analyse, obwohl groß angelegte biochemische Experimente erfordern die Kombination von Materialien aus verschiedenen STA-PUT läuft. Wenn sie von anderen Zelltypen getrennt wird, haploiden Spermatiden kultiviert und in vitro molekulare Manipulation unterzogen werden, bis zu drei Tagen, die leichter als sein kann In vivo-Behandlung oder die Erstellung eines Knockout Tier 19. Zellen, die mit dem beschriebenen STA-PUT-Protokoll erhalten wurden für einen Tag wurde ohne offensichtliche Anzeichen von Verunreinigung kultiviert, aber, wenn die Zellen für längere Zellkulturexperimente verwendet werden sollen, sind Geräte mit Ethanol sterilisiert werden, sollten alle Lösungen steril filtriert werden, und alle Schritte vor der Zell Laden und nach dem Fraktionssammlung sollte in einer Gewebekultur Haube durchgeführt werden. Außerdem sollte Kulturmedien, die Antibiotika verwendet werden. Die Tatsache, dass die STA-PUT-Methode nicht Zellfixierung erfordern macht es zum idealen Verfahren für Experimente, die lebensfähigen Zellen erfordern.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen konkurrieren. Dieses Protokoll demonstriert beinhaltet die Verwendung von Labormäusen und wurde in Übereinstimmung mit den einschlägigen Richtlinien, Vorschriften und Aufsichtsbehörden ausgeführt. Tiere in diesem Protokoll verwendet werden, unter der Leitung und Genehmigung von der Universität von Pennsylvania Institutional Animal Care und Verwenden Committee (IACUC Protokoll # 804284) gehalten.
Danksagungen
Diese Arbeit wurde vom NIH Zuschüsse GM055360 zu SLB und U54HD068157 zu RGM unterstützt. JMB wurde von der T32 Genetik Ausbildungsförderung an der Universität von Pennsylvania (GM008216) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| BSA | Affymetrix/USB | 10857 100MG | Alternate can be used. |
| 0.5%, 2%, and 4% BSA solutions | Dissolve 0.25 g, 11 g, and 22 g (respectively) in total volumes of 50 ml, 550 ml, and 550 ml of 1x KREBS (respectively). | To be made day of the STA-PUT procedure. Filter sterilize. | |
| KREBS (10x) | 3.26 g KH2PO4 + 139.5 g NaCl +5.89 g MgSO4/7H20 + 40 g Dextrose + 3.78 g CaCl2/2H20 + 7.12 g KCl, bring to 2 L with ddH20 | Autoclave/filter and store at 4 °C for several months. | |
| KREBS (1x) | Dissolve 4.24 g NaHCO3 in 100 ml ddH20. Add 200 ml 10x KREBS. Bring to 2 L with ddH20. | To be made day of the STA-PUT procedure. Filter sterilize. | |
| Collagenase | Sigma | C9891-1G | |
| DNAse | Sigma | DNEP-5MG | |
| Trypsin | Sigma | T9201-1G | |
| DAPI | Preference of researcher | ||
| Triton-X100 | Preference of researcher | ||
| Formaldehyde (~37%) | Preference of researcher | ||
| TABLE 2: EQUIPMENT | |||
| Equipment | Company | Catalog # | Comments |
| Complete STA-PUT apparatus | ProScience Glass Shop | STA-PUT (this procedure uses the standard sedimentation chamber: Cat. No. 56700-500) | Includes all glassware and equipment for the apparatus. Alternate glassware is available for performing STA-PUT with smaller cell numbers. |
| 10 μm mesh filter | Fisherbrand | 22363549 | |
| Mouse dissection tools | Preference of researcher | ||
| 14 ml round bottom fraction collection tubes with caps | Preference of researcher | ||
| Need approximately 100 tubes | |||
| Fraction collector | GE Healthcare Life Sciences | Model: Frac-920, Product code: 18-1177-40 | Alternate can be used. |
| Microscope slides, cover glass | Preference of researcher | ||
| Light/Fluorescent Microscope | Preference of researcher |
Referenzen
- Wistuba, J., Stukenborg, J., Luetjens, C. M. Mammalian Spermatogenesis. Funct. Dev. Embryol. 1, 99-117 (2007).
- Hess, R. A., Cooke, P. S., Hofmann, M. C., Murphy, K. M. Mechanistic insights into the regulation of the spermatogonial stem cell niche. Cell Cycle. 5, 1164-1170 (2006).
- Dores, C., Alpaugh, W., Dobrinski, I. From in vitro culture to in vivo models to study testis development and spermatogenesis. Cell Tissue Res. 349, 691-702 (2012).
- Hayashi, K., Ohta, H., Kurimoto, K., Aramaki, S., Saitou, M. Reconstitution of the mouse germ cell specification pathway in culture by pluripotent stem cells. Cell. 146, 519-532 (2011).
- Easley, C. A., et al. Direct differentiation of human pluripotent stem cells into haploid spermatogenic cells. Cell Rep. 2, 440-446 (2012).
- Bellve, A. R. Purification, culture, and fractionation of spermatogenic cells. Methods Enzymol. 225, 84-113 (1993).
- Meistrich, M. L., Bruce, W. R., Clermont, Y. Cellular composition of fractions of mouse testis cells following velocity sedimentation separation. Exp. Cell Res. 79, 213-227 (1973).
- Romrell, L. J., Bellve, A. R., Fawcett, D. W. Separation of mouse spermatogenic cells by sedimentation velocity. A morphological characterization. Dev. Biol. 49, 119-131 (1976).
- Miller, R. G., Phillips, R. A. Separation of cells by velocity sedimentation. J. Cell Physiol. 73, 191-201 (1969).
- Bastos, H., et al. Flow cytometric characterization of viable meiotic and postmeiotic cells by Hoechst 33342 in mouse spermatogenesis. Cytometry A. 65, 40-49 (2005).
- Getun, I. V., Torres, B., Bois, P. R. Flow cytometry purification of mouse meiotic cells. J. Vis. Exp. (50), e2602 (2011).
- Grabske, R. J., Lake, S., Gledhill, B. L., Meistrich, M. L. Centrifugal elutriation: separation of spermatogenic cells on the basis of sedimentation velocity. J. Cell Physiol. 86, 177-189 (1975).
- Meistrich, M. L., Trostle, P. K. Separation of mouse testis cells by equilibrium density centrifugation in renografin gradients. Exp. Cell Res. 92, 231-244 (1975).
- Gassei, K., Ehmcke, J., Schlatt, S. Efficient enrichment of undifferentiated GFR alpha 1+ spermatogonia from immature rat testis by magnetic activated cell sorting. Cell Tissue Res. 337, 177-183 (2009).
- Bellve, A. R., et al. Spermatogenic cells of the prepuberal mouse. Isolation and morphological characterization. J. Cell Biol. 74, 68-85 (1977).
- Handel, M. A., Schimenti, J. C. Genetics of mammalian meiosis: regulation, dynamics and impact on fertility. Nat. Rev. Genet. 11, 124-136 (2010).
- Zhao, M., Shirley, C. R., Mounsey, S., Meistrich, M. L. Nucleoprotein transitions during spermiogenesis in mice with transition nuclear protein Tnp1 and Tnp2 mutations. Biol. Reprod. 71, 1016-1025 (2004).
- Manku, G., Mazer, M., Culty, M. Neonatal testicular gonocytes isolation and processing for immunocytochemical analysis. Methods Mol. Biol. 825, 17-29 (2012).
- Dehnugara, T., Dhar, S., Rao, M. R. An in vitro, short-term culture method for mammalian haploid round spermatids amenable for molecular manipulation. Mol. Reprod. Dev. 79, 19-30 (1002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten