Method Article
La separación de los tipos de células de espermatogénesis Usando STA-PUT Sedimentación Velocity
En este artículo
Resumen
El método STA-PUT permite la separación de las diferentes poblaciones de células espermatogénica basado en el tamaño y la densidad.
Resumen
La espermatogénesis en mamíferos es un complejo proceso de diferenciación que se produce en varias etapas en los túbulos seminíferos de los testículos. Actualmente, no existe un sistema de cultivo celular fiable que permite la diferenciación espermatogénica in vitro, y la mayoría de los estudios biológicos de las células de espermatogénesis requiere la cosecha de tejidos de los modelos animales como el ratón y la rata. Debido a que el testículo contiene numerosos tipos de células - a la vez no espermatogénesis (de Leydig, de Sertoli, mieloides y células epiteliales) y de espermatogénesis (espermatogonias, espermatocitos, espermátidas redondas, condensación espermátidas y espermatozoides) - estudios de los mecanismos biológicos que intervienen en la espermatogénesis requerir el aislamiento y el enriquecimiento de estos diferentes tipos de células. El método STA-PUT permite la separación de una población heterogénea de células - en este caso, de los testículos - a través de un gradiente de BSA lineal. Tipos de células individuales sedimentan con diferente velocidad de sedimentación según la cetamaño LL, y fracciones enriquecidas para diferentes tipos de células pueden ser recogidos y utilizados en otros análisis. Mientras que el método STA-PUT no da lugar a fracciones altamente puras de tipos de células, por ejemplo, como se puede obtener con ciertos métodos de clasificación de células, proporciona un rendimiento mucho más alto del total de células en cada fracción
(~ 1 x 10 8 células / tipo de células espermatogénica de una población a partir de 7-8 x 10 8 células). Este método de alto rendimiento requiere sólo la cristalería especializada y se puede realizar en cualquier habitación fría o un refrigerador grande, por lo que es un método ideal para los laboratorios que tienen acceso limitado a los equipos especializados como un clasificador de células activadas por fluorescencia (FACS) o elutriador.
Introducción
La espermatogénesis en mamíferos es un complejo proceso de diferenciación que se produce en varias etapas en los túbulos seminíferos de los testículos 1. Brevemente, el vástago-como espermatogonias que residen cerca del epitelio de la brecha de los túbulos seminíferos y diferenciarse en espermatocitos, que luego se someten a divisiones meióticas. Después de la meiosis es completa, las células haploides resultantes, o espermátidas redondas, se someten a la espermiogénesis, un proceso de diferenciación que implica el derramamiento de citoplasma y compactación del núcleo. Espermátidas desarrollan gradualmente un flagelo y se someten a la elongación y la condensación del núcleo, produciendo alargándose y luego condensación espermátidas, respectivamente. Los productos finales son los espermatozoides, que son liberados en el lumen del túbulo seminífero y en última instancia en el epidídimo donde maduran más.
Debido a que el proceso de la espermatogénesis depende de las condiciones hormonales y moleculares especiales enlos testículos, un sistema fiable de cultivo in vitro para todo el proceso de la espermatogénesis todavía no se ha desarrollado 2,3. Los métodos de cultivo se han desarrollado para la creación de "células similares a las células germinales primordiales" y "células-spermatid como redondas" haploides a partir de células madre, pero estos métodos no son capaces de generar un gran número de estas células y dejar de producir células espermatogénica más tarde tipos 4,5. Afortunadamente, los tipos de células de espermatogénesis difieren significativamente en tamaño, lo que permite una suspensión de una sola célula obtenida de testículos enteros para ser separadas con un gradiente líquido. El método STA-PUT, se ha demostrado aquí, utiliza un gradiente lineal BSA y simple de sedimentación para separar las células de espermatogénesis en función del tamaño y la masa de 6-9.
El método STA-PUT tiene varias ventajas con respecto a los otros dos métodos más utilizados para separar los tipos de células de espermatogénesis: FACS y decantación 10-13. El aparato STA-PUT requiere onlY varias piezas de cristalería especializada reunieron en una habitación fría o un refrigerador grande. Por lo tanto, es menos caro que el uso de un clasificador de células o un elutriador. El método STA-PUT produce mayores cantidades de células por tipo de célula y los testículos que puede ser ordenada por FACS en un plazo de tiempo similar, aunque la pureza de cada población celular no es tan alta como los obtenidos con FACS 11. Clasificación de células utilizando perlas magnéticas (magnética clasificación de células activadas, MACS) se ha empleado recientemente con éxito para el enriquecimiento de las espermatogonias de una población de células testiculares mixto, pero en este momento no aptos para separar espermatocitos o espermátidas debido a la falta de conocimiento de la superficie apropiada marcadores 14. Una ventaja adicional del método STA-PUT sobre FACS o MACS es la capacidad de aislar las células viables adecuadas para cultivo posterior, ya que, en contraste con la mayoría de los protocolos de FACS, que no requiere ningún ADN o otros tipos de tinción. Para los estudios que requieren lrendimientos arge de tipos de células de espermatogénesis en el ~ 90% de pureza, el STA-PUT es un método ideal.
Protocolo
El protocolo de STA-PUT implica tres etapas: 1) Puesta en marcha de los aparatos y reactivos, 2) Preparación de la suspensión de células de testículos enteros, y 3) la carga de la célula, la sedimentación y la recogida de fracciones. Cuando es realizada por un equipo de dos investigadores, el protocolo de toma ocho horas en promedio.
1. Configuración del Aparato STA-PUT (Figura 1)
*** Aparato de STA-PUT debe ser colocado en un refrigerador grande 4 ° C o una habitación fría que también puede acomodar un colector de fracciones, si se prefiere que el método de colección.
- La noche antes (o al menos unas horas antes) de llevar a cabo el método, lavar todo el equipo (sobre todo el material de vidrio y tubos) y esterilizar con etanol al 70%. Deje equipo seco completamente antes de montar el aparato como se ilustra en la Figura 1.
- Asegure los dos cilindros de 2 L (Figuras 1B y C) y la cámara de carga de células ( Figura 1A) a la plataforma superior y conectar todo con dos pequeñas piezas de tubo con abrazaderas de tubo. Fijar todos los tubos cerrados. Selle el surtidor en la L cilindro más a la derecha 2.
- Coloque una pequeña barra de agitación en la cámara de carga de células (Figura 1A) y una barra de agitación más grande en el 2 L cilindro más a la izquierda (Figura 1B) que contendrá la BSA 2%.
- Coloque la cámara de sedimentación 2 L en la plataforma (Figura 1D). Coloque el deflector de metal (Figura 1F) directamente en la parte superior de la abertura en la parte inferior de la cámara de sedimentación (Figura 1D). Esto es crítico, ya que el deflector impide agitación con vórtex del líquido y la interrupción del gradiente de células durante la recogida de la fracción. Coloque la tapa en la parte superior de la cámara de sedimentación.
- Después de la aplicación de una muy pequeña cantidad de grasa de vacío a la junta de vidrio esmerilado de la llave de tres vías (Figura 1G), sujetar la llave de paso a la parte inferior de la SEcámara dimentation, conectando las juntas de vidrio esmerilado de la llave de paso y la cámara de sedimentación.
- Conectar la cámara de la celda de carga (Figura 1A) a la salida derecha de la llave de paso con un tubo. Cierre la llave de paso.
- Conecte el tubo de fraccionamiento de la célula a la salida izquierda de la llave de paso. El tubo de fraccionamiento comprende un trozo de tubo con una pipeta Pasteur de vidrio conectado al extremo abierto. Un trozo de tubo de diámetro más pequeño se une al extremo estrecho de la pipeta de vidrio. La pipeta estrecha restringe el flujo de la suspensión de células durante la recolección de fracciones. Fije este pequeño tubo en la parte inferior.
- Preparar 2 L de Krebs (1x) tamponar el día del experimento (Tabla 1). Entonces, preparar 550 ml de 2% de BSA en 1x de Krebs, 550 ml de 4% de BSA en 1x de Krebs, y 50 ml de 0,5% de BSA en 1x de Krebs. Filtrar y dejar enfriar estas soluciones a 4 ° C.
- Verter la solución de BSA al 4% en el cilindro derecho L 2 (Figura 1C) y la BSA 2%solución en la izquierda 2 L de cilindro (Figura 1B). Asegúrese de que no hay grandes burbujas en el tubo que conecta estos cilindros.
- Vierta tampón Krebs en la cámara de carga celular y llenar el tubo que conecta la cámara con la cámara de sedimentación, asegurándome de que no hay burbujas grandes, ya que podrían alterar el gradiente. Exprimir o chasquear la tubería ayuda suavemente para eliminar las burbujas. Asegúrese de que todo el tampón de Krebs es en el tubo y no en la cámara de la celda.
- Permitir que una pequeña cantidad de tampón de Krebs fluya dentro de la cámara de sedimentación y luego drenar casi todo el tampón en el tubo de fraccionamiento de la célula con el fin de llenar el tubo y eliminar cualquier burbuja grande.
- Coloque el colector de fracciones directamente debajo de la cámara de sedimentación. Asegúrese de que todos los tubos de fracción están en su lugar y se cubren con una envoltura de plástico para evitar la contaminación.
2. Aislar las células de espermatogénesis de testículos enteros
- Diseccionar testículos de ca 12 ratones adultos (de preferencia por lo menos ocho semanas de edad) y el lugar en tampón Krebs a temperatura ambiente para lavar cualquier material contaminante. Este protocolo está demostrado implica el uso de ratones de laboratorio y fue ejecutado en cumplimiento de los lineamientos de la Universidad de Comité de Cuidado de Animales institucional y Uso Pennsylvania.
- Añadir 45 mg de colagenasa a 50 ml de tampón de Krebs en un tubo cónico de la derecha antes de que la intención de añadir los túbulos seminíferos. Permitir que esta solución se caliente a 33 ° C durante unos pocos minutos. Dividir equitativamente en dos tubos de 50 ml cónicos.
- Decapsulate los testículos en una placa separada que contiene 8 ml de tampón de Krebs, descartando la túnica albugínea y la liberación de los túbulos seminíferos. La túnica albugínea es la membrana delgada que rodea los túbulos seminíferos. Los túbulos deben separarse fácilmente de la túnica albugínea. Para ello, realizará una incisión en la túnica albugínea, mantenga esta membrana con un pair de fórceps, y empujar los túbulos fuera y lejos de la membrana con otro par de pinzas.
- Añadir 4 ml de tampón de Krebs que contiene los túbulos a cada tubo cónico que contenía 25 ml de solución de colagenasa y se incuba, sacudimiento, a 33 ° C durante 10 min. Al final, los túbulos deben tener una apariencia "spaghetti-como".
- Permitir que los túbulos se asienten durante ~ 5 min a la parte inferior del tubo. Verter el sobrenadante y lavar 2x en 25 ml de tampón de Krebs (a temperatura ambiente), lo que permite a los túbulos se depositan en el fondo del tubo cada vez. Deja ~ 5 ml de tampón de Krebs en cada tubo.
- Mientras que el lavado, agregar 30 mg de tripsina a 50 ml de tampón de Krebs en un tubo Falcon de la derecha antes de que la intención de añadir los túbulos seminíferos. Permitir que esta solución se caliente a 33 ° C durante unos pocos minutos. Dividir equitativamente en dos tubos de 50 ml cónicos.
- Añadir 25 ml de solución de tripsina a cada uno de los dos tubos que contienen los túbulos. Añadir 3 g de DNasa (1 μg/10ml) a cada tubo para prevenir la células se apelmace. Incubar, temblando, a 33 º C durante 10 min.
- Utilice una amplia pipeta de orificio para agitar la solución que contiene los túbulos, el pipeteado de ellos dentro y fuera de aproximadamente 10x. La solución debe comenzar a parecerse más a una suspensión de células individuales.
- Incubar, temblando, a 33 º C durante otros 10 min. Utilice una amplia pipeta de orificio para dispersar los túbulos en una única suspensión de células, el pipeteado de ellos dentro y fuera de aproximadamente 25x. Si se sigue mostrando una gran cantidad de túbulos o grupos de células, se dispersan más con la pipeta y / o añadir otro 3 mg DNAsa a cada tubo (concentración inicial doble).
- Se filtra la suspensión de células individuales a través de un filtro de células de malla de 100 micras (una para cada tubo de 30 ml de suspensión de células). Combine las suspensiones celulares y contar el número total de células (debe ser entre 7-8 x 10 8 células). EL *** NO coloque más de 800 millones de células en el gradiente.
- Basándose en el recuento de células obtenida en la etapa 2.10, sedimentar el parámetro adecuadoIATE volumen de las células filtradas a 450 rcf durante 5 min y se lava con 30 ml de tampón de Krebs. Repita. *** Por lo general, 22 testículos producirán más de 800 millones de células, pero no cargue más de este número de células.
- Resuspender cuidadosamente las células en 25 ml de 0,5% de BSA que contiene entre 2,5 y 5 mg de ADNasa (dependiendo del grado de aglutinación de células) sin crear burbujas. Asegúrese de que las células no se agrupan. Se filtra la suspensión de células individuales a través de un filtro de células de malla de 100 micras. Las células están ahora listos para cargar. Mezclar bien antes de la carga invirtiendo el tubo varias veces.
3. Móvil Carga y Sedimentación
- Asegúrese de que la llave de paso está cerrado, pero en la posición que permita que el líquido fluya desde la cámara de la celda (Figura 1A) en la cámara de sedimentación (Figura 1D).
- Gire ambas placas barra de agitación a una temperatura baja (aproximadamente 70 rpm) para permitir que las barras de agitación se mueven sin cesar, pero lentamente.
- Se vierte la suspensión de células en la cámara celular (Figura 1A) y abrir la llave de paso de modo que las células fluyen lentamente en la cámara de sedimentación a una velocidad de 10 ml / min (Figura 1D). Cierre la llave de paso. Tasa de flujo puede determinarse mediante el marcado de intervalos de volumen en la cámara de sedimentación.
- Vierta 5 ml de solución de BSA al 0,5% en la cámara celular y drenar en la cámara de sedimentación a una velocidad de 10 ml / min. Cierre la llave de paso. Este paso se lavan las células fuera de la cámara de la celda. Repetir 4x.
- Preparar el gradiente: Abra las abrazaderas entre la cámara de la celda (Figura 1A) y los dos cilindros 2 L (Figura 1B y C), y comenzar a drenar el líquido en la cámara de sedimentación a una velocidad de 40 ml / min (Figura 1D) inmediatamente. Ajuste la velocidad de flujo por lo que toma aproximadamente 20 a 30 min para cargar el gradiente de BSA en la cámara de sedimentación. Una capa delgada, sin molestias de las células que está encima de laBSA gradiente debe ser visible. Una vez que la mayor parte de la BSA se carga, cierre la llave de paso y girar a la posición que va a permitir que el líquido salga de la cámara de sedimentación en el tubo de fraccionamiento.
- Apague las placas revuelo.
- Permitir que las células se separen por sedimentación durante una hora y 45 minutos. NO MOLESTAR EL APARATO DURANTE ESTE TIEMPO. Cualquier agitación mecánica podría perturbar el gradiente.
4. Fraccionamiento y Análisis de las fracciones
*** A medida que realiza los pasos siguientes, tenga cuidado de no alterar el gradiente. Si se altera el gradiente de BSA, el procedimiento no va a funcionar!
- Una vez que las células hayan sedimentado, escurrir lentamente 50 ml de la cámara de sedimentación en un tubo cónico de 50 ml y reservar. Esta fracción contiene generalmente grupos no deseados de células y los desechos.
- Fije el tubo de la fracción con el colector de fracciones. *** También es posible recoger las fracciones a mano si un Colle fracciónHéctor no está disponible.
- Reunir las fracciones: Ajuste el caudal con la llave de paso de modo que 10 ml (llenado un tubo de recogida) se recogieron cada 45 seg.
- Tape los tubos de recogida de fracción y girar durante 5 minutos a 450 RCF a 4 ° C. Verter el sobrenadante con cuidado, volver a suspender las células en el líquido restante y mantener las células en hielo.
- Una vez recogidas todas las fracciones, analizar microscópicamente las fracciones de diferentes poblaciones de células. Diferentes tipos de células se pueden distinguir basándose en el tamaño celular y la morfología nuclear 8,15. La Figura 2 ilustra los resultados representativos "" para las tres fracciones reunidas que están enriquecidas en células y espermatogonias (a) somáticas y meióticas, (B), y espermátidas redondas (c) el alargamiento y la condensación espermátidas.
- Tipo A espermatogonias son 12-14μm ca. de diámetro y tienen núcleos redondos que son homogéneos en la composición de la cromatina.
- Tipo B espermatogonias, que 8-9μm ca. de diámetro y han round núcleos que muestran la heterocromatina más densa a lo largo de la periferia nuclear.
- Espermatocitos Pre-leptotene son 7.5-8.2μm ca. de diámetro, tienen menos citoplasma de espermatogonias tipo B, y tienen núcleos que se parecen a los de tipo B espermatogonias.
- Espermatocitos primarios Leptoteno son 8-10 micras aprox. de diámetro y tienen núcleos que parecen similares a los de espermatocitos de pre-leptotene, pero parecen aumentar de peso cromatina más densa en la membrana nuclear.
- Zygotene espermatocitos primarios son 10-12 micras aprox. de diámetro y tienen núcleos que parecen similares a los de los espermatocitos primarios leptotene.
- Pachytene son en cualquier lugar 12 a 18 micras aprox. de diámetro y consisten en un borde delgado de citoplasma que rodea a un núcleo grande. Más grumos de cromatina densa se pueden ver en el núcleo.
- Espermátidas redondas son 10 m aprox. de diámetro y tienen un núcleo redondo con un chromocenter densamente-tinción en el medio.
- Residualcuerpos son ~ 6,5 m de diámetro, son redondos, y carecen de un núcleo.
- Alargándose espermátidas y condensación son similares en tamaño a redondear espermátidas, pero tienen un núcleo en forma de hoz único.
- Comience con la fracción 15 y analizar cada cinco fracciones de hasta 85. Por lo general, las fracciones inferiores a 15 serán demasiado mezclados y grumoso, y las fracciones superiores a 85 contienen pocos o ningún células utilizables.
- Para analizar una fracción, tomar 5UL de líquido desde el tubo de recogida de la fracción (una vez que las células se han resuspendido después de la centrifugación) y añadir a 5UL de 8% de formaldehído en tampón de Krebs. Permita que las células fijadas para sentarse a temperatura ambiente durante cinco minutos.
- Añadir 5 ul de 0,1% de Triton y DAPI (5 μ / ml de tampón de Krebs) a las células fijas. Permita que las células en reposo a temperatura ambiente durante 5 min.
- Ponga 10 l de la solución resultante en un portaobjetos, cubra con un cubreobjetos, y analizar con un microscopio de fluorescencia para determinar la pureza de cada fracción.
- Se combinan las fracciones que son similares en tamaño y morfología nuclear (véase "Los resultados representativos") para crear las siguientes poblaciones de células: células diploides meióticos y somáticos, espermátidas redondas y condensación / alargándose espermátidas.
Resultados
El resultado ideal el procedimiento STA-PUT es una separación bastante notable de las células de los testículos basado en el tamaño celular y la densidad. Mientras que las células aisladas de los testículos se sedimentan a través de la gradiente de BSA, varias bandas distintas de células pueden ser observados. Cualquier grupos de células tienden a hundirse hasta el fondo del gradiente y no contaminar las otras fracciones. Un poco más arriba el gradiente será el gran somáticas y células meióticas. Más arriba la pendiente seguirá siendo espermátidas redondas más pequeñas. En la parte superior de la pendiente se condensará espermátides, espermatozoides y contaminación de las células rojas de la sangre (estos parecen ser pequeñas células redondas sin núcleo).
Las fracciones pueden ser analizadas rápidamente utilizando una combinación de luz y microscopía de fluorescencia (figura 2) 15. Meiótica, espermatogonias y células somáticas diploides son las células más grandes que se encuentran en los testículos y contendrán grandes núcleos que relati manchativamente homogénea con DAPI. Espermátidas redondas son células pequeñas con núcleos redondos pequeños, generalmente con un chromocenter manchas brillantes. Condensación / alargándose espermátidas son células pequeñas, que a menudo se ven alargada, como si una pequeña cola se está formando. Estas células tienen núcleos pequeños y compactos que se tiñen intensamente con DAPI y tienen la forma de una hoz. Una vez que se combinan las fracciones de células, la pureza se puede determinar por análisis de transferencia de Western de los lisados celulares (Figura 3). Marcadores comunes de las células meióticas son los sinaptonémicos complejos 1 y proteínas scp1 Sycp2 16. Marcadores comunes de condensación espermátidas son proteínas de transición (por ejemplo TP1) o protaminas 17.
Aunque cada ejecución PUT-STA puede ser diferente, por lo general células meióticas, espermatogonias y células somáticas diploides se encuentra en las fracciones ca. 25-40, espermátidas redondas en fracciones de ca. 55-65, y condensación / alargamiento de espermátidas en fracciones de ca.65-75 Debido a una menor diferencia de tamaño entre las células meióticas / somáticas y espermátidas redondas, fracciones de ca. 45-50 menudo tienen un porcentaje aún de células meióticas / somáticas y espermátidas redondas. La tinción con DAPI ayudará a distinguir estas dos poblaciones de células. Hay menos solapamiento de la espermátida redonda y condensación / alargamiento de fracciones spermatid debido a la diferencia más grande en tamaño entre estas dos poblaciones de células. Por lo general, las fracciones por debajo de 15 contendrán muchos grandes grupos de células y fracciones por encima de 85 contendrá pocas células y muchos cuerpos residuales, o citoplasma unido a la membrana que es derramada por espermátidas.
En general, cuando las células de ~ 22 testículos se fraccionan con el procedimiento STA-PUT, produce ca. 10 8 células / tipo espermatogénico celular (células diploides meióticas / somáticas, espermátidas redondas y condensación / alargándose espermátidas). Las fracciones que se combinan para crear la población final de células deben ser al menos80% de pureza para el tipo de célula en cuestión. Si usted no ve este grado de pureza o mayor, puede haber un problema con la separación de células o el gradiente de BSA. Además, si hay pocas células en los primeros 20 fracciones y una abundancia de células en las fracciones 80 +, o si hay una abundancia de células en los primeros 20 fracciones y casi ninguna en las fracciones 70 +, el tiempo de sedimentación tiene que ser más optimizado. Por favor vea la discusión para obtener sugerencias sobre cómo disparar problemas.

Figura 1. Configuración del Aparato STA-PUT: Una imagen esquemática y real del aparato STA-PUT se muestran. Toda la cristalería está conectada por un tubo de plástico, incluyendo el conducto que conecta el aparato con el colector de fracciones. Las flechas indican la ubicación de las abrazaderas. A) cámara de carga de la célula, contiene una barra de agitación; B) del cilindro 2 L el 2% de BSA, contiene una barra de agitación; C) 2 cilindros L de BSA al 4%; D) cámara de sedimentación; E) placas Stir; F) del bafle;. G) Llave de paso Haga clic aquí para ver la imagen más grande .
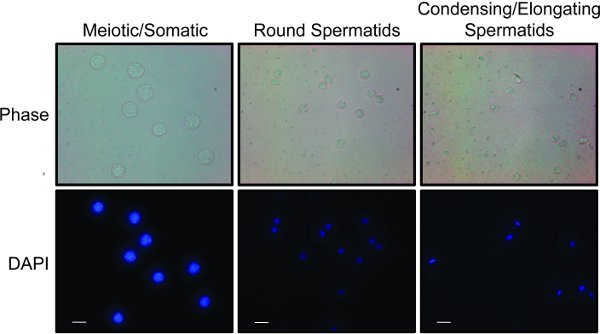
Figura 2. Las poblaciones de células obtenidas de la STA-PUT: fracciones se combinaron en tres poblaciones separadas de células: células meióticas y somáticos, espermátidas redondas y condensación y alargándose espermátidas. Cada población está manchado con DAPI para mostrar diferencias en el tamaño y la morfología nuclear. De imágenes de contraste de fase conlleva diferencias en el tamaño y forma celular. Barra blanca representa 10 micras. Haga clic aquí para ver la imagen más grande .
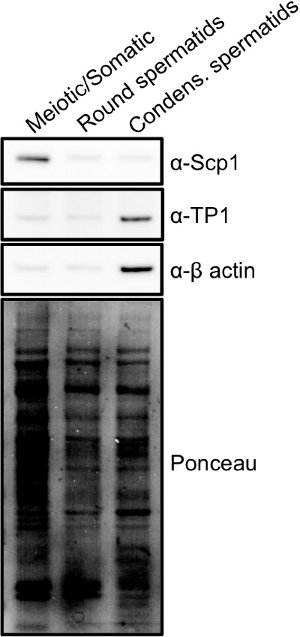
Figura 3. Los marcadores de diferentes poblaciones de células obtenidas a partir de la STA-PUT: extractos de células enteras se hicieron a partir de cada población celular se muestra en la Figura 1 y se realizó análisis de transferencia de Western para mostrar las diferencias de expresión de proteínas para cada población.. Proteína compleja Sinaptonémico 1 (Scp1) es una proteína expresada exclusivamente durante la meiosis y se encuentra enriquecido en las fracciones de la meiosis, mientras que la fracción espermátide condensación es enriquecida por la proteína de transición 1 (TP1), una proteína expresada al final de la espermatogénesis. Haga clic aquí para ver más grande imagen .
Discusión
Los que estudian la espermatogénesis se basan en modelos animales para muestras de células de espermatogénesis, como sistema fiable de cultivo celular todavía no existe para generar todos los tipos celulares de espermatogénesis 3. Aunque las células de espermatogénesis se recogen fácilmente de testículos enteros, sólo una población mixta resultante. Esto plantea un problema para aquellos que desean estudiar los subtipos específicos de estas células, como las células meióticas, espermátidas redondas y espermátidas condensación. Tres métodos diferentes se utilizan actualmente para separar estos subtipos de células de espermatogénesis: STA-PUT, FACS, y decantación 6-13. Los dos últimos métodos requieren el acceso a partes metálicas: un clasificador de células y un elutriador, respectivamente. Aunque el método FACS produce poblaciones altamente puras de los diferentes tipos de células de espermatogénesis, el proceso tarda seis horas y se produce sólo 0,5-2,0 x 10 6 células por tipo de célula por dos y cincuenta y ocho testículos 11. Decantación, como la metanfetamina PUT-STAOD, separa las células basándose en el tamaño y la densidad, sino que requiere el acceso a un elutriador, que es más caro que el aparato de STA-PUT.
El procedimiento de STA-PUT utiliza un gradiente simple BSA para separar las células de espermatogénesis de diferentes tamaños con un nivel bastante alto rendimiento (~ 10 8 células / habitantes al ~ 22 testículos). Relativa a los métodos de FACS, el procedimiento de STA-PUT produce más células / testículo y toma mucho menos tiempo para separar los tipos de células. En comparación con FACS y elutriación, el procedimiento STA-PUT es relativamente simple y barato. El STA-PUT requiere sólo una habitación fría o un refrigerador grande y un conjunto de objetos de vidrio especializada, por lo que es un método ideal para laboratorios que no tienen acceso a un clasificador de células o elutriador. Si se realiza correctamente, el STA-PUT puede proporcionar una población de aproximadamente 90% de pureza de espermátidas redondas o espermátidas condensación.
El método STA-PUT es muy útil, pero requiere la optimización de varios pasos diferentes, sobre todo sedimentation. Separación Sub-óptima de tipos de células puede ser causada por varias cuestiones diferentes, la mayoría relacionadas con el gradiente de BSA. Para hacer un gradiente adecuado, encender las barras de agitación en la cámara de carga de células y el cilindro 2 L celebración de la BSA 2%, mientras que va a crear el degradado. También limpiar todos los tubos de burbujas y colocar el deflector en su lugar en la cámara de sedimentación antes de cargar las células. La reducción de la velocidad de flujo de la BSA en o fuera de la cámara de sedimentación puede ayudar. Más importante aún, el aparato de STA-PUT no debe ser perturbada durante la creación de la pendiente, la sedimentación, o la recogida de fracciones.
Sub-óptima rendimientos celulares pueden ser el resultado de insuficiente número / tamaño de los testículos, la separación celular inadecuada durante el tratamiento con colagenasa / tripsina, y la formación de grumos de células. Si uno no es capaz de obtener el número adecuado de células para este protocolo STA-PUT, debido al uso de ratones recién nacidos o genotipos que producen un pequeño número de cel espermatogénicoLS, puede ser necesario el uso de más animales por STA-PUT o para ordenar un kit de PUT-STA cristalería optimizado para volúmenes más pequeños y los números de células (disponible de ProScience) 18. Para obtener un número óptimo de células (700-800 million), utilice al menos 11 ratones machos en edad reproductiva, a ser posible por lo menos 8-9 semanas de edad. Sin embargo, no más de 800 millones de células deben ser cargados en un STA-PUT. Si las células no han disociado en una sola suspensión celular después de tratamiento con tripsina, la concentración de DNasa puede ser aumentada hasta 1 g / 5 ml de solución. DNAsa es sensible a repetir ciclos de congelación / descongelación, y el uso de ADNasa fresco cada vez dará lugar a una dispersión más eficaz de los túbulos en una suspensión de células individuales. Se puede utilizar una amplia pipeta perforación para ayudar a romper los agregados celulares antes de filtrar a través de la malla.
Un aspecto del método STA-PUT que requerirá la optimización es la cantidad de tiempo que las células se dejan sedimentar a través del gradiente de BSA. Una horay 45 min por lo general funciona bien, pero este tiempo puede variar de un laboratorio a otro. Por lo general, diferentes capas de células se puede ver visualmente a lo largo del gradiente de BSA. Si hay pocas células en las primeras 20 fracciones recogidas y una gran cantidad de células en fracciones de 80 +, puede ser necesario que se extienda el tiempo de sedimentación. Si hay demasiadas células en los primeros 20 fracciones recogidas y hay insuficiente separación de tipos de células, puede ser necesario el tiempo de sedimentación que bajar.
Las células adquiridas con el procedimiento STA-PUT se pueden utilizar para muchos tipos diferentes de experimentos. El STA-PUT proporciona un amplio material para el análisis occidental blot, inmunofluorescencia y análisis de ARN, aunque los experimentos de bioquímica de gran escala pueden requerir la combinación de material de varias diferentes carreras STA-PUT. Cuando se separó de otros tipos de células, espermátides haploides pueden ser cultivadas y sometidas a manipulación molecular in vitro para hasta tres días, que puede ser más fácil que in vivo o la creación de un animal knockout 19. Las células obtenidas con el protocolo STA-PUT descrito se han cultivado durante un día y sin signos evidentes de contaminación, pero si las células se van a utilizar para los experimentos de cultivo de células más largas, el equipo deberá ser esterilizado con etanol, todas las soluciones deben ser esterilizado por filtración, y todo pasos antes de la carga celular y después de la recogida de fracciones se deben realizar en una campana de cultivo de tejidos. Además, deben utilizarse medios de cultivo que contienen antibióticos. El hecho de que el método STA-PUT no requiere la fijación de células hace que sea un procedimiento ideal para los experimentos que requieren células viables.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia. Este protocolo está demostrado implica el uso de ratones de laboratorio y fue ejecutado en cumplimiento de todas las directrices, reglamentos y organismos reguladores. Los animales utilizados en este protocolo se mantienen bajo la guía y la aprobación de la Universidad de Comité de Cuidado de Animales y el empleo Institucional Pennsylvania (protocolo de IACUC # 804284).
Agradecimientos
Esta investigación fue apoyada por el NIH subvenciones GM055360 a SLB y U54HD068157 de RGM. JMB fue apoyado por la Subvención de Entrenamiento T32 Genética de la Universidad de Pennsylvania (GM008216).
Materiales
| Name | Company | Catalog Number | Comments |
| BSA | Affymetrix/USB | 10857 100MG | Alternate can be used. |
| 0.5%, 2%, and 4% BSA solutions | Dissolve 0.25 g, 11 g, and 22 g (respectively) in total volumes of 50 ml, 550 ml, and 550 ml of 1x KREBS (respectively). | To be made day of the STA-PUT procedure. Filter sterilize. | |
| KREBS (10x) | 3.26 g KH2PO4 + 139.5 g NaCl +5.89 g MgSO4/7H20 + 40 g Dextrose + 3.78 g CaCl2/2H20 + 7.12 g KCl, bring to 2 L with ddH20 | Autoclave/filter and store at 4 °C for several months. | |
| KREBS (1x) | Dissolve 4.24 g NaHCO3 in 100 ml ddH20. Add 200 ml 10x KREBS. Bring to 2 L with ddH20. | To be made day of the STA-PUT procedure. Filter sterilize. | |
| Collagenase | Sigma | C9891-1G | |
| DNAse | Sigma | DNEP-5MG | |
| Trypsin | Sigma | T9201-1G | |
| DAPI | Preference of researcher | ||
| Triton-X100 | Preference of researcher | ||
| Formaldehyde (~37%) | Preference of researcher | ||
| TABLE 2: EQUIPMENT | |||
| Equipment | Company | Catalog # | Comments |
| Complete STA-PUT apparatus | ProScience Glass Shop | STA-PUT (this procedure uses the standard sedimentation chamber: Cat. No. 56700-500) | Includes all glassware and equipment for the apparatus. Alternate glassware is available for performing STA-PUT with smaller cell numbers. |
| 10 μm mesh filter | Fisherbrand | 22363549 | |
| Mouse dissection tools | Preference of researcher | ||
| 14 ml round bottom fraction collection tubes with caps | Preference of researcher | ||
| Need approximately 100 tubes | |||
| Fraction collector | GE Healthcare Life Sciences | Model: Frac-920, Product code: 18-1177-40 | Alternate can be used. |
| Microscope slides, cover glass | Preference of researcher | ||
| Light/Fluorescent Microscope | Preference of researcher |
Referencias
- Wistuba, J., Stukenborg, J., Luetjens, C. M. Mammalian Spermatogenesis. Funct. Dev. Embryol. 1, 99-117 (2007).
- Hess, R. A., Cooke, P. S., Hofmann, M. C., Murphy, K. M. Mechanistic insights into the regulation of the spermatogonial stem cell niche. Cell Cycle. 5, 1164-1170 (2006).
- Dores, C., Alpaugh, W., Dobrinski, I. From in vitro culture to in vivo models to study testis development and spermatogenesis. Cell Tissue Res. 349, 691-702 (2012).
- Hayashi, K., Ohta, H., Kurimoto, K., Aramaki, S., Saitou, M. Reconstitution of the mouse germ cell specification pathway in culture by pluripotent stem cells. Cell. 146, 519-532 (2011).
- Easley, C. A., et al. Direct differentiation of human pluripotent stem cells into haploid spermatogenic cells. Cell Rep. 2, 440-446 (2012).
- Bellve, A. R. Purification, culture, and fractionation of spermatogenic cells. Methods Enzymol. 225, 84-113 (1993).
- Meistrich, M. L., Bruce, W. R., Clermont, Y. Cellular composition of fractions of mouse testis cells following velocity sedimentation separation. Exp. Cell Res. 79, 213-227 (1973).
- Romrell, L. J., Bellve, A. R., Fawcett, D. W. Separation of mouse spermatogenic cells by sedimentation velocity. A morphological characterization. Dev. Biol. 49, 119-131 (1976).
- Miller, R. G., Phillips, R. A. Separation of cells by velocity sedimentation. J. Cell Physiol. 73, 191-201 (1969).
- Bastos, H., et al. Flow cytometric characterization of viable meiotic and postmeiotic cells by Hoechst 33342 in mouse spermatogenesis. Cytometry A. 65, 40-49 (2005).
- Getun, I. V., Torres, B., Bois, P. R. Flow cytometry purification of mouse meiotic cells. J. Vis. Exp. (50), e2602 (2011).
- Grabske, R. J., Lake, S., Gledhill, B. L., Meistrich, M. L. Centrifugal elutriation: separation of spermatogenic cells on the basis of sedimentation velocity. J. Cell Physiol. 86, 177-189 (1975).
- Meistrich, M. L., Trostle, P. K. Separation of mouse testis cells by equilibrium density centrifugation in renografin gradients. Exp. Cell Res. 92, 231-244 (1975).
- Gassei, K., Ehmcke, J., Schlatt, S. Efficient enrichment of undifferentiated GFR alpha 1+ spermatogonia from immature rat testis by magnetic activated cell sorting. Cell Tissue Res. 337, 177-183 (2009).
- Bellve, A. R., et al. Spermatogenic cells of the prepuberal mouse. Isolation and morphological characterization. J. Cell Biol. 74, 68-85 (1977).
- Handel, M. A., Schimenti, J. C. Genetics of mammalian meiosis: regulation, dynamics and impact on fertility. Nat. Rev. Genet. 11, 124-136 (2010).
- Zhao, M., Shirley, C. R., Mounsey, S., Meistrich, M. L. Nucleoprotein transitions during spermiogenesis in mice with transition nuclear protein Tnp1 and Tnp2 mutations. Biol. Reprod. 71, 1016-1025 (2004).
- Manku, G., Mazer, M., Culty, M. Neonatal testicular gonocytes isolation and processing for immunocytochemical analysis. Methods Mol. Biol. 825, 17-29 (2012).
- Dehnugara, T., Dhar, S., Rao, M. R. An in vitro, short-term culture method for mammalian haploid round spermatids amenable for molecular manipulation. Mol. Reprod. Dev. 79, 19-30 (1002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados