Method Article
STA-PUTの速度沈降を使用して造精細胞型の分離
要約
STA-PUTメソッドは、大きさや密度に基づいて精子形成細胞の異なる集団の分離を可能にする。
要約
哺乳類の精子形成は、精巣の精細管にいくつかの段階で発生する複雑な分化過程である。現在のところ、 インビトロでの精子形成の分化を可能にする信頼性のある細胞培養系がなく、精子形成細胞のほとんどの生物学的研究は、マウスおよびラットのような動物モデルからの組織採取を必要とする。非精子形成(ライディッヒ、セルトリ、骨髄、および上皮細胞)および精子形成の両方(精原細胞、精母細胞、円形精子細胞、精子細胞および精子を凝縮) - - 精巣は多数の細胞型が含まれているため、精子形成に関与する生物学的メカニズムの研究を隔離を必要とするこれらの異なる細胞型の富化。この場合、精巣から - - BSA線形勾配を介してSTA-PUT方法は、不均一な細胞集団の分離を可能にする。個々の細胞型は、CEのに応じて異なる沈降速度で沈降llのサイズ、および異なる細胞型について富化画分を回収し、さらなる分析に利用することができる。 STA-PUT方法は、特定の細胞選別法を用いて得ることができるように、 例えば、細胞型の高純度画分をもたらさないが、各画分中の全細胞のより高い収量を提供しない
(7-8×10 8細胞の出発集団から〜1×10 8個/精子形成細胞型)。この高い収率メソッドは特殊なガラス容器を必要とし、蛍光活性化セルソーター(FACS)又は水簸機等の特殊な装置へのアクセスが限られているラボのための理想的な方法で製造する、任意の低温室又は大冷蔵庫で行うことができる。
概要
哺乳類の精子形成は精巣1の精細管にいくつかの段階で発生する複雑な分化過程である。簡単に言うと、精細管の格差の上皮の近くに存在する精原細胞のような幹、その後減数分裂を起こす精母細胞に分化。減数分裂が完了した後、得られた半数体細胞、または円形精子細胞は、精子、細胞質及び核の圧縮の脱落を伴う分化プロセスを受ける。精子細胞は徐々に、それぞれ、鞭毛を開発し、核の伸びや、結露を起こし、伸長してから凝縮する精子細胞を生成する。最終製品は、精細管の内腔に放出され、最終的に、彼らは、さらに成熟精巣上体にしている精子、です。
精子形成のプロセスは、特殊なホルモンや分子の状態に依存しているため精巣は、精子形成の全過程のための信頼できるインビトロ培養系は、まだ2,3開発されていない。培養方法は、幹細胞から「始原生殖細胞様細胞」および半数体、「円形精子細胞様細胞」を作成するために開発されてきたが、これらの方法はまだ、これらの細胞を大量に生成し、それ以降の精子形成細胞を生成するために失敗することができない種類4,5。幸いなことに、精子細胞型は液体勾配で分離されるべき全体の精巣から得られた単一細胞懸濁液を可能にする、サイズが大きく異なる。 STA-PUTメソッドは、ここに証明し、大きさや質量6-9に基づいて精子形成細胞を分離するための直線のBSA勾配とシンプルな沈降を使用しています。
FACSおよび水簸10-13:STA-PUT方法は精子形成細胞タイプを分離する他の二つの最も広く使用されている方法に勝るいくつかの利点を有する。 STA-PUT装置は、ONLが必要です寒い部屋や大きな冷蔵庫に組み立て専門のガラス器のY数枚。このように、セルソーター又は水簸機を使用するよりも安価である。 STA-PUT方法は、各細胞集団の純度はFACS 11で得られたものほど高くはないが、匹敵する時間枠内FACSによってソートすることができるよりも、細胞型および精巣あたりの細胞のより高い量をもたらす。磁気ビーズを用いて細胞選別(ソーティング磁気活性化細胞、MACS)は最近成功した混合精巣細胞集団から精原細胞の濃縮のために用いられてきたが、現在による適切な表面マーカー14についての知識の欠如のために精母細胞または精子細胞を分離するには不向きである。 MACSまたはFACSオーバーSTA-PUT方法のさらなる利点は、ほとんどのFACSプロトコルとは対照的に、それは任意のDNA染色又は他のタイプを必要としないので、その後の培養に適した生存可能な細胞を単離する能力である。 Lを必要とする研究のため精子形成細胞の種類のアーゲ収率は約90%の純度で、STA-PUTは、理想的な方法である。
プロトコル
STA-PUTプロトコルは、3つの段階を含む:1)全体の精巣から細胞懸濁液の装置および試薬、2)準備、3)セルの負荷、沈降、およびフラクションコレクションのセットアップします。 2人の研究者のチームによって行われた場合に、プロトコルは、平均して8時間かかります。
1。 STA-PUT装置を設定します(図1)
*** STA-PUT装置は、4℃、大規模な冷蔵庫やコレクションの方法を優先する場合にも、フラクションコレクターを収容することができ、低温室に配置する必要があります。
- 前(あるいは、少なくとも数時間前)には、メソッドを実行する夜は、すべての機器(特に、ガラス製品、チューブ)を洗って、70%エタノールで滅菌する。完全に、図1に示すような装置を組み立てる前に、機器を乾燥させる。
- (二L 2シリンダ( 図 1BおよびC)および細胞装填室を確保図1A)トップのプラットフォームへとチューブクランプでチューブの2小片ですべてを接続してください。クランプすべての管が閉鎖した。右端の2Lのシリンダーに注ぎ口をシール。
- 細胞装填室の小さな撹拌棒( 図1A)、2%BSAを含むことになる左端の2 Lのシリンダ内のより大きな撹拌棒( 図1B)を配置します。
- プラットフォーム( 図1D)に2リットルの沈殿槽を配置します。沈殿槽( 図1D)の下部の開口部の上に直接金属バッフル( 図1F)を配置します。バッフルはフラクションコレクションの間の細胞勾配の液体と混乱のボルテックスを防ぐため、これは非常に重要です。沈殿槽の上にふたをする。
- 三方活栓( 図1G)のすりガラスジョイントに真空グリースを微量塗布した後、それ自体の底部にストップコックをクランプストップコックおよび沈降室のすりガラス継手を接続するdimentationチャンバ。
- チューブと活栓の右アウトレットに細胞装填室( 図1A)を接続します。ストップコックを閉じます。
- 活栓の左アウトレットに細胞分画チューブを取り付けます。分画チューブは開放端に接続されたガラスパスツールピペットを用いてチューブの一部を含む。小さなボアチューブ片をガラスピペットの狭い方の端に取り付けられている。狭いピペットは、フラクション回収時の細胞懸濁液の流れを制限する。一番下に、この小さなチューブをクランプする。
- 2 Lクレブスを準備(1X)の実験( 表1)の日をバッファリング。その後、1Xクレブス、1Xクレブス中550ミリリットルの4%BSA、および1Xクレブス中の50ミリリットル、0.5%BSA中550ミリリットルの2%BSAを準備します。濾過し、4℃にこれらのソリューションを冷却
- 右L 2シリンダ( 図1C)及び2%のBSA中の4%BSA溶液を注ぐ左2Lのシリンダ( 図1B)内の溶液。必ずこれらのシリンダをつなぐチューブに大きな気泡がないことを確認。
- セル負荷室にKrebs緩衝を注ぎ、沈殿槽で、このチャンバーを接続する配管を埋め、これらは勾配を乱す可能性があるので、確認して大きな気泡が存在しないこと。優しくチューブを絞るか、フリックすると、気泡を除去するのに役立ちます。クレブス緩衝液のすべてがチューブ内ではなく、セル室にあることを確認します。
- クレブス緩衝液に少量の沈殿槽に流入した後、チューブを充填し、任意の大きな気泡を除去するために細胞分画チューブにほぼすべてのバッファを流出させる。
- 直接沈殿槽の下にフラクションコレクターを配置します。すべての端数管が適切に配置され、汚染を防止するために、プラスチック製のラップで覆いいることを確認してください。
2。全精巣から造精細胞を単離する
- あらゆる汚染物質を洗い流すために、室温でクレブス緩衝液中のCA 12成体マウス(好ましくは、少なくとも8週齢)および場所から精巣を解剖。例示されてこのプロトコルは、実験用マウスの使用を必要とするし、ペンシルベニア大学の制度的動物実験委員会のガイドラインに従って実行されました。
- あなたは精細管を追加する予定直前コニカルチューブ内の50ミリリットルKrebs緩衝液に45 mgのコラゲナーゼを追加します。このソリューションは、数分間33℃まで加熱することができます。 2 50ミリリットルコニカルチューブに均等に分割します。
- 白膜を破棄し、精細管を解放し、8ミリリットルクレブス緩衝液を含有する別のプレートに精巣をカプセル解除。白膜は、精細管を包囲する薄い膜である。細管は容易に白膜からデタッチする必要があります。これを行うには、白膜の切開を行い、PAIでこの膜を開催鉗子のR、および鉗子の別のペアでから離れて膜から細管を押してください。
- コラゲナーゼ溶液25mlを含む各コニカルチューブに細管を含む4ミリリットルクレブス緩衝液を加え、10分間33℃で振とう、インキュベートする。最後には、細管は「スパゲッティ状」の外観を持っている必要があります。
- 細管は、チューブの底に約5分間沈降することができます。上澄みを注ぐと細管をチューブの底に毎回沈降させ、(室温)25ミリリットルKrebs緩衝液で2倍を洗う。各チューブの中で〜5ミリリットルクレブス緩衝液を残す。
- 洗いながら、あなたは精細管を追加する予定直前ファルコンチューブに50ミリリットルKrebs緩衝液に30mgのトリプシンを追加します。このソリューションは、数分間33℃まで加熱することができます。 2 50ミリリットルコニカルチューブに均等に分割します。
- 25ミリリットル細管を含む2チューブの各々にトリプシン溶液を加える。セルを防ぐために、各チューブに3μgのDNA分解酵素(1μg/10ml)を追加凝集からのS。 10分間33℃で、揺れ、インキュベートする。
- 約10倍とアウトそれらをペッティング、細管を含む溶液を撹拌するワイドボアピペットを使用してください。ソリューションは、複数の単一細胞懸濁液のように見えるを開始する必要があります。
- さらに10分間33℃で、揺れ、インキュベートする。約25倍に出入りしてピペッティング、単一細胞懸濁液中に細管を分散させるために広い口径のピペットを使用してください。それでも細管あるいは細胞塊がたくさん表示された場合は、ピペットを用いてより多くの分散および/または、各チューブへの別の3100μgのDNA分解酵素(二重初期濃度)を追加します。
- 100μmのメッシュセルストレーナー(30ml mlの細胞懸濁液を各チューブに1つ)を介して単一細胞懸濁液をろ過する。細胞懸濁液を結合し、細胞の総数を(7-8×10 8個の細胞の間にあるべきである)カウントされます。 ***勾配上に以上800,000,000細胞をロードしないでください。
- ステップ2.10で得られた細胞数に基づいて、approprをペレットiate 5分間450 RCFでフィルタ処理する細胞の体積と30ミリリットルクレブス緩衝液で洗浄する。繰り返します。 ***通常22精巣は、複数の800,000,000の細胞が得られますが、この細胞の数を超えてセットしないでください。
- 丁寧に泡立てない(細胞凝集の程度に応じて)DNA分解酵素μgの2.5〜5を含む25ミリリットルの0.5%BSAで細胞を懸濁します。細胞が凝集しないことを確認してください。 100μmのメッシュセルストレーナーを通して単一細胞懸濁液をろ過する。セルは現在、ロードする準備ができました。チューブを数回転倒ロードする前に、よく混ぜる。
3。セル負荷および沈降
- 必ずストップコックが閉じているが、液体沈降室( 図1D)中に細胞チャンバ( 図1A)から流れることを可能にする位置で行った。
- ゆっくりと攪拌棒が連続的に移動できるように設定を低(約70回転)の両方撹拌棒板を回しますが、。
- 細胞チャンバ( 図1A)内に細胞懸濁液を注ぎ、細胞を、10ml /分( 図1D)のレートで堆積チャンバ内に徐々に流入するようにストップコックを開く。ストップコックを閉じます。流量は、堆積チャンバのボリュームの間隔をマークすることによって決定することができる。
- 細胞チャンバ内に0.5%BSA溶液5mlを注ぎ、10ml /分の速度で沈殿槽に排出。ストップコックを閉じます。この工程は、細胞チャンバから細胞を洗浄します。 4Xを繰り返します。
- 勾配を準備します。セル室( 図1A)と2 2Lのボンベ( 図1BとC)の間にクランプを開き、40ミリリットル/分の速度( 図1D)で沈殿槽に液体を排出するために始めるすぐに。それが沈降室に、BSA勾配をロードするのに約20〜30分かかりますので、流量を調整します。の上に横たわっている細胞の薄い、乱されていない層BSAの勾配が表示されるはずです。 BSAのほとんどがロードされると、ストップコックを閉じ、液体は分別管内に沈殿槽から排出することを可能にする位置に回します。
- 撹拌プレートをオフにします。
- 細胞は1時間45分間沈降することができます。この時間の間に装置を乱すことがありません。任意の機械的攪拌は、グラデーションを乱す可能性があります。
4。画分の分別と分析
あなたは、次の手順を実行し、***、勾配を乱さないように注意してください。 BSA勾配が乱れている場合は、手順が動作しません!
- 細胞が沈殿した後、徐々に50ミリリットルコニカルチューブに沈殿槽から50ミリリットルを排出し、脇に置きます。この画分は、通常の細胞と破片の不要な塊が含まれています。
- フラクションコレクターに端数チューブを取り付けます。 ***フラクションコレならば手作業でフラクションを収集することも可能であるctorのは使用できません。
- 画分を収集します。(1コレクションチューブに充填する)10ミリリットル毎45秒を収集されるように、ストップコックで流量を調整します。
- フラクションコレクションチューブに蓋をし、4℃で450 RCFで5分間スピン、そっと上澄みを捨て、残りの液体中に細胞を再懸濁し、氷上で細胞を維持する。
- すべての画分が収集されると、微視的に異なる細胞集団のための画分を分析する。異なる細胞型は、細胞サイズおよび核の形態8,15に基づいて区別することができる。 図2(a)は体細胞および減数分裂細胞および精原細胞について富化された3つのプールされた画分を、(b)は、円形精子細胞のための「代表的な結果」を示し、 (C)精子細胞を伸長と凝縮。
- 精原細胞を入力して12-14μmのCAのです。直径とクロマチン組成が均質で丸い核を持っている。
- B型精原8-9μmのCAのです。直径とrounている核周辺部に沿ってより密度の高いヘテロクロマチンを示してD核。
- 前細糸期の精母細胞は7.5-8.2μmのCAです。直径、タイプB精原細胞より小さい細胞質を持っており、B型精原細胞と同様に見える核を持っている。
- 細糸期精母細胞は、8月10日100μMのCAです。直径と事前細糸期の精母細胞と同様に見えますが、核膜でより密なクロマチンを得るように見える核を持っている。
- 接合期精母細胞は、10月12日100μMのCAです。直径と細糸期精母細胞と同様に見える核を持っている。
- パキテン期の精母細胞は、任意の場所に12〜18ミクロンのCAからである。直径と大きな核を取り巻く細胞質の細いリムで構成されています。密なクロマチンのより多くの塊が核内で見ることができます。
- 丸い精子細胞は、10μmCAです。直径と中央の密集染色染色中心と丸い核を持っている。
- 残余体は直径〜6.5μmであり、円形で、核を欠いている。
- 伸長と凝縮精子細胞は、精子細胞を丸める大きさが似ていますが、ユニークな、鎌形核を持っている。
- 分15で始まり、85までのすべての5画分を分析。通常、15以下の画分をすぎて混合し、塊状となり、85以上の画分を、使用可能な細胞にいくつか含まれています。
- 割合を分析するには、(細胞を遠心分離した後再懸濁されたら)画のコレクションチューブから液体5μlのを取り、クレブス緩衝液は8%ホルムアルデヒド5μlのに追加。固定した細胞は、5分間室温で静置する。
- 固定した細胞を0.1%トリトンおよびDAPI(5μ/ mlのクレブス緩衝液)5μlのを追加します。細胞を、5分間室温で静置する。
- 、スライド上に得られた溶液を10μlを置きカバーガラスでカバーし、各画分の純度を決定するために、蛍光顕微鏡で分析します。
- 減数分裂と体二倍体細胞、円形精子および伸長/凝縮する精子細胞:大きさや核の形態が類似している細胞の次の集団を作成する(「代表的な結果」を参照)の分画を結合します。
結果
STA-PUTプロシージャから理想的な結果は、細胞の大きさおよび密度に基づいて、精巣からの細胞のかなり目立つ分離である。精巣から単離された細胞は、BSA勾配を介して沈降しているが、細胞のいくつかの別個のバンドが観察することができる。セルのいずれか塊は勾配の底に沈むようにし、他の画分を汚染しない傾向があります。もう少し勾配までは、大規模な体細胞および減数分裂細胞である。遠く勾配までは、まだ小さい円形精子細胞になります。勾配の上部に精子細胞、精子、赤血球を汚染する(これらは、核なしで小円形細胞であると思われる)、凝縮されます。
画分は、光及び蛍光顕微鏡法(図2)15の組み合わせを用いて迅速に分析することができる。減数分裂、精子、および体二倍体細胞は精巣で見つかった最大の細胞であり、relatiを染色に大きな核が含まれていますvely均一にDAPIで。丸い精子細胞は、一般的に明るく染色染色中心で、小さく丸い核を有する小さい細胞である。凝縮さ/伸長精子細胞は、小さな尾が形成されているかのように、多くの場合、楕円形に見える小さな細胞である。これらの細胞はDAPIで明るく染色し、鎌のような形をしている小型でコンパクトな核を持っている。細胞画分が組み合わされると、純度は、細胞溶解物のウェスタンブロット分析(図3)により決定することができる。減数分裂細胞の一般的なマーカーは、対合複合体1タンパク質SCP1とSycp2 16である。精子細胞を凝縮の一般的なマーカーは、移行タンパク質( 例えば TP1)またはプロタミン17です。
各STA-PUT実行は異なる可能性がありますが、通常、減数分裂細胞、精原細胞と体細胞二倍体細胞は、画分中の円形精子は約55〜65、。画分カリフォルニア州の25から40を発見され、フラクションカリフォルニア州の精子細胞を伸長/凝縮する。により体細胞/減数分裂細胞と円形精子の大きさの差が小さいと、65〜75、分画約 45〜50は、多くの場合、体細胞/減数分裂細胞や円形精子のさえ割合を持っている。 DAPIで染色すると、細胞のこれら2集団を区別するのに役立ちます。少ない円形精子細胞の重なりに起因する細胞のこれら2集団間のサイズが大きく違いによる精子細胞画分を伸長/凝縮さがあります。通常、15以下の画分を85以上の細胞画分の多くの大規模な塊が数個の細胞、多くの残留団体、または精子細胞によって流されている膜結合、細胞質が含まれていますが含まれます。
〜22精巣から細胞は、STA-PUTプロシージャを使用して分画するとき、一般的に、それは、CAが得られます。10 8細胞/精原細胞型(減数分裂/体性二倍体細胞、円形精子および精子細胞を伸長/なきこと)。細胞の最終集団を作成するために結合された画分は、少なくともあるべきである問題となっている細胞の種類のための純粋な80パーセント。この純度以上が表示されない場合は、細胞分離またはBSA勾配に問題がある可能性があります。また、いくつかの細胞は、80 +フラクションに最初の20画分および細胞の豊富に存在する場合、または最初の20画分中の細胞の存在量とほとんどは70 +フラクション中に存在する場合には、沈降時間をさらにする必要がある最適化された。どのようにトラブルシュートへの提案のための議論を参照してください。

図1。 STA-PUT装置の設定:STA-PUT装置の概略と実際の画像が示されている。すべてのガラス製品は、フラクションコレクターに装置を接続するチューブを含む、プラスチックチューブによって接続されている。矢印は、クランプの位置を示す。 A)細胞ローディングチャンバ、攪拌棒を含み、B)2 Lシリンダ 2%のBSAのために、攪拌棒が含まれていると、c)4%BSA用2Lのシリンダーと、d)沈殿槽、E)攪拌プレート、F)バッフル、G)コック。 拡大画像を表示するには、ここをクリックしてください 。
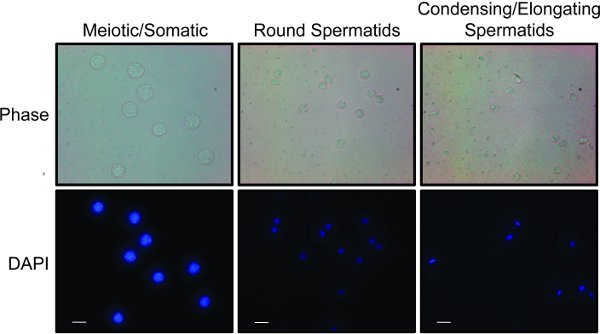
図2。 STA-PUTから得られた細胞集団 :減数分裂と体細胞、円形精子および精子細胞を凝縮し、伸長:画分3細胞の別々の集団に合わせた。各集団は、核の大きさおよび形態の違いを示すためにDAPIで染色されている。位相コントラスト撮影は、セルサイズおよび形状の違いを搬送する。白いバーは10μmで表しています。 拡大画像を表示するには、ここをクリックしてください 。
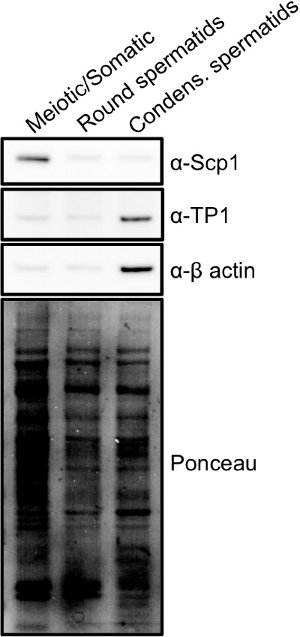
図3。 STA-PUTから得られた異なる細胞集団のマーカー:全細胞抽出物を、図1に示した各細胞集団から作製し、ウェスタンブロット分析を、各集団についてのタンパク質発現の違いを示すために実施した。シナプトネマ複合体タンパク質1(SCP1)減数分裂の際にのみ発現と凝縮精子細胞画分の遷移タンパク質1(TP1)、後半精子における発現されたタンパク質について濃縮されている間、減数分裂画分が濃縮された発見されたタンパク質である。 拡大表示するには、ここをクリックしてください画像 。
ディスカッション
信頼性の高い細胞培養系は、まだすべての精子形成細胞タイプ3を生成するために存在していないとして、精子形成を研究者たちは、精子形成細胞サンプルのための動物モデルに依存しています。精子形成細胞が容易に全体の精巣から収集しているが、唯一の混合集団をもたらす。これは、減数分裂細胞、円形精子、と凝縮精子細胞など、これらの細胞の特定のサブタイプを、勉強したい人のための問題となる。 FACSは、STA-入れ、水簸6月13日 :3つの異なる方法は、現在、精子形成細胞のこれらのサブタイプを分離するために使用される。それぞれ、セルソーターや水簸機:後者の二つの方法は、機器の高価な部分へのアクセスを必要とする。 FACS法は、精子形成の異なる細胞型の高度に純粋な集団が得られるものの、処理は6時間かかり2〜3睾丸当たり11細胞タイプごとに0.5〜2.0×10 6個の細胞が得られる。 STA-PUTメタ様水簸、OD、大きさや密度に基づいて細胞を分離したが、STA-PUT装置よりも高価である水簸機へのアクセスを必要とします。
STA-PUTプロシージャは、かなり高い収率(〜22精巣あたり〜10 8個/人口)で異なるサイズの精子形成細胞を分離するために、単純なBSAの勾配を使用しています。 FACS法に対して、STA-PUT手順は、多くの細胞/精巣を生じ、細胞型を分離するためにはるかに少ない時間がかかる。 FACSおよび水簸と比較して、STA-PUT手順は比較的単純で安価である。 STA-PUTは、セルソーターや水簸機を利用できないラボのための理想的な方法で行う、唯一の低温室や大型冷蔵庫、特殊なガラス製品のセットが必要です。適切に実行すると、STA-PUTは円形精子細胞または精子細胞の集の約90%純粋な集団を提供することができます。
STA-PUTメソッドは非常に便利ですが、いくつかの異なるステップでの最適化が必要であり、特にSedimentation。細胞型の準最適な分離は、ほとんどのBSA勾配に関連する、いくつかの異なる問題によって引き起こされ得る。適切なグラデーションを作成するには、グラデーションの作成中の2%BSAを保持している細胞装填室と2Lの筒内に攪拌棒をオンにします。また、気泡のすべてのチューブをクリアして、細胞をロードする前に、沈殿槽内の所定の位置にバッフルを置く。中または沈降室からBSAの流量を減少させることは役立ち得る。最も重要なことは、STA-PUT装置は、勾配、沈降、またはフラクションコレクションの作成時に邪魔されないようにしてください。
次善の細胞収率は、精巣の数が不十分/サイズ、コラゲナーゼ/トリプシン処理中の不適切な細胞の分離および細胞凝集の結果であり得る。 1は、精子形成CEL少数を生産新生児マウスや遺伝子型を使用しているため、このSTA-PUTプロトコルに対して適切な数の細胞を得ることができない場合lsが、そのSTA-PUTあたりより多くの動物を使用するか、または(ProScienceから入手可能)より少量の細胞数のために最適化されたSTA-PUTガラス製品キット18を注文する必要があるかもしれない。細胞の最適な数(700から800000000)を得るために、理想的には少なくとも8〜9週齢生殖年齢の少なくとも11雄マウスを使用しています。しかし、これ以上8億以上の細胞が1、STA-PUTにロードする必要があります。細胞はトリプシン処理後の単一細胞懸濁液に解離していない場合は、DNアーゼ濃度は1μgの/溶液5mlにまで増加させることができる。 DNアーゼは、凍結/解凍のサイクルを繰り返すことに敏感であり、新鮮なDNアーゼを毎回使用して単一細胞懸濁液に細管のより効果的な分散をもたらす。一つは、メッシュを通して濾過する前に、細胞塊をバラバラワイドボアピペットを使用することができます。
最適化を必要とするSTA-PUT方法の一態様は、細胞をBSA勾配を通して沈降させている時間の量である。一時間そして45分には、通常、うまく機能しますが、今回は、研究室に研究室とは異なる場合があります。通常、セルの異なる層はBSA勾配を通して視覚的に見ることができる。少数の細胞を回収し、最初の20分および80 +フラクション中の細胞に豊富に存在する場合、沈降時間を延長する必要があるかもしれない。あまりにも多くの細胞を回収し、最初の20画分に存在し、細胞型の分離が不十分であった場合、沈降時間を低くする必要があるかもしれない。
STA-PUT手順で取得した細胞は、実験の多くの異なるタイプのために使用することができる。大規模な生化学実験は、いくつかの異なるSTA-PUTの実行から材料を組み合わせる必要とし得るが、STA-PUTは、ウェスタンブロット分析、免疫蛍光、およびRNA分析のための十分な材料を提供する。他の細胞型から分離されたときに、半数体精子細胞がより容易とすることができる3つまで日間培養し、 インビトロでの分子操作に供され得る in vivoでの治療またはノックアウト動物の作成19。記載STA-PUTプロトコルで得られた細胞が汚染の明らかな兆候なしに一日間培養したが、細胞は、より長い細胞培養実験のために使用される場合、機器はエタノールで消毒されるべきであり、すべての溶液は濾過滅菌されるべきであり、すべてのセル負荷前とフラクションコレクションの後の手順は、組織培養フード内で行われるべきである。また、抗生物質を含む培養培地を使用すべきである。 STA-PUT方法は、細胞の固定を必要としないという事実は、生存可能な細胞を必要とする実験のための理想的な手順となる。
開示事項
著者は、彼らが競合する経済的利益を持っていないことを宣言します。例示されてこのプロトコルは、実験用マウスの使用を含む、すべての関連するガイドライン、規制、規制当局に準拠して実行されました。このプロトコルで使用される動物は、ペンシルベニア大学の施設内動物管理使用委員会(IACUCプロトコル番号804284)の指導と承認の下で維持されている。
謝辞
この研究は、RGMにSLBとU54HD068157にNIHの助成金GM055360によってサポートされていました。 JMBはペンシルバニア大学(GM008216)でT32遺伝学研修助成金によって支えられている。
資料
| Name | Company | Catalog Number | Comments |
| BSA | Affymetrix/USB | 10857 100MG | Alternate can be used. |
| 0.5%, 2%, and 4% BSA solutions | Dissolve 0.25 g, 11 g, and 22 g (respectively) in total volumes of 50 ml, 550 ml, and 550 ml of 1x KREBS (respectively). | To be made day of the STA-PUT procedure. Filter sterilize. | |
| KREBS (10x) | 3.26 g KH2PO4 + 139.5 g NaCl +5.89 g MgSO4/7H20 + 40 g Dextrose + 3.78 g CaCl2/2H20 + 7.12 g KCl, bring to 2 L with ddH20 | Autoclave/filter and store at 4 °C for several months. | |
| KREBS (1x) | Dissolve 4.24 g NaHCO3 in 100 ml ddH20. Add 200 ml 10x KREBS. Bring to 2 L with ddH20. | To be made day of the STA-PUT procedure. Filter sterilize. | |
| Collagenase | Sigma | C9891-1G | |
| DNAse | Sigma | DNEP-5MG | |
| Trypsin | Sigma | T9201-1G | |
| DAPI | Preference of researcher | ||
| Triton-X100 | Preference of researcher | ||
| Formaldehyde (~37%) | Preference of researcher | ||
| TABLE 2: EQUIPMENT | |||
| Equipment | Company | Catalog # | Comments |
| Complete STA-PUT apparatus | ProScience Glass Shop | STA-PUT (this procedure uses the standard sedimentation chamber: Cat. No. 56700-500) | Includes all glassware and equipment for the apparatus. Alternate glassware is available for performing STA-PUT with smaller cell numbers. |
| 10 μm mesh filter | Fisherbrand | 22363549 | |
| Mouse dissection tools | Preference of researcher | ||
| 14 ml round bottom fraction collection tubes with caps | Preference of researcher | ||
| Need approximately 100 tubes | |||
| Fraction collector | GE Healthcare Life Sciences | Model: Frac-920, Product code: 18-1177-40 | Alternate can be used. |
| Microscope slides, cover glass | Preference of researcher | ||
| Light/Fluorescent Microscope | Preference of researcher |
参考文献
- Wistuba, J., Stukenborg, J., Luetjens, C. M. Mammalian Spermatogenesis. Funct. Dev. Embryol. 1, 99-117 (2007).
- Hess, R. A., Cooke, P. S., Hofmann, M. C., Murphy, K. M. Mechanistic insights into the regulation of the spermatogonial stem cell niche. Cell Cycle. 5, 1164-1170 (2006).
- Dores, C., Alpaugh, W., Dobrinski, I. From in vitro culture to in vivo models to study testis development and spermatogenesis. Cell Tissue Res. 349, 691-702 (2012).
- Hayashi, K., Ohta, H., Kurimoto, K., Aramaki, S., Saitou, M. Reconstitution of the mouse germ cell specification pathway in culture by pluripotent stem cells. Cell. 146, 519-532 (2011).
- Easley, C. A., et al. Direct differentiation of human pluripotent stem cells into haploid spermatogenic cells. Cell Rep. 2, 440-446 (2012).
- Bellve, A. R. Purification, culture, and fractionation of spermatogenic cells. Methods Enzymol. 225, 84-113 (1993).
- Meistrich, M. L., Bruce, W. R., Clermont, Y. Cellular composition of fractions of mouse testis cells following velocity sedimentation separation. Exp. Cell Res. 79, 213-227 (1973).
- Romrell, L. J., Bellve, A. R., Fawcett, D. W. Separation of mouse spermatogenic cells by sedimentation velocity. A morphological characterization. Dev. Biol. 49, 119-131 (1976).
- Miller, R. G., Phillips, R. A. Separation of cells by velocity sedimentation. J. Cell Physiol. 73, 191-201 (1969).
- Bastos, H., et al. Flow cytometric characterization of viable meiotic and postmeiotic cells by Hoechst 33342 in mouse spermatogenesis. Cytometry A. 65, 40-49 (2005).
- Getun, I. V., Torres, B., Bois, P. R. Flow cytometry purification of mouse meiotic cells. J. Vis. Exp. (50), e2602 (2011).
- Grabske, R. J., Lake, S., Gledhill, B. L., Meistrich, M. L. Centrifugal elutriation: separation of spermatogenic cells on the basis of sedimentation velocity. J. Cell Physiol. 86, 177-189 (1975).
- Meistrich, M. L., Trostle, P. K. Separation of mouse testis cells by equilibrium density centrifugation in renografin gradients. Exp. Cell Res. 92, 231-244 (1975).
- Gassei, K., Ehmcke, J., Schlatt, S. Efficient enrichment of undifferentiated GFR alpha 1+ spermatogonia from immature rat testis by magnetic activated cell sorting. Cell Tissue Res. 337, 177-183 (2009).
- Bellve, A. R., et al. Spermatogenic cells of the prepuberal mouse. Isolation and morphological characterization. J. Cell Biol. 74, 68-85 (1977).
- Handel, M. A., Schimenti, J. C. Genetics of mammalian meiosis: regulation, dynamics and impact on fertility. Nat. Rev. Genet. 11, 124-136 (2010).
- Zhao, M., Shirley, C. R., Mounsey, S., Meistrich, M. L. Nucleoprotein transitions during spermiogenesis in mice with transition nuclear protein Tnp1 and Tnp2 mutations. Biol. Reprod. 71, 1016-1025 (2004).
- Manku, G., Mazer, M., Culty, M. Neonatal testicular gonocytes isolation and processing for immunocytochemical analysis. Methods Mol. Biol. 825, 17-29 (2012).
- Dehnugara, T., Dhar, S., Rao, M. R. An in vitro, short-term culture method for mammalian haploid round spermatids amenable for molecular manipulation. Mol. Reprod. Dev. 79, 19-30 (1002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved