Method Article
A separação de tipos de células espermatogênicas Usando STA-PUT velocidade de sedimentação
Neste Artigo
Resumo
O método STA-PUT permite a separação das diferentes populações de células espermatogénicas com base no tamanho e densidade.
Resumo
Espermatogénese mamífero é um processo de diferenciação complexo que ocorre em várias etapas, os túbulos seminíferos dos testículos. Atualmente, não existe um sistema de cultura de células confiável permitindo a diferenciação da espermatogênese in vitro, ea maioria dos estudos biológicos das células espermatogênicas requerem colheita de tecidos a partir de modelos animais, como ratos e ratinhos. Porque o testículo contém numerosos tipos de células - tanto não-espermatogênico (Leydig, Sertoli, mielóides e células epiteliais) e espermatogênicas (espermatogônias, espermatócitos, espermátides redondas, condensando espermátides e espermatozóides) - estudos dos mecanismos biológicos envolvidos na espermatogênese requer o isolamento e o enriquecimento destes tipos de células diferentes. O método STA-PUT permite a separação de uma população heterogénea de células - neste caso, a partir de testículos - por meio de um gradiente linear de BSA. Tipos de células individuais sedimentar com velocidade de sedimentação de acordo com a diferente cetamanho ll, e fracções enriquecidas com diferentes tipos de células pode ser recolhido e utilizado em análises posteriores. Enquanto o método de STA-PUT não resulta em fracções de elevada pureza de tipos de células, por exemplo, como pode ser obtido com determinados métodos de classificação celular, que faz prever um rendimento muito maior do total de células em cada fracção
(~ 1 x 10 8 células / tipo de célula espermatogênico de uma população inicial de 7-8 x 10 8 células). Este método de alto rendimento exige apenas vidraria especializada e pode ser realizada em qualquer sala fria ou geladeira grande, tornando-se um método ideal para laboratórios que têm acesso limitado aos equipamentos especializados como uma fluorescência ativada classificador de células (FACS) ou elutriator.
Introdução
Espermatogénese mamífero é um processo de diferenciação complexo que ocorre em várias etapas, os túbulos seminíferos dos testículos 1. Resumidamente, células-tronco como espermatogônias que residem perto do epitélio da divisão dos túbulos seminíferos e se diferenciam em espermatócitos, que, em seguida, passam por divisões meióticas. Após a meiose é completa, as células haplóides resultantes, ou espermátides arredondadas, são submetidos a espermiogênese, um processo de diferenciação que envolve o derramamento de citoplasma e compactação do núcleo. Espermátides gradualmente desenvolver um flagelo e submetidos a alongamento e condensação do núcleo, produzindo alongamento e, em seguida, condensando espermatídeos, respectivamente. Os produtos finais são os espermatozóides, que são liberados no lúmen do túbulo seminífero e, finalmente, para o epidídimo, onde eles amadurecem mais.
Como o processo de espermatogênese depende de condições hormonais e moleculares especiais emos testículos, um sistema in vitro de cultura de confiança para todo o processo de espermatogénese ainda não foi desenvolvido 2,3. Métodos de cultura têm sido desenvolvidos para a criação de "células-como células germinativas primordiais" e, "espermátides-como a volta" haplóides a partir de células-tronco, mas estes métodos ainda não são capazes de gerar um grande número dessas células e não conseguem produzir células espermatogênico mais tarde tipos 4,5. Felizmente, os tipos de células espermatogénicas diferem significativamente de tamanho, que permite a uma suspensão de uma única célula obtidos a partir de testículos inteiras sejam separadas com um gradiente de líquido. O método STA-PUT, demonstrado aqui, usa um gradiente linear BSA e sedimentação simples para separar células espermatogênicas com base no tamanho e massa 6-9.
O método STA-PUT tem várias vantagens sobre os outros dois métodos mais amplamente utilizados para separar os tipos de células espermatogénicas: FACS e elutriação 10-13. O aparelho STA-PUT requer only vários pedaços de vidro especializada montado em uma sala fria ou geladeira grande. Assim, é menos dispendioso do que o uso de um separador de células ou um elutriator. O método STA-PUT produz quantidades elevadas de células, por tipo de célula e os testículos do que pode ser classificada por FACS num período de tempo comparável, embora a pureza de cada população de células não é tão elevada quanto as obtidas com FACS 11. Células de triagem utilizando esferas magnéticas (triagem magnético ativado celular, MACS), recentemente tem sido empregada com sucesso para o enriquecimento das espermatogônias a partir de uma população de células dos testículos mista, mas de momento inadequado para separar espermatócitos ou espermátides, devido à falta de conhecimento da superfície apropriada marcadores 14. Uma vantagem adicional do método de STA-PUT sobre FACS ou MACS é a capacidade para isolar células viáveis adequados para a cultura subsequente, porque, em contraste com a maioria dos protocolos de FACS, que não requer qualquer ADN ou outros tipos de coloração. Para os estudos que requerem lrendimentos ARGE, de espermatogênicas tipos de células em ~ 90% de pureza, o STA-PUT é um método ideal.
Protocolo
O protocolo STA-PUT envolve três etapas: 1) Configure do aparelho e reagentes, 2) Preparação de suspensão de células de testículos inteiros, e 3) carregamento celular, sedimentação, e recolha de fracções. Quando realizada por uma equipe de dois pesquisadores, o protocolo leva oito horas, em média.
1. Configurar o aparelho STA-PUT (Figura 1)
*** Aparelho STA-PUT deve ser colocado numa grande frigorífico a 4 ° C ou de um quarto frio que também pode acomodar um colector de fracções, se que o método de recolha é o preferido.
- Na noite anterior (ou pelo menos algumas horas antes), você executar o método, lavar todo o equipamento (especialmente o de vidro e tubos) e esterilizar com álcool 70%. Vamos equipamento seca completamente, antes de montar o aparelho como ilustrado na Figura 1.
- Fixe os dois cilindros de 2 L (Figuras 1B e C) ea câmara de carga da célula ( Figura 1A) para a plataforma superior e conectar todos com dois pequenos pedaços de tubos com grampos de tubo. Prenda todos os tubos fechados. Selar o bico sobre o L cilindro mais à direita 2.
- Colocar uma pequena barra de agitação na câmara de carregamento de células (Figura 1A) e uma barra de agitação maior no 2 L cilindro mais à esquerda (Figura 1B) que conterá a BSA a 2%.
- Coloque a câmara de sedimentação de 2 L sobre a plataforma (Figura 1D). Coloque o deflector de metal (Figura 1F) directamente por cima da abertura na parte inferior da câmara de sedimentação (Figura 1D). Isto é crítico, como o deflector impede o vórtice do líquido e perturbação do gradiente de células durante a recolha de fracções. Coloque a tampa na parte superior da câmara de sedimentação.
- Após a aplicação de uma quantidade muito pequena de massa lubrificante de vácuo para a junta de vidro esmerilado de a torneira de três vias (Figura 1G), fixar a torneira de passagem para a parte inferior do sicâmara dimentation, ligando as juntas de vidro da torneira e da câmara de sedimentação.
- Ligue a câmara da célula de carga (Figura 1A) para a saída para a direita da torneira com um tubo. Fechar a torneira.
- Conecte o tubo de fracionamento celular para a tomada esquerda do torneira. O tubo de fraccionamento compreende uma peça de tubo com uma pipeta de Pasteur de vidro, ligado à extremidade aberta. Um pedaço da tubagem de furo menor é ligado à extremidade mais estreita da pipeta de vidro. A pipeta estreita restringe o fluxo da suspensão de células durante a fracção de recolha. Fixe este pequeno tubo na parte inferior.
- Preparar 2 L de Krebs (1x) tamponar o dia da experiência (Tabela 1). Em seguida, preparar 550 ml de 2% de BSA em 1x de Krebs, 550 ml de 4% de BSA em 1x de Krebs, e 50 ml de BSA a 0,5% em 1x de Krebs. Filtra-se e arrefecer as soluções a 4 ° C.
- Verter a solução de BSA a 4% no cilindro direito L 2 (Figura 1C) e BSA a 2%solução em 2 L da esquerda do cilindro (Figura 1B). Certifique-se que não há grandes bolhas na tubulação que conecta esses cilindros.
- Despeje tampão Krebs para a câmara de carga da pilha e encher o tubo que liga esta câmara com a câmara de sedimentação, certificando-se de que não há bolhas grandes, pois estes podem perturbar o gradiente. Apertando ou sacudindo o tubo suavemente ajuda a remover as bolhas. Certifique-se de todo o tampão de Krebs é no tubo e não na câmara de célula.
- Permitir que uma pequena quantidade de solução tampão de Krebs a fluir para dentro da câmara de decantação e depois drenar quase todo o tampão para os tubos de fraccionamento de células, a fim de encher o tubo e remover quaisquer bolhas de grandes dimensões.
- Coloque o coletor de fração diretamente sob a câmara de sedimentação. Certifique-se que todos os tubos de fração estão no lugar e coberta com filme plástico para evitar a contaminação.
2. Isolando espermatogênicas células de testículos inteiros
- Dissecar testículos de ca 12 ratos adultos (de preferência pelo menos oito semanas de idade) e coloque em tampão Krebs à temperatura ambiente para lavar qualquer material contaminante. Este protocolo está sendo demonstrada envolve o uso de ratos de laboratório e foi executado em conformidade com as diretrizes da Universidade do Comitê Institucional Animal Care e Use Pensilvânia.
- Adicionar 45 mg de colagenase a 50 ml de tampão Krebs em um tubo cônico de direito antes que você pretende adicionar os túbulos seminíferos. Permitir que a solução aquecer até 33 ° C durante alguns minutos. Divididos igualmente em dois tubos de 50 ml cônico.
- Decapsulate os testículos em um prato separado, contendo 8 ml de tampão Krebs, descartando a túnica albugínea e liberando os túbulos seminíferos. A túnica albugínea é a fina membrana que envolve os túbulos seminíferos. Os túbulos deve prontamente separar da túnica albugínea. Para fazer isso, fazer uma incisão na túnica albugínea, segure esta membrana com um pair de uma pinça, e empurrar os túbulos de fora e para longe da membrana com o outro par de fórceps.
- Adicionar 4 ml de tampão de Krebs contendo os túbulos de cada tubo cónico contendo 25 ml de solução de colagenase e incubar, sob agitação, à 33 ° C durante 10 min. No final, os túbulos deve ter uma aparência de "spaghetti-like".
- Permitir que os túbulos que se contentar com ~ 5 min para o fundo do tubo. Derrama-se o sobrenadante e lavar 2x em 25 ml de tampão de Krebs (à temperatura ambiente), permitindo que os túbulos para assentar no fundo do tubo de cada vez. Deixar ~ 5 ml de tampão de Krebs, em cada tubo.
- Enquanto a lavagem, adicionar 30 mg de tripsina a 50 ml de tampão Krebs em um tubo falcon direito antes que você pretende adicionar os túbulos seminíferos. Permitir que a solução aquecer até 33 ° C durante alguns minutos. Divididos igualmente em dois tubos de 50 ml cônico.
- Adicionar 25 ml de solução de tripsina a cada um dos dois tubos contendo os túbulos. Adiciona-se 3 ug de DNAse (1 μg/10ml) a cada tubo para prevenir a células de aglomeração. Incubar, sob agitação, à 33 ° C durante 10 min.
- Usar uma pipeta de orifício largo para agitar a solução contendo os túbulos, pipetando-os dentro e para fora aproximadamente 10x. A solução deve começar a olhar mais como uma suspensão única célula.
- Incubar, sob agitação, à 33 ° C durante 10 min adicionais. Use uma pipeta de diâmetro grande para dispersar os túbulos em uma suspensão única célula, pipetando-los dentro e fora aproximadamente 25x. Se você ainda ver um monte de túbulos ou aglomerados de células, dispersar mais com a pipeta e / ou adicionar outro DNAse 3 mg a cada tubo (concentração inicial duplo).
- Filtra-se a suspensão de células individuais através de um filtro de células de malha 100 um (uma para cada tubo de 30 ml de suspensão de células). Combina-se as suspensões de células e contagem do número total de células (deve estar entre 7-8 x 10 8 células). *** NÃO carregar mais de 800 milhões de células para o gradiente.
- Com base na contagem das células obtidas na etapa 2.10, sedimentar a aproprvolume de iate de células filtradas em 450 rcf durante 5 min e lava-se com 30 ml de tampão de Krebs. Repetir. Normalmente *** 22 testículos vai render mais de 800 milhões de células, mas não coloque mais do que esse número de células.
- Ressuspender cuidadosamente as células em 25 ml de BSA a 0,5%, contendo entre 2,5 e 5 ug de DNAse (dependendo do grau de agregação celular), sem criar bolhas. Certifique-se que as células não se aglutinar. Filtra-se a suspensão de células individuais através de um filtro de células de malha 100 um. As células estão agora prontos para carregar. Misture bem antes do carregamento, invertendo o tubo várias vezes.
3. Célula de carga e Sedimentação
- Certifique-se de que a torneira é fechada, mas na posição em que irá permitir que o líquido flua da câmara da célula (Figura 1A) para a câmara de sedimentação (Figura 1D).
- Vire ambas as placas barra de agitação para um nível baixo (cerca de 70 rpm) para permitir que as barras de agitação para se mover continuamente, mas lentamente.
- Despeje a suspensão de células para dentro da câmara de células (Figura 1A) e abrir a torneira de modo a que as células fluem lentamente para dentro da câmara de sedimentação, a uma taxa de 10 ml / min (Figura 1D). Fechar a torneira. Taxa de fluxo pode ser determinada por marcação intervalos de volume na câmara de sedimentação.
- Despeje 5 ml de solução de BSA a 0,5% para a câmara de célula e drene para a câmara de sedimentação, a uma taxa de 10 ml / min. Fechar a torneira. Este passo irá lavar as células para fora da câmara de célula. Repita 4x.
- Prepare o gradiente: Abra os grampos entre a câmara da célula (Figura 1A) e os dois cilindros de 2 L (Figura 1B e C), e começar a escoar o líquido para dentro da câmara de decantação a uma taxa de 40 ml / min (Figura 1D) imediatamente. Ajustar o fluxo de modo que leva cerca de 20-30 minutos para carregar o gradiente de BSA para a câmara de sedimentação. Uma camada fina, sem perturbações de células encontra-se na parte superior doGradiente BSA deve ser visível. Uma vez que a maior parte da BSA é carregado, feche a torneira e coloque-o na posição que irá permitir que o líquido escorra da câmara de sedimentação no tubo de fracionamento.
- Desligue as placas de agitação.
- Permitir que as células sedimentar durante uma hora e 45 minutos. Não perturbem o aparelho durante este tempo. Qualquer agitação mecânica poderia perturbar o gradiente.
4. O fraccionamento e Análise de fracções
*** Como você execute os seguintes passos, tenha cuidado para não perturbar o gradiente. Se o gradiente de BSA é perturbado, o procedimento não vai funcionar!
- Uma vez que as células tiverem sedimentado, escorrer lentamente 50 ml da câmara de sedimentação em um tubo cônico de 50 ml e reserve. Esta fracção contém geralmente aglomerados indesejados das células e detritos.
- Fixe o tubo fração para o coletor de fração. *** Também é possível coletar as frações à mão, se um colle fraçãoctor não está disponível.
- Colete frações: Ajustar a taxa de fluxo com a torneira para que 10 ml (enchendo um tubo de coleta) é coletada a cada 45 seg.
- Tapar os tubos de recolha de fracção e girar durante 5 minutos a 450 rcf a 4 ° C. Deitar fora o sobrenadante cuidadosamente, ressuspender as células em líquido restante, e manter as células no gelo.
- Uma vez que todas as frações são coletadas, microscopicamente analisar as frações para as populações de células diferentes. Diferentes tipos de células podem ser distinguidas com base no tamanho e morfologia celular nuclear 8,15. Figura 2 ilustra os resultados representativos "" para as três fracções reunidas que são enriquecidas para as células (uma) somáticas e meiose e espermatogónios, (b), e Espermátides arredondadas (c) alongando e condensação espermatídeos.
- Tipo A espermatogônias são 12 14μm ca. de diâmetro e têm núcleos redondos que são homogêneos em composição da cromatina.
- Tipo B espermatogônias são 8-9μm ca. em diâmetro e têm round núcleos que mostram heterocromatina mais densa ao longo da periferia nuclear.
- Espermatócitos Pré-leptotênicos são 7.5-8.2μm ca. de diâmetro, têm menos citoplasma de espermatogônias do tipo B, e têm núcleos que se assemelham às de Tipo B espermatogônias.
- Espermatócitos primários leptotênicos são 8-10 mM ca. em diâmetro e têm núcleos que se assemelham às de espermatócitos pré-leptotênicos, mas parecem ter mais densa da cromatina na membrana nuclear.
- Zigóteno espermatócitos primários são 10-12 mM ca. em diâmetro e têm núcleos que se assemelham às de espermatócitos primários leptotênicos.
- Espermatócitos Paquíteno estão em qualquer lugar 12-18 mM ca. de diâmetro e são constituídos por uma borda fina de citoplasma em torno de um núcleo grande. Mais aglomerados de cromatina densa pode ser visto no núcleo.
- Espermátides redondas são 10 m ca. em diâmetro e têm um núcleo redondo com um cromocentro densamente coloração no meio.
- Residualcorpos são ~ 6,5 m de diâmetro, são redondos, e carecem de um núcleo.
- Alongamento e condensação espermatídeos são semelhantes em tamanho a espermatídeos redondas, mas têm, de um núcleo em forma de foice única.
- Comece com a fração de 15 e analisar cada cinco frações de até 85. Normalmente, as frações inferiores a 15 vai ser muito misturado e agrupado, e as frações superiores a 85 irá conter poucos ou nenhum células utilizáveis.
- Para analisar uma fracção, tomar 5ul de líquido a partir do tubo de recolha de fracções (uma vez que as células foram ressuspensas após centrifugação) e adicionar a 5ul de 8% de formaldeído em tampão de Krebs. Permitir que as células fixas para descansar em temperatura ambiente por cinco minutos.
- Adicionar 5 ul de 0,1% de Triton e DAPI (5 μ / ml de tampão de Krebs) para as células fixadas. Permitir que as células para descansar em temperatura ambiente por 5 min.
- Coloque 10 ml da solução resultante sobre uma lâmina, cubra com uma lamínula, e analisar com um microscópio de fluorescência para determinar a pureza de cada fração.
- Combine frações que são semelhantes em tamanho e morfologia nuclear (ver "Os resultados representativos") para criar os seguintes populações de células: células diploides meiose e somáticos, espermátides redondas e condensação / alongando espermátides.
Resultados
O resultado ideal do processo de STA-PUT é uma separação bastante perceptível de células dos testículos com base no tamanho de célula e a densidade. Enquanto as células isoladas a partir dos testículos são sedimentando através do gradiente de BSA, várias bandas distintas de células pode ser observada. Quaisquer aglomerados de células tendem a afundar-se para o fundo do gradiente e não contaminam as outras fracções. Um pouco mais acima do gradiente será o grande somáticas e células meióticas. Mais acima o gradiente ainda será espermátides arredondadas menores. No topo do gradiente vai ser condensado espermatídeos, esperma e contaminando as células vermelhas do sangue (estes parecem ser pequenas células redondas sem núcleo).
As fracções podem ser analisadas mais rapidamente usando uma combinação de luz e microscopia de fluorescência (Figura 2) 15. Meiótica, espermatogônias e células diplóides somáticas são as maiores células encontradas nos testículos e conterá grandes núcleos que relati manchavely homogeneamente com DAPI. Espermátides redondas são células menores com núcleos redondos menores, geralmente com uma cromocentro coloração brilhante. Condensação / alongando espermátides são pequenas células que muitas vezes parecem oblongo, como se uma pequena cauda está se formando. Estas células têm núcleos compactos, menores que mancham brilhantemente com DAPI e são em forma de uma foice. Uma vez que as fracções de células são combinadas, a pureza pode ser adicionalmente determinado por análise de transferência de Western dos lisados celulares (Figura 3). Marcadores comuns de células meióticas são os complexos sinaptonêmicos um proteínas SCP1 e Sycp2 16. Marcadores usuais de condensação espermatídeos são proteínas de transição (por exemplo TP1) ou protaminas 17.
Embora cada corrida STA-PUT pode ser diferente, as células geralmente meiose, espermatogônias e células somáticas diplóides serão encontrados em frações ca. 25-40, espermátides arredondadas em frações ca. 55-65, e condensação / alongando espermátides em frações ca.65-75 Devido a uma menor diferença de tamanho entre as células meióticas / somáticas e espermátides arredondadas, frações ca. 45-50, muitas vezes têm um percentual ainda de células meióticas / somáticas e espermátides arredondadas. A coloração com DAPI vai ajudar a distinguir estas duas populações de células. Há menos sobreposição do spermatid rodada e condensação / alongando fracções spermatid devido à maior diferença de tamanho entre as duas populações de células. Normalmente, as frações inferiores a 15 conterá muitas grandes aglomerados de células e frações acima de 85 conterá algumas células e muitos corpos residuais, ou citoplasma ligada à membrana que é derramado por espermátides.
Geralmente, quando as células de ~ 22 testículos são fracionadas com o procedimento STA-PUT, produz ca. 10 8 células / tipo espermatogênico celular (células diploides meiose / somáticos, espermátides arredondadas, e condensação / alongando espermátides). As fracções que são combinadas para criar a população final de células deve ser, pelo menos80% de pureza para o tipo de célula em questão. Se você não vê este grau de pureza igual ou superior, pode haver um problema com a separação de células ou o gradiente de BSA. Além disso, se houver algumas células nas primeiras 20 fracções e uma abundância de células em fracções 80 +, ou se existe uma abundância de células nas primeiras 20 fracções e quase nenhum em fracções 70 +, o tempo de sedimentação precisa ser mais otimizada. Por favor, veja a discussão para sugestões sobre a forma de problemas filmagens.

Figura 1. Configurar o aparelho STA-PUT: A imagem esquemática e real do aparelho STA-PUT são mostrados. Todos os artigos de vidro ligada a um tubo de plástico, incluindo o tubo que liga o aparelho para o colector de fracções. As setas indicam a localização de grampos. A) câmara de carga celular, contém uma barra de agitação; B) 2 L cilindro para 2% BSA, contém uma barra de agitação; C) 2 L de cilindro para 4% BSA; D) câmara de sedimentação, e) placas Stir; F) defletor;. G) Torneira Clique aqui para ver a imagem ampliada .
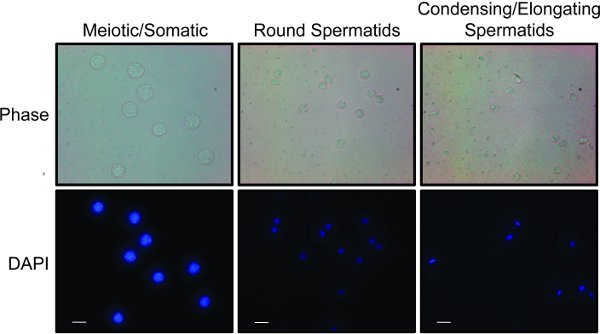
Figura 2. Populações de células obtidas a partir do STA-PUT: Frações foram combinados em três populações distintas de células: células meióticas e somáticos, espermátides redondas e condensação e alongando espermátides. Cada população é corado com DAPI para mostrar as diferenças em tamanho e morfologia nuclear. Fase de imagiologia de contraste transmite diferenças em tamanho e forma da célula. Barra branca representa 10 m. Clique aqui para ver a imagem ampliada .
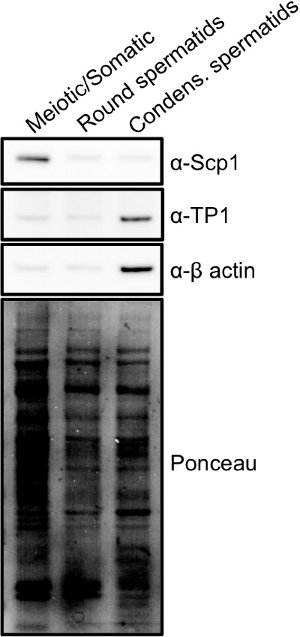
Figura 3. Os marcadores de diferentes populações de células obtidas a partir da STA-PUT: Os extractos celulares totais foram feitas a partir de cada população de células mostrado na Figura 1 e a análise Western blot foi realizada para mostrar as diferenças de expressão de proteína para cada população.. Proteína complexa Sinaptonêmico 1 (SCP1) é uma proteína expressa exclusivamente durante a meiose e é encontrado nas frações de meiose, enquanto a fração spermatid condensação é enriquecido para a proteína de transição 1 (TP1), uma proteína expressa no final de espermiogênese. Clique aqui para ampliar imagem .
Discussão
Aqueles que estudam a espermatogênese confiar em modelos animais para amostras de células de espermatogénese, como um sistema de cultura de células confiável ainda não existe para gerar todos os tipos celulares espermatogênicas 3. Embora as células espermatogênicas são facilmente coletadas de testículos inteiros, apenas uma população mista resulta. Isto coloca um problema para aqueles que desejam estudar subtipos específicos dessas células, como as células meióticas, espermátides redondas e espermátides condensação. Três métodos diferentes são usados atualmente para separar esses subtipos de células espermatogênicas: STA-PUT, FACS, e elutriação 6-13. Os dois últimos métodos requerem o acesso a peças caras de equipamentos: um classificador de celular e um elutriator, respectivamente. Embora o método de FACS gera populações altamente puras dos diferentes tipos de células espermatogénicas, o processo leva seis horas e produz apenas 0,5-2,0 x 10 6 culas por tipo de célula por 2-3 testículos 11. Elutriação, como a metanfetamina STA-PUTod, separa as células com base no tamanho e densidade, mas requer o acesso a uma elutriator, que é mais caro do que o aparelho de STA-PUT.
O procedimento STA-PUT usa um gradiente BSA simples para separar células espermatogênicas de diferentes tamanhos, com uma elevada produtividade (~ 10 8 células / população por ~ 22 testes). Em relação a métodos de FACS, o procedimento STA-PUT produz mais células / testículos e leva muito menos tempo para separar os tipos de células. Comparado com FACS e decantação, o procedimento STA-PUT é relativamente simples e de baixo custo. O STA-PUT requer apenas uma sala fria ou geladeira grande e um conjunto de objectos de vidro especializada, tornando-se um método ideal para laboratórios sem acesso a um classificador de células ou elutriator. Quando realizada corretamente, o STA-PUT pode proporcionar um puro população de aproximadamente 90% de espermátides redondas ou espermátides condensação.
O método STA-PUT é muito útil, mas exige otimização em várias etapas diferentes, especialmente sedimentation. Separação sub-óptima de tipos de células pode ser causada por vários problemas diferentes, mais relacionados com o gradiente de BSA. Para fazer um gradiente adequado, acender as barras de agitação na câmara de carga da célula e o cilindro 2 L segurando a BSA 2%, enquanto você está criando o gradiente. Também limpar toda a tubulação de bolhas e colocar o defletor no lugar na câmara de sedimentação antes de carregar as células. Reduzir a taxa de fluxo da BSA para dentro ou para fora da câmara de sedimentação pode ajudar. Mais importante ainda, o aparelho de STA-PUT não deve ser perturbado durante a criação do gradiente, sedimentação, ou a recolha de fracções.
Sub-óptima rendimentos celulares podem ser o resultado de número insuficiente / tamanho de testículos, separação celular inadequada durante o tratamento com colagenase / tripsina, e a aglutinação de células. Se alguém não é capaz de obter o número adequado de células para este protocolo STA-PUT, devido à utilização de camundongos recém-nascidos ou genótipos que produzem um pequeno número de cel espermatogênicols, pode ser necessário usar mais animais por STA-PUT ou para solicitar um kit de STA-COLOCAR vidro otimizado para pequenos volumes e números de celulares (disponível a partir de ProScience) 18. Para obter um número ideal de células (700-800000000), use pelo menos 11 camundongos machos em idade reprodutiva, o ideal é pelo menos 8-9 semanas de idade. No entanto, há mais de 800 milhões de células deve ser carregado em um STA-PUT. Se as células não foram dissociados numa única suspensão de células após tratamento com tripsina, a concentração de ADNase pode ser aumentada até 1 mg / 5 ml de solução. DNAse é sensível para repetir ciclos de congelamento / descongelamento, e utilizando ADNase fresco cada vez vai resultar em uma dispersão mais eficaz de túbulos numa suspensão de células individuais. Pode-se utilizar uma pipeta de orifício largo para ajudar a quebrar aglomerados de células antes de se filtrar através de uma malha.
Um aspecto do método STA-PUT, que irá requerer optimização é a quantidade de tempo que as células são deixadas a sedimentar por meio do gradiente de BSA. Uma horae 45 min geralmente funciona bem, mas esse tempo pode variar de laboratório para laboratório. Normalmente, as diferentes camadas de células pode ser visto visualmente ao longo do gradiente de BSA. Se existem poucas células nas primeiras 20 fracções recolhidas e uma abundância de células em fracções 80 +, o tempo de sedimentação pode ter que ser aumentado. Se existirem demasiadas células nas primeiras 20 fracções recolhidas e não há separação insuficiente de tipos de células, o tempo de sedimentação pode necessitar de ser reduzido.
As células obtidas com o processo de STA-PUT pode ser usada para muitos tipos diferentes de experiências. O STA-PUT oferece amplo material para análise western blot, imunofluorescência e análise de RNA, embora experimentos de bioquímica em larga escala pode exigir a combinação de material de várias corridas diferentes STA-PUT. Quando separado de outros tipos de células, espermatídeos haplóides podem ser cultivadas e submetidas a manipulação in vitro molecular por até três dias, o que pode ser mais fácil do que in vivo ou a criação de um animal knockout 19. As células obtidos com o protocolo de STA-PUT descrito foram cultivadas durante um dia sem sinais óbvios de contaminação, mas se as células são para ser usado por longos experiências de cultura celular, o equipamento deve ser esterilizado com etanol, todas as soluções deverá ser esterilizada por filtração, e todos passos, antes do carregamento da célula e após a recolha de fracções devem ser realizadas numa chaminé de cultura de tecidos. Além disso, os meios de cultura que contêm os antibióticos devem ser usados. O facto de que o método de STA-PUT não requer a fixação das células torna-se um processo ideal para experiências que requerem células viáveis.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes. Este protocolo está sendo demonstrada envolve o uso de ratos de laboratório e foi executado em conformidade com todas as diretrizes, regulamentos e agências reguladoras. Animais utilizados neste protocolo são mantidos sob a orientação e aprovação da Universidade do Comitê Animal Care e Use Institucional Pensilvânia (IACUC o protocolo n º 804284).
Agradecimentos
Esta pesquisa foi apoiada pelo NIH concede GM055360 para SLB e U54HD068157 a RGM. JMB foi apoiado pelo Training Grant T32 Genética da Universidade da Pensilvânia (GM008216).
Materiais
| Name | Company | Catalog Number | Comments |
| BSA | Affymetrix/USB | 10857 100MG | Alternate can be used. |
| 0.5%, 2%, and 4% BSA solutions | Dissolve 0.25 g, 11 g, and 22 g (respectively) in total volumes of 50 ml, 550 ml, and 550 ml of 1x KREBS (respectively). | To be made day of the STA-PUT procedure. Filter sterilize. | |
| KREBS (10x) | 3.26 g KH2PO4 + 139.5 g NaCl +5.89 g MgSO4/7H20 + 40 g Dextrose + 3.78 g CaCl2/2H20 + 7.12 g KCl, bring to 2 L with ddH20 | Autoclave/filter and store at 4 °C for several months. | |
| KREBS (1x) | Dissolve 4.24 g NaHCO3 in 100 ml ddH20. Add 200 ml 10x KREBS. Bring to 2 L with ddH20. | To be made day of the STA-PUT procedure. Filter sterilize. | |
| Collagenase | Sigma | C9891-1G | |
| DNAse | Sigma | DNEP-5MG | |
| Trypsin | Sigma | T9201-1G | |
| DAPI | Preference of researcher | ||
| Triton-X100 | Preference of researcher | ||
| Formaldehyde (~37%) | Preference of researcher | ||
| TABLE 2: EQUIPMENT | |||
| Equipment | Company | Catalog # | Comments |
| Complete STA-PUT apparatus | ProScience Glass Shop | STA-PUT (this procedure uses the standard sedimentation chamber: Cat. No. 56700-500) | Includes all glassware and equipment for the apparatus. Alternate glassware is available for performing STA-PUT with smaller cell numbers. |
| 10 μm mesh filter | Fisherbrand | 22363549 | |
| Mouse dissection tools | Preference of researcher | ||
| 14 ml round bottom fraction collection tubes with caps | Preference of researcher | ||
| Need approximately 100 tubes | |||
| Fraction collector | GE Healthcare Life Sciences | Model: Frac-920, Product code: 18-1177-40 | Alternate can be used. |
| Microscope slides, cover glass | Preference of researcher | ||
| Light/Fluorescent Microscope | Preference of researcher |
Referências
- Wistuba, J., Stukenborg, J., Luetjens, C. M. Mammalian Spermatogenesis. Funct. Dev. Embryol. 1, 99-117 (2007).
- Hess, R. A., Cooke, P. S., Hofmann, M. C., Murphy, K. M. Mechanistic insights into the regulation of the spermatogonial stem cell niche. Cell Cycle. 5, 1164-1170 (2006).
- Dores, C., Alpaugh, W., Dobrinski, I. From in vitro culture to in vivo models to study testis development and spermatogenesis. Cell Tissue Res. 349, 691-702 (2012).
- Hayashi, K., Ohta, H., Kurimoto, K., Aramaki, S., Saitou, M. Reconstitution of the mouse germ cell specification pathway in culture by pluripotent stem cells. Cell. 146, 519-532 (2011).
- Easley, C. A., et al. Direct differentiation of human pluripotent stem cells into haploid spermatogenic cells. Cell Rep. 2, 440-446 (2012).
- Bellve, A. R. Purification, culture, and fractionation of spermatogenic cells. Methods Enzymol. 225, 84-113 (1993).
- Meistrich, M. L., Bruce, W. R., Clermont, Y. Cellular composition of fractions of mouse testis cells following velocity sedimentation separation. Exp. Cell Res. 79, 213-227 (1973).
- Romrell, L. J., Bellve, A. R., Fawcett, D. W. Separation of mouse spermatogenic cells by sedimentation velocity. A morphological characterization. Dev. Biol. 49, 119-131 (1976).
- Miller, R. G., Phillips, R. A. Separation of cells by velocity sedimentation. J. Cell Physiol. 73, 191-201 (1969).
- Bastos, H., et al. Flow cytometric characterization of viable meiotic and postmeiotic cells by Hoechst 33342 in mouse spermatogenesis. Cytometry A. 65, 40-49 (2005).
- Getun, I. V., Torres, B., Bois, P. R. Flow cytometry purification of mouse meiotic cells. J. Vis. Exp. (50), e2602 (2011).
- Grabske, R. J., Lake, S., Gledhill, B. L., Meistrich, M. L. Centrifugal elutriation: separation of spermatogenic cells on the basis of sedimentation velocity. J. Cell Physiol. 86, 177-189 (1975).
- Meistrich, M. L., Trostle, P. K. Separation of mouse testis cells by equilibrium density centrifugation in renografin gradients. Exp. Cell Res. 92, 231-244 (1975).
- Gassei, K., Ehmcke, J., Schlatt, S. Efficient enrichment of undifferentiated GFR alpha 1+ spermatogonia from immature rat testis by magnetic activated cell sorting. Cell Tissue Res. 337, 177-183 (2009).
- Bellve, A. R., et al. Spermatogenic cells of the prepuberal mouse. Isolation and morphological characterization. J. Cell Biol. 74, 68-85 (1977).
- Handel, M. A., Schimenti, J. C. Genetics of mammalian meiosis: regulation, dynamics and impact on fertility. Nat. Rev. Genet. 11, 124-136 (2010).
- Zhao, M., Shirley, C. R., Mounsey, S., Meistrich, M. L. Nucleoprotein transitions during spermiogenesis in mice with transition nuclear protein Tnp1 and Tnp2 mutations. Biol. Reprod. 71, 1016-1025 (2004).
- Manku, G., Mazer, M., Culty, M. Neonatal testicular gonocytes isolation and processing for immunocytochemical analysis. Methods Mol. Biol. 825, 17-29 (2012).
- Dehnugara, T., Dhar, S., Rao, M. R. An in vitro, short-term culture method for mammalian haploid round spermatids amenable for molecular manipulation. Mol. Reprod. Dev. 79, 19-30 (1002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados