Method Article
Substantia nigra ve ventral Tegmental Bölgesi Dopamin Yönetmelik Kapsamlı Profilleme
Bu Makalede
Özet
Dopamin belirgin hücre gövdeleri ve dopamin nöron dendritler içeren Ortabeyin çekirdekler, düzenlenmiştir. Burada substantia nigra (SN) ve kemirgenlerde ventral tegmental alan (VTA) ve orta beyin çekirdeklerinde dopamin regülasyonu üzerine, böylece bir diseksiyon ve örnek işleme sonuçları maksimize etmek için yaklaşım, sonuç ve görüşlerini açıklar.
Özet
Dopamin MSS bir gayretle çalıştı nörotransmitterdir. Nitekim, lokomotor aktivite ve ödül ile ilgili davranışı kendi katılımı dopamin regülasyonu ile ilişkili moleküler eksikliklerin bir soruşturma beş yıl teşvik etti. Nigrostriatal ve mesoaccumbens yolların terminal alanında bölgelerde düzenlenmesi için moleküler temeli üzerine beyin odak dopamin yönetmeliğin bu soruşturmaların çoğunluğu, striatum ve nukleus akumbens. Ayrıca, bu tür çalışmaların sadece ıslak doku ağırlığı normale dopamin doku içeriğinin analizi üzerinde yoğunlaşmıştır. Böyle tirozin hidroksilaz (TH) protein, TH fosforilasyon, dopamin taşıyıcısı (DAT) ve veziküler monoamin transporter 2 (VMAT2) protein olarak, dopamin düzenleyen proteinlerin incelenmesi genellikle aynı örnek dopamin doku içeriğinin analizini içermez. Dopamin doku içeriği ve düzenleyen proteinleri (post-tra dahil olmak üzere her iki analiz yeteneğinslational değişiklikler) protein düzeyi ve TH, DAT, ya VMAT2 fonksiyonu ile dopamin arasındaki ilişkiyi yorumlama doğasında güç verir, aynı zamanda örnek ekonomisi uzatır sadece. Henüz daha az maliyet ve çevirmenize araştırmacılar 'seçim hemen her paradigma dopamin moleküler düzenlenmesi irdeliyoruz üretir.
Biz orta beyindeki analizleri odaklanır. SN ve VTA genellikle dopamin regülasyonu en çalışmalarda ihmal rağmen, bu çekirdekler kolayca uygulama ile disseke edilir. Kapsamlı bir dopamin doku içeriği ve TH okuma, DAT, ya VMAT2 yapılabilir. Orada davranışı SN ve VTA dopamin fonksiyonunun etkisi literatürde filizlenen ve orada 1-5 eksojen maddeler veya hastalık süreçleri sıkışmaları edilir. Ayrıca, bu tür büyüme faktörleri gibi bileşikler SN veya VTA içinde nispeten büyük ölçüde, dopamin ve dopamin düzenleyen proteinler üzerinde derin bir etkiye sahiptir Biz bu iki çekirdeğin ve her çekirdek (Şekil 1) için spesifik in vivo dopamin regülasyonu moleküler mekanizmaları, ortaya bir profil üreten disseke doku örnek işleme ayırmak diseksiyon tekniği örneklerle gösterecek.
Protokol
1. Diseksiyon
- Islak-buz bir yatak, bir kemirgen beyin matris (koronal kesitler dışında 1 mm ayrılmalıdır), 5 jilet içeren Petri ve # 11 bistüri soğutun. Ayrı bir kapta, kuru buz içine yerine 2 ml boyutu mikrofüj tüpler etiketlenmiştir.
- Araştırmacı ötenazi yöntemi seçecektir. Biz izofluran, İdeal olarak, bir buharlaştırıcı kullanılması gerektiği konusunda çok kısa bir anestezi yapılması tekrarlanabilir sonuçlar var. Ancak, eğer mevcut değilse, biz bir platform içeren büyük bir pil kavanoz kullanın. Onaylanmış bir havalandırma kapağı bulunan pil kavanoz ile, platformun altında bir izofloran doymuş gazlı bez yerleştirin ve izofluran pil kavanoza bombalamak için izin vermek için 3-5 dakika bekleyin. Içindeki sıçan yerleştirin ve en kısa sürede sıçan Şuurunu kaybetti gibi dekapitasyon için kaldırın. Hızla beyin (ideal iki dakika altında), soğuk suyun altında durulayın kaldırmak ve soğutulmuş kemirgen beyin matris hemen yerleştirin.
- Pozisyonundan sonra bir dakikamatris içine beyin ing, striatum ve nukleus akumbens Ortabeyin çekirdeklerin yanı sıra analiz için istendiğinde kiazmada için rostral 2 mm civarında başlayan, soğutulan beynin içine soğuk tıraş bıçakları yerleştirin. , Pons üzerinden yarıda görünceye kadar her 1 mm bölümü soğuk tıraş bıçakları yerleştirirken her bıçak daha kolay çıkarılması kolaylaştıracak şekilde her bir sonraki jilet yerleştirme sendeleyerek devam edin.
- Jilet dışarı çekerken, hipokampus başlaması için bekliyoruz. Şekil 2'de gösterildiği gibi tamamen Ortabeyin sarılı erdiğinde, # 11 neşter bıçak kullanarak bölümleri geçmeye başlar.
- Hemen kuru buz önceden soğutulmuş mikrofuge'de tüp içine disseke doku yerleştirin. Sıçan, iki koronal dilimleri ve üç, maksimum, minimum SN ve VTA incelemek edebilmek için bekliyoruz. Mağaza dokular -80 ° C'de işleme için hazır olana kadar.
2. Doku Analizi: HPLC fveya Dopamin ve metabolitleri
HPLC cihazı ve bakım hakkında ayrıntılı bilgi için, yazının sonunda HPLC analizi için bkz.
- Yavaşça hemen olarak hizmet 20 ng / mL 'lik bir konsantrasyonda N-metil dopamin içeren kuru buz ile buz 0,1 M HClO 4-EDTA solüsyonu (0.1 M HClO 4 ve 0.1 mM EDTA) içinde 9, çıkarıldıktan sonra dokusu homojenize HPLC analizi boyunca numunenin geri kazanımı için bir iç standart. Kullandığımız Homojenizatör tüm gücün% 10 ayar ile Branson Sonifier 150, (10 1). Aşağıdaki sonikasyon hacimleri tavsiye edilir:
Sıçan, SN ul = 250 (tek taraflı diseksiyon), ul 400 (iki taraflı diseksiyon), VTA = 200 ul (tek taraflı diseksiyon), 400 ul (iki taraflı diseksiyon).
Fare, (sadece ikili diseksiyonu), SN = 200 ul, VTA = 200 ul. - Homojenizasyon sonra, kuru buz örnekleri tutun. Örnekler daha sonra centrif vardır12.000 RPM hızda uged (DuPont Sorvall Microspin 24S) tortuları proteini pelet Western blot tayini için kullanılır. Süpernatanlar HPLC içine doğrudan enjekte edilir. Aşağıdaki enjeksiyon hacimleri sıçan veya fare ile hassas analizler için tavsiye edilir: (. Ya hazırlık itibaren) SN = 150 (. Ya hazırlık itibaren), VTA = 160 ul
- Stok standart dopamin bileşeninin monoaminler ve metabolitlerinin uygun miktarda * 0.1 M perklorik asit ile 0.1 mM EDTA ilave edilerek 1 mg / ml 'de hazırlanmıştır. Her bir bileşiğin konsantrasyonu 5 mg / ml 'dir triptofan hariç 1 mg / ml' dir. Gerekene kadar stok standart 10 ul hacimde ayrılmıştır ve, ultra saklanır.
* Tüm ağırlıklar uygunsa bileşiğin tuz formu için düzeltilmiştir.
Perklorik asit çözeltisi 100 ml stok standart bir 10 ul tablet seyreltilmesi ile çalışan standart hazırlayın. Çalışma standart konsantrasyonu 0.5 ug / ml 'dir triptofan hariç 0.1 ug / ml' dir. 50 ulBu çalışma, standart 25 ng triptofan hariç her bir bileşenin 5 ng bir on-sütun miktarı HPLC enjekte edilir. - Örnek tablet içinde dopamin kurtarma Belirlenmesi:
Örnek bir kısım gelen dopamin kurtarma belirlemek için çeşitli adımlar vardır. - İlk olarak, standart dopamin pik yüksekliği tarafından numunenin dopamin pik yüksekliği bölmek ve standart dopamin toplam miktarı (ng) tarafından bu oran çarpılır. Standart dopamin konsantrasyonunu standart 0.1 ng / uL ve 50 uL test olmasıdır. Böylece, standart dopamin miktarı 5 ng. Bu nedenle, aşağıda verilen bir denklemi Örnek tespit dopamin geri kazanımı için de kullanılabilir:
(Standart örnek / dopamin pik yüksekliği Dopamin pik yüksekliği) * 5 ng - İç standart N-metil dopamin kullanan örnek kaybı için düzeltme:
N-metil dopamin gerçek kurtarma N-metil dop bölerek dopamin ile aynı şekilde hesaplanırStandart bir N-metil dopamin pik yüksekliği tarafından ve standart N-metil dopamin toplam miktarı (ng) tarafından bu oran çarparak örnek amin pik yüksekliği. Dopamin gibi, standart N-metil dopamin konsantrasyonu 0.1 ng / uL olduğunu. Standart 50 uL tahlil edilmiştir. Böylece, standart bir N-metil dopamin miktarı 5 ng. Bu nedenle, aşağıda verilen bir denklemi Örnek N-metil dopamin geri kazanım belirlenmesi için de kullanılabilir:
(Standart örnek olarak N-metil dopamin pik yüksekliği / N-metil dopamin pik yüksekliği) * 5NG
Bununla birlikte, çünkü her bir örnek olarak N-metil dopamin olmayan örnek kendisinden fakat HPLC tampon gelmektedir, her bir örnek beklenen N-metil dopamin miktarda elde edilir. HPLC tampon içinde N-metil depamin konsantrasyonu 20 ng / ml veya 0,02 uL / ng, böylece her bir örnek olarak N-metil dopamin beklenen miktarı alikotu hacimce HPLC tampon N-metil depamin konsantrasyonu çarpılması suretiyle elde edilir olduğu H için kullanılan her numuneninPLC analizi. Bu aşağıdaki denklemde gösterilmiştir:
(UL / 0.02 ng) * (örneğin tablet hacmi HPLC analizi için kullanıldı) - Beklenen ve geri N-metil dopamin arasındaki fark daha sonra herhangi bir örnek dökülmesi için ayarlayarak elde dopamin miktarı için düzeltmek için kullanılır. Basitçe beklenen N-metil dopamin oranı alabilir / N-metil dopamin kurtarılmış ve geri kazanılan dopamin miktarına göre, bu çarpma. Böylece, Örnek alikotu dopamin miktarı genel denklemi aşağıda verilmiştir:
(Standart örnek / dopamin pik yüksekliği Dopamin pik yüksekliği) * (örnek olarak, standart / N-metil dopamin pik yüksekliği N-metil dopamin pik yüksekliği) * (uL / 0.02 ng) * (HPLC analizi için kullanılan örnek alikotu hacmi ) - Toplam dopamin örnek kurtarıldı:
Örnek bir alikotu kurtarıldı dopamin değeri daha sonra bir numunedeki dopamin toplam miktarı tahmin etmek için kullanılır. Bu duruma miktarı (ng) o bölünmesi ile yapılırf DA kısım hacim ve numune içeri sonicated olduğunu HPLC tampon toplam hacmi bu değer Bu aşağıdaki denklem ile verilir:
(Örnek dopamin miktarı (ng) tablet / örnek tablet hacmi) * (örnek sonike edildi içine HPLC tampon toplam hacmi).
Okuyucunun dopamin-regüle SN ve VTA sadece proteinin, fakat striatum ve çekirdek accumbens yanı gelen readouts ile birlikte dopamin ve metabolitlerinin değerlendirmesinin kapsamlı bir sunum için aşağıdaki çalışmalar 2,4,10 anılır.
3. Doku Analizi: TH ve DAT Sonuçları Toplam Protein ve Final Normalizasyon
- 4 ° C'de tutmak için ıslak buz içine çöktürülmüş proteini peletleri (HPLC tampon tedavisi türetilmiştir) yerleştirin Tüm tampon kaldırıldı ve (doğrulayıcı analizi gerekli ise) arşivlendi emin olun. SN ya VTA (sadece sıçan) iki taraflı olarak işlenecek ise, 300 uL (SN) ya da 2 ekleme% 1 SDS 5 mM Tris (pH 8.3) ile pelet ve sonikasyon ile 1 mM EDTA ihtiva eden bir 00 uL (VTA). Tek taraflı diseksiyonlar doku işlenmesi halinde VTA peletlerine SN pelet veya 100 ul için SDS çözüm 150 uL ekleyin.
- Protein denatürasyon tamamlamak ve oda sıcaklığına kadar soğuması için ~ 5 dakika boyunca yakınında kaynar su içinde örnekleri yerleştirin. Emin olun kapakları sıkıca bu aşamada yapılır.
- 40 ug protein - bir protein, standart eğri (albümini standart) 2 aralığında dahil olmak üzere, BCA deneyi kullanılarak örnek protein konsantrasyonunu belirlemek. Test 5 ul üç nüsha olarak örnek hacmi ve standart eğri karşı protein miktarı belirlemek için medyan değeri kullanın. Protein konsantrasyonu için çalışma hacmi bölün. Bu toplam protein kurtarma toplam TH, DAT ve VMAT2 sonuçları normalleştirilmesi için alınan iki adım ilk Not.
- % 10'luk akrilamid g SDS-elektroforez azaltmak için numune tamponu ile örnekler (ditiyotretol içeren) hazırlayınels. İdeal olarak, nihai toplam protein konsantrasyonu ~ 2 ug / ml olması gerekir. Bu konsantrasyon seçimi nedeni total protein ~ 100 mikrogram tam ser31 ve ser40 TH fosforilasyon ölçmek için yükleme için gerekli olacak gibi, TH fosforilasyon nihai belirlenmesi için gerekli olan örnek hacmi azaltmaktır. Sarı renkli numune tamponu eklendikten sonra örnek görülür ise, örnek çok asittir. Mavi renk geri gelene kadar 10 ul artışlarla 1 M Tris (pH 8.2) ekleyin.
- Dopamin-düzenleyen proteinlerin aşağıdaki tespitler için aşağıdaki gibi numunesinin:
- TH: TH protein için kalibre edilmiş standart (ng), SN olarak TH konsantrasyonu (toplam mikrogram protein başı ng TH gibi) karşı, ~ dan mikrogram total protein 2,4 başına 0,05-0,27 ng TH değişebilir bekleniyor 7,10,11. 5.0 ng TH ve TH primer antikor kullanarak (Millipore cat # AB152, PVP T 1:1000 dilüsyon - 0.5 arasında değişen doğrusal bir TH standart eğri, KarşıDoğrusal bir standart eğri üretir -20 engelleme çözeltisi), SN toplam proteinin optimum yük ~ 10 ug olmalıdır. VTA olarak TH konsantrasyonu ~ 0.4 g protein 4,11 ortalama 1.0 ng TH arasında değişmektedir. Böylece, VTA için toplam protein yük ~ 5 ug olmalıdır.
- DAT: SN veya VTA yılında DAT göreceli miktarları striatum ve nukleus akumbens 4 soydaş terminali alanında bölgelerde daha az anlamlı olarak vardır. Kurtarılan TH protein normalize olarak DAT bağıl ifade de SN ve VTA anlamlı olarak daha düşüktür. Buna göre, SN veya VTA DAT protein miktarının belirlenmesi için protein yükleri terminal alanında bölgelerin örnek yüklere göre çok büyük olması gerekir. Toplam proteinin 30 mg en az VTA in DAT değerlendirmede hassasiyet için gerekli ve 50 ug toplam proteinin nominal bir yük SN in değerlendirilmesi için ihtiyacı olan edilir. Kullanılan primer antikor Santa Cruz, kedi # sc-1433.
- VMAT2: VMAT2 ifadesi, Total protein olarak normalize, nigrostriatal bölgelerde daha mesoaccumbens daha fazladır. Ancak, TH ifadeye göre, VMAT2 ifade striatum 4 SN ve az daha yüksektir. Santa Cruz cat # sc-15.314, ~ nominal toplam protein yükü 40 mikrogram VMAT2 miktarının tayini için en iyi olmak için kullanma.
- 10% akrilamid jel üzerinde SDS-PAGE kullanılarak toplam protein miktarı uygun çalıştırın. Bio-Rad Protean II elektroforez birimi büyük bir jel biçimidir tespitler için kullanılır. 0.45 mikron gözenek büyüklüğüne nitroselüloz üzerine proteinler aktarın. Transferi için, bir Hoeffer tankı en az 27 Volt ayarlı transferi gece boyunca yer almasına izin veriyor.
- Lekeler ~ 5 dakika boyunca Ponceau S çözeltisi (% 5 asetik asit içinde% 1 Ponceau S) ile leke sonra, en azından 30 dakika boyunca kurumaya ve izin verir. Bireysel protein bantları açıkça çözmek ve arka plan boyama kaldırılıncaya kadar% 0.2 HCI solüsyonu ile iyice De-leke. Ponceau S lekenin bir görüntü eldeing başka her kulvardaki göreceli protein yükleri ölçmek ve TH, DAT, ya VMAT2 sonuçları (Şekil 3) normalleştirmek için Image J kullanarak.
4. Doku Analizi: Siteye özgü TH Fosforilasyon
Ser31 ya ser40 azından TH fosforilasyon 12 katekolaminerjik hücrelerinde L-DOPA biyosentez artırabilir. SN ve VTA tesis edilmediği gibi dopaminerjik beyin bölgelerinde L-DOPA biyosentezi artırmak için gerekli her yerinde fosforilasyon miktarı, ser31 fosforilasyon L-DOPA biyosentezi 10 düzenleyen ve DA ile birlikte değişir önemli bir rol oynadığını kanıt olmamakla birlikte striatum arasında doku içeriği, nükleus akumbens, SN, ve VTA 2, 10. Çok sayıda çalışma fosforilasyon bir eşik 12 ulaşıldığında, özellikle eğer, TH aktivite etkiler gösterir gibi Bununla birlikte, ser40 tespitler dahil edilmesi gereklidir.
Iken ser19 phosphorylatiTek başına 13,14 TH aktivitesi etkilemez üzerine, bunun göz önüne alındığında, DA nöron içinde bulunan +-bağımlı sinyalleşme Ca 2 için bir koruyucu olarak kabul edilebilir bir hücre dışı Ca2 + koşulları altında 12 depolarizan ser19 fosforilasyon arttırmak için gereklidir. Dahası, sadece SN ve VTA 10 ser31 fosforilasyon ile ser19 fosforilasyon anlamlı bir pozitif korelasyon ser19 fosforilasyon durumunu ser31 fosforilasyon etkileyebilecek gösteren, var, ve böylece dolaylı olarak L-DOPA biyosentezi.
Siteye özgü TH fosforilasyon stokiyometri optimal ölçümü için örnek yük hususlar: Aşağıda, disseke dokularda siteye özgü TH fosforilasyon doğru ve kesin tespitler için gerekli hususlar sunulmuştur. Mümkün olduğunda, bir kalibre TH fosforilasyon standart örneği TH fosforilasyon değerlendirmeye dahil edilmelidir. Örnek yük acc dikkate almak zorundadırHer fosforilasyon yerinde ount doğasında stokiyometri böylece assay kullanılan antikorun dinamik bir çalışma aralığında fosforilasyon rakamlarla olduğu. Son bir not olarak, her bir örnek için tahlil gelen doğasında toplam protein, aynı zamanda standart eğri şeritlerde yüklenmelidir. Bu kolayca TH ifade etmez bir taşıyıcı proteine (örneğin sıçan karaciğer gibi) ile sağlanır.
- . 0.25 2,10,11 - ser19 üç fosforilasyon siteler ki, ser19 fosforilasyon stokiyometri seviyeleri 0.15 arasında değişen, SN ve VTA en büyük vardır. Diğer dikkate saptama yöntemi ile, ser19 PS 0.5 ve 5.0 ng fosfo-ser19 10 arasında doğrusal aralığında sayısal olmasıdır. Ser19 TH fosforilasyon güvenilir bir ölçü sağlayacak - bu hususlar, 5 ve 10 ng (2.5 ng fosfo-ser19 örnekten böylece tahmini 0,75 veren) arasında toplam TH protein yükü göz önüne alındığında. Biz 1:1000 dilüsyon (Kat. # p1580-19) Phosphosolutions birincil kullanın.
- . 0.10 2,4,10,11 - ser31 ser31 fosforilasyon stokiyometri seviyeleri ~ 0.04 arasında değişen kendi soydaş terminali alanına bölgeleri ile karşılaştırıldığında, SN ve VTA nispeten daha azdır. Bizim tespit yöntemi olarak, ser31 ps 0.5 ve 7.0 ng fosfo-ser31 10 arasında doğrusal aralığı tespit edilir. Bu düşünceler, (böylece tahmini 0.50 vererek - numuneden 3.0 ng fosfo-ser31) 10 ve 30 ng arasında toplam TH protein yükü göz önüne alındığında ser31TH fosforilasyon güvenilir bir ölçüsü olacaktır. Ser31 miktarının bir örnek için Şekil 4A bakınız. Bizim primer antikor bizim in-house standartlar 2 kullanılarak fosfor-epitop 21. Yüzyılda Biyokimyasallar, (Boston, MA) tarafından üretilen ve özgüllük için doğrulandı bir in-house afiniteyle saflaştırılmış antikordur.
- ser40 SN ve ~ 0.02 VTA aralığında ser40 fosforilasyon stokiyometri seviyeleri -. 0.06 2,4,10,11. Bizim tespit yöntemi, s tarafındaner40 ps 0.2 ve 2.0 ng fosfo-ser40 10 arasında doğrusal aralığı tespit edilir. Bu düşünceler, (böylece tahmini 0.20 vererek - numuneden 1.8 ng fosfo-ser40) 10 ve 30 ng arasında toplam TH protein yükü göz önüne alındığında ser40TH fosforilasyon güvenilir bir ölçüsü olacaktır. Ser40 miktarının bir örnek için Şekil 4B bakınız. Biz 1:1000 dilüsyon (Kat. # p1580-40) Phosphosolutions birincil kullanın.
5.. Temsilcisi Sonuçlar
- SN vs VTA dopamin kantitatif analizinde alınabilir dopamin üç okuma (veya metabolitleri) vardır;. Diseksiyonu kurtarıldı toplam başına, başına protein, ve TH protein (striatum, SN, nükleus akumbens kanıtlandı başına ve Aşağıdaki Tablo 1 'de VTA). SN ve VTA'da arasındaki toplam dopamin kurtarma 2-3 koronal dilim diseksiyonlar 2 için 6-9 ng arasında değişen oldukça karşılaştırılabilir. Toplam proteine dopamin kurtarma Normalleştirici tha gösterecektirDiseksiyon yöntemi dayanan t, VTA SN in 6-8 ng / mg protein ve VTA 2, 4 in 9-10 ng / mg protein ortalama, toplam protein başına daha dopamin sahip olacağı, kullanılan. Son olarak, kurtarılan toplam TH dopamin normalleşme de, SN ve VTA'da arasında bir fark ortaya VTA 10 daha fazla olması, ve 0.2 ve 0.8 arasında değişen gerektiğini ng iki bölge 2,10 arasında dopamin başına ng TH protein.
DA bölge Toplam DA kurtarıldı Mg protein başına DA DA başına ng TH striatum 214 ± 16 165 ± 13 0.56 ± 0.11 SN 8.4 ± 0.8 6.1 ± 0.5 0.18 ± 0.03 Nucleus accumbens 60 ± 6 75 ± 4 0.77 ± 0.03 VTA 6.0 ± 1.0 9.2 ± 1.4 0.22 ± 0.03 - Toplam proteinlerin: nicelendirilmek üzere kalibreli TH proteini standardı kullanılarak TH, DAT, VMAT2, daha TH Diseksiyon (SN 60 ng ve VTA 2 içinde 26 ng) den daha VTA SN geri kazanılır. Ancak, protein normalize zaman, bu ilişki VTA ~ 3 olmak total protein başına TH ile ters - SN göre 5 kat daha fazla için, (SN VTA ve ~ 0.09 ~ 0.32 ng / mg protein) 4, 10.
SN ve VTA yılında DAT beklenen canlanmanın 4 kurtarıldı toplam protein başına veya total TH başına kadar VTA de biraz daha iyileşme ile, benzer. Özellikle, DAT proteinin soydaş terminali alan bölgelerde 4 ile karşılaştırıldığında daha az bol bu bölgelerde olduğunu sup.
Toplam protein başına VMAT2 kurtarma VTA karşı SN 4 daha fazladır. Bununla birlikte, TH proteini normalize olduğunda, SN 4 biraz daha büyük geri kazanım vardır. - Bir dizi çalışma Şantiye özgü TH fosforilasyon, ser19, ser31 tutarlı sonuçlar olmuştur, hem de ser40 fosforilasyon SN ve VTA miktar ve soydaş terminali alanına bölgelere göre. Ser19 fosforilasyon striatum ve nukleus akumbens (~ 0.05-0.15) 2,4,7,10,11 göre SN ve VTA (~ 0.2-0.3) içinde özellikle fazladır. Bu somatodendritik bölgeler 2,4,7,10,11 arasında 0.10 - Ser31 fosforilasyon ~ 0.06 olmak, kendi soydaş terminali alanına bölgelere nazaran SN ve VTA anlamlı olarak daha azdır. NSDAP-1015 ile aromatik asit dekarboksilaz inhibisyonu sırasında, sadece 10 VTA içinde ser31 fosforilasyon bir 2 kat artış var. 0.02 ve 0.05 SN arasında Ser40 fosforilasyon aralıklarıVTA ve genelde bu stokiyometri önemli soydaş terminali alanına bölgelerde 2,4,7,10,11 farklı değildir.

Şekil 1. Bir doku diseksiyonu Dopaminerjik readouts.
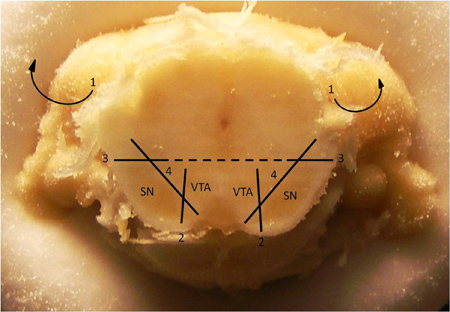
Orta beyin dopaminerjik neuropil izole edilmesi için Şekil 2. Diseksiyon Tekniği. Ventral tegmental alan (VTA) den substantia nigra (SN) diseksiyon için Tekniği. 1. Örten korteks ve hipokampus (bu yapıların zaten yukarıdaki resimde kaldırılmıştır) çıkarın. 2. VTA gelen SN pigmentli alanı ayıran bir dikey kesme olun. 3. Sadece SN dorsal ve lateral büyük bir kısmı yukarıda orta hatta yakın veya yatay bir kesim olun. 4. Uzaklıkta beyin sapı geri kalanından SN Tease. Bir kez SN kaldırıldı, benzer uzaklıkta VTA didiklemekOrtabeyin geri kalanı. Not: Bu bölümde tipik AP 5.7 de bregma göreli koordinatları, gözlenmektedir.

Şekil 3. Ikinci (ve son) Görüntü J analizi için toplam protein yük-Ponceau S boyama normalleşmesi. Rat substantia nigra örneklerinde toplam TH belirlenmesi Ponceau G proteini boyama. Ilk beş şeritlerinin hangi sıçan karaciğer homojenattan 28 ug protein substantia nigra örnekleri protein yükü yansıtmak için ilave edildi için, standart eğri toplam TH bırakılır oluştururlar. Bir sonraki şeritli molekül ağırlığı (Mw) belirteç içerir. Kalan şeritleri sıçan substantia nigra örneklerinden ~ 28μg protein içerir. Protein yükleri BCA yöntemi ile belirlendiği üzere, her numunenin proteinin konsantrasyonuna bağlıdır. Ancak, eşit yükleri ne olmalıdır rağmen, hafif gösteren örnekler arasında Ponceau S boyama karanlığında farklılıklar bulunmaktadırHer numune için Ponceau S boyama miktarını analiz etmek ImageJ analizi ile normalleşme tarafından düzeltilmiş olan protein konsantrasyonları, değişkenliği.

Şekil 4. Kontrolleri ve tedavileri Temsilcisi TH fosforilasyon sonuçları. Temsilcisi ser31 fosforile tirozin hidroksilaz (PTH) ve bir önceki çalışmada 4. A. tuzlu ve metamfetamin tedavi Wistar sıçanların ser40 PTH Western blot rat substantia nigra örneklerinde ser 31 PTH. 0.3 ng 2.0 ng ve algılama lineer aralığı içinde kalibre ser 31 PTH standart eğri aralıkları. Toplam TH seviyeleri önceki Western Blot analizine dayanarak, toplam TH 6 ng her bir örnek için yüklendi. B. sıçan ventral tegmental örneklerinde ser40 PTH. kalibre ser40 PTH standart eğri aralıkları 0.2 ng 1.5 ng ve algılama lineer aralığı içinde. Toplam TH seviyeleri önceki Western Blot analizine dayanarak, toplam TH 9 ng her bir örnek için yüklendi.
Tartışmalar
Şekil 1 'de belirtildiği gibi, yukarıda detaylı yöntemler dopamin birden readouts ve sıçan veya fare ya elde SN ya VTA bir numuneden olan proteinleri düzenleyen TH, DAT ve VMAT2 vermelidir. Yine, bu Protokolün yürütülmesi yararları araştırmacı dopamin hemen her deneysel paradigma altında in vivo olarak düzenlenir ve bunu yaparken, herhangi bir gerekli hayvan sayısını azaltarak önemli deneysel kaynak tasarrufu nasıl bir operasyonel eşleştirilmiş girilmesi gerekmektedir olmalarıdır deney.
Bu araştırmacı buz HPLC tampon içinde diseksiyon (4 ° C), doku depolama (en az -70 ° C), doku sonication (depolama sıcaklığı çıkarıldıktan sonra hemen sonikasyon) sırasında uygulanan sıcaklık gereksinimleri gözlemlemek ve kesinlikle şarttır sonraki pelet oluşumu ve işleme. Pelet sonike ve SDS çözelti içinde kaynatıldı sonra, numuneler Furth olmaya devam edebilirer oda sıcaklığında işlendi. Arşivlenen HPLC Depolama numune analiz ve protein analizi için numune tampon hazırladığı numuneler -80 olmalıdır ° C
Yine, protokol büyük avantajı in vivo dopamin regülasyonu ile ilgili operasyonel-maç sonuçları doğuştan gelen bir yaklaşımdır. Ayrıca, dopaminerjik neuropil belirteçleri (TH, DAT) araştırmacı olduğunu güvencesi büyük ölçüde sağlamak için dopamin doku readouts normalize tutarlılık ve doğruluk ile SN veya VTA diseksiyon. Bağımlılığı, psikiyatrik bozukluk ve lokomotor arenalarda dopamin katılımı göz önüne alındığında, bu protokol birçok deneylerde istihdam edilebilir. Bir önemli sınırlama bu kez ser31 ser40 ya da fosforilasyon artış L-DOPA biyosentezi artırmak için in vivo olarak gerekli olduğu ölçüde de bilinmemektedir olarak TH fosforilasyon, sonuçların yorumlanması, muhafazakar olması gerektiğidir. Belirtildiği gibi, ancak, ev olduğuser31 fosforilasyon L-DOPA biyosentezi düzenleyen görünür ve idence MSS 2,10 toplam dopamin doku içeriğini düzenleyen bir rolü vardır. Bu zamanda, TH protein ve TH fosforilasyon için standart ticari olarak mevcut değildir. Ancak, bu laboratuvarda in vivo TH fosforilasyon yönetmeliğe ilk kağıt 11 yayımlanmıştır kullanılandan dayanan bu standartlara uyulması ve genişletti. Yine de, bu protokolü kullanarak bu ayrık bölgelerde iyileşti TH proteine dopamin doku içeriği normalize etmek mümkündür.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu çalışma ve 2,10 olarak anılan, finansmanı, Yaşlılık Araştırma, Edward P. Stiles Fonu ve Kuzeybatı Louisiana Biyomedikal Araştırma Vakfı Amerikan Federasyonu MF Salvatore bir araştırma hibeler ile, kısmen sağlandı ve Ike Muslow predoctoral Kardeşliği BS Pruett için, LSU Sağlık Bilimleri Merkezi-Shreveport.
Malzemeler
HPLC sisteminde:
Temel sistemimizin, bir Shimadzu LC10-ADvp HPLC pompası, bir Waters WISP 717 otomatik örnek enjektör, bir 250 mm x 4.4 5 mikron Spherosorb ODS-1 C18 ters faz kolonu (Waters), bir Bioanalytical Systems (BAS) TL12 dual camsı oluşmaktadır karbon elektrot, iki BAS LC4B elektrokimyasal dedektörler ve Waters 2 veri toplama ve entegrasyon sistemi güçlendirin.
Sütun 30-45 tutulur ° C (BAS LC22A kolon ısıtıcı). Mobil faz, 0.1 M sodyum fosfat (pH 3,0), 0.1 mM EDTA, 1-oktan sülfonik asit (Eastman Kodak) 0,2-0,4 mM, ve bir 0.45 mikron filtre ile filtrelenmiştir% 0.35 asetonitril (v / v) 'dir. Akış hızı 1.2 ml / dak taşımaktadır. Mobil faz dört litrelik gruplar pH, oktan sülfonik asit ve kolon sıcaklığı ayarlayarak ayırma için optimize edilir. Mobil faz geri kazanılır ve sürekli çözünmüş oksijen kaldırmak için helyum gazı ile temizlenir. Mobil faz, geri dönüşümümakul bir zaman süresi için iyi çözünürlük korumak için hemen hemen esastır. Mobil faz raf ömrü her dönem ilk 2-7 dakika boşa aktarmak için bir akış anahtarı (entegratör tarafından kontrol) ile korunur.
Elektrotlar bir Ag/AgC1 referans elektroduna göre yaklaşık 0,78 ve 0.95V potansiyelleri az tutulur. Yüksek potansiyel olarak elektrot triptofan (NMDA ve dahili standart) tayin edilmesi için özel olarak kullanılır. 0.78 V potansiyel triptofan dışındaki monoaminler ve bileşiklerin tespiti için gürültü oranı üstün bir sinyali sağlar. Kromatogramlar güçlendirin iş istasyonunun sabit diskinde saklanan ve daha sonra işlenmiş ve veri metabolit miktarları ve grup veri derleme hesaplanması için bir Excel doğrudan aktarılır.
Pompa: Shimadzu LC-10AD
Hücre: BAS Çapraz Akış. Camsı karbon 0.780 ile 0.9 elektrot çalışma50 V potansiyel.
Dedektör: BAS LC-4B çift kanal modunda çalıştırılır.
Veri ACQ. Sistem: Waters Pro 2 güçlendirin.
Enjektör: Waters WISP 717
Sütun: Waters Spherosorb ODS-1, 5 uM partikül, 4.4 mm X 250 mm.
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | |
| Sodyum dodesil sülfat (SDS) | - JT Baker | 4095-02 | |
| Trizma Base | Sigma | T1503-1KG | |
| Trizma HCl | Sigma | T3253-1KG | |
| Gliserin | Sigma | G8773-500 ml | |
| PVP-40 | Sigma | PVP40-1KG | |
| DPBS | Gibco | 21600-069 | |
| Tween20 | Sigma | P1379-500 ml | |
| Glisin | Sigma | G8898-1KG | |
| Ponceau S | Fluka | 81460 | |
| Bromophenol Mavi | Sigma | B8026-5G | |
| Ditiyotretol | Sigma | D-9163 | |
| Protein Standart 2 mg BSA | Sigma | P5619-25VL | |
| Pierce BCA Protein Testi Reaktif A | Thermo Fisher Scientific- | 23223 | |
| Hassas Plus, Protein Standart | Bio Rad | 161-0373 | |
| [125l]-protein A, spesifik aktivite | Perkin-Elmer |
Tablo 2. Özel reaktifler.
| Reaktifler | Formüller |
| % 10 SDS | 10 g SDS, 100 mL DI H 2 0 |
| % 1 SDS (pH 8.2) |
|
| Bakır II Sülfat Çözüm |
|
| 3X Örnek Tampon |
|
| 1X Örnek Tampon | DI H 2 0 kullanarak 1X örnek tampon 3X Örnek Tampon aşağı sulandırınız |
| 10X Tampon Koşu (4 L yapar) |
|
| 10X Transferi Tampon: (4 L yapar) |
|
| Ponceau |
|
| .2% HCl | DI H 2 0 500ml 5.2 mL HCl |
| PVP-T20 soln engelleme. (4 L yapar) |
|
| 10X Blot Tampon (4 L yapar) |
|
Tirozin hidroksilaz standartları: Bu laboratuvar tarafından kullanılan kalibre TH protein ve fosforilasyon standartları sonuçta Dr John Haycock 11 laboratuar kaynaklı önceden ayarlanmış TH standartlarına karşı TH ve protein fosforilasyon stoichiometries için analiz edildi PC12 hücre ekstreleri, türetilen .
Referanslar
- Trevitt, J. T., Carlson, B. B., Nowend, K., Salamone, J. D. Substantia nigra pars reticulate is a highly potent site of action for the behavioral effects of the D1 antagonist SCH23390 in rat. Psychopharmacology. 156, 32-41 (2001).
- Salvatore, M. F., Pruett, B. S., Spann, S. L., Dempsey, C. Aging reveals a role for nigral tyrosine hydroxylase ser31 phosphorylation in locomotor activity generation. PLoS ONE. 4, e8466 (2009).
- Rossato, J. L., Bevilaqua, L. R. M., Izquierdo, I., Medina, J. H., Cammarota, M. Dopamine controls persistence of long-term memory storage. Science. 325, 1017-1020 (2009).
- Keller, C. M., Salvatore, M. F., Pruett, B. S., Guerdin, G. F., Goeders, N. E. Biphasic dopamine regulation in mesoaccumbens pathway in response to non-contigent binge and escalating methamphetamine regimens in the Wistar rat. Psychopharmacology. 215, 513-526 (2011).
- Lu, L., Dempsey, J., Liu, S. Y., Bossert, J. M., Shaham, Y. A single infusion of brain-derived neurotrophic factor into the ventral tegmental area induces long-lasting potentiation of cocaine seeking after withdrawal. J. Neurosci. 24, 1604-1611 (2004).
- Hoffer, B. J., Hoffman, A., Bowenkamp, K., Huettl, P., Hudson, J., Martin, D., Lin, L. F., Gerhardt, G. A. Glial cell line-derived neurotrophic factor reverses toxin-induced injury to midbrain dopaminergic neurons in vivo. Neurosci. Lett. 182, 107-111 (1994).
- Salvatore, M. F., Zhang, J. L., Large, D. M., Wilson, P. E., Gash, C. R., Thomas, T. C., Haycock, J. W., Bing, G., Stanford, J. A., Gash, D. M., Gerhardt, G. A. Striatal GDNF administration increases tyrosine hydroxylase phosphorylation in the rat striatum and substantia nigra. J. Neurochem. 90, 245-254 (2004).
- Lu, L., Wang, X., Wu, P., Xu, C., Zhao, M., Morales, M., Harvey, B. K., Hoffer, B. J., Shaham, Y. Role of ventral tegmental area glial cell-line derived neurotrophic factor in incubation of cocaine craving. Biol. Psychiatry. 66, 137-145 (2009).
- Lavicky, J., Dunn, A. J. Corticotropin-releasing factor stimulates catecholamine release in hypothalamus and prefrontal cortex in freely moving rats as assessed by microdialysis. J. Neurochem. 60, 602-612 (1993).
- Salvatore, M. F., Pruett, B. S. Dichotomy of tyrosine hydroxylase and dopamine regulation between somatodendritic and terminal field areas of nigrostriatal and mesoaccumbens pathways. PLoS ONE. 7, e29867 (2012).
- Salvatore, M. F., Garcia-Espana, A., Goldstein, M., Deutch, A. Y., Haycock, J. W. Stoichiometry of tyrosine hydroxylase phosphorylation in the nigrostriatal and mesolimbic systems in vivo: Effects of acute haloperidol and related compounds. J. Neurochem. 75, 225-232 (2000).
- Salvatore, M. F., Waymire, J. C., Haycock, J. W. Depolarization-stimulated catecholamine biosynthesis: involvement of protein kinases and tyrosine hydroxylase phosphorylation sites in situ. J. Neurochem. 79, 349-360 (2001).
- Haycock, J. W., Lew, J. Y., Garcia-Espana, A., Lee, K. Y., Harada, K., Meller, E., Goldstein, M. Role of serine-19 phosphorylation in regulating tyrosine hydroxylase studied with site- and phosphospecific antibodies and site-directed mutagenesis. J. Neurochem. 71, 1670-1675 (1998).
- Lindgren, N., Xu, Z. Q., Linskog, M., Herrera-Marschitz, M., Goiny, M., Haycock, J. W., Goldstein, M., Hokfelt, T., Fisone, G. Regulation of tyrosine hydroxylase activity and phosphorylation at ser19 and ser40 via activation of glutamate NMDA receptors in rat striatum. J. Neurochem. 74, 2470-2477 (2000).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır