Method Article
黒質や腹側被蓋野のドーパミン規制の包括的なプロファイリング
要約
ドーパミンは、はっきりとドーパミンニューロンの細胞体と樹状突起を含む脳核、で規制されています。ここでは黒質(SN)とげっ歯類では腹側被蓋野(VTA)の中脳核のドーパミン調節では、結果を最大化するために解剖し、サンプル処理のアプローチを説明し、その結果、結論と洞察力。
要約
ドーパミンは中枢神経系で精力的に研究神経伝達物質である。確かに、その自発運動への関与と報酬に関連する動作は、ドーパミン調節に関連する分子の不備にお問い合わせの五十年を促進しています。線条体および側坐核、黒質線条体とmesoaccumbens経路のターミナルフィールド領域におけるその調節の分子基盤に応じて脳フォーカスのドーパミン調節のこれらの問い合わせが多数。さらに、このような研究が唯一のウェットティッシュの重量に正規化とドーパミン組織含有量の分析に集中している。そのようなチロシンヒドロキシラーゼ(TH)タンパク質、THのリン酸化、ドーパミントランスポーター(DAT)、および小胞モノアミン輸送体2(VMAT2)タンパク質として、ドーパミン調節するタンパク質の研究は、しばしば同一のサンプルにおけるドーパミン組織含有量の分析が含まれていません。ドーパミン組織のコンテンツとその調節タンパク質(ポスト-TRAを含む両方を分析する能力nslational変更)TH、DATのタンパク質レベルと機能とドーパミンの関係を解釈する固有の力を与える、またはVMAT2だけでなく、サンプルの経済を拡張するだけでなく。この低コストに変換し、さらには研究者の選択の事実上すべてのパラダイムにおけるドーパミンの分子制御への洞察を生成します。
我々は中脳での分析の焦点を合わせる。 SNとVTAは、通常、ドーパミン調節のほとんどの研究では無視されていますが、これらの核は簡単に実践して解剖されています。包括的なドーパミン組織のコンテンツとTHの読み出し、DAT、またはVMAT2を行うことができる。そこに行動上のSNとVTAのドーパミン機能の影響に関する文献を急成長し、そこに1から5外因性物質または疾患過程のimpingementsされています。さらに、成長因子などの化合物は、SNまたはVTAで比較的大きい程度に、ドーパミンやドーパミン調節蛋白質に大きな影響を持っている我々は、これらの2つの核とそれぞれの原子核(図1)の特定のin vivoでのドーパミン調節の分子機構を明らかにプロファイルを生成し、解剖組織サンプル処理を分離するために解剖の手法を説明します。
プロトコル
1。解剖
- 濡れた氷のベッドの上で、齧歯類の脳マトリックス(冠状断面が離れて1 mmの分離)、5カミソリ、及び#11メスを含むペトリ皿を冷やす。別の容器に、場所はドライアイスに2ミリリットルサイズのマイクロチューブにラベルを付けました。
- 調査官は、安楽死の方法を選択します。我々は、イソフルランでは非常に簡単な麻酔を行って再現性の高い結果を持っている、理想的には、気化器を使用する必要があります。ただし、利用できません、我々はプラットフォームを含む大規模なバッテリーのjarを使用しています。承認された換気フードに位置する電槽を使用すると、プラットフォーム下イソフルラン飽和ガーゼパッドを配置し、イソフルランは、バッテリのjarを飽和できるように3-5分待ちます。内側にラットを配置し、できるだけ早くラットが意識を失ったとして斬首のために削除します。急速に脳(理想的には2分未満)で、冷たい水ですすぎを削除し、冷やした齧歯類の脳の行列ですぐに配置します。
- 位置1分後行列に脳をING、冷却脳に冷たいカミソリの刃を挿入し、線条体および側坐核は中脳の核に加えて、分析のために望まれている場合は、視交叉の吻側2ミリメートルの周りに始まる。個々のブレードを簡単に除去を容易にするように、後続の各カミソリの刃の位置をずらすこと、橋の途中に到着するまで各1mmのセクションに冷たいカミソリの刃を挿入して続行します。
- カミソリを抜くときは、海馬の先頭を探します。それは完全に脳を包んしたとき、 図2に示すように、第11位メス刃を使用してセクションを取ることから始まります。
- 直ちにドライアイス上で事前に冷却遠心チューブに解剖し、組織を配置します。ラットでは、2つの冠状スライスと最大3つの最小値からSNとVTAを分析することができることを期待しています。店舗組織-80°Cで処理の準備ができるまで。
2。組織分析:HPLC Fまたはドーパミンおよび代謝
HPLC装置およびメンテナンスの詳細については、原稿の末尾にHPLC分析を参照してください。
- 優しくとして20 ng / mLの濃度でN-メチルドーパミンを含む氷冷0.1 M HClO 4-EDTA溶液(0.1 M HClO 4&0.1mMのEDTA)9を使用して 、ドライアイスから除去した後すぐに組織をホモジナイズHPLC分析中の試料の回収のための内部標準。我々が使用するホモジナイザーは、フルパワーの10%に設定したブランソン超音波処理150、(10の1)です。以下の超音波ボリュームは推奨されています。
400μlの(両側郭清)、ラット、SN = 250μlの(一方的な郭清)で、液400(両側郭清)、VTA = 200μL(一方的な郭清)。
マウスでは、(唯一の二国間の解剖)、SN = 200μlの、VTA = 200μlの。 - 均質化した後、ドライアイス上のサンプルを保持します。サンプルはその後centrifです。堆積物に12,000 rpmでuged(デュポンソーバルマイクロスピン24S)は、タンパク質ペレットを、ウェスタンブロットの決定に使用される。上清をHPLCに直接注入されています。 SN = 150(どちら準備から。)、VTA = 160μL(いずれかの準備から。):次の注入量は、ラットやマウスの正確な分析のために推奨されている
- 在庫規格は、0.1 M過塩素酸0.1mMのEDTAにドーパミンのコンポーネント*モノアミンおよび代謝物の適切な量を追加することにより、1 mg / mlを用意しています。各化合物の濃度は5 mg / mlであるトリプトファンを除いては1 mg / mlである。在庫規格は、10μlのアリコートに分割し、必要になるまで超に格納されています。
*全ての重みは、該当する場合の化合物の塩の形態のために修正されます。
過塩素酸溶液100mlにストック標準の10μlのアリコートを希釈することにより、作業標準を準備します。作業標準の濃度は0.5μg/ mlであるトリプトファンを除いては0.1μg/ mlである。 50μlのこの作業標準は、25 ngのであるトリプトファンを除く各成分5 ngのカラム上の量をHPLCに注入される。 - サンプルアリコート内のドーパミンの回復の決定:
サンプルのアリコートからドーパミンの回復を決定するために関与するいくつかのステップがあります。 - まず、標準のドーパミンピーク高さによる試料のドーパミンピーク高さを分割し、標準のドーパミンの合計量(ng)によってこの比率を乗算します。当社の標準ドーパミン濃度が標準の0.1 ng /μLのと50μLをアッセイである。したがって、標準のドーパミンの量は5 ngのです。したがって、以下の式は、与えられたサンプル中の決定ドーパミン回復に使用することができます。
(標準のサンプル/ドーパミンピーク高さでドーパミンピーク高さ)* 5 ngの - 内部標準N-メチルドーパミンを使用して、サンプルの損失を補正する。
N-メチルドーパミンの実際の回復は、N-メチルDOPを分割することによってドーパミンと同じ方法で計算されます。サンプル中のアミンのピーク高さは標準のN-メチルドーパミンピーク高さと標準のN-メチルドーパミンの合計量(ng)によってこの比率を乗算します。ドーパミンと同様に、私たちの標準的なN-メチルドーパミン濃度は0.1 ng /μLです。標準の50μLをアッセイされる。したがって、標準のN-メチルドーパミンの量は5 ngのです。したがって、以下の式は、与えられたサンプル中のN-メチルドーパミンの回復を決定するために使用することができます。
(標準では、サンプル中のN-メチルドーパミンピーク高さ/ N-メチルドーパミンピーク高さ)* 5ng
しかし、各サンプル中のN-メチルドーパミンはなく、サンプル自体からではなく、HPLCバッファから来る、各サンプルに期待N-メチルドーパミンの量が計算されます。 HPLCバッファのN-メチルドーパミン濃度は20 ng / mLの0.02 ng /μLの、各サンプル中のN-メチルドーパミンはアリコートボリュームHPLCによりバッファのN-メチルドーパミン濃度を乗じて検出されたのように予想される量であるHのために使用された各サンプルのPLC分析。これは次の式で示されています。
(μL/ 0.02 NG)*(HPLC分析に用いたサンプルのアリコート量) - 予想される回収し、N-メチルドーパミンの違いは、どのようなサンプルの損失を調整することにより回収ドーパミンの量を修正するために使用することができます。単純に予想されるN-メチルドーパミン/ N-メチルドーパミンを回収し、回収ドーパミンの量によって、これを掛けるの比を取る。したがって、サンプルのアリコートにおけるドーパミン量の全体的な方程式を以下に示します。
(サンプル/標準のドーパミンピーク高さのドーパミンピーク高さ)*(N-メチルサンプルの標準/ N-メチルドーパミンピーク高さのドーパミンピーク高さ)*(μL/ 0.02 ng)を*(HPLC分析に用いたサンプルのアリコートのボリューム) - 合計ドーパミンは、サンプルから回収した。
サンプルのアリコートから回収されたドーパミンの値は、与えられたサンプル中のドーパミンの総量を推定するために使用されています。これは、回収量(ng)をOを分割することによって行われますF DAアリコートボリュームで、サンプルがログイン超音波処理されていることをHPLCバッファの総容量でこの値を乗じてこれは、以下の式で与えられます。
(サンプルのアリコートのサンプルアリコート/ボリューム内のドーパミンの量(ng))*(サンプルは超音波処理した先のHPLCバッファーの合計量)。
読者も同様にドーパミン調節SNとVTAだけでなく、中のタンパク質が、線条体および側坐核からの読み出しと一緒にドーパミンおよび代謝物の評価の総合的なプレゼンテーションのための以下の研究2,4,10と呼ばれています。
3。組織分析:総タンパクとTHとDAT結果の最終的な正規化
- 4℃を維持するために、ぬれた氷の中に沈殿したタンパク質ペレットを(HPLCバッファ処理に由来する)に置きすべてのバッファが削除(確認分析が必要な場合)アーカイブされていることを確認します。 SNまたはVTAは、(ラットのみ)両側に処理する場合は、300μL(SN)または2を追加1%SDS、5 mMトリス(pH 8.3)で、ペレットと超音波処理に1mM EDTAを含む00μL(VTA)。一方的な解剖から組織を処理する場合VTAペレットにSNペレットまたは100μlにSDS溶液150μLを追加します。
- タンパク質の変性を完了し、室温まで冷却できるように約5分間の近くに沸騰したお湯にサンプルを置きます。キャップはしっかりとこのステップで行われていることを確認します。
- 40μgのタンパク質 - タンパク質の標準曲線(アルブミン標準)2の範囲を含めて、BCAアッセイを用いてサンプル中のタンパク質濃度を決定します。アッセイを5μlの三連の試料の体積と標準曲線に対して、タンパク質の量を決定するために中央値を使用しています。タンパク質濃度のアッセイ体積で割る。これは全タンパク質の回復に合計TH、DAT、およびVMAT2結果を正規化するために取らつのステップの最初であることに注意してください。
- 10%アクリルアミドgにSDS-電気泳動を削減するためのサンプル緩衝液(ジチオスレイトールを含む)でサンプルを調製ELS。理想的には、最終的な総タンパク質濃度は〜2μg/μLのでなければなりません。この濃度を選択する理由は、総蛋白の〜100μgを正確にser31とser40 THのリン酸化を定量化するためにロードするために必要となりますので、THリン酸化の最終的な決定のために必要なサンプル量を減らすことです。黄色の色はサンプルバッファーを添加した後のサンプルで見られている場合は、サンプルがあまりにも酸性です。青い色が復元されるまで10μlの単位で1 Mトリス(pHは8.2)を追加します。
- ドーパミン調節タンパク質は、次の決定のために次のようにサンプルを準備します。
- TH:TH蛋白質のキャリブレーション標準(NGなど)に対しては、SNのTHの濃度(総μgのタンパク質あたりの当たりngのTHなど)μgの当たり約0.05から0.27 ngのTHからの総タンパク質2,4の範囲であることが期待され、 7,10,11。 5.0 ngのTHやTHに一次抗体を使用して(ミリポア社製の猫#AB152、PVP Tで1:1000希釈 - 0.5に至るまで線形TH標準曲線に対する線形標準曲線を生成する-20ブロッキング溶液)、SNからの総タンパク質の最適な負荷は約10μgのでなければなりません。 VTAにおけるTHの濃度は約0.4からμgのタンパク質4,11当たり1.0 ngのTHの範囲である。したがって、VTAの総タンパク質の負荷が〜5μgのでなければなりません。
- DAT:DATの相対量SNまたはVTAでは、線条体および側坐核の4同族端末のフィールド領域に比べて有意に少なくなります。回復したTHタンパク質に正規化としてDATの相対的な発現はまた、SNとVTAで有意に低くなっています。したがって、SNまたはVTAでDATタンパク質を定量するためのタンパク質の負荷は、ターミナルフィールド領域のサンプル負荷に比べてはるかに大きくする必要があります。総タンパク質の30μgの最小値は、VTAのDAT評価の精度が必要とされ、50μgの総タンパク質の公称負荷はSNの評価の必要性です。使用される主な抗体は、サンタクルス、猫#SC-1433です。
- VMAT2:VMAT2の発現、総蛋白のように正規化され、黒質線条体領域よりもmesoaccumbensに大きい。しかし、TH発現の相対的な、VMAT2の発現は、線条体4のSNと、少なくともで最大です。 VMAT2の定量化に最適であるサンタクルス猫#SC-15314、〜40μgの名目上の総タンパク質の負荷を使用します。
- 10%アクリルアミドゲルでSDS-PAGEを用いた総タンパク質の適切な量を実行します。 Bio-Rad社変幻II電気泳動ユニットは、大規模なゲルフォーマットである決定に使用されます。 0.45μmの孔サイズのニトロセルロース上にタンパク質を転送します。転送のために、少なくとも27ボルトに設定されHoefferタンクは転送が一晩場所を取ることができます。
- ブロットは、少なくとも30分間乾燥し、その後約5分間ポンソーS溶液(5%氷酢酸の1%ポンソーS)で染色することができます。個々のタンパク質のバンドが明確に解決し、バックグラウンド染色が削除されるまで、0.2パーセントのHCl溶液と激しくデ染色。ポンソーS染色の画像を取得INGは、DAT、さらに各レーンに相対的なタンパク質の負荷を定量化し、THを正規化するイメージJを使用するか、VMAT2結果( 図3)。
4。組織分析:サイト固有のTHのリン酸化
ser31またはser40におけるTHのリン酸化は、カテコールアミンの細胞12のL-DOPAの合成を増やすことができます。 SNとVTAのようなドーパミンの脳領域ではL-DOPAの合成を増加させるために必要な各サイトのリン酸化量が確立されていませんが、ser31のリン酸化がDAにL-DOPAの合成10の調節に重要な役割を果たしていると共変動するという証拠がある線条体間の組織の内容、側坐核、sn、およびVTA 2、10。多くの研究は、それがリン酸化のしきい値は12に達している場合は特に、THの活性に影響を与える可能性が示されているようにそれにもかかわらず、ser40決定を含めると、必要である。
一方、ser19 phosphorylati単独で13,14 THの活性には影響しませんで、それが与えられ、DAニューロンに+依存性シグナル伝達のCa 2のセンチネルと見なすことができ、細胞外Ca 2 +の条件12を脱分極下のser19のリン酸化を増加させる必要があります。さらに、唯一のSNとVTA 10 ser31のリン酸化とser19のリン酸化の有意な正の相関がser19のリン酸化状態がser31のリン酸化に影響を与える可能性があること意味があるため、間接的にL-DOPAの合成。
サイト固有のTHのリンの化学量論の最適な定量化のためのサンプルの負荷に関する考慮事項:以下は、解剖組織内のサイト固有のTHのリン酸化を正確に測定するために必要な考慮事項が提示されます。可能な場合は、キャリブレーションTHリン酸化の標準は、サンプルTHリン酸化の評価に含める必要があります。サンプルのロードは、ACCに入れなければならないアッセイが使用されている抗体の動的な動作範囲内でリンを定量化するように、各リン酸化部位でount固有の化学量論。最後の注意として、各サンプルの分析に入って来る固有の総タンパク質量は、標準曲線のレーンにロードする必要があります。これは簡単にTHを表現していないキャリアタンパク質(例えば、ラットの肝臓など)を実現しています。
- 0.25 2,10,11 - ser19 3のリン酸化部位のうち、ser19リン化学量論のレベルは0.15に至るまで、SNとVTAで最も大きくなります。その他の考慮事項は、私たちの検出方法により、ser19 PSは0.5および5.0 ngのリン酸化ser19 10との間に線形の範囲で定量化されていることです。 ser19 THリン酸化の信頼性のある尺度を提供するであろう - これらの考慮事項、5および10 ng(2.5 ngのホスホ - ser19サンプルからは、このように推定0.75を与える)の間の総THタンパク質負荷与えられた。我々は、1:1000希釈でプライマリPhosphosolutions(カタログ#p1580-19)を使用する。
- 0.10 2,4,10,11 - ser31 ser31リン化学量論のレベルは〜0.04に至るまで、彼らの同族のターミナルフィールド領域に比べてSNとVTAの比較的少ない。私たちの検出方法により、ser31 psのは、0.5および7.0 ngのリン酸化ser31 10との間に線形の範囲で検出されます。これらの考慮事項、(したがって、推定0.50を与える - サンプルから3.0 ngのホスホ-ser31)10〜30 ngの間の総THタンパク質負荷与えられたser31THリン酸化の信頼性のある尺度を提供するであろう。 ser31定量化の例については、 図4Aを参照してください。私たちの一次抗体は、当社の社内基準2を使用してリン酸化エピトープを21 世紀の生化学、(ボストン、マサチューセッツ州)によって製造され、特異性について検証された社内のアフィニティー精製抗体である。
- ser40 SNとVTAの範囲内のser40のリン酸化量論レベル〜0.02から- 。0.06 2,4,10,11。私たちの検出方法、sでer40 psのは、0.2および2.0 ngのリン酸化ser40 10の間の線形の範囲で検出されます。これらの考慮事項、(したがって、推定0.20を与える - サンプルから1.8 ngのホスホ-ser40)10〜30 ngの間の総THタンパク質負荷与えられたser40THリン酸化の信頼性のある尺度を提供するであろう。 ser40定量化の例については、 図4Bを参照してください。我々は、1:1000希釈で(カタログ#p1580-40)主要なPhosphosolutionsを使用しています。
5。代表的な結果
- SN対VTAのドーパミンの定量分析に取られるドーパミンの3読み出し(または代謝物)があります;。清から回収した総当たりとして、当たりのタンパク質、及びTH蛋白質(線条体、SN、側坐核のために示すように、当たりとは下記の表1にVTA)。 SNとVTA間の総ドーパミンの回復は二から三冠状スライス解剖2の6から9 ngの間に至るまで、かなり匹敵するものです。総タンパク質にドーパミン回復を正規化すると、股関節が表示されます解剖法に基づくtは、VTAは、SN 6〜8 ngの/ mgタンパク質とVTA 2、4、9〜10 ngの/ mgタンパク質を平均し、総タンパク質あたりの大きなドーパミンを持つことになり、採用した。最後に、回収した総THへのドーパミンの正規化はまた、VTA 10に大きくなること、SNとVTAの違いを明らかにし、二つの領域2,10の間に0.2〜0.8 ngのドーパミン当たりngのTH蛋白質の間の範囲があります。
DA地域 合計DAが回復 mgタンパク質当たりのDA DA当たりngのTH 線条体 214±16 165±13 0.56±0.11 SN 8.4±0.8 6.1±0.5 0.18±0.03 核ACcumbens 60±6 75±4 0.77±0.03 VTA 6.0±1.0 9.2±1.4 0.22±0.03 - 総タンパク:定量化のためにキャリブレーションTHタンパク質標準を使用して、TH、DAT、VMAT2、より多くのTHは郭清(SN 60 ngおよびVTA 2 26 NG)からVTAよりもSNで回収されています。ただし、VTAの総タンパク質あたりのTHは〜3であると、この関係が逆転し、タンパク質への正規化- 4(SNのVTAと〜0.09〜0.32 ngの/μgのタンパク質)、SNに比べて5倍以上に、 10。
SNとVTAのDATの予想される回復は、4を回収し 、総タンパク質あたりのまたは総THごとに限りVTAで少し回復して、似ています。特に、DATタンパク質は同種の端末のフィールド領域4に比べてはるかに少ない豊富なこれらの地域である supの。
総タンパク質量当たりとしてVMAT2回復はVTA対SN 4大きい。しかし、THタンパク質に正規化された場合、SN 4で若干大きく回復があります。 - 多くの研究から、 サイト固有のTHのリン酸化 、ser19、ser31で一貫性のある結果がありました、またser40のリン酸化SNとVTAの量、および同族のターミナルフィールド領域の関係インチSer19リン酸化は、線条体および側坐核(〜0.05から0.15)2,4,7,10,11に比べてSNとVTA(〜0.2から0.3)で特に大きい。これらの細胞体領域の2,4,7,10,11の間で0.10 - Ser31リン酸化は、〜0.06である、彼らの同族のターミナルフィールド領域に比べてSNとVTAで有意に少なくなります。 NSD-1015を有する芳香族カルボン酸脱炭酸酵素の阻害の間に、わずか10 VTAのser31のリン酸化の2倍の増加があります。 SN 0.02と0.05の間のSer40のリン酸化の範囲とVTAと一般的には、この化学量論は大幅に2,4,7,10,11同族ターミナルフィールド領域から違いはありません。

図1 1つの組織解剖からドーパミン読み出し。
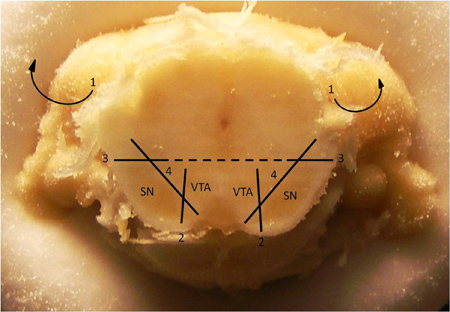
中脳ドーパミン作動性神経網を分離するための図2。解剖法。腹側被蓋野(VTA)から黒質(SN)を解剖するための技術。 1。覆っている皮質と海馬(これらの構造は既に上記の画像で削除されました)を削除します。 2。 VTAからのSnの色素領域を分離する垂直カットします。 3。ただSNの背側正中線上に大部分またはその付近に水平なカットを行います。 4。離れて脳幹の残りの部分からSNをいじめる。 SNが削除された後、同様に離れてからVTAをいじめる脳の残りの部分。注:このセクションは、通常、AP 5.7でブレグマからの相対座標で観察されています。

画像J解析のための総タンパク質の負荷ポンソーS染色の3番目の(そして最後の)正規化図 。ラット黒質試料中の総TH決定のポンソーSタンパク質染色。最初の5つのレーンは、左を形成する標準的な総TH曲線であり、そのラット肝ホモジネートから28μgのタンパク質は、黒質試料からのタンパク質の負荷を反映するように添加した。次のレーンは分子量(MW)マーカーを含む。残りのレーンは、ラット黒質試料から〜28μgのタンパク質が含まれています。 BCA法で決定されるタンパク質の負荷は、各サンプルのタンパク質濃度に基づいています。しかし、同じ負荷のあるべき姿にもかかわらず、わずかなことを示すサンプル間のポンソーS染色の暗闇の中でバリエーションがあります各サンプルのポンソーS染色の量を分析するためにImageJの解析を用いて正規化によって補正されたタンパク質濃度の変動。

図4コントロールと治療法から代表THリン酸化の結果。代表的なser31リン酸化チロシンヒドロキシラーゼ(PTH)と以前の研究4。Aから生理食塩水とメタンフェタミン投与Wistarラットからser40 PTHウェスタンブロットラット黒質試料中のSER 31 PTH 0.3 ngから2.0 ngまでキャリブレーションSER 31 PTH標準曲線の範囲と検出の直線範囲内にあります。合計THレベルの以前のウェスタンブロット分析に基づいて、合計THの6 ngの各サンプルにロードされていました。B.ラット腹側被蓋野試料中のser40 PTH。キャリブレーションser40 PTH標準曲線の範囲は0.2 ng〜1.5 ngまでと検出の直線範囲内にある。合計THレベルの以前のウェスタンブロット分析に基づいて、合計TH 9 ngの各サンプルにロードされていました。
ディスカッション
図1に概説され、上記詳述した方法は、ドーパミンの複数の読み出しおよびラットまたはマウスから得られたSNまたはVTAの1つのサンプルから、その調節タンパク質TH、DAT、およびVMAT2を生成する必要があります。再び、このプロトコルを実施する利点は、研究者はドーパミンが実質的にすべての実験的なパラダイムの下でin vivoでの規制と、そうすることで、いずれかに必要な動物数を減らすことによって、重要な実験的なリソースを節約する方法の運用をマッチさせた読み出しを得ることができるということです実験。
それは研究者が氷冷HPLCバッファ内の解剖(4°C)、組織の記憶(少なくとも-70°C)、組織の超音波処理(貯蔵温度から除去した後、ただちに超音波)に課せられた温度条件を観察し、ことが絶対不可欠である後続のペレットの形成と処理。ペレットを超音波処理し、SDS溶液で煮沸した後、サンプルはフュルトであり続けることができるERは、室温で処理されます。アーカイブされたHPLCのストレージは、サンプルを分析し、タンパク質分析用のサンプルバッファー調製したサンプルは-80℃と
再び、プロトコルの主な利点は、in vivoでのドーパミン調節に関連する運用上の一致結果に生得的なアプローチである。さらに、ドーパミン作動性神経網のマーカー(TH、DAT)捜査官であることを保証大量の尺度を提供するドーパミン組織の読み出しを正規化一貫性と精度でSNまたはVTAを解剖。中毒、精神障害におけるドーパミンの関与、および運動競技場を指定して、このプロトコルは、多くの実験で採用される可能性があります。一つ注目すべき制限は、それがこの時点でser31またはser40のリン酸化の増加はL-DOPAの合成を高めるために、生体内で必要とされる程度を知られていないとして、THのリン酸化の結果の解釈は、保守的であるべきであるということです。しかし、前述のように、EVがありますser31リン酸化は、L-DOPAの合成を調節するために表示され、CNS 2,10総ドーパミン組織のコンテンツを制御する役割を持っていることをidence。この時点では、THタンパク質とTHのリン酸化のための基準は、市販されていない。しかし、この研究室ではin vivoでの THリン酸化調節に関する最初の論文は11を発表したときに使用されているものに基づいてそのような基準を維持し、拡大してきました。それでも、このプロトコルを使用して、これらの離散的な領域で回復THタンパク質にドーパミン組織のコンテンツを正規化することが可能です。
開示事項
利害の衝突が宣言されません。
謝辞
この作品、として2,10を挙げて 、のための資金は、老化研究、エドワード·P.スタイルズ信託基金とノースウエストルイジアナ州の医学研究財団のためのアメリカ連合からMFサルバトーレの研究助成賞を受賞することによって、部分的には、提供されていましたとBSプルエットにアイクMuslow博士号を取得する前のフェローシップ、LSUの健康科学センターシュリーブポートから。
資料
HPLCシステム:
基本的なシステムは島津LC10-ADvp HPLCポンプ、ウォーターズWISP 717自動サンプルインジェクター、250 X 4.4ミリメートル、5ミクロンSpherosorb ODS-1 C18逆相カラム(Waters)、バイオ分析システム(BAS)TL12デュアルガラスで構成されています炭素電極、2 BAS LC4B電気化学検出器、およびウォーターズは、2のデータ収集およびデータの統合システムに力を与える。
列は30から45°C(BAS LC22Aカラムヒーター)に維持されています。移動相は0.1 Mリン酸ナトリウム液(pH3.0)、0.1mMのEDTA、0.2から0.4 mMの1 - オクタンスルホン酸(イーストマンコダック - )、および0.35%0.45ミクロンフィルターを通して濾過し、アセトニトリル(v / v)である。流量は1.2 ml /分である。移動相の4リットルのバッチは、pH、オクタンスルホン酸およびカラム温度を調整することにより、分離のために最適化されています。移動相はリサイクルされており、継続的に溶存酸素を除去するためにヘリウムガスでパージされています。移動相のリサイクル合理的な期間のために良好な分解能を維持するためにほとんど不可欠である。移動相の貯蔵寿命は、各実行の最初の2から7分を無駄にそらすために、フロースイッチ(積分器によって制御される)を使用することによって維持されています。
電極はAg/AgC1参照電極に対して約0.78と0.95Vの電位で維持されています。より高い電位での電極は、トリプトファン(およびNMDA内部標準)を決定するために排他的に使用されます。 0.78 Vの電位はトリプトファン以外のモノアミン及びその化合物の検出のための雑音比に優れた信号を提供します。クロマトグラムをエンパワーワークステーションのハードドライブに保存され、その後、処理され、データは代謝産物の量およびグループのデータのコンパイルを計算するためのExcelスプレッドシートに直接転送されます。
ポンプ:島津LC-10AD
細胞:BASクロスフロー。 0.780および0.9で作用電極グラッシーカーボン50 Vの可能性。
検出器:BAS LC-4Bは、デュアルチャネルモードで動作する。
データACQ。システム:ウォーターズはPro 2をエンパワー。
インジェクター:ウォーターズWISP 717
カラム:ウォーターズSpherosorb ODS-1、5μm粒子、4.4ミリメートルX 250ミリメートル。
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
| ドデシル硫酸ナトリウム(SDS) | - JTベーカー | 4095から02 | |
| Trizmaベース | シグマ | T1503-1KG | |
| Trizma HClを | シグマ | T3253-1KG | |
| グリセロール | シグマ | G8773-500 mLの | |
| PVP-40 | シグマ | PVP40-1KG | |
| DPBS | ギブコ | 21600-069 | |
| Tween20を | シグマ | P1379-500 mLの | |
| グリシン | シグマ | G8898-1KG | |
| ポンソーS | フルカ | 81460 | |
| ブロモフェノールブルー | シグマ | B8026-5G | |
| ジチオスレイトール | シグマ | D-9163 | |
| タンパク質標準2mgのBSA | シグマ | P5619-25VL | |
| ピアスBCAタンパク質アッセイ試薬 | サーモフィッシャーサイエンティフィック | 23223 | |
| プレシジョンプラスプロテインスタンダード | バイオラッド社 | 161-0373 | |
| [125] - 蛋白質、特定のアクティビティ | パーキンエルマー |
表2特定の試薬 が含まれています。
| 試薬 | 式 |
| 10%SDS | 10グラムSDS、100 mLのDI H 2 0 |
| 1%SDS液(pH〜8.2) |
|
| 銅II硫酸溶液 |
|
| 3Xサンプルバッファー |
|
| 1Xサンプルバッファー | DI H 2 0を使用して1Xサンプルバッファーに3Xサンプルバッファーを希釈する |
| 10Xランニング緩衝液(4 Lになります) |
|
| 10X転送バッファ(4 Lになります) |
|
| ポンソー |
|
| 0.2パーセントのHCl溶液 | DI H 2 O 500mlを5.2 mLの塩酸 |
| PVP-T20はSolnをブロックします。 (4 Lになります) |
|
| 10Xブロット緩衝液(4 Lになります) |
|
チロシン水酸化酵素の基準:この研究室で使用されるキャリブレーションTH蛋白質およびリンの基準は、最終的にドクター·ジョン干し草の山11の研究室に由来する以前にキャリブレーションTH規格に対してTHタンパク質含有量とリン化学量論を分析したPC12細胞抽出物から誘導される。
参考文献
- Trevitt, J. T., Carlson, B. B., Nowend, K., Salamone, J. D. Substantia nigra pars reticulate is a highly potent site of action for the behavioral effects of the D1 antagonist SCH23390 in rat. Psychopharmacology. 156, 32-41 (2001).
- Salvatore, M. F., Pruett, B. S., Spann, S. L., Dempsey, C. Aging reveals a role for nigral tyrosine hydroxylase ser31 phosphorylation in locomotor activity generation. PLoS ONE. 4, e8466 (2009).
- Rossato, J. L., Bevilaqua, L. R. M., Izquierdo, I., Medina, J. H., Cammarota, M. Dopamine controls persistence of long-term memory storage. Science. 325, 1017-1020 (2009).
- Keller, C. M., Salvatore, M. F., Pruett, B. S., Guerdin, G. F., Goeders, N. E. Biphasic dopamine regulation in mesoaccumbens pathway in response to non-contigent binge and escalating methamphetamine regimens in the Wistar rat. Psychopharmacology. 215, 513-526 (2011).
- Lu, L., Dempsey, J., Liu, S. Y., Bossert, J. M., Shaham, Y. A single infusion of brain-derived neurotrophic factor into the ventral tegmental area induces long-lasting potentiation of cocaine seeking after withdrawal. J. Neurosci. 24, 1604-1611 (2004).
- Hoffer, B. J., Hoffman, A., Bowenkamp, K., Huettl, P., Hudson, J., Martin, D., Lin, L. F., Gerhardt, G. A. Glial cell line-derived neurotrophic factor reverses toxin-induced injury to midbrain dopaminergic neurons in vivo. Neurosci. Lett. 182, 107-111 (1994).
- Salvatore, M. F., Zhang, J. L., Large, D. M., Wilson, P. E., Gash, C. R., Thomas, T. C., Haycock, J. W., Bing, G., Stanford, J. A., Gash, D. M., Gerhardt, G. A. Striatal GDNF administration increases tyrosine hydroxylase phosphorylation in the rat striatum and substantia nigra. J. Neurochem. 90, 245-254 (2004).
- Lu, L., Wang, X., Wu, P., Xu, C., Zhao, M., Morales, M., Harvey, B. K., Hoffer, B. J., Shaham, Y. Role of ventral tegmental area glial cell-line derived neurotrophic factor in incubation of cocaine craving. Biol. Psychiatry. 66, 137-145 (2009).
- Lavicky, J., Dunn, A. J. Corticotropin-releasing factor stimulates catecholamine release in hypothalamus and prefrontal cortex in freely moving rats as assessed by microdialysis. J. Neurochem. 60, 602-612 (1993).
- Salvatore, M. F., Pruett, B. S. Dichotomy of tyrosine hydroxylase and dopamine regulation between somatodendritic and terminal field areas of nigrostriatal and mesoaccumbens pathways. PLoS ONE. 7, e29867 (2012).
- Salvatore, M. F., Garcia-Espana, A., Goldstein, M., Deutch, A. Y., Haycock, J. W. Stoichiometry of tyrosine hydroxylase phosphorylation in the nigrostriatal and mesolimbic systems in vivo: Effects of acute haloperidol and related compounds. J. Neurochem. 75, 225-232 (2000).
- Salvatore, M. F., Waymire, J. C., Haycock, J. W. Depolarization-stimulated catecholamine biosynthesis: involvement of protein kinases and tyrosine hydroxylase phosphorylation sites in situ. J. Neurochem. 79, 349-360 (2001).
- Haycock, J. W., Lew, J. Y., Garcia-Espana, A., Lee, K. Y., Harada, K., Meller, E., Goldstein, M. Role of serine-19 phosphorylation in regulating tyrosine hydroxylase studied with site- and phosphospecific antibodies and site-directed mutagenesis. J. Neurochem. 71, 1670-1675 (1998).
- Lindgren, N., Xu, Z. Q., Linskog, M., Herrera-Marschitz, M., Goiny, M., Haycock, J. W., Goldstein, M., Hokfelt, T., Fisone, G. Regulation of tyrosine hydroxylase activity and phosphorylation at ser19 and ser40 via activation of glutamate NMDA receptors in rat striatum. J. Neurochem. 74, 2470-2477 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved