Method Article
Umfassende Profilierung der Verordnung Dopamin in der Substantia nigra und ventralen Tegmentum
In diesem Artikel
Zusammenfassung
Dopamin wird deutlich im Mittelhirn Kerne, die den Zellkörper und Dendriten der Dopamin-Neuronen enthalten geregelt. Hier beschreiben wir eine Dissektion und Probe-Handling-Ansatz, um Ergebnisse zu maximieren, und damit Schlussfolgerungen und Erkenntnisse, auf die Dopamin-Regulierung im Mittelhirn Kerne der Substantia nigra (SN) und ventralen Tegmentum (VTA) bei Nagern.
Zusammenfassung
Dopamin ist ein kräftig studierte Neurotransmitter im ZNS. In der Tat hat sein Engagement in der Bewegungsaktivität und Lohn-bezogenen Verhalten fünf Jahrzehnten zur Untersuchung der molekularen Mängel, die Dopamin-Regelung verbundenen gefördert. Die meisten dieser Anfragen von Dopamin im Gehirn Verordnung Fokus auf die molekulare Grundlage für die Regulierung in den Terminal-Bereich Regionen der nigrostriatalen und mesoaccumbens Wege; Striatum und Nucleus accumbens. Darüber hinaus haben solche Studien auf der Analyse der Dopamin-Gehalt Gewebe mit einer Normalisierung auf nur feuchten Tuch Gewicht konzentriert. Die Untersuchung der Proteine, die Dopamin regulieren, wie zB Tyrosin-Hydroxylase (TH) Protein, TH-Phosphorylierung, Dopamin-Transporter (DAT), und vesikulären Monoamin-Transporter 2 (VMAT2) Protein oft nicht, eine Analyse der Dopamin-Gehalt im Gewebe der gleichen Probe. Die Fähigkeit, sowohl Dopamin Gewebe Inhalte und deren regulierende Proteine (einschließlich Post-tra analysierennslational Modifikationen) gibt nicht nur innewohnende Kraft der Interpretation der Beziehung von Dopamin mit der Protein-Ebene und die Funktion der TH, DAT oder VMAT2, sondern erstreckt sich auch Probe Wirtschaft. Dies schlägt sich in geringeren Kosten, und doch produziert Einblicke in die molekulare Regulation von Dopamin in praktisch jedem Paradigma der Ermittler Wahl.
Wir fokussieren die Analysen im Mittelhirn. Obwohl die SN und VTA in der Regel in den meisten Studien der Dopamin-Regulierung vernachlässigt werden, werden diese Kerne leicht mit etwas Übung seziert. Eine umfassende Auslesen von Dopamin Gewebe Inhalt und TH-, DAT oder VMAT2 durchgeführt werden kann. Es wird aufkeimende Literatur über die Auswirkungen der Dopamin-Funktion in der SN und VTA auf das Verhalten und die Beeinträchtigungen von körperfremden Substanzen oder Krankheitsprozesse darin 1-5. Darüber hinaus haben Verbindungen, wie zB Wachstumsfaktoren eine tiefgreifende Wirkung auf Dopamin-und Dopamin-regulierende Proteine, zu einer vergleichsweise größeren Ausmaß in der SN oder VTA Wir zeigen die Dissektion Technik, um diese zwei Kerne und die Probe Verarbeitung von präparierten Gewebe, das ein Profil enthüllen molekulare Mechanismen der Dopamin-Regulation in vivo, spezifisch für jede Kerne (Abbildung 1) erzeugt zu trennen.
Protokoll
1. Zergliederung
- Auf einem Bett von Nass-Eis, eine Chill-Nagergehirn Matrix (koronalen Abschnitte getrennt von 1 mm), eine Petrischale mit 5 Rasiermesser und eine Nr. 11 Skalpell. In einem separaten Behälter, beschriftet Platz 2 ml Größe Mikrozentrifugenröhrchen in Trockeneis.
- Der Prüfer wählt die Methode der Euthanasie. Wir haben reproduzierbare Ergebnisse die Durchführung einer sehr kurzen Narkose mit Isofluran, im Idealfall, ein Verdampfer verwendet werden sollte. Allerdings, wenn nicht verfügbar, verwenden wir eine große Batterie Gefäß mit einer Plattform. Mit der Batterie jar in einer zugelassenen Belüftung Haube befindet, platzieren Sie eine Isofluran-gesättigten Mulltupfer unterhalb der Plattform und warten Sie 3-5 Minuten, damit der Isofluran, um die Batterie jar zu sättigen. Legen Sie die Ratte im Inneren, und entfernen Sie für Enthauptung sobald die Ratte hat das Bewusstsein verlor. Raschen Entfernung des Gehirns (im Idealfall in weniger als zwei Minuten), unter kaltem Wasser abspülen, und legen Sie sofort in der gekühlten Nagergehirn Matrix.
- Eine Minute nach PositionÝng das Gehirn in der Matrix, legen kalten Rasierklingen in der gekühlten Gehirn, beginnend etwa 2 mm rostral des Chiasma, wenn das Striatum und Nucleus accumbens für die Analyse zusätzlich zu dem Mittelhirn Kerne erwünscht sind. Weiter Einsetzen kalten Rasierklingen mit je 1 mm Abschnitt bis nach der Mitte des Pons und der Staffelung der Platzierung der einzelnen nachfolgenden Rasierklinge, um so leichteres Entfernen der einzelnen Klinge zu erleichtern.
- Beim Herausziehen des Rasierer für den Beginn des Hippocampus zu sehen. Wenn es sich total um den Mittelhirn gehüllt, beginnen die Abschnitte mit der # 11 Skalpellklinge nehmen, wie in Abbildung 2 dargestellt.
- Anschließend wird der seziert Gewebe in das vorgekühlte Mikrozentrifugenröhrchen auf dem Trockeneis. Bei der Ratte erwarten zu können, SN und VTA aus einem Minimum von zwei koronalen Scheiben schneiden und auf maximal drei sezieren. Shop Gewebe bei -80 ° C bis zur Verarbeitung bereit.
2. Tissue-Analyse: HPLC-foder Dopamin und Metabolite
Für vollständige Informationen über die HPLC-Ausrüstung und Wartung, der HPLC-Analyse finden Sie am Ende des Manuskripts.
- Vorsichtig homogenisieren Gewebe sofort nach der Entnahme aus Trockeneis mit eiskaltem 0,1 M HClO 4-EDTA-Lösung (0,1 M HClO 4 & 0,1 mM EDTA) 9, die N-Methyl enthält Dopamin in einer Konzentration von 20 ng / mL, die als dient ein interner Standard für die Wiederherstellung der Probe während der HPLC-Analyse. Der Homogenisator wir verwenden, ist eine Branson Sonifier 150, mit der Einstellung bei 10% der vollen Leistung (1 von 10). Die folgenden Bände Beschallung werden empfohlen:
In Ratten, SN = 250 ul (einseitige Dissektion), 400 ul (bilaterale Dissektion), VTA = 200 ul (einseitige Dissektion), 400 ul (bilaterale Dissektion).
In der Maus (nur bilaterale Dissektionen), SN = 200 pl, VTA = 200 pl. - Nach der Homogenisierung, halten Proben auf Trockeneis. Die Proben sind dann CENTRIFuged (DuPont Sorvall Microspin 24S) bei 12.000 rpm in das Sediment der Proteinpellet für Western-Blot-Bestimmungen verwendet werden. Die Überstände werden direkt in die HPLC injiziert. Die folgenden Injektionsvolumina sind für eine genaue Analyse der Ratte oder der Maus zu empfehlen: (. Von beiden prep) SN = 150 (. Von beiden prep), VTA = 160 ul
- Die Lager-Standard wird bei 1 mg / ml durch Zugabe der entsprechenden Menge an Mono und Metaboliten * von Dopamin-Komponente bis 0,1 M Perchlorsäure 0,1 mM EDTA hergestellt. Die Konzentration jeder Verbindung 1 mg / ml, außer Tryptophan, 5 mg / ml beträgt. Der Bestand ist in 10 Standard-ul Aliquots aufgeteilt und in der ultratiefen bis sie benötigt werden.
* Alle Gewichte sind für die Salz-Form der Verbindung ggf. korrigiert.
Bereiten Sie die Arbeitsstandards durch Verdünnen einer 10 ul Aliquot von Lager-Standard bis 100 ml des Perchlorsäurelösung. Konzentration der Arbeitslösung Standard ist 0,1 ug / ml außer Tryptophan, die 0,5 ug / ml ist. 50 ulDiese Prüfzähler ist in die HPLC für eine On-Column-Menge von 5 ng von jeder Komponente, außer Tryptophan, die 25 ng injiziert. - Bestimmung von Dopamin Erholung innerhalb Probenaliquot:
Es gibt mehrere Schritte involviert, um die Dopamin-Wiederherstellung aus einer Probe Aliquot bestimmen. - Erstens teilen die Dopamin-Peakhöhe der Probe durch den Dopamin-Peakhöhe des Standards und multiplizieren dieses Verhältnis durch die Gesamtmenge (ng) von Dopamin in der Norm. Unsere Standard-Dopamin-Konzentration liegt bei 0,1 ng / ul und 50 ul Standard untersucht wird. Somit ist die Menge an Dopamin im Standard 5 ng. Somit kann die folgende Gleichung bestimmt Dopamin Rückgewinnung in einer gegebenen Probe verwendet werden:
(Dopamin Peakhöhe Probe in / Dopamin Peakhöhe im Standard) * 5 ng - Die Korrektur für den Verlust der Probe mit dem internen Standard-N-Methyl-Dopamin:
Die tatsächliche Wiederherstellung von N-Methyl Dopamin in der gleichen Weise wie Dopamin, indem die N-Methyl dop berechnetAmin Peakhöhen in der Probe durch den N-Methyl Dopamin Peakhöhe des Standards und Multiplizieren dieses Verhältnis der Gesamtmenge (ng) N-Methyl-Dopamin im Standard. Wie Dopamin, ist unser Standard-N-Methyl-Dopamin-Konzentration 0,1 ng / ul. 50 ul der Norm getestet wird. Somit ist die Menge von N-Methyl Dopamin im Standard 5 ng. Somit kann die folgende Gleichung verwendet werden, um N-Methyl Dopamin Rückgewinnung in einer gegebenen Probe bestimmt werden:
(N-Methyl Dopamin Peakhöhe in der Probe / N-Methyl Dopamin Spitzenhöhe in Standard) * 5 ng
Da jedoch die N-Methyl Dopamin in jeder Probe nicht von der Probe selbst, sondern von der HPLC-Puffer kommt, wird die Menge an N-Methyl Dopamin in jeder Probe zu erwarten berechnet. Die N-Methyl-Dopamin-Konzentration im HPLC-Puffer beträgt 20 ng / ml oder 0,02 ng / mL, so dass die erwartete Menge an N-Methyl Dopamin in jeder Probe wird durch Multiplizieren der N-Methyl-Dopamin-Konzentration des HPLC-Puffer durch die Aliquot Bandes jeder Probe für H verwendetSPS-Analyse. Dies wird in der Gleichung unten gezeigt:
(0,02 ng / ul) * (aliquote Volumen der Probe für die HPLC-Analyse verwendet) - Die Differenz zwischen der erwarteten und gewonnen N-Methyl Dopamin kann dann verwendet, um den für die Menge an Dopamin durch Einstellen für jede Probe gewonnen Verlust zu korrigieren. Einfach den erwarteten Verhältnis von N-Methyl Dopamin / geschrumpft N-Methyl Dopamin und multiplizieren die Menge an Dopamin gewonnen. Somit wird die allgemeine Gleichung für die Menge an Dopamin im eines Probenaliquots unten angegeben:
(Dopamin Peakhöhe in der Probe / Dopamin Spitzenhöhe in Standard) * (N-Methyl Dopamin Peakhöhe im Standard / N-Methyl Dopamin Peakhöhe in der Probe) * (0,02 ng / mL) * (Aliquot Volumen der Probe für die HPLC-Analyse verwendet ) - Insgesamt Dopamin aus einer Probe gewonnen:
Der Wert von Dopamin aus einer Probe gewonnen Aliquot wird dann verwendet, um die Gesamtmenge von Dopamin in einer gegebenen Probe zu extrapolieren. Dies wird durch Dividieren der eingezogene Betrag (ng) o getanf DA von der aliquoten Menge und Multiplikation dieses Wertes durch das Gesamtvolumen der HPLC-Puffer, dass die Probe mit Ultraschall behandelt wurde auf Dies wird durch die folgende Gleichung gegeben:
(Menge (ng) von Dopamin im Probenaliquothandhabungsvorrichtung / Volumen von Probenaliquothandhabungsvorrichtung) * (Gesamtvolumen HPLC-Puffer in die Probe wurde mit Ultraschall behandelt).
Der Leser wird auf den folgenden Studien 2,4,10 für eine umfassende Darstellung der Beurteilung von Dopamin und Metabolite in Verbindung mit Positionsanzeigen von Dopamin-regulierende Proteine nicht nur in SN und VTA, aber Striatum und Nucleus accumbens sowie bezeichnet.
3. Tissue-Analyse: Total Protein und Final Normalisierung der TH-und DAT-Ergebnisse
- Platzieren Sie die gefällten Proteins Pellets (abgeleitet von der HPLC-Puffer Behandlung) in nassem Eis auf 4 ° C zu halten Sicherstellen, dass alle Puffer wurde entfernt und archiviert (wenn bestätigende Analyse erforderlich ist). Wenn die SN oder VTA ist es, bilateral verarbeitet werden (Ratte nur), fügen Sie 300 ul (SN) oder 200 ul (VTA) von 1% SDS, enthaltend 5 mM Tris (pH 8,3) und 1 mM EDTA zu dem Pellet und Sonifikat. Fügen Sie 150 ul des SDS-Lösung zu SN Pellets oder 100 ul zu VTA Pellets, wenn die Verarbeitung von Gewebe einseitige Dissektionen.
- Die Proben werden in der Nähe von kochendem Wasser für ~ 5 Minuten bis Proteindenaturierung zu vervollständigen und zu ermöglichen, auf Raumtemperatur abkühlen gelassen. Stellen Sie sicher, Kappen werden sicher bei diesem Schritt gehalten.
- Bestimmen Sie Protein-Konzentration in den Proben unter Verwendung des BCA-Tests, einschließlich eines Proteins Standardkurve (Albumin-Norm) Bereich von 2 - 40 ug Protein. Assay 5 ul Volumen der Probe in dreifacher Ausfertigung und mit dem Medianwert auf Proteinmenge gegen die Standardkurve bestimmen. Dividieren durch die Assay-Volumen für die Protein-Konzentration. Beachten Sie, dies ist das erste von zwei Schritten zur Normalisierung insgesamt TH, DAT, und VMAT2 Ergebnisse zu Gesamt-Protein Recovery genommen.
- Bereiten Sie die Proben mit Probenpuffer (mit Dithiothreitol) zum reduzierende SDS-Elektrophorese auf 10% Acrylamid gels. Idealerweise sollte die endgültige Gesamtproteinkonzentration ~ 2 ug / ul sein. Der Grund für diese Konzentration ist es, die Auswahl Probenvolumen notwendig für die ultimative Bestimmung der TH-Phosphorylierung zu reduzieren, als ~ 100 ug Gesamt-Protein ist notwendig für das Laden, um genau zu quantifizieren und ser31 ser40 TH-Phosphorylierung. Wenn die gelbe Farbe in der Probe nach Zugabe von Probenpuffer sehen ist, ist die Probe zu sauer. Zugabe von 1 M Tris (pH 8,2) in 10 ul Schritten bis die blaue Farbe wird wieder.
- Bereiten Sie die Proben wie folgt für die folgenden Bestimmungen der Dopamin-regulierende Proteine:
- TH: Vor dem kalibrierten Standard für TH-Protein (in ng), die Konzentration von TH (als pro ng pro Gesamtgewicht TH ug Protein) in der SN wird erwartet, dass von ~ reichen von 0,05 bis 0,27 ng pro TH ug Gesamtprotein 2,4, 7,10,11. Vor einer linearen TH Standardkurve reicht von 0,5 bis 5,0 ng TH und mit primären Antikörpers an TH (Millipore Cat # AB152, 1:1000 Verdünnung in PVP-T-20 Blockierungslösung), die eine lineare Standardkurve erzeugt, sollte die optimale Auslastung der gesamten Proteins aus der SN ~ 10 pg sein. Die Konzentration der TH in der VTA im Bereich von ~ 0,4 bis 1,0 ng TH pro ug Protein 4,11. So sollte Gesamtprotein Last für VTA ~ 5 ug sein.
- DAT: Die relativen Mengen der DAT in SN oder VTA sind deutlich geringer als in den verwandten Bereich Terminal Regionen Striatum und Nucleus accumbens 4. Die relative Expression der DAT als zurückgewonnen TH-Protein normalisiert ist ebenfalls signifikant niedriger in SN und VTA. Dementsprechend brauchen Protein Belastungen für die Quantifizierung von DAT-Protein in SN oder VTA viel größer sein im Vergleich zu Probe Lasten der terminalen Bereich Regionen. Ein Minimum von 30 ug Gesamt-Protein ist für die Präzision in der DAT-Bewertung im VTA benötigt und eine Nennlast von 50 ug Gesamt-Protein ist notwendig für die Beurteilung in der SN. Der primäre Antikörper verwendet wird, ist Santa Cruz, cat # sc-1433.
- VMAT2: Die Expression von VMAT2, Normiert auf Gesamtprotein, größer ist als in den mesoaccumbens nigrostriatalen Regionen. Jedoch relativ zu TH-Expression ist VMAT2 Expression größten in SN und mindestens im Striatum 4. Mit Santa Cruz cat # sc-15314, eine nominale Last von Gesamt-Protein ~ 40 pg bis sich am besten für die Quantifizierung der VMAT2.
- Führen Sie die entsprechende Menge an Gesamt-Protein mittels SDS-PAGE auf 10% Acrylamid-Gelen. Die Bio-Rad Protean II Elektrophorese-Einheit ist für die Bestimmungen, die eine große Gel-Format verwendet wird. Übertragen Sie die Proteine auf 0,45 um Porengröße Nitrocellulose. Für den Transfer, stellen Sie ein Hoeffer Kraftstoffbehälter zu mindestens 27 Volt ermöglicht die Übertragung auf Platz über Nacht zu nehmen.
- Lassen Sie die Blots für mindestens 30 Minuten trocknen lassen und dann färben mit Ponceau S-Lösung (1% Ponceau S in 5% Eisessig) für ~ 5 Minuten. De-Fleck kräftig mit 0,2% HCl-Lösung, bis einzelne Proteinbanden deutlich zu lösen und Hintergrundfärbung entfernt wird. Erhalten eines Bildes des Ponceau S-FärbemittelIng mit Image J weiter zu quantifizieren relativen Protein Lasten in jeder Bahn und zu normalisieren, TH, DAT oder VMAT2 Ergebnisse (Abbildung 3).
4. Tissue Analysis: Site-spezifische TH-Phosphorylierung
Die Phosphorylierung von TH bei ser31 oder ser40 kann L-DOPA-Biosynthese in katecholaminergen Zellen 12 zu erhöhen. Obwohl die Menge der Phosphorylierung an jedem Standort erforderlich, L-DOPA-Biosynthese in dopaminergen Hirnregionen wie SN und VTA nicht hergestellt erhöhen, gibt es Belege dafür, dass ser31 Phosphorylierung eine wichtige Rolle bei der Regulierung L-DOPA-Biosynthese 10 und Co-DA variiert mit spielt Inhalt Gewebe unter dem Striatum, Nucleus accumbens, SN und VTA 2, 10. Dennoch sind Aufnahme ser40 Bestimmung notwendig, da zahlreiche Studien gezeigt, kann TH-Aktivität beeinflussen, insbesondere wenn ein Schwellenwert der Phosphorylierung 12 erreicht ist.
Während ser19 phosphorylatihat keinen Einfluss auf TH-Aktivität allein 13,14, kann es als ein Wächter für die Ca 2 +-abhängige Signalwege in der DA-Neuronen werden, da extrazellulären Ca 2 + ist notwendig, um ser19 Phosphorylierung unter depolarisierenden Bedingungen 12 zu erhöhen. Darüber hinaus gibt es eine positive Korrelation von ser19 Phosphorylierung mit ser31 Phosphorylierung nur in der SN und VTA 10, was bedeutet, dass ser19 Phosphorylierungsstatus könnte ser31 Phosphorylierung beeinträchtigen, und somit indirekt L-DOPA-Biosynthese.
Probe Last Überlegungen für eine optimale Quantifizierung von ortsspezifischen TH Phosphorylierung Stöchiometrie: Im Folgenden wird die Überlegungen für die genaue und präzise Bestimmung von ortsspezifischen TH-Phosphorylierung in sezierten Gewebe erforderlich vorgestellt. Wenn möglich, sollte eine kalibrierte TH Phosphorylierung Standard zur Bewertung der Probe TH Phosphorylierung einbezogen werden. Die Probe Last muss in acc nehmenmuam inhärente Stöchiometrie an jedem Phosphorylierungsstelle, so dass der Assay quantifiziert Phosphorylierung innerhalb des dynamischen Arbeitsbereich des Antikörpers verwendet wird. Als abschließende Bemerkung sollte die inhärente Gesamt-Protein kommt in den Assay für jede Probe auch in den Gassen Standardkurve geladen werden. Dies lässt sich leicht mit einem Trägerprotein (zB Rattenleber), die nicht exprimiert TH erreicht.
- . ser19 Von den drei Phosphorylierungsstellen sind ser19 Phosphorylierung Stöchiometrie Ebenen größte in SN und VTA und reicht von 0,15 bis 0,25 2,10,11. Die andere Überlegung ist, dass durch unsere Nachweismethode, ser19 ps im linearen Bereich liegt zwischen 0,5 und 5,0 ng Phospho-ser19 10 quantifiziert. Angesichts dieser Überlegungen wurden insgesamt TH Protein Belastung zwischen 5 und 10 ng (und damit eine geschätzte 0,75 bis 2,5 ng Phospho-ser19 aus der Probe) wäre ein zuverlässiges Maß für ser19 TH Phosphorylierung bieten. Wir verwenden Phosphosolutions primären (Kat. Nr. P1580-19) bei einer Verdünnung von 1:1000.
- . ser31 ser31 Phosphorylierung Stöchiometrie Ebenen sind vergleichsweise weniger in SN und VTA im Vergleich zu ihren verwandten Bereich Terminal Regionen, angefangen von ~ 0,04 bis 0,10 2,4,10,11. Durch unsere Nachweismethode wird ser31 ps im linearen Bereich zwischen 0,5 und 7,0 ng Phospho-ser31 10 erfasst. Angesichts dieser Überlegungen wurden insgesamt TH Protein Belastung zwischen 10 und 30 ng (und damit eine geschätzte 0,50 bis 3,0 ng Phospho-ser31 aus der Probe) würde ein verlässliches Maß für ser31TH Phosphorylierung. Siehe Abbildung 4A zeigt ein Beispiel für ser31 Quantifizierung. Unsere primäre Antikörper ist ein in-house affinitätsgereinigten Antikörper, die von 21. Jahrhundert Biochemikalien, (Boston, MA) hergestellt wurde, und validiert für die Spezifität des phospho-Epitop mit unserer hauseigenen Standards 2.
- ser40 ser40 Phosphorylierung Stöchiometrie Ebenen in SN und VTA Bereich von ~ 0,02 -. 0,06 2,4,10,11. Durch unsere Nachweismethode, sER40 ps in linearer Bereich zwischen 0,2 und 2,0 ng Phospho-ser40 10 erfasst. Angesichts dieser Überlegungen wurden insgesamt TH Protein Belastung zwischen 10 und 30 ng (und damit eine geschätzte 0,20 bis 1,8 ng Phospho-ser40 aus der Probe) würde ein verlässliches Maß für ser40TH Phosphorylierung. Siehe Abbildung 4B zeigt ein Beispiel für ser40 Quantifizierung. Wir verwenden Phosphosolutions primären (Kat. # p1580-40) bei einer Verdünnung von 1:1000.
5. Repräsentative Ergebnisse
- Dopamin im SN vs VTA Es gibt drei Messwerte von Dopamin (oder Metaboliten), die in der quantitativen Analyse entnommen werden können;. Nach insgesamt von der Zerlegung wiedergewonnen, pro Protein, und pro TH-Protein (gezeigt für Striatum, SN, Nucleus accumbens und VTA in Tabelle 1 unten). Insgesamt Dopamin Erholung zwischen SN und VTA ist ziemlich vergleichbar, im Bereich zwischen 6-9 ng für zwei bis drei koronare Schicht Dissektionen 2. Normalisieren Dopamin Erholung an Gesamt-Protein wird zeigen, that, auf die Dissektion Methode eingesetzt, dass der VTA wird mehr Dopamin pro Gesamtprotein haben, im Durchschnitt 6-8 ng / mg Protein in SN und 9-10 ng / mg Protein in VTA-2, 4. Schließlich sollte Normalisierung der Dopamin insgesamt TH gewonnen zeigen auch eine Differenz zwischen SN und VTA, größer in der VTA 10 und zwischen 0,2 und 0,8 ng pro ng Dopamin TH-Protein zwischen den beiden Regionen 2,10.
DA Region Insgesamt DA erholt DA pro mg Protein DA pro ng TH Striatum 214 ± 16 165 ± 13 0,56 ± 0,11 SN 8,4 ± 0,8 6,1 ± 0,5 0,18 ± 0,03 Nucleus accumbens 60 ± 6 75 ± 4 0,77 ± 0,03 VTA 6,0 ± 1,0 9,2 ± 1,4 0,22 ± 0,03 - Insgesamt Proteine: TH, DAT, VMAT2 unter Verwendung des kalibrierten TH-Protein-Standard für die Quantifizierung ist mehr als SN TH in der VTA aus der Dissektion (60 ng in SN und VTA 26 ng in 2) gewonnen. Wenn jedoch an Protein normalisiert, kehrt diese Beziehung mit TH pro Gesamtprotein in der VTA wobei ~ 3 - bis 5-fach größer als in der SN, (~ 0,32 ng / ug Protein in VTA und ~ 0,09 in SN) 4, 10.
Die erwartete Erholung der DAT in SN und VTA ist ähnlich, mit etwas mehr Erholung in der VTA als pro Gesamtprotein oder nach insgesamt 4 TH erholt. Bemerkenswert ist, ist DAT-Protein viel weniger reichlich in diesen Regionen im Vergleich zu den verwandten Bereich Terminal-Bereiche 4 .
VMAT2 Erholung nach Gesamt-Protein ist größer in der VTA im Vergleich zu SN 4. Wenn jedoch die TH-Protein normalisiert, es ist etwas größer Erholung der SN 4. - Site-spezifische TH-Phosphorylierung Von einer Reihe von Studien hat es konsistente Ergebnisse in ser19, ser31, und ser40 Phosphorylierung Menge in der SN und VTA, und auch im Verhältnis zu den verwandten Bereich Terminal-Regionen. Ser19-Phosphorylierung ist vor allem größer in der SN und VTA (~ 0,2-0,3) im Vergleich zum Striatum und Nucleus accumbens (~ 0,05 bis 0,15) 2,4,7,10,11. Ser31-Phosphorylierung ist deutlich weniger in der SN und VTA im Vergleich zu ihren verwandten Bereich Terminal Regionen, wobei ~ 0,06 bis 0,10 zwischen diesen Regionen somatodendritischen 2,4,7,10,11. Bei der Hemmung der aromatischen Säure-Decarboxylase mit NSD-1015, ist eine 2-fache Zunahme der ser31 Phosphorylierung in VTA nur 10. Ser40 Phosphorylierung zwischen 0,02 und 0,05 in der SN undVTA und in der Regel diese Stöchiometrie nicht erheblich von den verwandten Bereich Terminal Regionen 2,4,7,10,11 abweichen.

Abbildung 1. Dopaminerge Auslesen von einem Gewebedissektion.
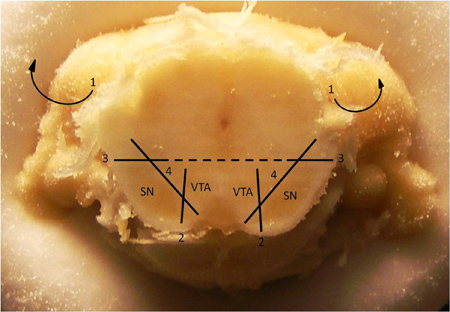
Abbildung 2. Dissektionstechnik zur Isolierung des dopaminergen Mittelhirn Neuropil. Technik zum Präparieren der Substantia nigra (SN) vom ventralen Tegmentum (VTA). 1. Entfernen Sie darüber liegenden Cortex und Hippocampus (diese Strukturen sind bereits in dem obigen Bild wurde entfernt). 2. Einen vertikalen Schnitt Trennen des pigmentierten Bereich der SN von der VTA. 3. Einen waagerechten Schnitt in der Nähe der Mittellinie oberhalb der dorsalen und lateralen größten Teil des SN. 4. Tease die SN weg vom Rest des Hirnstamms. Sobald SN entfernt worden ist, in ähnlicher Weise necken den VTA weg von derRest des Mittelhirns. Hinweis: Dieser Abschnitt wird in der Regel an den Koordinaten, bezogen auf Bregma, bei AP 5,7 beobachtet.

Abbildung 3. Zweite (und letzte) Normalisierung des gesamten Proteins Last-Ponceau S-Färbung für Bild J-Analyse. Ponceau S-Protein-Färbung von insgesamt TH Bestimmung in Substantia nigra der Ratte Proben. Die ersten fünf Bahnen bilden die linken sind die Norm insgesamt TH-Kurve, an denen 28 ug Protein aus Rattenleber-Homogenat wurde hinzugefügt, um das Protein Belastung aus der Substantia nigra Proben spiegeln. Die nächste Spur enthält Molekulargewicht (MW) Marker. Die verbleibenden Spuren enthalten ~ 28μg Protein aus Substantia nigra der Ratte Proben. Die Protein-Lasten von der Proteinkonzentration jeder Probe, die das BCA-Verfahren bestimmt wird. Doch trotz allem, was sollte gleich sein, Lasten, gibt es Unterschiede in der Dunkelheit der Ponceau S-Färbung zwischen den Proben auf eine leichteVariabilität in Proteinkonzentrationen, die durch Normierung mit ImageJ Analyse, um die Menge von Ponceau S-Färbung für jede Probe analysiert wird korrigiert.

Abbildung 4. Vertreter TH Phosphorylierung Ergebnisse von Kontrollen und Behandlungen. Vertreter ser31 phosphorylierte Tyrosin-Hydroxylase (PTH) und PTH-ser40 Western Blots aus Kochsalzlösung und Methamphetamin behandelten Wistar-Ratten aus einer früheren Studie 4. A. Ser 31 PTH in Substantia nigra der Ratte Proben. Die kalibrierten Ser 31 PTH Standardkurve im Bereich von 0,3 ng bis 2,0 ng und im linearen Bereich der Detektion. Auf der Grundlage früherer Western-Blot-Analyse von Gesamt-TH Ebenen wurden 6 ng Gesamt-TH für jede Probe geladen. B. ser40 PTH in Ratten ventralen tegmentalen Proben. Die kalibrierten ser40 PTH Standardkurve im Bereich von 0,2 ng bis 1,5 ng und im linearen Bereich der Detektion. Auf der Grundlage früherer Western-Blot-Analyse von Gesamt-TH Ebenen wurden 9 ng Gesamt-TH für jede Probe geladen.
Diskussion
Wie in Abbildung 1 dargestellt, sollten die oben genannten Methoden liefern mehrfache Auslesen von Dopamin und dessen regulierende Proteine TH, DAT, und VMAT2 aus einer Probe von SN oder VTA entweder aus der Ratte oder der Maus gewonnen. Auch hier sind die Vorteile der Durchführung dieses Protokoll, dass der Prüfer kann operativ abgestimmt, wie die Messwerte von Dopamin in vivo unter nahezu allen experimentellen Paradigma geregelt und dabei sparen erhebliche experimentellen Ressourcen durch Reduzierung der Anzahl der Tiere in jeder gewünschten erhalten Experiment.
Es ist absolut erforderlich, dass der Prüfer Temperaturanforderungen während der Dissektion (4 ° C), Lagerung von Gewebe (mindestens -70 ° C), Gewebe-Beschallung (sofortige Ultraschallbehandlung nach der Entnahme aus Lagertemperatur) in eiskaltem Puffer HPLC auferlegt zu beobachten und anschließende Pelletierung und-verarbeitung. Sobald das Pellet wird mit Ultraschall behandelt und gekocht, in SDS-Lösung können die Proben auch weiterhin FürthER bei Raumtemperatur verarbeitet. Speicherung der archivierten HPLC analysiert und die Probe Probenpuffer vorbereiteten Proben für Protein-Analyse sollte bei -80 ° C liegen
Auch hier ist der große Vorteil des Protokolls der angeborenen Ansatz zur operativ-Spiel Ergebnisse im Zusammenhang mit Dopamin-Regulation in vivo. Darüber hinaus Normalisierung Dopamin-Gewebe-Anzeigen auf Marker des dopaminergen Neuropil (TH, DAT) bieten ein großes Maß an Sicherheit, dass die Ermittler ist Sezieren SN oder VTA mit Konsistenz und Genauigkeit. Angesichts der Beteiligung von Dopamin in der Sucht, psychiatrische Erkrankung, Arenen und Bewegungsapparates, könnte dieses Protokoll in vielen Experimenten eingesetzt werden. Eine bemerkenswerte Einschränkung ist, dass die Auslegung des TH Phosphorylierung Ergebnisse sollte konservativ, da es nicht zu diesem Zeitpunkt das Ausmaß, in dem ein Anstieg der Phosphorylierung an ser31 oder ser40 in vivo zu L-DOPA-Biosynthese zu erhöhen erforderlich ist bekannt. Wie erwähnt, gibt es evidence, dass ser31 Phosphorylierung zu L-DOPA-Biosynthese reguliert wird und eine Rolle bei der Regulierung insgesamt Dopamin Gewebe, deren im ZNS 2,10. Zu diesem Zeitpunkt sind die Standards für TH-Protein und TH Phosphorylierung nicht im Handel erhältlich. Allerdings hat diese Labor gehalten und solche Standards auf diejenigen verwendet werden, wenn das erste Papier auf TH-Phosphorylierung in vivo Regulation 11 veröffentlicht wurde, basiert erweitert. Dennoch ist es möglich, Dopamin Gewebe wiederherzustellenden Inhalt TH Protein in diesen diskreten Bereichen unter Verwendung dieses Protokolls zu normalisieren.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Finanzierung des dieser Arbeit, und zitiert als 2,10 wurde zur Verfügung gestellt, zum Teil durch ein Forschungsstipendium ausgezeichnet zu MF Salvatore von der American Federation for Aging Research, The Edward P. Stiles Trust Fund und des Biomedical Research Foundation Nordwesten von Louisiana, und nach BS Pruett von der Ike Muslow Promotionsstipendium, LSU Health Sciences Center-Shreveport.
Materialien
HPLC-System:
Das Basissystem besteht aus einem Shimadzu LC10-ADVP HPLC-Pumpe, einem Waters WISP 717 automatischen Probengeber, eine 250 x 4,4 mm 5 micron Spherosorb ODS-1 C18 Reverse-Phase-Säule (Waters), einem Bioanalytical Systems (BAS) TL12 Dual glasigen Kohlenstoff-Elektrode, zwei BAS LC4B elektrochemische Detektoren und einem Waters Empower 2 Datenerhebung und-Integration-System.
Die Kolonne wird bei 30-45 ° C gehalten (BAS LC22A Säulenheizung). Die mobile Phase ist 0,1 M Natriumphosphat (pH 3,0), 0,1 mM EDTA, 0,2-0,4 mM 1-Octansulfonsäure (Eastman-Kodak) und 0,35% Acetonitril (v / v), durch einen 0,45 Mikrometer-Filter filtriert. Durchfluss ist von 1,2 ml / min. Vier-Liter-Chargen der mobilen Phase zur Separation durch Einstellen des pH, Octansulfonsäure und Säulentemperatur optimiert. Die mobile Phase zurückgeführt wird, und wird kontinuierlich mit Heliumgas gespült, um gelösten Sauerstoff zu entfernen. Das Recycling der mobilen Phaseist fast unerlässlich für eine gute Auflösung für einen angemessenen Zeitraum aufrechtzuerhalten. Die mobile Phase Haltbarkeit wird unter Verwendung eines Strömungsschalters (gesteuert durch den Integrator) umgeleitet werden, um den ersten 2-7 min jedes Laufs Abfälle gehalten.
Die Elektroden sind bei Potentialen von etwa 0,78 und 0,95 V in Bezug auf eine Referenzelektrode Ag/AgC1 gehalten. Die Elektrode an der höheren Potentialseite ist ausschließlich für die Bestimmung von Tryptophan (und der NMDA-interner Standard) verwendet. Der 0,78-V-Potential bietet eine überlegene Signal-Rausch-Verhältnis für den Nachweis der Monoamine und Verbindungen, andere als Tryptophan. Die Chromatogramme werden auf der Festplatte des Empower-Workstation gespeichert und anschließend bearbeitet und die Daten direkt in eine Excel-Tabelle zur Berechnung der Metabolit Mengen und Zusammenstellung der Gruppe Daten übertragen.
Pumpe: Shimadzu LC-10AD
Cell: BAS Cross Flow. Glassy-Carbon-Arbeitselektrode bei 0,780 und 0,950 V Potential.
Detektor: BAS LC-4B betrieben im Dual Channel Modus.
DATA ACQ. System: Waters Empower Pro 2.
Injektor: Waters WISP 717
Säule: Waters Spherosorb ODS-1, 5 um Partikel, 4,4 mm x 250 mm.
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| Natriumdodecylsulfat (SDS) | - JT Baker | 4095-02 | |
| Trizma Base | Sigma | T1503-1KG | |
| Trizma HCl | Sigma | T3253-1KG | |
| Glycerin | Sigma | G8773-500 ml | |
| PVP-40 | Sigma | PVP40-1KG | |
| dPBS | Gibco | 21600-069 | |
| Tween20 | Sigma | P1379-500 ml | |
| Glycine | Sigma | G8898-1KG | |
| Ponceau S | Fluka | 81460 | |
| Bromphenolblau | Sigma | B8026-5G | |
| Dithiothreitol | Sigma | D-9163 | |
| Protein Standard 2 mg BSA | Sigma | P5619-25VL | |
| Pierce BCA Protein Assay Reagent A | Thermo-Fisher Scientific | 23223 | |
| Precision Plus Protein Standard | Bio Rad | 161-0373 | |
| [125I]-Protein A, spezifische Aktivität | Perkin-Elmer |
Tabelle 2. Spezifische Reagenzien.
| Reagenzien | Formeln |
| 10% SDS | 10 g SDS, 100 ml DI H 2 0 |
| 1% SDS (pH 8,2) |
|
| Kupfer-II-Sulfat-Lösung |
|
| 3X Sample Buffer |
|
| 1x Probenpuffer | Verdünnen Sie 3X Sample Buffer nach unten auf den 1x Probenpuffer mit DI H 2 0 |
| 10X Laufpuffer (Ergibt 4 L) |
|
| 10X Transfer-Puffer: (Ergibt 4 L) |
|
| Ponceau |
|
| 0,2% HCl-Lösung | 5,2 ml HCl in 500 ml DI H 2 0 |
| PVP-T20 Blocking-Lsg. (Ergibt 4 L) |
|
| 10X-Blot-Puffer (Ergibt 4 L) |
|
Tyrosinhydroxylase Standards: Die kalibrierten TH-Protein-Phosphorylierung und Standards, die von diesem Labor verwendet werden, von PC12-Zellextrakten, die für TH Proteingehalt und Phosphorylierung Stöchiometrien gegen eines zuvor kalibrierten TH-Standards, die letztlich ihren Ursprung aus dem Labor von Dr. John Haycock 11 analysiert wurden abgeleitet .
Referenzen
- Trevitt, J. T., Carlson, B. B., Nowend, K., Salamone, J. D. Substantia nigra pars reticulate is a highly potent site of action for the behavioral effects of the D1 antagonist SCH23390 in rat. Psychopharmacology. 156, 32-41 (2001).
- Salvatore, M. F., Pruett, B. S., Spann, S. L., Dempsey, C. Aging reveals a role for nigral tyrosine hydroxylase ser31 phosphorylation in locomotor activity generation. PLoS ONE. 4, e8466 (2009).
- Rossato, J. L., Bevilaqua, L. R. M., Izquierdo, I., Medina, J. H., Cammarota, M. Dopamine controls persistence of long-term memory storage. Science. 325, 1017-1020 (2009).
- Keller, C. M., Salvatore, M. F., Pruett, B. S., Guerdin, G. F., Goeders, N. E. Biphasic dopamine regulation in mesoaccumbens pathway in response to non-contigent binge and escalating methamphetamine regimens in the Wistar rat. Psychopharmacology. 215, 513-526 (2011).
- Lu, L., Dempsey, J., Liu, S. Y., Bossert, J. M., Shaham, Y. A single infusion of brain-derived neurotrophic factor into the ventral tegmental area induces long-lasting potentiation of cocaine seeking after withdrawal. J. Neurosci. 24, 1604-1611 (2004).
- Hoffer, B. J., Hoffman, A., Bowenkamp, K., Huettl, P., Hudson, J., Martin, D., Lin, L. F., Gerhardt, G. A. Glial cell line-derived neurotrophic factor reverses toxin-induced injury to midbrain dopaminergic neurons in vivo. Neurosci. Lett. 182, 107-111 (1994).
- Salvatore, M. F., Zhang, J. L., Large, D. M., Wilson, P. E., Gash, C. R., Thomas, T. C., Haycock, J. W., Bing, G., Stanford, J. A., Gash, D. M., Gerhardt, G. A. Striatal GDNF administration increases tyrosine hydroxylase phosphorylation in the rat striatum and substantia nigra. J. Neurochem. 90, 245-254 (2004).
- Lu, L., Wang, X., Wu, P., Xu, C., Zhao, M., Morales, M., Harvey, B. K., Hoffer, B. J., Shaham, Y. Role of ventral tegmental area glial cell-line derived neurotrophic factor in incubation of cocaine craving. Biol. Psychiatry. 66, 137-145 (2009).
- Lavicky, J., Dunn, A. J. Corticotropin-releasing factor stimulates catecholamine release in hypothalamus and prefrontal cortex in freely moving rats as assessed by microdialysis. J. Neurochem. 60, 602-612 (1993).
- Salvatore, M. F., Pruett, B. S. Dichotomy of tyrosine hydroxylase and dopamine regulation between somatodendritic and terminal field areas of nigrostriatal and mesoaccumbens pathways. PLoS ONE. 7, e29867 (2012).
- Salvatore, M. F., Garcia-Espana, A., Goldstein, M., Deutch, A. Y., Haycock, J. W. Stoichiometry of tyrosine hydroxylase phosphorylation in the nigrostriatal and mesolimbic systems in vivo: Effects of acute haloperidol and related compounds. J. Neurochem. 75, 225-232 (2000).
- Salvatore, M. F., Waymire, J. C., Haycock, J. W. Depolarization-stimulated catecholamine biosynthesis: involvement of protein kinases and tyrosine hydroxylase phosphorylation sites in situ. J. Neurochem. 79, 349-360 (2001).
- Haycock, J. W., Lew, J. Y., Garcia-Espana, A., Lee, K. Y., Harada, K., Meller, E., Goldstein, M. Role of serine-19 phosphorylation in regulating tyrosine hydroxylase studied with site- and phosphospecific antibodies and site-directed mutagenesis. J. Neurochem. 71, 1670-1675 (1998).
- Lindgren, N., Xu, Z. Q., Linskog, M., Herrera-Marschitz, M., Goiny, M., Haycock, J. W., Goldstein, M., Hokfelt, T., Fisone, G. Regulation of tyrosine hydroxylase activity and phosphorylation at ser19 and ser40 via activation of glutamate NMDA receptors in rat striatum. J. Neurochem. 74, 2470-2477 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten