Method Article
פרופיל מקיף של הסדרת substantia nigra הדופמין ואזור Tegmental הגחון
In This Article
Summary
דופאמין הוא מוסדר בבירור בגרעין המוח התיכון, אשר מכילים תאים הגופות דנדריטים של נוירונים דופאמין. כאן נתאר את הגישה לנתיחה ו מדגם הטיפול על מנת למקסם את התוצאות, ולכן מסקנות ותובנות, על ויסות הדופמין בגרעין המוח התיכון של nigra substantia (SN) ואזור tegmental הגחוני (VTA) במכרסמים.
Abstract
דופמין הוא מוליך עצבי למד במרץ מערכת העצבים המרכזית. אכן, את מעורבותה בפעילות של תנועה ותגמול הקשור להתנהגות טיפחה חמישה עשורים החקירה לעניין הליקויים מולקולריים הקשורים תקנה דופמין. רוב אלה שאלות של רגולציה הדופמין במוח המיקוד על הבסיס המולקולרי של ויסות שלה את שדה באזורים מסוף המסלולים nigrostriatal ו mesoaccumbens, הסטריאטום ו הנסמך הגרעין. יתרה מכך, מחקרים אלה התמקדו בניתוח תוכן רקמות דופמין נורמליזציה עם משקל רק רקמות רטוב. חקירת החלבונים המווסתים דופמין, כגון hydroxylase החלבון טירוזין (ה '), זירחון TH, טרנספורטר דופאמין (DAT), ו טרנספורטר אוקסידאז שלפוחי 2 (VMAT2) חלבון לעתים קרובות אינם כוללים ניתוח של תוכן רקמות הדופמין מדגם זהה. היכולת לנתח את תוכן הן רקמות דופאמין חלבונים המסדירים שלה (כולל פוסט traשינויים nslational) לא רק נותן כוח אינהרנטי לפרש את הקשר של דופמין עם רמת חלבון והתפקוד של TH, DAT, או VMAT2, אלא גם מרחיב את הכלכלה המדגם. זה מיתרגם עלות פחות, ובכל זאת מייצרת תובנות תקנה המולקולרי של הדופמין הפרדיגמה כמעט כל בחירה של החוקרים.
אנו מתמקדים בניתוח של המוח התיכון. למרות SN ו VTA מוזנחים בדרך כלל רוב המחקרים תקנה דופמין, גרעינים אלה גזור בקלות עם הפרקטיקה. Readout מקיפה של תוכן רקמות TH דופאמין, DAT, או VMAT2 ניתן לבצע. שם הוא המתפתחת ספרות על ההשפעה של תפקוד הדופאמין SN ו VTA על ההתנהגות, ועל הפרעות וחדירות חיצוניות של חומרים חיצוניים או תהליכי מחלה החלים בהם 1-5. יתר על כן, תרכובות כגון גורמי גדילה יש השפעה עמוקה על חלבונים דופאמין דופאמין מווסת במידה יחסית רבה יותר SN או VTA אנו מדגימים את הטכניקה לנתיחה כדי לבודד אותם גרעינים 2 ו עיבוד דגימת רקמה גזור שמייצר פרופיל חושף מנגנונים מולקולריים תקנה דופמין in vivo, ספציפיות עבור כל גרעינים (איור 1).
Protocol
1. בתור
- על מצע של קרח רטוב, לצנן המוח מכרסם מטריקס (סעיפים העטרה הפרדה 1 מ"מ זה מזה), צלחת פטרי המכילה 5 סכיני גילוח, ו # 11 אזמל. בכלי נפרד, במקום הנקרא 2 גודל מ"ל צינורות microfuge אל קרח יבש.
- החוקר יבחר את השיטה של המתת חסד. יש לנו תוצאות לשחזור מבצעים הרדמה קצרה מאוד isoflurane, באופן אידיאלי, מאדה יש להשתמש. עם זאת, אם לא זמין, אנו משתמשים צנצנת סוללה גדולה ובה פלטפורמה. צנצנת עם מכסה הסוללה נמצא האיוורור תאושר, להציב לוח isoflurane רווי גזה מתחת פלטפורמה ומחכה 3-5 דקות כדי לאפשר isoflurane כדי להרוות את הצנצנת הסוללה. מניחים את החולדה בתוך ולהסיר את עריפת הראש ברגע עכברוש איבד את הכרתו. במהירות להסיר את המוח (באופן אידיאלי תחת שתי דקות), לשטוף במים קרים, ומניחים מיד את מטריצת מכרסם צונן המוח.
- רגע אחד אחרי המיקוםמחודשת של המוח לתוך מטריקס, הכנס סכיני גילוח קר אל המוח מקורר, החל בסביבות 2 מ"מ מקורי אל הצומת האופטי אם הסטריאטום ו הנסמך גרעין הם הרצויה לניתוח בנוסף גרעינים המוח התיכון. המשך החדרת סכיני גילוח קרים עם כל מקטע 1 מ"מ עד שהגיע באמצע פונס, מועד את המיקום של כל להב הסכין לאחר מכן, כדי להקל על פינוי קל יותר של להב בנפרד.
- כאשר מוציאה את סכיני גילוח, לחפש התחלה של ההיפוקמפוס. כאשר היא עטופה כולה סביב המוח התיכון, להתחיל לקחת חלקים באמצעות סכין # 11 אזמל, כפי שמודגם באיור 2.
- מיד למקם את רקמת גזור לתוך הצינור מראש מקורר microfuge על קרח יבש. בחולדה, מצפים להיות מסוגלים לנתח SN ו VTA מתוך מינימום של שתי פרוסות העטרה ועד למקסימום של 3. החנות רקמות ב -80 ° C עד מוכן לעיבוד.
2. בדיקת רקמות: HPLC ואו דופאמין מטבוליטים
לקבלת מידע מלא על ציוד ותחזוקה HPLC, עיין ניתוח HPLC בסוף כתב היד.
- בעדינות homogenize רקמות מיד לאחר הוצאתו קרח יבש באמצעות קר כקרח פתרון 0.1 4-M EDTA HClO (0.1 מ 'HClO 4 & 0.1 mM EDTA) 9, המכיל N-methyl דופמין בריכוז של 20 ננוגרם / מ"ל המשמש תקן פנימי להבראת מדגם במהלך ניתוח HPLC. Homogenizer אנו משתמשים הוא Sonifier ברנסון 150, כאשר רמת 10% של כוח מלא (1 מתוך 10). הכרכים sonication הבאות מומלצות:
בחולדה, SN = 250 μl (דיסקציה חד צדדית), 400 μl (דיסקציה דו צדדי), VTA = 200 (דיסקציה חד צדדית) μl, 400 μl (דיסקציה דו צדדי).
בשנת העכבר, (והניתוחים הבילטרליים בלבד), SN = 200 μl, VTA = 200 μl. - לאחר homogenization, החזק דגימות על קרח יבש. דוגמאות אז centrifuged (דופונט Sorvall Microspin 24S) בסל"ד 12,000 ל משקעים חלבון גלולה לשמש קביעות כתם המערבי. Supernatants מוזרקים ישירות לתוך HPLC. הכרכים הבאים הזרקת מומלץ ניתוח מדויק חולדה או עכבר: (. מתוך הכנה או) SN = 150 (. מ מכין גם), VTA = 160 μl
- תקן מלאי מוכן של 1 מ"ג / מ"ל על ידי הוספת כמות מתאימה של monoamines מטבוליטים * רכיב דופמין לחומצה 0.1 perchloric M 0.1 mM EDTA. ריכוז של מתחם זה הוא 1 מ"ג / מ"ל למעט טריפטופן המהווה 5 מ"ג / מ"ל. תקן המניה מחולק 10 aliquots μl ומאוחסנים ultralow עד הצורך.
* משקל כל מתוקנות של הטופס מלח של המתחם אם ישים.
להכין תקן עובד על ידי דילול aliquot 10 μl של תקן המניות 100 מ"ל של תמיסת חומצה perchloric. ריכוז תקן עובד הוא 0.1 מיקרוגרם / מ"ל למעט טריפטופן שהיא 0.5 מיקרוגרם / מ"ל. 50 μl שלתקן זה עובד מוזרק HPLC בסכום על טור של 5 ננוגרם של כל רכיב, פרט טריפטופן המהווה 25 ng. - קביעת התאוששות דופאמין בתוך aliquot מדגם:
ישנם מספר שלבים המעורבים לקבוע את ההתאוששות דופמין מ aliquot המדגם. - ראשית, יש לחלק את גובה שיא דופמין המדגם על ידי גובה שיא דופמין ברמה ולהתרבות זה היחס של הסכום הכולל (ng) של דופמין בתקן. ריכוז הדופאמין הרגיל שלנו הוא 0.1 μL ng / μL ו 50 של תקן זה ושם ישקלו לו ויעריכו. לפיכך, כמות הדופמין תקן הוא 5 ng. לכן, המשוואה למטה ניתן להשתמש להחלמה דופמין נקבע במדגם נתון:
(גובה שיא הדופמין גובה מדגם / דופמין השיא בתקן) * 5 ng - תיקון על אובדן של המדגם באמצעות דופמין פנימי רגילה N-methyl:
התאוששות ממשית של דופמין N-methyl מחושב באותו אופן כמו דופאמין על ידי חלוקת N-methyl DOPאמין גובה שיא במדגם על ידי גובה N-methyl דופמין השיא של תקן ומתרבים זה היחס של הסכום הכולל (ng) של דופמין N-methyl בתקן. כמו דופאמין, N-מתיל בריכוז הרגיל שלנו דופמין הוא 0.1 ng / μL. 50 μL של תקן זה ושם ישקלו לו ויעריכו. לכן, את כמות הדופמין N-methyl ברמת היא 5 ng. לכן, המשוואה למטה ניתן להשתמש כדי לקבוע N-methyl התאוששות דופמין במדגם נתון:
(N-מתיל השיא דופמין גובה במדגם / N-methyl השיא דופמין גובה סטנדרטי) * 5ng
עם זאת, כי דופאמין N-methyl במדגם זה לא בא מן המדגם עצמו אלא למאגר HPLC, כמות הדופמין N-methyl הצפוי מדגם זה מחושב. ריכוז N-methyl הדופמין HPLC המאגר הוא 20 ng / mL או 0.02 ng / μL, ולכן הסכום הצפוי של דופמין מתיל N במדגם זה נמצא על ידי הכפלת ריכוז N-methyl דופמין מאגר HPLC על פי היקף aliquot של מדגם זה משמש HPLC ניתוח. זו באה לידי ביטוי במשוואה הבאה:
(0.02 ng / μL) * (נפח aliquot המדגם המשמש ניתוח HPLC) - ההבדל בין דופמין N-methyl צפוי התאושש לאחר מכן ניתן להשתמש כדי לתקן בסכום של דופמין התאושש לאחר ניכוי בגין אובדן המדגם. כל שעליך לעשות הוא לקחת את היחס בין דופמין N-methyl הצפוי / התאושש N-methyl דופאמין להכפיל את זה על ידי כמות הדופמין התאושש. לכן, המשוואה כוללת בסך של הדופמין aliquot המדגם היא כדלקמן:
(גובה שיא הדופמין גובה מדגם / דופמין השיא בתקן) * (N-מתיל השיא דופמין גובה בגובה סטנדרטי / N-methyl דופמין השיא במדגם) * (0.02 ng / μL) * (נפח aliquot המדגם המשמש HPLC ניתוח ) - דופמין סה"כ התאושש מדגם:
הערך של דופמין התאושש aliquot מדגם לאחר מכן נעשה שימוש כדי להסיק את הסכום הכולל של דופמין במדגם נתון. הדבר נעשה על ידי חלוקת סכום התאושש (ng) oו התובע על פי היקף aliquot ומתרבים ערך זה על פי היקף הכולל של המאגר HPLC כי המדגם היה sonicated פנימה זו ניתנת על ידי המשוואה הבאה:
(כמות (ng) של דופמין במדגם aliquot / נפח aliquot המדגם) * (סך היקף המאגר HPLC שלתוכו המדגם sonicated).
הקורא נקרא המחקרים הבאים 2,4,10 עבור מצגת מקיפה של הערכה של דופאמין מטבוליטים יחד עם readouts של דופמין ויסות חלבונים לא רק SN ו VTA, אך הנסמך הסטריאטום ואת הגרעין גם כן.
3. בדיקת רקמות: נורמליזציה סה"כ חלבון והאחרון של תוצאות ה ו DAT
- מניחים את כדורי חלבון שזירזו (נגזר הטיפול חיץ HPLC) אל קרח רטוב כדי לשמור על 4 ° C. להבטיח כי כל חיץ הוסר ו בארכיון (אם נדרש ניתוח מאשרות). אם SN או VTA הוא להיות מעובד באופן בילטרלי (עכבר בלבד), להוסיף 300 μL (SN) או 200 μL (VTA) של 1% SDS המכיל 5 מ"מ טריס (pH 8.3) ו 1 mM EDTA כדי גלולה ו sonicate. הוספת 150 μL של פתרון SDS ל SN כדורי או 100 μl אל כדורי VTA אם עיבוד רקמה והניתוחים חד צדדיים.
- מניחים את הדגימות במים רותחים הקרוב ~ 5 דקות כדי להשלים denaturation חלבון להתקרר לטמפרטורת החדר. להבטיח כמוסות מוחזקים היטב בשלב זה.
- קביעת ריכוז חלבון בדגימות באמצעות assay BCA, כולל עיקול חלבון תקן (סטנדרט אלבומין) בטווח של 2-40 מיקרוגרם חלבון. 5 assay μl היקף המדגם בשלושה עותקים ולהשתמש הערך החציוני לקבוע כמות חלבון על עקומת סטנדרטי. מחלקים לפי נפח assay ריכוז החלבון. הערה זו היא הראשונה של שני הצעדים שננקטו על נרמול TH הכולל, DAT, ו VMAT2 תוצאות חלבון להחלמה מוחלטת.
- הכן את הדוגמאות עם חיץ המדגם (המכיל dithiothreitol) להפחתת-SDS אלקטרופורזה על acrylamide גרם 10%אלס. באופן אידיאלי, ריכוז החלבון הסופי הכולל צריך להיות ~ 2 מיקרוגרם / μl. הסיבה לבחירה זו היא להפחית את ריכוז נפח דגימה הכרחי להגדרה הסופית של זירחון TH, כמו ~ 100 מיקרוגרם של חלבון הכולל יהיה צורך לטעינת לכמת במדויק ser31 ו ser40 זירחון TH. אם הצבע הצהוב נראה במדגם לאחר הוספת המאגר מדגם, המדגם הוא חומצי מדי. הוסף 1 M Tris (pH 8.2) ב -10 במרווחים μl עד בצבע כחול משוחזר.
- הכן את הדוגמאות כדלקמן על קביעות אלה של דופמין ויסות חלבונים:
- TH: על תקן מכויל לחלבון TH (כמו נ"ג), ריכוז של TH (כמו TH לכל ng לכל חלבון מיקרוגרם הכל) ב SN צפוי לנוע בין 0.05-0.27 ~ TH ng לכל חלבון מיקרוגרם סך 2,4, 7,10,11. על עקומת TH ליניארי רגיל, החל 0.5-5.0 ng TH באמצעות נוגדנים העיקרי TH (החתול Millipore # AB152, 1:1000 דילול ב PVP Tפתרון חסימת -20) אשר מייצר עקומה ליניארית רגילה, עומס אופטימלי של החלבון הכולל SN צריך להיות ~ 10 מיקרוגרם. ריכוז של TH ב VTA נע בין 0.4 ל TH ~ 1.0 ננוגרם לכל חלבון מיקרוגרם 4,11. כך, עומס חלבון הכולל VTA צריך להיות ~ 5 מיקרוגרם.
- DAT: הכמויות היחסיות של DAT ב SN או VTA באופן משמעותי פחות, כי בתחום האזורים מאותו מקור מסוף של הסטריאטום ואת הגרעין הנסמך 4. הביטוי היחסי של DAT כמו מנורמל לחלבון TH התאושש גם נמוך משמעותית SN ו VTA. בהתאם לכך, המון חלבון לכימות חלבונים DAT ב SN VTA או צריך להיות הרבה יותר גדול לעומת המון דוגמאות של האזורים שדה סופניים. מינימום של 30 מיקרוגרם של חלבון הכולל דרוש דיוק DAT ההערכה VTA ואת עומס נומינלי של 50 מיקרוגרם חלבון הכולל הוא הצורך בהערכה של SN. הנוגדן העיקרי בשימוש הוא סנטה קרוז, חתול # SC-1433.
- VMAT2: ביטוי VMAT2, מנורמל לגבי חלבון בסך הכל, היא רבה יותר מאשר באזורים mesoaccumbens nigrostriatal. עם זאת, ביחס TH ביטוי, ביטוי VMAT2 הוא הגדול ביותר SN והפחות בסטריאטום 4. שימוש סנטה קרוז החתול # SC-15314, עומס נומינלי כולל של חלבון ~ 40 מיקרוגרם כדי להיות הטוב ביותר עבור כימות VMAT2.
- הפעל את הכמות המתאימה של חלבון הכולל שימוש SDS-PAGE על ג'ל acrylamide 10%. ביו רד הפושט צורה ולובש צורה היחידה השנייה אלקטרופורזה משמשת את קביעות, אשר היא תבנית ג'ל גדול. להעביר את החלבונים על nitrocellulose בגודל מיקרומטר 0.45 הנקבוביות. העברה, מיכל Hoeffer מוגדר לפחות 27 וולט מאפשר העברת להתרחש בין לילה.
- אפשר כתמים את להתייבש לפחות 30 דקות, ואז הכתם בתמיסה S Ponceau (1% Ponceau S בחומצה אצטית קרחונית 5%) עבור ~ 5 דקות. De-כתם במרץ פתרון HCl 0.2% עד להקות חלבון בודדים בבירור לפתור מכתים הרקע יוסר. להשיג תמונה של Ponceau S כתםing באמצעות J תמונה עוד יותר לכמת המון חלבון יחסית במסלול כל לנרמל TH, DAT, או VMAT2 התוצאות (איור 3).
4. בדיקת רקמות: אתר ספציפי זירחון TH
זירחון של TH ב ser31 או ser40 יכולים להגדיל את L-DOPA ביוסינתזה בתאים catecholaminergic 12. למרות כמות זירחון בכל אתר יש צורך להגדיל את L-DOPA ביוסינתזה של אזורים במוח כמו דופאמין SN ו VTA לא הוקמה, יש ראיות כי ser31 זירחון משחק תפקיד משמעותי בוויסות L-DOPA ביוסינתזה 10 ושיתוף משתנה עם התובע רקמת תוכן בין הסטריאטום, הגרעין הנסמך, SN, ו VTA 2, 10. עם זאת, הכללת ser40 קביעות נחוצים, כמו מחקרים רבים מראים את זה יכול להשפיע על פעילות TH, במיוחד אם הסף של זירחון הוא הגיע 12.
בעוד ser19 phosphorylatiאינה משפיעה על פעילות TH לבד 13,14, זה יכול להיחשב סנטינל עבור Ca 2 + תלויות איתות נוירון התובע, לאור העובדה תאי Ca 2 + יש להגביר את ser19 זירחון תחת depolarizing התנאים 12. יתר על כן, קיים מתאם חיובי מובהק של זירחון ser19 עם זירחון ser31 רק SN ו VTA 10, המציינת כי ser19 מצב זרחון יכול להשפיע ser31 זירחון, וכך בעקיפין L-DOPA ביוסינתזה.
עומס לדוגמא השיקולים כימות אופטימלי של stoichiometry אתר ספציפי TH זירחון: להלן, השיקולים הנדרשים קביעות מדויקות ומדויק של זירחון באתר ספציפי TH ברקמות גזור מוצג. במידת האפשר, זירחון מכויל תקן TH יש לכלול הערכה של זירחון מדגם TH. מטען מדגם חייבת להביא ACCstoichiometry ount הטמון בכל אתר זירחון כך assay מכמת זירחון בטווח העבודה הדינמי של הנוגדן בשימוש. בתור הערה סופית, חלבון הכולל הגלום נכנס assay עבור מדגם זה יש לטעון גם את נתיבי עקומות סטנדרטיות. זו מושגת בקלות עם חלבון נשא (כגון בכבד חולדה), שאינה להביע TH.
- . ser19 מבין שלושת אתרי זרחון, ser19 stoichiometry רמות זרחון הם הגדולים ביותר ב SN ו VTA, החל 0.15-0.25 2,10,11. השיקול השני הוא כי על ידי שיטת הזיהוי שלנו, ser19 PS הוא לכמת בטווח ליניארי בין 0.5 ו - 5.0 ng phospho-ser19 10. לאור שיקולים אלה, TH הכולל חלבון עומס בין 5 ל 10 ננוגרם (ובכך 0.75 מוערך - 2.5 phospho-ser19 ng מן המדגם) יספק אמצעי אמין של זירחון ser19 TH. אנו משתמשים Phosphosolutions העיקרי (קט '# p1580-19) בדילול 1:1000.
- ser31. ser31 stoichiometry רמות זרחון הם יחסית פחות SN ו VTA לעומת שדה מאותו מקור שלהם באזורים סופניים, החל ~ 0.04-0.10 2,4,10,11. לפי שיטת הזיהוי שלנו, ser31 PS מזוהה בטווח ליניארי בין 0.5 ו - 7.0 ng phospho-ser31 10. לאור שיקולים אלה, TH הכולל חלבון עומס בין 10 ל 30 ננוגרם (ובכך 0.50 מוערך - 3.0 ננוגרם phospho-ser31 מן המדגם) יספק אמצעי אמין של זירחון ser31TH. ראו תרשים 4 א למשל של כימות ser31. הנוגדן העיקרי שלנו הוא בתוך הבית זיקה-מטוהרים נוגדנים אשר מיוצרים על ידי 21 המאה ביוכימיקלים רחוב (בוסטון, MA), תוקף את הספציפיות phospho-epitope באמצעות סטנדרטים בתוך הבית שלנו 2.
- ser40 ser40 stoichiometry זרחון רמות SN טווח VTA מ ~ 0.02 -. 0.06 2,4,10,11. לפי שיטת הזיהוי שלנו, שלer40 PS מזוהה בטווח ליניארי בין 0.2 ו -2.0 ננוגרם phospho-ser40 10. לאור שיקולים אלה, TH הכולל חלבון עומס בין 10 ל 30 ננוגרם (ובכך 0.20 מוערך - 1.8 ננוגרם phospho-ser40 מן המדגם) יספק אמצעי אמין של זירחון ser40TH. ראה 4B דמות למשל של כימות ser40. אנו משתמשים Phosphosolutions העיקרי (קט '# p1580-40) בדילול 1:1000.
5. נציג תוצאות
- הדופמין SN לעומת VTA ישנם שלושה readouts של דופאמין (או מטבוליטים) שניתן לנקוט על ניתוח כמותי,. לפי סך התאושש לנתיחה, לכל חלבון, לכל חלבון TH (הדגים הסטריאטום, SN, הנסמך גרעין, ו VTA בטבלה 1 להלן). התאוששות מוחלטת בין דופמין SN ו VTA דומה למדי, הנעים בין 6-9 ng עבור שניים עד שלושה והניתוחים פרוסה העטרה 2. נרמול התאוששות דופמין לחלבון סך יראה thaלא, בהתבסס על שיטת לנתיחה מועסק, כי VTA תהיה גדולה יותר דופמין לכל חלבון בסך הכל, ממוצע של 6-8 נ"ג / מ"ג חלבון SN ו 9-10 ng / חלבון מ"ג 2 VTA, 4. לבסוף, נורמליזציה של דופמין TH הכולל התאושש צריך גם לחשוף את ההבדל בין SN ו VTA, להיות יותר VTA 10, ונעה בין 0.2 ו - 0.8 ננוגרם לכל חלבון דופמין TH ng בין שני אזורים 2,10.
התובע באזור סה"כ התובע התאושש התובע לכל חלבון מ"ג התובע לכל ng TH הסטריאטום 214 ± 16 165 ± 13 0.56 ± 0.11 SN 8.4 ± 0.8 6.1 ± 0.5 0.18 ± 0.03 גרעין ACcumbens 60 ± 6 75 ± 4 0.77 ± 0.03 VTA 6.0 ± 1.0 9.2 ± 1.4 0.22 ± 0.03 - חלבונים סה"כ: ה, DAT, VMAT2 באמצעות חלבון מכויל תקן TH על כימות, TH יותר הוא התאושש ב SN מ VTA מ לנתיחה (60 ng ב SN ו 26 ng ב VTA 2). עם זאת, כאשר מנורמל לחלבון, מערכת יחסים זו הופכת, עם TH לכל חלבון סך VTA להיות ~ 3 - עד פי 5 יותר מאשר SN, (~ 0.32 ng / מיקרוגרם חלבון VTA ו ~ 0.09 ב SN) 4, 10.
התאוששות צפויה של DAT ב SN ו VTA דומה, עם התאוששות מעט יותר VTA לפי חלבון הכולל או לפי TH הכולל התאושש 4. יש לציין כי חלבון DAT הרבה פחות בשפע באזורים אלה לעומת שדה האזורים מאותו מקור Terminal 4 .
VMAT2 התאוששות לפי חלבון הכולל הוא גדול יותר לעומת VTA SN 4. עם זאת, כאשר מנורמל לחלבון TH, יש התאוששות קלה יותר SN 4. - אתר ספציפי זירחון TH ממספר מחקרים, היו תוצאות עקביות ב ser19, ser31, ו ser40 כמות זירחון של SN ו VTA, וגם ביחס לאזורים שדה מאותו מקור סופניים. Ser19 זירחון הוא בעיקר יותר SN ו VTA (~ 0.2-0.3) לעומת הסטריאטום ואת הגרעין הנסמך (~ 0.05-0.15) 2,4,7,10,11. Ser31 זירחון באופן משמעותי פחות SN ו VTA לעומת שדה באזורים שלהם מאותו מקור הטרמינל, להיות ~ 0.06-0.10 בין אזורים somatodendritic 2,4,7,10,11. במהלך עיכוב של decarboxylase חומצה ארומטי עם NSD-1015, יש עלייה של פי 2 זירחון ser31 ב VTA רק 10. Ser40 זרחון נע בין 0.02 לבין 0.05 ב SN וVTA ובאופן כללי stoichiometry זה אינו שונה באופן משמעותי מהשטח אזורים מאותו מקור מסוף 2,4,7,10,11.

באיור 1. Readouts דופאמין מ לנתיחה 1 רקמות.
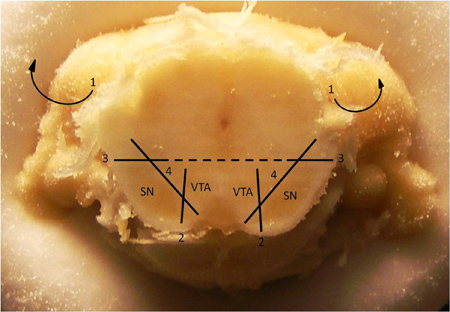
2. איור Dissection טכניקה לבודד neuropil המוח התיכון דופאמין. טכניקה substantia nigra לנתח (SN) מאזור tegmental הגחוני (VTA). 1. הסרת הקליפה שמעליה ואת ההיפוקמפוס (מבנים אלה כבר הוסרו בתמונה למעלה). 2. לעשות חתך אנכי המפריד בין אזור פיגמנט של SN מ VTA. 3. לעשות חתך אופקי או ליד קו האמצע מעל רוב הגב וגם לרוחב של SN. 4. להקניט SN הרחק משאר גזע המוח. לאחר SN הוסר, בדומה להקניט VTA מןשאר המוח התיכון. הערה: חלק זה הוא נצפה בדרך כלל קואורדינטות, ביחס גבחת, ב AP 5.7.

איור 3. השני (והאחרון) נורמליזציה של מכתים חלבון הכולל S עומס Ponceau לניתוח J תמונה. חלבון מכתים Ponceau S להגדרה TH הכולל דגימות substantia nigra חולדה. הראשון חמישה נתיבים משמאל הם מהווים את עקומת סטנדרט TH הכולל, אשר מיקרוגרם חלבון 28 מ homogenate בכבד חולדה נוספה לשקף את עומס חלבון מן דגימות nigra substantia. המסלול הבא מכיל מולקולרית (MW) סמנים משקל. בסמטאות הנותרים מכילים חלבון ~ 28μg מ עכברוש substantia nigra דגימות. טוען את חלבון מבוססים על ריכוז החלבון של מדגם זה, כפי שנקבע על ידי שיטת BCA. עם זאת, למרות מה צריך להיות שווה המון, יש וריאציות בחשכת מכתים S Ponceau בין דגימות המצביעים קלההשונות בריכוזי חלבון, אשר תוקנה על ידי נורמליזציה באמצעות ניתוח ImageJ לנתח את כמות מכתים S Ponceau עבור מדגם זה.

איור 4. ה נציג זרחון תוצאות הבקרה וטיפולי. נציג ser31 hydroxylase טירוזין phosphorylated (PTH) ו ser40 כתמים PTH מערביים של חולדות שטופלו מליחים מתאמפטמין Wistar מהמחקר הקודם 4. א ser 31 PTH בחולדה substantia nigra דגימות. את מכויל סר 31 טווחי PTH עקומת סטנדרטיים מ 0.3 ל 2.0 ng ng והוא בטווח ליניארי של זיהוי. בהתבסס על הניתוח הקודם כתם המערבי של רמות ה בסך הכל, 6 ננוגרם של TH סך הועמסו על מדגם זה. ב ' ser40 PTH בדגימות חולדה tegmental הגחון. את מכויל ser40 טווחי PTH עקומת סטנדרטיים מ ng 0.2 עד 1.5 ננוגרם והוא בטווח ליניארי של זיהוי. בהתבסס על הניתוח הקודם כתם המערבי של רמות ה בסך הכל, 9 ng של TH סך הועמסו על מדגם זה.
Discussion
כפי שמתואר באיור 1, השיטות שפורטו לעיל צריך להניב readouts רבים של דופאמין ויסות שלה חלבונים ה, DAT, ו VMAT2 ממדגם אחד או SN VTA לקבל חולדה או עכבר. שוב, היתרונות של ביצוע זה הן כי פרוטוקול החוקר יכול להשיג readouts מבצעית המותאמות של כמה דופמין מוסדר in vivo תחת הפרדיגמה כמעט כל ניסיוני, ובכך לחסוך משאבים ניסויים משמעותיים על ידי הפחתת מספר בעלי החיים הנדרש בכל הניסוי.
זה חובה על החוקר לבחון דרישות טמפרטורה שהוטלו במהלך דיסקציה (4 ° C), אחסון של רקמה (לפחות -70 ° C), sonication רקמות (sonication מיידית לאחר הוצאתו טמפרטורת אחסון) ב קר כקרח חיץ HPLC ו לאחר היווצרות גלולה ועיבוד. פעם גלולה הוא sonicated והרתיח בפתרון SDS, הדגימות יכול להמשיך להיות פירטאה מעובד בטמפרטורת החדר. אחסון בארכיון של HPLC ניתח מדגם החיץ מדגם דגימות מוכנות לניתוח החלבון צריך להיות -80 ° C.
שוב, היתרון הגדול של הפרוטוקול הוא הגישה מולדת מבצעית בהתאמה תוצאות הנוגעים תקנה דופמין in vivo. יתר על כן, נרמול readouts רקמות דופמין סמנים של neuropil דופאמין (TH, DAT) המספקים מידה רבה של ביטחון כי החוקר הוא לנתח SN או VTA עם עקביות ודיוק. לאור מעורבותם של הדופמין ההפרעה, התמכרות פסיכיאטרי, ועל זירות של תנועה, פרוטוקול זה יכול להיות מועסק בניסויים רבים. מגבלה אחת ראויה לציון היא כי הפרשנות של התוצאות זרחון ה צריך להיות שמרני, כפי שהוא אינו ידוע בשלב זה עד כמה גידול זירחון על ser31 או ser40 נדרש in vivo להגדיל L-DOPA ביוסינתזה. עם זאת, כאמור, יש EVidence כי ser31 זירחון מופיע להסדיר L-DOPA ביוסינתזה ויש לו תפקיד בוויסות תוכן הכולל רקמות הדופמין את מערכת העצבים המרכזית 2,10. בשלב זה, סטנדרטים חלבון וה זירחון TH אינם זמינים באופן מסחרי. עם זאת, במעבדה זו מקיימת והרחיב סטנדרטים כאלה המבוססים על אלו המשמשים כאשר העיתון הראשון על ויסות TH זירחון in vivo פורסם 11. ובכל זאת, אפשר לנרמל את התוכן רקמות דופמין לחלבון TH התאושש אלה אזורים נפרדים תוך שימוש בפרוטוקול זה.
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
מימון עבור עבודה זו, וכפי שצוטט 2,10, נקבע, בין השאר, על ידי פרסים מחקר להעניק MF סלווטורה של הפדרציה האמריקאית לחקר הזיקנה, אדוארד פ 'סטיילס אמון הקרן ביו קרן המחקר של מערב לואיזיאנה, וכדי BS פרואט מן אחוות אייק Muslow Predoctoral, LSU למדעי הבריאות מרכז, Shreveport.
Materials
HPLC המערכת:
המערכת הבסיסית כוללת משאבה LC10-ADvp HPLC Shimadzu, ווטרס 717 Wisp אוטומטית מדגם ההזרקה, 250 X 4.4 מ"מ 5 מיקרון Spherosorb ODS-1 טור C18 הפוך שלבים (ווטרס), מספר מערכות Bioanalytical (BAS) TL12 זכוכית כפולה אלקטרודות פחמן, שני באס LC4B גלאי אלקטרו, וכמה ווטרס העצמת 2 על איסוף מידע מערכת אינטגרציה.
עמודה נשמר 30-45 מעלות צלזיוס (BAS דוד LC22A עמודה). בשלב הנייד הוא 0.1 סודיום פוספט M (pH 3.0), 0.1 mM EDTA, 0.2-0.4 mM 1-אוקטן חומצה sulfonic (איסטמן קודאק-), ו אצטוניטריל 0.35% (V / V), מסונן באמצעות מסנן 0.45 מיקרון. קצב הזרימה הוא של 1.2 מ"ל / דקה. ארבע קבוצות ליטר בשלב ניידים מותאמים הפרדות על ידי התאמת ה-pH, חומצה אוקטן sulfonic וטמפרטורה העמודה. בשלב ניידים ממוחזרים, והוא מטוהר ברציפות עם גז הליום להסיר החמצן המומס. מיחזור שלב סלולריהכרחי כמעט כדי לשמור על רזולוציה טובה למשך זמן סביר. בשלב הנייד חיי מדף נשמר באמצעות בורר זרימת (בשליטת אינטגרטור) להסיט לבזבז דקות 1 2-7 של כל סיבוב.
האלקטרודות מתוחזקים על פוטנציאל של כ 0.78 ו 0.95V לגבי האלקטרודה Ag/AgC1 התייחסות. האלקטרודה על פוטנציאל גבוה יותר משמש אך ורק לקביעת טריפטופן (ורמת פנימי NMDA). הפוטנציאל 0.78 V מספק אות מעולה יחס רעש כדי לאתר את monoamines ותרכובות, למעט טריפטופן. Chromatograms מאוחסנים על הכונן הקשיח של תחנת העבודה העצמת, ומעובד לאחר מכן והנתונים מועברים ישירות לתוך גיליון אלקטרוני של Excel לצורך חישוב כמויות מטבוליט ו אוסף של נתונים קבוצתיים.
משאבת: Shimadzu LC-10AD
נייד: זרימה BAS קרוס. הפחמן מזוגגות עובד האלקטרודה על 0.780 ו 0.950 פוטנציאל V.
גלאי: BAS LC-4B פעל במצב ערוץ כפול.
נתונים ACQ. מערכת: ווטרס העצמת Pro 2.
מזרק: Wisp ווטרס 717
טור: ווטרס Spherosorb ODS-1, 5 החלקיקים מיקרומטר, 4.4 מ"מ X 250 מ"מ.
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | |
| Dodecyl נתרן סולפט (SDS) | - JT בייקר | 4095-02 | |
| מאגר Trizma | סיגמא | T1503-1 ק"ג | |
| Trizma HCl | סיגמא | T3253-1 ק"ג | |
| גליצרול | סיגמא | G8773-500 מ"ל | |
| PVP-40 | סיגמא | PVP40-1 ק"ג | |
| dPBS | Gibco | 21600-069 | |
| Tween20 | סיגמא | P1379-500 מ"ל | |
| גליצין | סיגמא | G8898-1 ק"ג | |
| Ponceau S | Fluka | 81460 | |
| Bromophenol כחול | סיגמא | B8026-5G | |
| Dithiothreitol | סיגמא | D-9163 | |
| חלבון רגיל 2 מ"ג BSA | סיגמא | P5619-25VL | |
| פירס Assay BCA חלבון מגיב | תרמו פישר סיינטיפיק | 23223 | |
| Precision פלוס רגיל חלבון | ביו רד | 161-0373 | |
| [125I], חלבונים, פעילות ספציפית | פרקין אלמר, |
טבלה 2. חומרים כימיים ספציפיים.
| ריאגנטים | נוסחאות |
| 10% SDS | 10 גרם SDS, 100 מ"ל DI H 2 0 |
| 1% SDS (pH עד 8.2) |
|
| נחושת סולפט II פתרון |
|
| לדוגמה 3X מאגר |
|
| 1X לדוגמא הצפת | לדלל את מאגר לדוגמה 3X למאגר 1X באמצעות מדגם DI H 2 0 |
| 10X הפעלת מאגר (גורם 4 ל ') |
|
| מאגר העברה 10X: (עושה 4 ל ') |
|
| Ponceau |
|
| 0.2% HCl פתרון | 5.2 מ"ל HCl ב 500 מ"ל של DI H 2 0 |
| PVP-T20 חסימת Soln. (גורם 4 ל ') |
|
| מאגר כתם 10X (גורם 4 ל ') |
|
סטנדרטים hydroxylase טירוזין: מכויל על זירחון חלבונים ו ה סטנדרטים המשמשים במעבדה זו נגזרות PC12 תמציות סלולריים, אשר נותחו על תכולת החלבון וה stoichiometries זרחון על תקני ה מכויל בעבר כי בסופו של דבר, שמקורם במעבדה של ד"ר ג'ון הייקוק 11 .
References
- Trevitt, J. T., Carlson, B. B., Nowend, K., Salamone, J. D. Substantia nigra pars reticulate is a highly potent site of action for the behavioral effects of the D1 antagonist SCH23390 in rat. Psychopharmacology. 156, 32-41 (2001).
- Salvatore, M. F., Pruett, B. S., Spann, S. L., Dempsey, C. Aging reveals a role for nigral tyrosine hydroxylase ser31 phosphorylation in locomotor activity generation. PLoS ONE. 4, e8466 (2009).
- Rossato, J. L., Bevilaqua, L. R. M., Izquierdo, I., Medina, J. H., Cammarota, M. Dopamine controls persistence of long-term memory storage. Science. 325, 1017-1020 (2009).
- Keller, C. M., Salvatore, M. F., Pruett, B. S., Guerdin, G. F., Goeders, N. E. Biphasic dopamine regulation in mesoaccumbens pathway in response to non-contigent binge and escalating methamphetamine regimens in the Wistar rat. Psychopharmacology. 215, 513-526 (2011).
- Lu, L., Dempsey, J., Liu, S. Y., Bossert, J. M., Shaham, Y. A single infusion of brain-derived neurotrophic factor into the ventral tegmental area induces long-lasting potentiation of cocaine seeking after withdrawal. J. Neurosci. 24, 1604-1611 (2004).
- Hoffer, B. J., Hoffman, A., Bowenkamp, K., Huettl, P., Hudson, J., Martin, D., Lin, L. F., Gerhardt, G. A. Glial cell line-derived neurotrophic factor reverses toxin-induced injury to midbrain dopaminergic neurons in vivo. Neurosci. Lett. 182, 107-111 (1994).
- Salvatore, M. F., Zhang, J. L., Large, D. M., Wilson, P. E., Gash, C. R., Thomas, T. C., Haycock, J. W., Bing, G., Stanford, J. A., Gash, D. M., Gerhardt, G. A. Striatal GDNF administration increases tyrosine hydroxylase phosphorylation in the rat striatum and substantia nigra. J. Neurochem. 90, 245-254 (2004).
- Lu, L., Wang, X., Wu, P., Xu, C., Zhao, M., Morales, M., Harvey, B. K., Hoffer, B. J., Shaham, Y. Role of ventral tegmental area glial cell-line derived neurotrophic factor in incubation of cocaine craving. Biol. Psychiatry. 66, 137-145 (2009).
- Lavicky, J., Dunn, A. J. Corticotropin-releasing factor stimulates catecholamine release in hypothalamus and prefrontal cortex in freely moving rats as assessed by microdialysis. J. Neurochem. 60, 602-612 (1993).
- Salvatore, M. F., Pruett, B. S. Dichotomy of tyrosine hydroxylase and dopamine regulation between somatodendritic and terminal field areas of nigrostriatal and mesoaccumbens pathways. PLoS ONE. 7, e29867 (2012).
- Salvatore, M. F., Garcia-Espana, A., Goldstein, M., Deutch, A. Y., Haycock, J. W. Stoichiometry of tyrosine hydroxylase phosphorylation in the nigrostriatal and mesolimbic systems in vivo: Effects of acute haloperidol and related compounds. J. Neurochem. 75, 225-232 (2000).
- Salvatore, M. F., Waymire, J. C., Haycock, J. W. Depolarization-stimulated catecholamine biosynthesis: involvement of protein kinases and tyrosine hydroxylase phosphorylation sites in situ. J. Neurochem. 79, 349-360 (2001).
- Haycock, J. W., Lew, J. Y., Garcia-Espana, A., Lee, K. Y., Harada, K., Meller, E., Goldstein, M. Role of serine-19 phosphorylation in regulating tyrosine hydroxylase studied with site- and phosphospecific antibodies and site-directed mutagenesis. J. Neurochem. 71, 1670-1675 (1998).
- Lindgren, N., Xu, Z. Q., Linskog, M., Herrera-Marschitz, M., Goiny, M., Haycock, J. W., Goldstein, M., Hokfelt, T., Fisone, G. Regulation of tyrosine hydroxylase activity and phosphorylation at ser19 and ser40 via activation of glutamate NMDA receptors in rat striatum. J. Neurochem. 74, 2470-2477 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved