Method Article
شامل التنميط من لائحة الدوبامين في المادة السوداء والمنطقة الجوفية السقيفية
In This Article
Summary
وينظم بوضوح الدوبامين في نواة الدماغ المتوسط، والتي تحتوي على خلية وهيئات والتشعبات من الخلايا العصبية المنتجة للدوبامين. نحن هنا وصفا لنهج ونموذج تشريح مناولة إلى تحقيق أقصى قدر من النتائج، وبالتالي استنتاجات ورؤى، بشأن تنظيم الدوبامين في الدماغ المتوسط نواة من المادة السوداء (SN) ومنطقة الجوفية السقيفية (VTA) لدى القوارض.
Abstract
الدوبامين هو ناقل عصبي درس بقوة في الجهاز العصبي المركزي. في الواقع، قد عزز مشاركتها في النشاط الحركي والسلوك المتصل بالإثابة، خمسة عقود من التحقيق في أوجه القصور الجزيئية المرتبطة مع تنظيم الدوبامين. غالبية هذه التحقيقات من تنظيم الدوبامين في الدماغ التركيز على الأساس الجزيئي لائحته في مناطق ميدان المحطة من المسارات السوداوي وmesoaccumbens؛ المخطط والمتكئة نواة. وعلاوة على ذلك، وركزت هذه الدراسات على تحليل محتوى الأنسجة الدوبامين مع التطبيع فقط لوزن النسيج الرطب. التحقيق من البروتينات التي تنظم الدوبامين، مثل هيدروكسيلاز التيروزين (TH) بروتين، الفسفرة TH، نقل الدوبامين (DAT)، ونقل مونوامين حويصلي 2 (VMAT2) بروتين في كثير من الأحيان لا تشمل تحليل محتوى الأنسجة الدوبامين في نفس العينة. القدرة على تحليل محتوى كل من الأنسجة الدوبامين والبروتينات التي تنظم فيها (بما في ذلك في مرحلة ما بعد هيئة تنظيم الاتصالاتتعديلات nslational) لا يعطي سوى القوة الكامنة في تفسير العلاقة بين دوبامين مع مستوى البروتين وظيفة TH، DAT، أو VMAT2، بل يمتد أيضا اقتصاد عينة. وهذا يترجم إلى أقل التكاليف، وحتى الآن تنتج نظرة ثاقبة لتنظيم الجزيئي للدوبامين في نموذج تقريبا أي خيار من المحققين.
ونحن نركز على التحليلات في المخ الأوسط. على الرغم من أن تهمل عادة SN وVTA في معظم الدراسات من تنظيم الدوبامين، وتشريح هذه النوى بسهولة مع الممارسة. ويمكن إجراء قراءات شاملة لمحتوى الأنسجة الدوبامين وTH، DAT، أو VMAT2. هناك ازدهار الأدب عن تأثير وظيفة الدوبامين في التعطيل وVTA على السلوك، والإصطدامات من المواد الخارجية أو عمليات المرض فيها 1-5. وعلاوة على ذلك، ومركبات مثل عوامل النمو يكون لها تأثير عميق على البروتينات الدوبامين والدوبامين التنظيم، إلى حد أكبر نسبيا في التعطيل أو VTA وسوف نوضح تقنية تشريح للفصل بين هذه النوى اثنين وتجهيز عينة من الأنسجة التي تنتج تشريح لمحة كشف الآليات الجزيئية لتنظيم الدوبامين في الجسم الحي، محددة لكل نواة (الشكل 1).
Protocol
1. تشريح
- على سرير من الثلج الرطب، والبرد مصفوفة المخ القوارض (الأقسام الاكليلية فصل 1 ملم بعيدا)، وطبق بتري تحتوي على 5 شفرات الحلاقة، ومشرط رقم 11. في وعاء منفصل، وصفت مكان 2 أنابيب microfuge مل حجم إلى الثلج الجاف.
- وسوف المحقق اختيار طريقة القتل الرحيم. لدينا نتائج استنساخه إجراء تخدير وجيزة جدا مع isoflurane، ومن الناحية المثالية، استخدام المرذاذ ان يكون عليه. ومع ذلك، إذا لم يتوفر، ونحن نستخدم وعاء كبير يحتوي على بطارية منصة. مع جرة بطارية يقع في غطاء محرك السيارة التهوية وافق، وضع الشاش isoflurane المشبعة تحت منصة والانتظار 3-5 دقائق للسماح للisoflurane لتشبع جرة البطارية. وضع فأر داخل وإزالة لقطع الرأس بمجرد أن الفئران قد فقد وعيه. يزيل سريعا الدماغ (من الناحية المثالية في أقل من دقيقة)، وشطف تحت الماء البارد، ووضع على الفور في المصفوفة القوارض الدماغ مبردة.
- دقيقة واحدة بعد موقفجى الدماغ في مصفوفة، تضاف شفرات الحلاقة الباردة في الدماغ المبردة، ابتداء حوالي 2 مم منقاري إلى chiasm البصرية وإذا رغبت في المخطط والمتكئة نواة لتحليلها بالإضافة إلى نوى الدماغ المتوسط. مواصلة إدخال شفرات الحلاقة الباردة مع كل مقطع 1 ملم حتى تصل في منتصف الجسر، مذهلة تنسيب كل شفرة حلاقة لاحق وذلك لتسهل من عملية إزالة كل شفرة الفردية.
- عندما سحب وشفرات الحلاقة، والبحث عن بداية قرن آمون. عندما اختتم تماما في جميع أنحاء المخ الأوسط، ونبدأ في اتخاذ المقاطع باستخدام شفرة # 11 مشرط، كما هو موضح في الشكل رقم 2.
- وضع على الفور الأنسجة تشريح في أنبوب microfuge قبل المبردة على الثلج الجاف. في الفئران، ونتوقع أن تكون قادرة على تشريح SN وVTA من حد أدنى من شريحتين الاكليلية وبحد أقصى ثلاثة. الأنسجة مخزن في -80 درجة مئوية حتى استعداد للمعالجة.
2. تحليل الأنسجة: HPLC وأو الدوبامين والأيضات
للحصول على معلومات كاملة عن معدات HPLC والصيانة، والرجوع إلى تحليل HPLC في نهاية المخطوط.
- التجانس بلطف الأنسجة فورا بعد إزالة الجليد الجاف من استخدام المثلج 0.1 حل 4-M EDTA HClO (0.1 M HClO 4 و 0.1 ملي EDTA) 9، والتي تحتوي على N-الميثيل الدوبامين عند تركيز 20 نانوغرام / مل، التي تعد بمثابة معيار داخلي للانتعاش من خلال تحليل عينة HPLC. الخالط والتي نستخدمها هي Sonifier برانسون 150، مع الإعداد في 10٪ من القوة الكاملة (1 من 10). وأوصى مجلدات صوتنة التالية:
في الفئران، SN = 250 ميكروليتر (تشريح من جانب واحد)، و 400 ميكروليتر (تشريح الثنائية)، VTA = 200 (تشريح من جانب واحد) ميكرولتر، 400 ميكروليتر (تشريح الثنائية).
في الماوس، (تشريح الثنائية فقط)، SN = 200 ميكروليتر، VTA = 200 ميكروليتر. - بعد التجانس، عقد العينات في الثلج الجاف. العينات ثم centrifuged (دوبونت Sorvall Microspin 24S) في 12000 دورة في الدقيقة إلى ترسبات البروتين بيليه لاستخدامها في قرارات لطخة غربية. يتم حقن supernatants مباشرة في هبلك. وأوصى حجم الضخ التالية للحصول على تحليل دقيق في الفئران أو الماوس: (. من أي الإعدادية) SN = 150 (. من أي الإعدادية)، VTA = 160 ميكروليتر
- يتم إعداد معيار المخزون في 1 ملغ / مل عن طريق إضافة كمية مناسبة من أمينات أحادية والأيضات * مكون من الدوبامين إلى 0.1 حمض البيركلوريك 0.1 M ملي EDTA. تركيز كل مركب هي 1 ملغ / مل باستثناء التربتوفان التي هي 5 ملغ / مل. وينقسم المعيار الأوراق المالية في 10 aliquots ميكرولتر وتخزينها في ultralow لحين الحاجة إليها.
* يتم تصحيح جميع الأوزان لشكل ملح من المجمع إن وجدت.
إعداد معيار العمل عن طريق تمييع 1 قسامة 10 ميكرولتر من مستوى المخزون إلى 100 مل من محلول حامض البيركلوريك. تركيز على معيار العمل هو 0.1 ميكروغرام / مل باستثناء التربتوفان وهو 0.5 ميكروغرام / مل. 50 ميكرولتر منيتم حقن هذا المعيار العاملين في HPLC لمبلغ على عمود من 5 نانوغرام في كل مكون باستثناء التربتوفان الذي هو 25 نانوغرام. - تقرير من الانتعاش الدوبامين في قسامة عينة:
هناك العديد من الخطوات المتضمنة لتحديد استرداد الدوبامين من قسامة عينة. - أولا، تقسيم ارتفاع ذروة الدوبامين من العينة من ارتفاع قمة الدوبامين من معيار وتتضاعف هذه النسبة من المبلغ الإجمالي (NG) الدوبامين في معيار. تركيزنا الدوبامين هو معيار ويعاير 0.1 ميكروليتر نانوغرام / ميكروليتر و 50 من معيار. وهكذا، فإن كمية الدوبامين في مستوى هو 5 نانوغرام. وبالتالي، يمكن استخدام المعادلة التالية لاسترداد الدوبامين العزم في عينة معينة:
(الدوبامين ارتفاع الذروة في عينة / الدوبامين ارتفاع في مستوى الذروة) * 5 نانوغرام - تصحيح لخسارة من عينة باستخدام الداخلية معيار N-الميثيل الدوبامين:
يتم حساب الاسترداد الفعلي من N-الميثيل الدوبامين في بنفس الطريقة التي الدوبامين بقسمة DOP N-الميثيلأمين ارتفاع قمة في عينة من ارتفاع الدوبامين ذروة N-الميثيل من معيار ومضاعفة هذه النسبة من المبلغ الإجمالي (ن غ) من N-الميثيل الدوبامين في معيار. مثل الدوبامين، لدينا معيار تركيز الدوبامين N-الميثيل هو 0.1 نانوغرام / ميكروليتر. ويعاير 50 ميكرولتر من هذا المعيار. وبالتالي، فإن كمية N-الميثيل الدوبامين في مستوى هو 5 نانوغرام. وبالتالي، يمكن استخدام المعادلة التالية لتحديد N-الميثيل انتعاش الدوبامين في عينة معينة:
(N-الميثيل ارتفاع ذروة الدوبامين في عينة / قمة الدوبامين N-الميثيل في ارتفاع قياسي) * 5ng
ومع ذلك، لأن الدوبامين N-الميثيل في كل عينة لا يأتي من العينة نفسها ولكن من المخزن المؤقت HPLC، يتم حساب كمية الدوبامين N-الميثيل المتوقعة في كل عينة. تركيز الدوبامين N-الميثيل في عازلة HPLC هو 20 نانوغرام / مل أو 0.02 نانوغرام / ميكروليتر، لذلك تم العثور على المبلغ المتوقع من الميثيل N-الدوبامين في كل عينة عن طريق ضرب تركيز الدوبامين N-الميثيل المخزن المؤقت HPLC من حجم قسامة من كل عينة المستخدمة لHالمجلس التشريعي الفلسطيني تحليل. ويتجلى هذا في المعادلة التالية:
(0.02 نانوغرام / ميكروليتر) * (قسامة حجم العينة المستخدمة في تحليل HPLC) - ويمكن بعد ذلك الفرق بين الدوبامين N-الميثيل المتوقعة وتعافى يمكن استخدامها لتصحيح لكمية الدوبامين تعافى من خلال تعديل عينة عن أي خسارة. ببساطة تأخذ نسبة الدوبامين N-الميثيل المتوقعة / تعافى N-الميثيل الدوبامين وضرب هذا المقدار من الدوبامين استردادها. وهكذا، وبالنظر إلى المعادلة الشاملة للكمية الدوبامين في قسامة عينة أدناه:
(الدوبامين ارتفاع بلغت ذروتها في ذروة ارتفاع عينة / الدوبامين في معيار) * (N-الميثيل ذروة ارتفاع في مستوى الدوبامين / N-الميثيل الدوبامين ارتفاع الذروة في عينة) * (0.02 نانوغرام / ميكروليتر) * (قسامة حجم العينة المستخدمة في تحليل HPLC ) - الدوبامين مجموع تعافى من عينة:
ثم يتم استخدام قيمة الدوبامين تعافى من قسامة عينة لاستقراء المبلغ الإجمالي للدوبامين في عينة معينة. يتم ذلك من خلال تقسيم المبلغ المسترد (NG) سو دا من حجم قسامة ومضاعفة هذه القيمة إجمالي حجم المخزن المؤقت الذي تم HPLC sonicated العينة فيها ويتم منح هذه بواسطة المعادلة التالية:
(المبلغ (NG) الدوبامين في عينة قسامة / حجم قسامة عينة) * (إجمالي حجم العازلة إلى HPLC الذي sonicated العينة).
وعلى القارئ الرجوع إلى الدراسات التالية 2،4،10 لتقديم عرض شامل للتقييم من الدوبامين والأيضات بالتزامن مع قراءات من الدوبامين، التي تنظم كذلك البروتينات، ليس فقط في التعطيل وVTA، ولكن المخطط والمتكئة نواة.
3. تحليل الأنسجة: البروتين الكلي والنهائي تطبيع النتائج عشر وDAT
- وضع الكريات بروتين عجلت (مشتقة من العلاج العازلة HPLC) في الجليد الرطب للحفاظ على 4 درجات مئوية. تأكد من أن تمت إزالة جميع العازلة وأرشفة (إذا كان المطلوب تحليل مؤكد). إذا كان التعطيل أو VTA هو أن تتم معالجتها بشكل ثنائي (فأر فقط)، وإضافة 300 ميليلتر (SN) أو 200 ميكروليتر (VTA) من 1٪ SDS التي تحتوي على 5 مم تريس (درجة الحموضة 8.3) و 1 مم EDTA لبيليه ويصوتن. إضافة 150 ميليلتر من الحل SDS إلى الكريات SN أو ميكرولتر من 100 إلى الكريات VTA إذا معالجة الأنسجة من التشريح من جانب واحد.
- وضع العينات في الماء المغلي لمدة 5 دقائق قرب ~ لاستكمال تمسخ البروتين والسماح لتبرد لدرجة حرارة الغرفة. وتعقد بشكل آمن يضمن مباراة دولية في هذه الخطوة.
- تحديد تركيز البروتين في العينات باستخدام مقايسة اتفاق التعاون الأساسي، بما في ذلك البروتين منحنى معيار (قياسي الزلال) مجموعة من 2 حتي 40 ميكروغرام من البروتين. حجم فحص ميكرولتر 5 من العينة في ثلاث نسخ واستخدام قيمة متوسط لتحديد كمية البروتين ضد المنحنى القياسي. القسمة على وحدة التخزين لفحص تركيز البروتين. لاحظ أن هذه هي أول اثنين من الخطوات التي اتخذت لتطبيع TH مجموع، DAT، والنتائج VMAT2 إلى انتعاش البروتين الكلي.
- تحضير العينات مع عينة العازلة (التي تحتوي على dithiothreitol) للحد من SDS-الكهربائي عن ز الأكريلاميد بنسبة 10٪ELS. من الناحية المثالية، ينبغي للنهائي تركيز البروتين الكلي تكون ~ 2 ميكروغرام / ميكروليتر. والسبب في ذلك اختيار تركيز هو الحد من حجم العينة ضرورية لتقرير النهائي للالفسفرة TH، كما ~ 100 ميكروغرام من البروتين الكلي وسيكون من الضروري لتحميل لتحديد بدقة ser31 وser40 الفسفرة TH. إذا رأيت لون أصفر في عينة بعد إضافة العازلة عينة، وعينة غير حمضية جدا. إضافة 1 م تريس (درجة الحموضة 8.2) في 10 ميكرولتر زيادات حتى يتم استعادة اللون الأزرق.
- إعداد العينات على النحو التالي للقرارات التالية من الدوبامين التنظيم البروتينات:
- ومن المتوقع ضد معيارا لمعايرة بروتين TH (كما نغ)، وتركيز ث (كما في نانوغرام لكل بروتين ميكروغرام الكل) في التعطيل لتتراوح ما بين ~ 0،05-0،27 TH نانوغرام لكل بروتين مجموع 2،4 ميكروغرام،: TH 7،10،11. ضد منحنى خطي TH القياسية، والتي تتراوح 0،5 حتي 5،0 نانوغرام عشر وباستخدام الأجسام المضادة الأولية إلى TH (ميليبور القط # AB152، 1:1000 تخفيف تي في PVP-20 عرقلة الحل) الذي ينتج منحنى خطي القياسية، وينبغي أن الحمل الأمثل من البروتين الكلي من SN تكون ~ 10 ميكروغرام. تركيز TH في VTA يتراوح ~ 0،4-1،0 TH نانوغرام لكل بروتين 4،11 ميكروغرام. وبالتالي، يجب أن إجمالي حمولة البروتين ليكون VTA ~ 5 ميكروغرام.
- DAT: إن الكميات النسبية للDAT في التعطيل أو VTA هي أقل بكثير من ذلك في المناطق محطة حقل وما شابه ذلك من المخطط، والنواة المتكئة 4. التعبير النسبية للتطبيع كما DAT إلى بروتين TH تعافى هو أيضا أقل من ذلك بكثير في التعطيل وVTA. وفقا لذلك، يحمل البروتين لتحديد كمية البروتين في DAT SN أو VTA تحتاج إلى أن تكون أكبر بكثير بالمقارنة مع الأحمال عينة من مناطق ميدان المحطة. وهناك حاجة إلى الحد الأدنى من 30 ميكروغرام من البروتين الكلي للدقة في تقييم DAT في VTA وحمولة الاسمية للبروتين ميكروغرام 50 المجموع هو الحاجة إلى تقييم في التعطيل. الأجسام المضادة الأولية المستخدمة هي سانتا كروز، القط # SC-1433.
- VMAT2: التعبير عن VMAT2، كما أن تطبيع البروتين الكلي، هو أكبر في mesoaccumbens من المناطق السوداوي. ومع ذلك، بالنسبة إلى التعبير TH، VMAT2 التعبير هو أعظم في التعطيل وأقلها في المخطط 4. باستخدام سانتا كروز القط # SC-15314، وهو الاسمي تحميل البروتين الكلي من ~ 40 ميكروغرام ليكون أفضل لتقدير حجم VMAT2.
- تشغيل كمية مناسبة من البروتين الكلي باستخدام SDS-PAGE عن المواد الهلامية الأكريلاميد بنسبة 10٪. يستخدم بيو راد الكهربائي الثاني متقلب وحدة للقرارات، والذي هو شكل هلام كبير. نقل البروتينات على 0.45 ميكرون النيتروسليلوز حجم المسام. لنقل، وخزان Hoeffer لتعيين ما لا يقل عن 27 فولت تسمح بنقل أن يعقد خلال الليل.
- السماح للالبقع لتجف لمدة لا تقل عن 30 دقيقة وبعد ذلك وصمة عار مع حل الشقائقية S (1٪ الشقائقية S في حامض الخليك الجليدي 5٪) لمدة 5 دقائق ~. دي وصمة بقوة مع محلول HCl 0.2٪ حتى العصابات بروتين الفردية حل واضح وتتم إزالة تلوين الخلفية. الحصول على صورة من S الشقائقية وصمة عارجي جي باستخدام صورة لتحديد المزيد من الأحمال البروتين النسبية في كل حارة وتطبيع TH، DAT، أو VMAT2 النتائج (الشكل 3).
4. تحليل الأنسجة: الموقع محددة الفسفرة TH
لا يمكن للالفسفرة من TH في ser31 أو ser40 زيادة لام دوبا الحيوي في الخلايا كاتيكولاميني 12. على الرغم من أن كمية من الفسفرة في كل موقع من الضروري زيادة لام دوبا الحيوي في مناطق الدماغ مثل الدوبامين لم يتم تأسيس SN وVTA، هناك أدلة على أن ser31 الفسفرة تلعب دورا هاما في تنظيم لام دوبا الحيوي (10) وشارك في يختلف مع DA محتوى الأنسجة بين المخطط، النواة المتكئة، SN، وVTA 2، 10. ومع ذلك، فإن إدراج ser40 القرارات اللازمة، كما العديد من الدراسات تظهر أنها يمكن أن تؤثر على نشاط TH، خصوصا إذا تم التوصل الى عتبة الفسفرة 12.
في حين ser19 phosphorylatiلا يؤثر على نشاط وحدها 13،14 ث، يمكن أن تنظر إليه على أنه الحارس لكا 2 + التي تعتمد على إشارات في الخلايا العصبية DA، بالنظر إلى أن الكالسيوم خارج الخلية 2 + من الضروري زيادة ser19 الفسفرة تحت ظروف depolarizing 12. وعلاوة على ذلك، هناك علاقة ايجابية كبيرة من ser19 الفسفرة مع ser31 الفسفرة إلا في التعطيل وVTA 10، مما يدل على أن الوضع ser19 الفسفرة يمكن أن تؤثر على ser31 الفسفرة، وبالتالي الحيوي بشكل غير مباشر لام دوبا.
الاعتبارات تحميل عينة من أجل القياس الكمي الأمثل للموقع المحدد TH رياضيات الكيمياء الفسفرة: اقل، وتقدم الاعتبارات المطلوبة للقرارات صحيحة ودقيقة من الفسفرة TH في مواقع محددة في أنسجة تشريح. عندما يكون ذلك ممكنا، ينبغي أن تضمن الفسفرة TH معايرة القياسية في تقييم الفسفرة TH عينة. يجب تحميل عينة تأخذ في لجنة التنسيق الإداريةount الاتحاد العنصري المتأصلة في كل موقع الفسفرة بحيث فحص الكمي الفسفرة ضمن نطاق عمل ديناميكية من الأجسام المضادة المستخدمة. كما ملاحظة أخيرة، يجب أن البروتين المتأصلة مجموع القادمين إلى فحص لكل عينة تحميلها أيضا في الممرات منحنى القياسية. ويتحقق هذا بسهولة مع البروتين الناقل (مثل كبد الفئران) والتي لا تعبر عن TH.
- . ser19 ومن بين المواقع الفسفرة الثلاثة، ser19 مستويات رياضيات الكيمياء الفسفرة هي أعظم في التعطيل وVTA، بدءا 0،15-0،25 2،10،11. على اعتبار آخر هو أنه من خلال طريقة الكشف لدينا، وكميا ser19 فرع فلسطين في نطاق خطي بين 0.5 و 5.0 نانوغرام الفوسفات ser19-10. ونظرا لهذه الاعتبارات، وهو بروتين TH مجموع حمولة تتراوح بين 5 و نانوغرام 10 (مما يعطي 0،75 المقدرة - 2.5-الفوسفات ser19 نانوغرام من العينة) من شأنه أن يوفر مقياسا يمكن الاعتماد عليها من الفسفرة TH ser19. نحن نستخدم Phosphosolutions الابتدائي (الفئة # p1580-19) في تخفيف 1:1000.
- . ser31 رياضيات الكيمياء الفسفرة ser31 مستويات أقل نسبيا في التعطيل وVTA مقارنة بهم وما شابه ذلك مناطق ميدان المحطة، والتي تتراوح بين ~ 0،04-0،10 2،4،10،11. بواسطة طريقة كشف لنا، تم الكشف عن ser31 فرع فلسطين في نطاق خطي بين 0.5 و 7.0 نانوغرام 10-ser31 الفوسفات. ونظرا لهذه الاعتبارات، وهو بروتين TH مجموع الحمولة ما بين 10 و نانوغرام 30 (مما يعطي 0،50 المقدرة - 3.0 نانوغرام الفوسفات، ser31 من العينة) من شأنه أن يوفر مقياسا يمكن الاعتماد عليها من الفسفرة ser31TH. انظر الشكل 4A للحصول على مثال ser31 الكمي. الأجسام المضادة اهتمامنا الرئيسي هو في المنزل تقارب-تنقية الأجسام المضادة التي تم تصنيعها قبل 21 القرن الحادي والكيميائية الحيوية، (بوسطن، ماساتشوستس)، والتحقق من صحتها لخصوصية والفوسفات، حاتمة باستخدام لدينا في المنزل المعايير 2.
- ser40 ser40 مستويات رياضيات الكيمياء الفسفرة في التعطيل وVTA مجموعة من ~ 0.02 - 0.06 2،4،10،11. بواسطة طريقة كشف لنا، قتم الكشف عن er40 فرع فلسطين في نطاق خطي بين 0.2 و 2.0 نانوغرام الفوسفات ser40-10. ونظرا لهذه الاعتبارات، وهو بروتين TH مجموع الحمولة ما بين 10 و نانوغرام 30 (مما يعطي 0،20 المقدرة - 1.8 نانوغرام الفوسفات، ser40 من العينة) من شأنه أن يوفر مقياسا يمكن الاعتماد عليها من الفسفرة ser40TH. انظر 4B شخصية للحصول على مثال ser40 الكمي. نحن نستخدم Phosphosolutions الابتدائي (الفئة # p1580-40) في تخفيف 1:1000.
5. ممثل النتائج
- الدوبامين في SN مقابل VTA وهناك ثلاث قراءات للدوبامين (أو الأيض) التي يمكن اتخاذها في التحليل الكمي؛. وفقا لمجموع تعافى من تشريح، في البروتين، ولكل بروتين TH (أظهر للالمخطط، SN، المتكئة نواة، و VTA في الجدول رقم 1 أدناه). مجموع استرداد الدوبامين بين التعطيل وVTA هو مشابه إلى حد ما، وتتراوح بين 6-9 نانوغرام من يومين إلى ثلاثة تشريح شريحة الاكليلية 2. وسوف تطبيع انتعاش الدوبامين إلى البروتين الكلي إظهار ثاتي، على أساس أسلوب تشريح العاملين، على أن VTA سيكون لها أكبر الدوبامين في البروتين الكلي، بمتوسط 6-8 نانوغرام / ملغ من البروتين في التعطيل و9-10 نانوغرام بروتين ملغ / VTA في 2 و 4. أخيرا، يجب تطبيع الدوبامين إلى TH مجموع تعافى تكشف أيضا عن الفرق بين التعطيل وVTA، كونها أكبر في VTA 10، وتتراوح ما بين 0.2 و 0.8 نانوغرام الدوبامين في بروتين TH نانوغرام بين المنطقتين 2،10.
DA المنطقة استعاد إجمالي DA DA لكل بروتين ملغ DA TH نانوغرام لكل المخطط 214 ± 16 165 ± 13 0.56 ± 0.11 SN 8.4 ± 0.8 6.1 ± 0.5 0.18 ± 0.03 نواة تيار مترددcumbens 60 ± 6 75 ± 4 0.77 ± 0.03 VTA 6.0 ± 1.0 9.2 ± 1.4 0.22 ± 0.03 - البروتينات الكلية: TH، DAT، VMAT2 باستخدام بروتين TH معايرة قياسية لالكمي، يتم استرداد أكثر TH في التعطيل من VTA من تشريح (60 نانوغرام في SN و 26 نانوغرام في VTA 2). ومع ذلك، عندما طبعت على البروتين، وهذا يعكس العلاقة، مع TH في البروتين الكلي في VTA كونها ~ 3 - 5 أضعاف أكبر مما كانت عليه في التعطيل، (~ 0،32 نانوغرام / ميكروغرام من البروتين و 0.09 في VTA ~ في SN) 4، 10.
الانتعاش المتوقع لدات في التعطيل وVTA مشابه، مع انتعاش أكثر قليلا في VTA حسب البروتين الكلي أو حسب TH مجموع انتشال 4. ولا سيما، DAT البروتين هو أقل بكثير من وفرة في هذه المناطق مقارنة مع مناطق محطة حقل وما شابه ذلك 4 .
VMAT2 استرداد وفقا لالبروتين الكلي أكبر في VTA مقابل SN 4. ومع ذلك، عندما طبعت لبروتين TH، هناك انتعاش أكبر قليلا في SN 4. - موقع خاص الفسفرة TH من عدد من الدراسات، كانت هناك نتائج متسقة في ser31، ser19، وser40 كمية الفسفرة في التعطيل وVTA، وأيضا في ما يتعلق مناطق محطة حقل وما شابه ذلك. Ser19 الفسفرة أكبر ولا سيما في التعطيل وVTA (~ 0،2-0،3) مقارنة المخطط والنواة المتكئة (~ 0،05-0،15) 2،4،7،10،11. Ser31 الفسفرة هي أقل بشكل ملحوظ في التعطيل وVTA مقارنة بهم وما شابه ذلك مناطق ميدان المحطة، ويجري ~ 0،06-0،10 بين هذه المناطق somatodendritic 2،4،7،10،11. خلال تثبيط كربوكسيل حمض العطرية مع NSD-1015، فإن هناك زيادة بنسبة 2 أضعاف في ser31 الفسفرة في VTA 10 فقط. يتراوح بين 0.02 الفسفرة Ser40 و 0.05 في التعطيل وVTA وعموما هذا الجزء النظري لا تختلف كثيرا عن مناطق محطة حقل 2،4،7،10،11 وما شابه ذلك.

الشكل 1. قراءات الدوبامين من تشريح الأنسجة واحد.
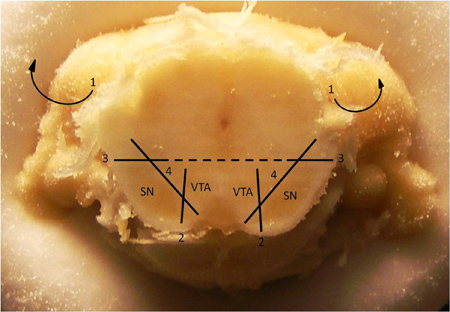
تقنيات شخصية تشريح 2. على عزل neuropil الدماغ المتوسط الدوبامين. تقنية لتشريح substantia الرمادية (SN) من منطقة الجوفية السقيفية (VTA). 1. إزالة القشرة الفوقية وقرن آمون (وقد تم بالفعل إزالة هذه الهياكل في الصورة أعلاه). 2. جعل خفض عمودي يفصل بين منطقة الصباغية من التعطيل من VTA. 3. جعل قطع أفقي على أو بالقرب من خط الوسط فقط فوق الجزء الظهري والجانبية أكثر من التعطيل. 4. ندف من SN بعيدا عن بقية الدماغ. مرة واحدة تمت إزالة SN، ندف بالمثل VTA بعيدا عنبقية الدماغ المتوسط. ملاحظة: ويلاحظ عادة في هذا القسم الإحداثيات، نسبة إلى Bregma، في AP 5.7.

الشكل 3. الثانية (والأخيرة) من مجموع تطبيع تلطيخ الحمل الشقائقية S بروتين لتحليل J صورة. الشقائقية تلوين البروتين لتحديد TH الكلي في عينات الفئران المادة السوداء. أول خمسة مسارات تشكيل اليسار هي المعيار منحنى إجمالي TH، أضيف إليها 28 ميكروغرام من البروتين جناسة كبد الفئران بحيث تكون قادرة على تحميل البروتين من عينات المادة السوداء. الممر التالي على الوزن الجزيئي (MW) علامات. الممرات المتبقية تحتوي على البروتين ~ 28μg عينات من الفئران المادة السوداء. وتستند يحمل بروتين على تركيز البروتين في كل عينة على النحو الذي تحدده طريقة BCA. لكن، على الرغم من ما ينبغي أن يكون على قدم المساواة الأحمال، هناك اختلافات في ظلام تلطيخ الشقائقية S بين عينات مما يدل على طفيفالتغير في تركيزات البروتين، والذي تم تصحيحه من قبل لتطبيع باستخدام يماغيج تحليل لتحليل كمية من تلطيخ الشقائقية S لكل عينة.

الشكل 4. النتائج الممثل الفسفرة TH من الضوابط والمعالجات. ممثل ser31 هيدروكسيلاز التيروزين فسفرته (PTH) وser40 البقع PTH الغربية من المياه المالحة والميثامفيتامين فئران ويستار المعالجة من دراسة سابقة 4. أ. سر 31 PTH في عينات الفئران المادة السوداء. ومعايرة سر 31 نطاقات PTH منحنى قياسي من 0.3 نانوغرام إلى نانوغرام 2.0 ويقع ضمن نطاق خطي من الكشف. بناء على التحليل السابق لطخة غربية من مستويات TH المجموع، تم تحميل 6 نانوغرام من TH الإجمالية لكل عينة. ب. ser40 PTH في عينات الفئران الجوفية السقيفية. ومعايرة ser40 يتراوح PTH منحنى قياسي من 0.2 إلى 1.5 نغ نغ، وهو ضمن مجموعة من خطي كشف. بناء على التحليل السابق لطخة غربية من مستويات TH المجموع، تم تحميل 9 نانوغرام من TH الإجمالية لكل عينة.
Discussion
كما هو مبين في الشكل رقم 1، وينبغي أن الأساليب المفصلة أعلاه تعطي قراءات متعددة من الدوبامين وTH لها البروتينات التي تنظم، DAT، وVMAT2 من عينة واحدة من التعطيل أو VTA تم الحصول عليها من الفئران أو الماوس. مرة أخرى، وفوائد تنفيذ هذا البروتوكول، أن المحقق يمكن الحصول على قراءات من الناحية التشغيلية المطابقة لكيفية تنظيم الدوبامين في الجسم الحي تحت أي نموذج تجريبي وعمليا، في القيام بذلك، حفظ الموارد تجريبية هامة من خلال تقليل عدد الحيوانات المطلوبة في أي التجربة.
من الضروري للغاية أن المحقق مراعاة متطلبات درجة الحرارة التي فرضت خلال تشريح (4 درجة مئوية)، والتخزين من النسيج (ما لا يقل عن -70 درجة مئوية)، صوتنة الأنسجة (صوتنة فوري بعد إزالة من درجة حرارة التخزين) في الجليد الباردة العازلة HPLC و بيليه لاحق تشكيل وتجهيز. بمجرد sonicated وبيليه ويغلى في حل الحزب الديمقراطي الصربي، قد عينات لا تزال فورثإيه معالجتها في درجة حرارة الغرفة. حلل تخزين HPLC المؤرشفة العينة والعينات العازلة عينة المعدة لتحليل البروتين يجب أن تكون على -80 درجة مئوية.
مرة أخرى، فإن الميزة الرئيسية لهذا البروتوكول هو النهج الفطري إلى المباراة عمليا النتائج المتعلقة تنظيم الدوبامين في الجسم الحي. وعلاوة على ذلك، وتطبيع قراءات الأنسجة الدوبامين إلى علامات neuropil الدوبامين (TH، DAT) توفير قدر كبير من التأكيد على أن المحقق تشريح SN أو VTA مع التناسق والدقة. نظرا لتورط الدوبامين في اضطراب، والإدمان النفسي، والساحات الحركي، يمكن أن تستخدم هذا البروتوكول في العديد من التجارب. واحد الحد الملحوظ هو أن تفسير النتائج الفسفرة TH ينبغي أن تكون المحافظة، كما من غير المعروف في الوقت الحالي إلى أي مدى هناك حاجة إلى زيادة الفسفرة في ser31 أو ser40 في الجسم الحي لزيادة لام دوبا الحيوي. لكن، وكما ذكرت، هناك EVidence أن ser31 الفسفرة يبدو لتنظيم لام دوبا الحيوي، ولها دور في تنظيم مجموع محتوى الأنسجة الدوبامين في الجهاز العصبي المركزي 2،10. في هذا الوقت، ومعايير لبروتين عشر والفسفرة TH ليست متاحة تجاريا. ومع ذلك، فقد حافظت هذه المختبرات وسعت هذه المعايير على أساس تلك المستخدمة عندما تم نشر اول ورقة بشأن تنظيم الفسفرة TH في الجسم الحي 11. ومع ذلك، فمن الممكن لتطبيع الدوبامين محتوى الأنسجة لبروتين TH استعادت في هذه المناطق منفصلة باستخدام هذا البروتوكول.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وقدمت التمويل اللازم لهذا العمل، واستشهد بها 2،10، في جزء منها عن طريق البحث الجوائز منحة لسالفاتوري MF من الاتحاد الأمريكي لبحوث الشيخوخة، وعين إدوارد السلالم الصندوق الاستئماني ومؤسسة البحوث الطبية الحيوية من ولاية لويزيانا الشمالية الغربية، وBS بروت من زمالة Muslow آيك Predoctoral، LSU مركز علوم الصحة، شريفيبورت.
Materials
HPLC النظام:
النظام الأساسي يتكون من مضخة شيمادزو HPLC LC10-ADvp، وهي مياه WISP 717 التلقائي محقن العينة، ويحتوي على 250 X 4.4 ملم 5 ميكرون Spherosorb المواد المستنفدة للأوزون-1-C18 عكس مرحلة العمود (المياه)، وأنظمة Bioanalytical (BAS) TL12 زجاجي مزدوج قطب كهربائي الكربون، واثنين من أجهزة الكشف عن BAS LC4B الكهروكيميائية، والمياه 1 2 تمكين جمع البيانات ونظام التكامل.
يتم الحفاظ على عمود في 30-45 درجة مئوية (BAS سخان عمود LC22A). الطور المتحرك هو 0.1 فوسفات الصوديوم M (درجة الحموضة 3.0)، 0.1 ملي EDTA، 0،2-0،4 ملي 1-أوكتان حمض السلفونيك (ايستمان كوداك-)، والأسيتونيتريل 0.35٪ (V / V) وتصفيتها من خلال مرشح 0.45 ميكرون. معدل التدفق من 1.2 مل / دقيقة. هي الأمثل أربع دفعات لتر من الطور المتحرك للفصل عن طريق ضبط درجة الحموضة، أوكتان حمض السلفونيك ودرجة حرارة العمود. يتم إعادة تدويرها في المرحلة المتنقلة، ويتم إزالة بشكل مستمر مع غاز الهيليوم لإزالة الأكسجين الذائب. إعادة التدوير من الطور المتحركهو تقريبا من الضروري للحفاظ على قرار جيد لفترة معقولة من الزمن. يتم الحفاظ على الطور المتحرك العمر الافتراضي باستخدام مفتاح تدفق (التي يسيطر عليها تكامل) لتحويل النفايات إلى أول 2-7 دقيقة من كل تشغيل.
تتم المحافظة على الأقطاب في إمكانات 0.78 تقريبا و0.95V فيما يتعلق الإلكترود المرجعي Ag/AgC1. يستخدم الكهربائي في ارتفاع محتمل على وجه الحصر لتحديد التربتوفان (ومعيار داخلي NMDA). إمكانات V 0.78 يوفر إشارة إلى أعلى نسبة الضوضاء للكشف عن أمينات أحادية والمركبات، وغيرها من التربتوفان. يتم تخزين المخططات الاستشرابية على القرص الثابت من محطة العمل تمكين، ومعالجتها في وقت لاحق، ونقل البيانات مباشرة إلى جدول بيانات Excel لحساب كميات المستقلب وتجميع البيانات المجموعة.
مضخة: شيمادزو LC-10AD
الخلية: BAS الصليب التدفق. كربون زجاجي كهربائي يعمل على 0.780 و 0.950 V المحتملة.
كشف: BAS LC-4B تعمل في وضع قناة مزدوجة.
بيانات ACQ. النظام: مياه تمكين برو 2.
حاقن: مياه WISP 717
العمود: مياه Spherosorb المواد المستنفدة للأوزون 1 و 5 ميكرومتر الجسيمات، 4.4 مم X 250 مم.
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | |
| كبريتات الصوديوم دوديسيل (SDS) | - JT بيكر | 4095-02 | |
| Trizma قاعدة | سيغما | T1503-1KG | |
| Trizma حمض الهيدروكلوريك | سيغما | T3253-1KG | |
| الغليسيرول | سيغما | G8773-500 مل | |
| PVP-40 | سيغما | PVP40-1KG | |
| dPBS | Gibco | 21600-069 | |
| Tween20 | سيغما | P1379-500 مل | |
| جليكاين | سيغما | G8898-1KG | |
| الشقائقية S | Fluka | 81460 | |
| زرقة البروموفينول | سيغما | B8026-5G | |
| Dithiothreitol | سيغما | D-9163 | |
| بروتين ستاندرد 2 ملغ BSA | سيغما | P5619-25VL | |
| بيرس فحص البروتين BCA الكاشف A | الحرارية فيشر العلمية | 23223 | |
| الدقة بالاضافة الى معيار البروتين | راد الحيوي | 161-0373 | |
| [125I]-البروتين، نشاط معين | بيركن، إلمر |
الجدول 2. الكواشف محددة.
| الكواشف | الصيغ |
| 10٪ SDS | 10 ز SDS، 100 مل DI H 2 0 |
| 1 SDS٪ (الرقم الهيدروجيني إلى 8.2) |
|
| الحل الثاني كبريتات النحاس |
|
| 3X عينة الواق |
|
| 1X عينة الواق | تمييع 3X الواق عينة وصولا الى عازلة عينة 1X باستخدام DI H 2 0 |
| 10X تشغيل المخزن المؤقت (يجعل 4 L) |
|
| 10X عازلة لنقل: (يجعل 4 L) |
|
| الشقائقية |
|
| 0.2٪ حمض الهيدروكلوريك الحل | 5.2 مل من حمض الهيدروكلوريك في 500ml من H DI 2 0 |
| PVP-T20 حجب Soln. (يجعل 4 L) |
|
| 10X الاحتياطي لطخة (يجعل 4 L) |
|
معايير هيدروكسيلاز التيروزين: وتستمد معايرة TH البروتين والفسفرة المعايير المستخدمة من قبل هذا المختبر من مقتطفات خلية PC12، والتي تم تحليلها لمحتوى البروتين عشر وstoichiometries الفسفرة ضد المعايير TH معايرة سابقا التي نشأت في نهاية المطاف من المختبر الدكتور جون هايكوك 11 .
References
- Trevitt, J. T., Carlson, B. B., Nowend, K., Salamone, J. D. Substantia nigra pars reticulate is a highly potent site of action for the behavioral effects of the D1 antagonist SCH23390 in rat. Psychopharmacology. 156, 32-41 (2001).
- Salvatore, M. F., Pruett, B. S., Spann, S. L., Dempsey, C. Aging reveals a role for nigral tyrosine hydroxylase ser31 phosphorylation in locomotor activity generation. PLoS ONE. 4, e8466 (2009).
- Rossato, J. L., Bevilaqua, L. R. M., Izquierdo, I., Medina, J. H., Cammarota, M. Dopamine controls persistence of long-term memory storage. Science. 325, 1017-1020 (2009).
- Keller, C. M., Salvatore, M. F., Pruett, B. S., Guerdin, G. F., Goeders, N. E. Biphasic dopamine regulation in mesoaccumbens pathway in response to non-contigent binge and escalating methamphetamine regimens in the Wistar rat. Psychopharmacology. 215, 513-526 (2011).
- Lu, L., Dempsey, J., Liu, S. Y., Bossert, J. M., Shaham, Y. A single infusion of brain-derived neurotrophic factor into the ventral tegmental area induces long-lasting potentiation of cocaine seeking after withdrawal. J. Neurosci. 24, 1604-1611 (2004).
- Hoffer, B. J., Hoffman, A., Bowenkamp, K., Huettl, P., Hudson, J., Martin, D., Lin, L. F., Gerhardt, G. A. Glial cell line-derived neurotrophic factor reverses toxin-induced injury to midbrain dopaminergic neurons in vivo. Neurosci. Lett. 182, 107-111 (1994).
- Salvatore, M. F., Zhang, J. L., Large, D. M., Wilson, P. E., Gash, C. R., Thomas, T. C., Haycock, J. W., Bing, G., Stanford, J. A., Gash, D. M., Gerhardt, G. A. Striatal GDNF administration increases tyrosine hydroxylase phosphorylation in the rat striatum and substantia nigra. J. Neurochem. 90, 245-254 (2004).
- Lu, L., Wang, X., Wu, P., Xu, C., Zhao, M., Morales, M., Harvey, B. K., Hoffer, B. J., Shaham, Y. Role of ventral tegmental area glial cell-line derived neurotrophic factor in incubation of cocaine craving. Biol. Psychiatry. 66, 137-145 (2009).
- Lavicky, J., Dunn, A. J. Corticotropin-releasing factor stimulates catecholamine release in hypothalamus and prefrontal cortex in freely moving rats as assessed by microdialysis. J. Neurochem. 60, 602-612 (1993).
- Salvatore, M. F., Pruett, B. S. Dichotomy of tyrosine hydroxylase and dopamine regulation between somatodendritic and terminal field areas of nigrostriatal and mesoaccumbens pathways. PLoS ONE. 7, e29867 (2012).
- Salvatore, M. F., Garcia-Espana, A., Goldstein, M., Deutch, A. Y., Haycock, J. W. Stoichiometry of tyrosine hydroxylase phosphorylation in the nigrostriatal and mesolimbic systems in vivo: Effects of acute haloperidol and related compounds. J. Neurochem. 75, 225-232 (2000).
- Salvatore, M. F., Waymire, J. C., Haycock, J. W. Depolarization-stimulated catecholamine biosynthesis: involvement of protein kinases and tyrosine hydroxylase phosphorylation sites in situ. J. Neurochem. 79, 349-360 (2001).
- Haycock, J. W., Lew, J. Y., Garcia-Espana, A., Lee, K. Y., Harada, K., Meller, E., Goldstein, M. Role of serine-19 phosphorylation in regulating tyrosine hydroxylase studied with site- and phosphospecific antibodies and site-directed mutagenesis. J. Neurochem. 71, 1670-1675 (1998).
- Lindgren, N., Xu, Z. Q., Linskog, M., Herrera-Marschitz, M., Goiny, M., Haycock, J. W., Goldstein, M., Hokfelt, T., Fisone, G. Regulation of tyrosine hydroxylase activity and phosphorylation at ser19 and ser40 via activation of glutamate NMDA receptors in rat striatum. J. Neurochem. 74, 2470-2477 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved