Method Article
Substantia Nigra 및 복부 Tegmental 지역의 도파민 규정의 종합적인 프로파일
요약
도파민은 분명히 세포 기관 및 도파민 뉴런의 dendrites을 포함 midbrain의 핵에서 규제하고 있습니다. 여기 substantia nigra (SN)과 설치류의 복부 tegmental 지역 (VTA)의 midbrain의 핵에 도파민 규정에 따라서 절개 및 샘플 처리 결과를 극대화하는 접근 방식과 결론 및 통찰력을 설명합니다.
초록
도파민은 CNS에 적극적으로 공부 신경 전달 물질이다. 사실, 전위의 활동 및 보상 관련 행동의 개입은 도파민 조절과 관련된 분자 결함으로 문의 50 여년간을 육성하고있다. nigrostriatal 및 mesoaccumbens 경로의 터미널 필드 지역의 규제에 대한 분자 기초시 뇌 초점에서 도파민 규제 이러한 질문의 대부분은, striatum과 핵의 accumbens. 또한, 이러한 연구는 서부 유럽 표준시 조직 무게로 정상화와 도파민 조직 내용의 분석을 집중하고 있습니다. 같은 티로신 hydroxylase (TH) 단백질 번째 인산화, 도파민 수송 (DAT) 및 기공을 갖는 모노 아민 전송기 2 (VMAT2) 단백질로, 도파민 조절 단백질의 조사는 종종 동일한 예제에서 도파민 조직 내용의 분석에 포함되지 않습니다. 도파민 조직 내용과 그 조절 단백질 (POST-tra를 포함하여 모두를 분석할 수있는 능력nslational 수정)은 단백질 수준과 TH, DAT, 또는 VMAT2의 기능과 도파민의 관계를 해석에 내재된 능력을 제공, 또한 샘플 경제를 확장뿐만 아니라. 아직은 적은 비용,로이 번역은 수사관 '선택의 거의 모든 패러다임에서 도파민의 분자 조절에 대한 식견을 생산하고 있습니다.
우리는 midbrain에 분석을 집중. SN 및 VTA는 일반적으로 도파민 규제 대부분의 연구에서 소홀히하고 있지만, 이러한 핵 쉽게 실천으로 해부한다. 종합 도파민 조직 컨텐츠와 TH의 판독, DAT, 또는 VMAT2가 실시됩니다. 이 행위에 대한 SN 및 VTA의 도파민 기능의 영향에 문학 급성장, 그리고 그 안에 1-5 외인성 물질 또는 질병 프로세스의 impingements있다. 또한, 이러한 성장 요인과 같은 화합물은 SN 또는 VTA에서 비교적 큰 범위까지, 도파민과 도파민 조절 단백질에 지대한 영향을 미칠 우리는이 두 핵 각각의 핵 (그림 1) 특정 생체내에서 도파민 규정의 분자 메커니즘을 공개 프로필을 생산하고 해부 조직의 샘플 처리를 분리하는 해부의 기술을 설명합니다.
프로토콜
1. 해부
- 축축한 얼음 침대에서 쥐 두뇌 매트릭스 (코로나 부분은 떨어져 1mm를 차별), 5 면도칼이 들어있는 배양 접시, 그리고 # 11 메스를 진정 하라구. 별도의 용기에, 장소는 드라이 아이스에이 ML 사이즈 microfuge 튜브를 분류.
- 조사는 안락사의 방법을 선택합니다. 우리는 isoflurane, 이상적으로, 기화기를 사용하여야있는 매우 간단한 마취를하고 재현성 결과가 있습니다. 다만, 사용할 수 없습니다, 우리는 플랫폼을 포함하는 대형 배터리 항아리를 사용합니다. 승인된 환기 후드에있는 배터리 병으로 플랫폼 아래 isoflurane-포화 거즈 패드를 배치하고 isoflurane은 배터리 항아리를 포화 수 있도록 3-5분을 기다립니다. 내부 쥐를 삽입하고 바로 쥐 의식을 잃은로 잘린 위해 제거합니다. 신속하게 뇌 (이상 2 분안에) 차가운 물 속에 린스를 제거하고 냉장 쥐 두뇌 매트릭스에 즉시 배치합니다.
- 입장시 1 분에매트릭스로 뇌를 접근한 것은 striatum 및 핵의 accumbens은 midbrain의 핵 이외에 분석을 위해 필요한 경우 광학 chiasm에 주동이의 2mm 주위 시작 냉각 두뇌로 차가운 면도날을 삽입합니다. , 폰스래요 통해 중간에 도착할 때까지 각 1mm 섹션으로 차가운 면도날을 삽입 각 개별 블레이드의 쉽게 제거를 촉진을 줄 수있는만큼 각 후속 면도날의 배치를 역에서 계속합니다.
- 면도칼을 끌어낼 때, 해마의 시작을 찾습니다. 그림 2에서 그림과 같이 완전히 midbrain을 감싸되면, # 11 메스 블레이드를 사용하여 섹션을 시작합니다.
- 즉시 드라이 아이스에 미리 냉각 microfuge 관으로 해부 조직을 넣으십시오. 쥐 년, 두 코로나 조각과 세의 최대 최소에서 SN과 VTA 해부 수 있기를 기대합니다. 스토어 티슈 -80 ° C에서 처리를위한 준비까지.
2. 조직 분석 : HPLC F혹은 도파민과 Metabolites
HPLC 장비 및 유지 보수에 대한 완전한 정보를 보려면, 원고 끝에 HPLC 분석을 참조하십시오.
- 부드럽게 즉시 역할 20 NG / ML의 농도에서 N-메틸 도파민을 포함 드라이 아이스를 사용하여 얼음처럼 차가운 0.1 M HClO 4-EDTA (에틸렌 다이아 민 테트라 초산) 용액 (0.1 M HClO 4 & 0.1 밀리미터 EDTA (에틸렌 다이아 민 테트라 초산)) 9에서 제거 후 조직을 homogenize HPLC 분석시 시료의 회복을위한 내부 표준입니다. 우리가 사용하는 균질 화기는 전체 전력의 10 %에서 설정을 가진 브랜 Sonifier 150 (10 1)입니다. 다음 sonication 볼륨을 권장하고 있습니다 :
시궁창에서 SN μl = 250 (일방적 해부), μl 400 (양쪽 절개), VTA = 200 μl (일방적 해부), 400 μl (양쪽 절개).
에서 마우스, (단지 양자 해부), SN = 200 μl, VTA = 200 μl. - 균질화 후, 드라이 아이스에 샘플을 누르고 있습니다. 샘플 그때 centrif 있습니다12,000 rpm으로 uged (듀퐁 Sorvall Microspin 24 폭격기) 침전에 단백질이 펠렛 서양 얼룩의 결정에 사용될 수 있습니다. supernatants는 HPLC에 직접 주입합니다. 다음 사출 볼륨 쥐 또는 마우스의 정확한 분석을 위해 권장됩니다 (. 중 초등학교에서) SN = 150 (. 어느 초등학교에서), VTA = 160 μl
- 주식 기준은 도파민 성분의 monoamines과 metabolites의 해당 금액 * 0.1 M perchloric 산에 0.1 밀리미터 EDTA (에틸렌 다이아 민 테트라 초산)를 추가하여 1 밀리그램 / ML에 준비가되어 있습니다. 각 화합물의 농도는 5 밀리그램 / ML은 트립토판을 제외한 1 밀리그램 / ML입니다. 필요할 때까지 주식 표준은 10 μl aliquots로 나누어 ultralow에 저장됩니다.
* 모든 가중치는 해당되는 경우 화합물의 소금 양식에 대한 수정합니다.
perchloric 산성 용액의 100 ML에 주식 표준의 10 μl 나누어지는을 diluting하여 작업 표준을 준비합니다. 작업 표준의 농도는 0.5 μg / ML은 트립토판을 제외한 0.1 μg / ML입니다. 50 μl이 작업 표준은 25 NG입니다 트립토판을 제외한 각 구성 요소의 5 NG의 온 - 컬럼 금액 HPLC에 주입된다. - 샘플 나누어지는 내에서 도파민 회복의 결정 :
샘플 나누어지는에서 도파민 회복을 결정하기 위해 관련된 여러 단계가 있습니다. - 첫째, 표준의 도파민 피크의 높이에 의해 시료의 도파민 피크 높이를 분할하고 표준에서 도파민의 총 금액 (NG)하여이 비율을 곱하면됩니다. 우리의 표준 도파민 농도는 표준 0.1 / NG μL와 50 μL가 assayed이다. 따라서 표준에서 도파민의 수량은 5 NG입니다. 따라서, 아래 방정식은 주어진 예제에서 결정 도파민 복구에 사용할 수 있습니다 :
(표준의 샘플 / 도파민 피크 높이 도파민 피크 높이) * 5 NG - 내부 표준 N-메틸 도파민을 사용하여 시료의 손실 수정 :
N-메틸 도파민의 실제 복구는 N-메틸 dop를 나누어 도파민과 같은 방식으로 계산됩니다표준의 N-메틸 도파민 피크의 높이에 의해 및 표준의 N-메틸 도파민의 총 금액 (NG)하여이 비율을 곱한 예제에서 아민 피크 높이. 도파민과 마찬가지로 우리의 표준 N-메틸 도파민 농도가 0.1 NG / μL입니다. 표준의 50 μL가 assayed됩니다. 따라서, 표준의 N-메틸 도파민의 양이 5 NG입니다. 따라서, 아래 방정식은 주어진 예제에서 N-메틸 도파민 복구를 결정하는 데 사용할 수 있습니다 :
(표준의 예제에서 N-메틸 도파민 피크 높이 / N-메틸 도파민 피크 높이) * 5ng
그러나, 때문에 각 예제에서 N-메틸 도파민하지 시료 자체에서하지만, HPLC 버퍼에서 유래, 각 샘플에서 예상 N-메틸 도파민의 양을 계산한다. HPLC 버퍼에 N-메틸 도파민 농도는 20 NG / ML이나 0.02가 μL / NG 때문에 각 예제에서 N-메틸 도파민의 예상 금액 나누어지는 볼륨으로 HPLC 버퍼의 N-메틸 도파민 농도를 곱하여 발견되고있다 H에 사용된 각 시료의PLC 분석. 이것은 다음 방정식으로 증명된다 :
(μL / 0.02 NG) * (샘플의 나누어지는 볼륨 HPLC 분석에 사용) - 예상과 회복 N-메틸 도파민의 차이 그러면 어떤 시료 손실을 조정하여 복구할 도파민의 양을 위해를 수정하는 데 사용할 수 있습니다. 간단하게 예상되는 N-메틸 도파민의 비율을 / N-메틸 도파민을 발견하고 복구 도파민의 양을하여이 작업을 곱하면됩니다. 따라서 샘플 나누어지는에서 도파민의 양에 대한 전체적인 방정식은 다음과 주어집니다 :
(표준의 샘플 / 도파민 피크의 높이에서 도파민 피크 높이) * (샘플의 표준 / N-메틸 도파민 피크 높이의 N-메틸 도파민 피크 높이) * (μL / 0.02 NG) * (HPLC 분석에 사용되는 샘플의 나누어지는 볼륨 ) - 총 도파민은 샘플에서 나온 :
샘플 나누어지는에서 발견한 도파민의 값은 다음 주어진 샘플에 도파민의 총 금액을 추정하는 데 사용됩니다. 이것은 회수 금액 (NG) o를 나누어 이루어집니다F DA 나누어지는 볼륨 의해 시료가 로그 sonicated 것을 HPLC 버퍼의 총 부피하여이 값을 곱한 이것은 아래의 방정식에 의해 주어집니다 :
(예제에서 도파민의 양을 (NG) 나누어지는 / 샘플 나누어지는의 볼륨) * (샘플 sonicated되었고 HPLC로 버퍼의 총 부피).
독자는 도파민 조절 SN 및 VTA뿐만 아니라에 단백질지만, striatum 및 핵 accumbens뿐만로부터 설치 했어요과 함께 도파민과 metabolites의 평가의 종합적인 프레 젠 테이션에 대한 다음 연구 2,4,10라고합니다.
3. 조직 분석 : TH 및 DAT 결과 총 단백질과 결승 정규화
- 4 ° C를 유지하기 위해 서부 유럽 표준시 얼음으로 시켰던 단백질 알약을 (HPLC 버퍼 처리에서 파생된) 장소 모든 버퍼가 제거와 (확실한 분석이 필요한 경우) 보관되었는지 확인하십시오. SN 또는 VTA가 (단지 쥐) 양자 처리하는 경우, 300 μL (SN) 또는 2를 추가1퍼센트 SDS는 5 밀리미터 트리스 (산도 8.3)과 펠릿 및 sonicate 1 밀리미터 EDTA (에틸렌 다이아 민 테트라 초산)를 포함한 중 00 μL (VTA). 일방적 절개의 조직을 처리하는 경우 VTA 알약으로 SN 쥐똥 또는 100 μl로 SDS 용액 150 μL를 추가합니다.
- 단백질 변성을 완료하고 실온으로 냉각 있도록 ~ 5 분 동안 근처의 끓는 물에 샘플을 놓습니다. 확인 모자는 안전이 단계에서 개최됩니다.
- 40 μg 단백질 - 단백질 표준 곡선 (알부민 기준) 2의 범위를 포함 BCA 분석을 사용하여 샘플에서 단백질 농도를 확인합니다. 검정 5 μl의 세중의에서 샘플의 볼륨과 표준 곡선으로부터 단백질 량을 결정하는 평균 값을 사용합니다. 단백질 농도에 대한 분석 볼륨으로 나눕니다. 이것은 총 단백질 회복에 총 TH, DAT, 그리고 VMAT2 결과를 정규화를 위해 촬영한 두 단계의 첫 번째입니다.
- 10% 아크릴 아미드 g에서 SDS-전기 영동을 줄이기위한 샘플 버퍼로 샘플을 (dithiothreitol를 포함)의 준비ELS. 이상적으로, 마지막 총 단백질 농도는 ~ 2 μg / μl 있어야합니다. 이 농도 선택에 대한 이유는 전체 단백질의 ~ 100 μg가 정확 ser31 및 ser40 번째 인산화 수치로드에 필요한 있기 때문입니다 번째 인산화의 궁극적인 결정에 필요한 샘플 볼륨을 줄이는 것입니다. 옐로우 색상이 샘플 버퍼를 삽입한 후 예제에서 볼 경우, 샘플이 너무 산성이다. 블루 색상이 복원되기 전까지 10 μl 단위로 1 M 트리스 (산도 8.2) 추가합니다.
- 도파민 조절 단백질의 다음과 같은 결정에 대해 다음과 같이 샘플을 준비 :
- TH : TH 단백질을위한 보정 표준 (NG 등), SN에서 TH의 농도 (총 μg 단백질 당 당 NG TH)에 서는, ~부터 μg 총 단백질 2,4 당 0.05-0.27 NG TH를 범위로 예상된다 7,10,11. 5.0 NG의 TH 및 TH에 일차 항체를 사용하여 (Millipore 고양이 # AB152, PVP T의 1:1000 희석 - 0.5에서부터 선형 TH 표준 곡선, 반대선형 표준 곡선을 생산 -20 차단 솔루션), SN에서 총 단백질의 최적의 부하는 ~ 10 μg이어야합니다. VTA의 TH의 농도는 ~ 0.4 μg의 단백질 4,11 당 1.0 NG 일까지 범위. 따라서, VTA에 대한 전체 단백질로드 ~ 5 μg이어야합니다.
- DAT : SN 또는 VTA의 DAT의 상대 수량은 striatum과 핵 accumbens 4 기원 터미널 필드 지역에서 적은 그보다 훨씬 있습니다. 복구된 TH 단백질로 정규화로 DAT의 상대적인 표현도 SN 및 VTA에 상당히 낮습니다. 따라서, SN 또는 VTA에서 DAT 단백질을 quantifying위한 단백질로드 터미널 현장 영역의 샘플 부하에 비해 훨씬 더 있어야합니다. 총 단백질의 30 μg의 최소 VTA의 DAT 평가의 정밀도에 필요한 50 μg 총 단백질의 공칭 부하는 SN의 평가에 대한 필요성입니다. 사용된 일차 항체는 산타 크루즈, 고양이 # SC-1433입니다.
- VMAT2 : VMAT2의 표현, 총 단백질뿐 정상화, nigrostriatal 지역보다 mesoaccumbens에 많습니다. 그러나 TH 표현에 상대, VMAT2 표현은 striatum 4 SN 및 최소로 최고입니다. 산타 크루즈 고양이 # SC-15314, ~의 공칭 총 단백질 량 40 μg VMAT2의 부량 위해 최선이 될 수를 사용.
- 10 % 아크릴 아미드를 젤에서 SDS-PAGE를 사용하여 총 단백질의 적절한 수량을 실행합니다. 바이오 방사선 프로 테우스 II 전기 영동 장치는 대형 겔 포맷 결정을 위해 사용됩니다. 0.45 μm의 기공 크기의 nitrocellulose에 단백질을 전송합니다. 송금의 경우 Hoeffer 탱크는 적어도 27 볼트로 설정하면 전송이 밤 내내 자리를 차지할 수 있습니다.
- blots가 ~ 5 분간 개양귀비빛의 S 용액 (5 % 빙초산의 1% 개양귀비빛의 S)와 얼룩 후 최소 30 분 동안 건조하고 허용합니다. 개별 단백질 밴드가 명확하게 해결하고 배경 염색법이 제거되기 전까지 0.2 % HCL 용액과 함께 강력하게 드 - 얼룩. 개양귀비빛의 S 얼룩의 이미지를 구합니다ING 더 나아가 각 차선 상대적인 단백질 부하를 계량하고 TH, DAT, 또는 VMAT2 결과 (그림 3)을 정상화하기 위해 이미지 J를 사용합니다.
4. 조직 분석 : 사이트 특정 회 인산화
ser31 또는 ser40에서 TH의 인산화 12 catecholaminergic 세포에서 L-DOPA의 생합성을 높일 수 있습니다. SN 및 VTA이 설정되지 않은 같은 dopaminergic 두뇌 지역에서 L-DOPA의 생합성 증가하는 데 필요한 각 사이트의 인산화의 양은, ser31 인산화은 L-DOPA의 생합성 10 규제와 검사와 함께 공동 다릅니다에서 중요한 역할을한다는 증거가 있지만 striatum 간의 조직 콘텐츠, 핵 accumbens, SN 및 VTA 2, 10. 수많은 연구가 인산화의 한계가 12에 도달되는 경우 특히 그것이, TH 활동에 영향을 미칠 수있다는 걸 보여 같이 그럼에도 불구하고, ser40 결정의 함유 물질이 필요합니다.
동안 ser19 phosphorylati혼자 13,14를 TH 활동에 영향을주지 않습니다에, 그것은 주어진 검사가 신경 세포의 + - 종속 신호 칼슘 2에 대한 센티넬 간주될 수 세포외 칼슘 2 + 조건에게 12 depolarizing 아래 ser19 인산화을 높이는 것이 필요합니다. 또한, 전용 SN 및 VTA 10 ser31 인산화과 ser19 인산화의 중요한 긍정적인 상관 관계가 ser19 인산화 상태가 ser31 인산화에 영향을 미칠 수있다는 뜻을 나타내는, 존재, 따라서 간접적으로 L-DOPA의 생합성.
사이트 관련 번째 인산화의 stoichiometry의 최적 부량위한 샘플 하중 고려 사항 : 아래는 해부 조직에서 사이트 특정 회 인산화의 정확하고 정밀한 결정에 필요한 고려 사항을 설명하고있다. 가능한 경우 보정 번째 인산화 표준은 샘플 번째 인산화의 평가에 포함되어야한다. 샘플로드 ACC 고려한다각 인산화 사이트에서 ount 고유의 stoichiometry 그래서 분석이 사용되는 항체의 동적 작동 범위 내에서 인산화을 quantifies니다. 최종 메모으로, 각각의 샘플에 대한 분석으로 유입되는 고유의 총 단백질은 또한 표준 곡선 레인에로드되어야합니다. 이것은 쉽게 TH를 표현하지 않는 캐리어 단백질 (예 : 쥐의 간 등)로 이루어진다.
- . 0.25 2,10,11 - ser19 세 인산화 사이트 중에서 ser19 인산화의 stoichiometry 수준은 0.15에 이르기까지, SN 및 VTA에서 가장 큰 있습니다. 다른 고려 사항은 우리의 검출 방법에 의해 ser19 PS는 0.5 및 5.0 NG phospho-ser19 10 사이의 선형 범위에 계량되어있다는 것입니다. ser19 회 인산화의 안정적인 측정을 제공하는 - 이러한 고려 사항, 5 및 10 기 (2.5 NG phospho-ser19 샘플에서 이처럼 예상 0.75을주는) 사이 총 TH 단백질 하중을 감안할 때. 우리는 1:1000 희석시 (Cat. # p1580-19) Phosphosolutions은 기본 사용.
- . 0.10 2,4,10,11 - ser31 ser31 인산화의 stoichiometry 수준은 ~ 0.04에 이르기까지 자신들의 조상이 같은 터미널 필드 지역에 비해 SN 및 VTA에 비교적 적습니다. 우리의 검출 방법으로 ser31 PS 0.5 및 7.0 NG phospho-ser31 10 사이의 선형 범위에서 감지된다. 이러한 고려 사항, (즉 약 0.50을 부여 - 샘플에서 3.0 NG phospho-ser31) 10 30 NG 사이 총 TH 단백질 하중을 감안할 때 ser31TH 인산화의 안정적인 측정을 제공합니다. ser31 부량의 예를 들면 그림 4A를 참조하십시오. 우리의 주요 항체는 우리 사내 표준 2를 사용 phospho-에피토프을 21 세기 Biochemicals (보스톤, MA)에 의해 제조하고, 특이성에 대한 확인되었다 내부 친화성 - 정화 항체이다.
- ser40 SN과 ~ 0.02에서 VTA 범위에서 ser40 인산화의 stoichiometry 수준 -. 0.06 2,4,10,11. 우리의 검출 방법의 기준er40 PS는 0.2 및 2.0 NG phospho-ser40 10 사이의 선형 범위에서 감지된다. 이러한 고려 사항, (즉 약 0.20을 부여 - 샘플에서 1.8 NG phospho-ser40) 10 30 NG 사이 총 TH 단백질 하중을 감안할 때 ser40TH 인산화의 안정적인 측정을 제공합니다. ser40 부량의 예를 들면 그림 4B를 참조하십시오. 우리는 1:1000 희석시 (Cat. # p1580-40) Phosphosolutions는 기본 사용합니다.
5. 대표 결과
- SN 대 VTA의 도파민 정량 분석에 취해질 수 도파민 세 설치 했어요 (또는 metabolites)가 있습니다,. 해부로부터 복구 합계에 따라, 당 단백질, 그리고 TH 단백질 (striatum, SN, 핵의 accumbens에 대해 시연, 당 및이 아래 표 1에서 VTA). SN 및 VTA 사이 총 도파민 복구 2 ~ 3 코로나 슬라이스 해부도 2 6-9 기 사이에 이르기까지 매우 비교됩니다. 총 단백질로 도파민 복구를 정상화하는 것은 THA 표시됩니다절개 방법에 기반을 떠는, VTA는 SN의 6-8 NG / MG 단백질과 VTA 2, 4 9-10 NG / MG 단백질 평균, 총 단백질 당 더 많은 도파민을 것이라고, 고용. 마지막으로, 총 회수 일까지 도파민의 정상화 또한, SN 및 VTA 사이의 차이를 밝히지 VTA 10 큰 권력은 0.2와 0.8 사이에 이르기까지한다 NG 두 지역 2,10 사이에 도파민 당 NG TH 단백질.
DA 지역 총 검찰이 회복 MG 단백질 당 검찰 DA 당 NG의 TH striatum 214 ± 16 165 ± 13 0.56 ± 0.11 SN 8.4 ± 0.8 6.1 ± 0.5 0.18 ± 0.03 은밀한 교류cumbens 60 ± 6 75 ± 4 0.77 ± 0.03 VTA 6.0 ± 1.0 9.2 ± 1.4 0.22 ± 0.03 - 총 단백질 : 부량 위해 보정된 TH 단백질 표준을 사용하여 TH, DAT, VMAT2 더 TH는 절개 (SN 60 NG와 VTA 2 26 기)에서 VTA보다 SN에서 발견된다. 그러나 단백질로 정규화하면,이 관계는 VTA가 ~ 3가되는 총 단백질 당 TH 함께 반대 - SN에 비해 5 배 이상으로, (SN의 VTA와 ~ 0.09에 ~ 0.32 NG / μg 단백질) 4, 10.
SN 및 VTA의 DAT의 예상 복구 4 회수 총 단백질 당 또는 총 TH 당만큼 VTA에서 약간 더 회복과 함께 비슷합니다. 특히, DAT 단백질은 동족의 터미널 필드 지역 사에 비해 훨씬 풍부한이 지역에있다 를 한모금.
총 단백질 당 등 VMAT2 복구 VTA 대 SN 4 많습니다. 그러나 TH 단백질로 정규화하면 SN 4 조금 더 회복이 있습니다. - 연구의 여러 사이트에서 다른 사이트로 특정 회 인산화, ser19, ser31에서 일관된 결과가 있었 있으며 ser40 인산화의 SN 및 VTA의 수량과 동족의 터미널 필드 지역에 관계 인치 Ser19 인산화는 striatum과 핵 accumbens (~ 0.05-0.15) 2,4,7,10,11에 비해 SN 및 VTA (~ 0.2-0.3)에서 특히 큽니다. 이러한 somatodendritic 지역 2,4,7,10,11 사이에 0.10 - Ser31 인산화이 ~ 0.06되고, 그들의 기원 터미널 필드 지역에 비해 SN 및 VTA에 상당히 적습니다. NSD-1015과 방향족 산성 탈카복실화효소의 억제 동안 불과 10 VTA의 ser31 인산화의 2 배 이상 증가가있다. 0.02와 0.05 SN과 사이 Ser40 인산화 범위VTA는 일반적으로이 stoichiometry가 크게 기원 터미널 현장 지역 2,4,7,10,11 다를하지 않습니다.

그림 1. 한명 조직 해부의 Dopaminergic 설치 했어요.
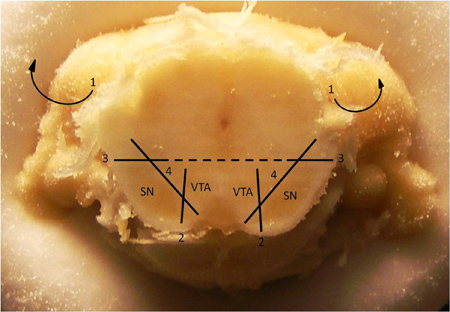
midbrain dopaminergic neuropil를 격리 그림 2. 절개 기법. 복부 tegmental 지역 (VTA)에서 substantia nigra (SN)을 해부위한 기법. 1. overlying의 피질과 해마 (이러한 구조가 이미 위의 이미지에서 제거되었습니다)를 제거합니다. 2. VTA에서 SN의 색소 영역을 분리하는 수직 절개를합니다. 3. 단지 SN의 지느러미와 측면 대부분 위의 중간선이나 근처의 수평 절개를합니다. 4. 멀리 brainstem의 나머지 부분에서 SN 애무 해줘. 일단 SN이 제거되었고, 비슷한 거리에서 VTA을 괴롭혀midbrain의 나머지. 참고 :이 섹션은 일반적으로 AP 5.7에서 Bregma에 대한 상대 좌표,에서 관찰된다.

그림 3. 두 번째 (이자 마지막) 이미지 J 분석을위한 총 단백질로드 개양귀비빛의 S 염색법의 정상화. 쥐 substantia nigra 샘플에 총 번째 결정 개양귀비빛의 S 단백질 염색법. 처음 다섯 차선 어느 쥐의 간 homogenate에서 28 μg 단백질은 substantia nigra 샘플의 단백질 량을 미러링하기 위해 추가되었습니다 위해, 표준 총 번째 커브를 왼쪽으로하고 있습니다 형성하고 있습니다. 다음 차선은 분자량 (MW) 마커가 포함되어 있습니다. 나머지 차선은 쥐의 substantia nigra 샘플에서 ~ 28μg 단백질을 포함하고 있습니다. 단백질로드는 BCA 방법에 의해 결정되는대로 각 시료의 단백질 농도를 기준으로합니다. 그러나 평등로드해야 하는것과는 달리 약간을 나타내는 샘플 간의 개양귀비빛의 S 염색법의 어둠에 변화가 없습니다각 샘플에 대해 개양귀비빛의 S 염색법의 양을 분석 ImageJ 분석을 이용하여 정규화에 의해 수정되었습니다 단백질 농도에서 변화.

그림 4. 컨트롤과 트리 트먼트의 대표 번째 인산화 결과. 대표 ser31 phosphorylated 티로신 hydroxylase (PTH)와 이전의 연구 4. A.에서 염분과 필로폰 취급 Wistar 쥐처럼에서 ser40 PTH 서양 blots 쥐 substantia nigra 샘플에 백산 31 PTH. 0.3 NG에서 2.0 NG 및 감지 선형 범위 내에 보정 백산 31 PTH 표준 곡선 범위. 총 번째 수준의 이전 서양 얼룩 분석을 바탕으로 총 TH 6 NG는 각 샘플에 대해로드되었습니다. B.이 쥐의 복부 tegmental 샘플에 ser40 PTH. 보정 ser40 PTH 표준 곡선 범위를 0.2에서 1.5 NG NG 및 감지 선형 범위 내에. 총 번째 수준의 이전 서양 얼룩 분석을 바탕으로 총 TH 9 NG는 각 샘플에 대해로드되었습니다.
토론
그림 1에 명시된 바와 같이 위에 설명된 방법은 도파민의 여러 설치 했어요 그리고 쥐 드나 마우스 중 하나에서 얻은 SN 또는 VTA 중 하나를 샘플로부터 조절 단백질의 TH, DAT, 그리고 VMAT2를 얻을 수 있습니다. 다시 말하지만,이 프로토콜을 수행의 장점은 조사가 도파민은 거의 모든 실험적인 패러다임 하에서 생체내에서 규제하고, 그동안, 어떤에서 필요한 동물의 수를 줄임으로써 상당한 실험 자료를 저장하는 방법의 작전상-일치 설치 했어요를 얻을 수 있습니다 실험.
이 조사는 얼음처럼 차가운 HPLC 버퍼의 해부 (4 ℃), 조직의 저장 용량 (최소 -70 ° C), 조직 sonication (보관 온도의 탈퇴 후 즉시 sonication)시 부과 온도 요구 사항을 관찰하고있는 절대적으로 필수적입니다 이후 펠렛 형성 및 가공. 펠렛은 sonicated 및 SDS 용액에 삶은되면 샘플 furth가 계속 발생할 수 있습니다어 실온에서 처리. 보관된 HPLC의 스토리지 샘플을 분석하고 단백질 분석을위한 샘플 버퍼 준비된 샘플은 -80에 도착할 ° C.
다시 말하지만, 프로토콜의 주요 장점은 생체내에서 도파민 규제에 관한 작전상 - 경기 결과에 타고난 접근 방식이다. 또한, dopaminergic neuropil의 마커 (TH, DAT) 탐정임을 보증의 큰 척도를 제공에 도파민 조직 설치 했어요를 정상화 일관성 및 정확도와 SN 또는 VTA을 해부. 중독, 정신 장애, 그리고 전위의 경기장에서 도파민의 참여 감안할 때,이 프로토콜은 많은 실험에 채용된 수 있습니다. 하나 주목할만한 제한은 그것이 이번 ser31 또는 ser40의 인산화 증가는 L-DOPA의 생합성 증가하는 생체내에 필요한 범위에 한계가로서 번째 인산화 결과의 해석은, 보수해야한다는 것입니다. 언급했듯이 그러나, EV가ser31 인산화은 L-DOPA의 생합성 조절하기 위해 나타나고있는 idence은 CNS 2,10에 총 도파민 조직 콘텐츠를 규제의 역할을하고 있습니다. 이때 TH 단백질 및 번째 인산화에 대한 기준은 상업적으로 사용할 수 없습니다. 그러나,이 실험실은 생체내의 회 인산화 조절에 관한 최초의 논문은 11을 발행되었을 때 사용되는 근거로 그런 기준을 유지하고 확장했다. 그럼에도 불구하고 그것은이 프로토콜을 사용하여 이러한 개별 지역의 복구 TH 단백질로 도파민 조직 컨텐츠를 정상화하는 것이 가능합니다.
공개
관심의 어떠한 충돌 선언 없습니다.
감사의 말
이 작품과 같은 2,10를 인용, 자금은 노화 연구, 에드워드 P. 스타일즈 신탁 기금 및 노스 웨스트 루이지애나의 바이오 메디컬 연구 재단에 대한 미국 연방에서 MF 살바토레에 대한 연구 기금 수상에 의해, 부분적으로 제공된 그리고 아이크 Muslow Predoctoral 원정대에서 학사 Pruett까지 LSU 보건 과학 센터 - 위조.
자료
HPLC 시스템 :
기본 시스템은 Shimadzu LC10-ADvp HPLC 펌프, 워터스시키는 717 자동 시료 주입기, 250 x 4.4 mm 5 미크론 Spherosorb ODS-1 C18 리버스 상 열 (워터스), Bioanalytical 시스템 (BAS) TL12 이중 유리로 구성되어 있습니다 탄소 전극, 두 BAS LC4B 전기 화학 감지기 및 워터스는 2 데이터 수집 및 통합 시스템의 능력을 주소서.
칼럼은 30-45에서 관리하고 있습니다 ° C (BAS LC22A 열 히터). 모바일 단계는 0.1 M의 인산 나트륨 (산도 3.0), 0.1 밀리미터 EDTA (에틸렌 다이아 민 테트라 초산), 1-옥탄 설폰산 (이스트만 - 코닥) 0.2-0.4 밀리미터, 그리고 0.45 미크론 필터를 통해 여과 0.35 %의 acetonitrile (V / V)입니다. 유속은 1.2 ML / 분입니다. 모바일 단계의 네 리터 배치는 산도, 옥탄가 Sulfonic의 산성과 열 온도를 조정하여 분판을 위해 최적화되었습니다. 모바일 단계는 재활용하고 있으며, 지속적으로 용존산소를 제거하는 헬륨 가스를 정화한다. 모바일 위상의 재활용시간의 합리적인 기간에 좋은 해상도를 유지하는 데 거의 필수적입니다. 모바일 위상 보관 수명은 각 실행의 첫 2-7 분 시간을 낭비 돌린다 플로우 스위치 (통합에 의해 제어)를 사용하여 유지됩니다.
전극은 Ag/AgC1 기준 전극에 대하여 약 0.78와 0.95V의 가능성에 유지 관리됩니다. 높은 잠재력의 전극은 트립토판 (및 NMDA 내부 표준)의 결정에 대해 독점적으로 사용됩니다. 0.78 V의 잠재력은 트립토판 이외 monoamines과 화합물의 검출을위한 잡음 비율로 우수한 신호를 제공합니다. chromatograms는 주소서 워크 스테이션의 하드 드라이브에 저장하고, 이후 처리 및 데이터 신진 대사 금액 및 그룹 데이터를 컴파일 계산을위한 Excel 스프레드 시트로 직접 전송됩니다.
펌프 : Shimadzu LC-10AD
셀 : BAS 크로스 흐름. 유리 탄소가 0.780과 0.9에서 전극을 조사50 V의 잠재력.
감지기 : BAS LC-4B는 듀얼 채널 모드에서 운영.
데이터 Acq. 시스템 : 워터스는 프로이 능력을 주소서.
분사기 : 워터시키는 717
칼럼 : 워터스 Spherosorb ODS-1, 5 μm의 입자, 4.4 mm X 250mm.
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | |
| 나트륨 Dodecyl 황산 (SDS) | - JT 베이커 | 4095-02 | |
| Trizma 자료 | 시그마 | T1503-1KG | |
| Trizma HCL | 시그마 | T3253-1KG | |
| 글리세린 | 시그마 | G8773-500 ML | |
| PVP-40 | 시그마 | PVP40-1KG | |
| dPBS | Gibco | 21600-069 | |
| Tween20 | 시그마 | P1379-500 ML | |
| 글리신 | 시그마 | G8898-1KG | |
| 개양귀비빛의 S | Fluka | 81,460 | |
| Bromophenol 블루 | 시그마 | B8026-5G | |
| Dithiothreitol | 시그마 | D-9163 | |
| 단백질 표준이 MG BSA | 시그마 | P5619-25VL | |
| 피어스 BCA 단백질 분석 시약 | 열 피셔 과학 | 23,223 | |
| 정밀 플러스 단백질 표준 | 바이오는 힘이에요 | 161-0373 | |
| [125I]-단백질, 특정 활동 | Perkin-엘머 |
표 2. 특정 시약.
| 시약 | 수식 |
| 10% SDS | 10g SDS, 100 ML DI H 2 0 |
| 1퍼센트 SDS (산도 8.2) |
|
| 구리 II 황산 솔루션 |
|
| 배 샘플 버퍼 |
|
| 1X 샘플 버퍼 | DI H 2 0을 사용하는 1X 샘플 버퍼에 3 배 샘플 버퍼를 희석 |
| 10X 버퍼를 실행하면 (4 패를 만듭니다) |
|
| 10X 전송 버퍼 : (4 패를 만듭니다) |
|
| 개양귀비빛의 |
|
| 0.2 % HCL 솔루션 | DI H 2 0 500mL에서 5.2 ML HCL |
| PVP-T20은 Soln 차단. (4 패를 만듭니다) |
|
| 10X 얼룩 버퍼 (4 패를 만듭니다) |
|
티로신 hydroxylase 표준은 :이 실험실에서 사용하는 보정 TH 단백질 및 인산화 표준은 궁극적으로 닥터 존 Haycock 11 실험실에서 유래 이전에 보정 TH 표준에 대한 TH 단백질 함량과 인산화의 stoichiometries에 대해 분석했다 PC12 세포 추출물에서 파생됩니다 .
참고문헌
- Trevitt, J. T., Carlson, B. B., Nowend, K., Salamone, J. D. Substantia nigra pars reticulate is a highly potent site of action for the behavioral effects of the D1 antagonist SCH23390 in rat. Psychopharmacology. 156, 32-41 (2001).
- Salvatore, M. F., Pruett, B. S., Spann, S. L., Dempsey, C. Aging reveals a role for nigral tyrosine hydroxylase ser31 phosphorylation in locomotor activity generation. PLoS ONE. 4, e8466 (2009).
- Rossato, J. L., Bevilaqua, L. R. M., Izquierdo, I., Medina, J. H., Cammarota, M. Dopamine controls persistence of long-term memory storage. Science. 325, 1017-1020 (2009).
- Keller, C. M., Salvatore, M. F., Pruett, B. S., Guerdin, G. F., Goeders, N. E. Biphasic dopamine regulation in mesoaccumbens pathway in response to non-contigent binge and escalating methamphetamine regimens in the Wistar rat. Psychopharmacology. 215, 513-526 (2011).
- Lu, L., Dempsey, J., Liu, S. Y., Bossert, J. M., Shaham, Y. A single infusion of brain-derived neurotrophic factor into the ventral tegmental area induces long-lasting potentiation of cocaine seeking after withdrawal. J. Neurosci. 24, 1604-1611 (2004).
- Hoffer, B. J., Hoffman, A., Bowenkamp, K., Huettl, P., Hudson, J., Martin, D., Lin, L. F., Gerhardt, G. A. Glial cell line-derived neurotrophic factor reverses toxin-induced injury to midbrain dopaminergic neurons in vivo. Neurosci. Lett. 182, 107-111 (1994).
- Salvatore, M. F., Zhang, J. L., Large, D. M., Wilson, P. E., Gash, C. R., Thomas, T. C., Haycock, J. W., Bing, G., Stanford, J. A., Gash, D. M., Gerhardt, G. A. Striatal GDNF administration increases tyrosine hydroxylase phosphorylation in the rat striatum and substantia nigra. J. Neurochem. 90, 245-254 (2004).
- Lu, L., Wang, X., Wu, P., Xu, C., Zhao, M., Morales, M., Harvey, B. K., Hoffer, B. J., Shaham, Y. Role of ventral tegmental area glial cell-line derived neurotrophic factor in incubation of cocaine craving. Biol. Psychiatry. 66, 137-145 (2009).
- Lavicky, J., Dunn, A. J. Corticotropin-releasing factor stimulates catecholamine release in hypothalamus and prefrontal cortex in freely moving rats as assessed by microdialysis. J. Neurochem. 60, 602-612 (1993).
- Salvatore, M. F., Pruett, B. S. Dichotomy of tyrosine hydroxylase and dopamine regulation between somatodendritic and terminal field areas of nigrostriatal and mesoaccumbens pathways. PLoS ONE. 7, e29867 (2012).
- Salvatore, M. F., Garcia-Espana, A., Goldstein, M., Deutch, A. Y., Haycock, J. W. Stoichiometry of tyrosine hydroxylase phosphorylation in the nigrostriatal and mesolimbic systems in vivo: Effects of acute haloperidol and related compounds. J. Neurochem. 75, 225-232 (2000).
- Salvatore, M. F., Waymire, J. C., Haycock, J. W. Depolarization-stimulated catecholamine biosynthesis: involvement of protein kinases and tyrosine hydroxylase phosphorylation sites in situ. J. Neurochem. 79, 349-360 (2001).
- Haycock, J. W., Lew, J. Y., Garcia-Espana, A., Lee, K. Y., Harada, K., Meller, E., Goldstein, M. Role of serine-19 phosphorylation in regulating tyrosine hydroxylase studied with site- and phosphospecific antibodies and site-directed mutagenesis. J. Neurochem. 71, 1670-1675 (1998).
- Lindgren, N., Xu, Z. Q., Linskog, M., Herrera-Marschitz, M., Goiny, M., Haycock, J. W., Goldstein, M., Hokfelt, T., Fisone, G. Regulation of tyrosine hydroxylase activity and phosphorylation at ser19 and ser40 via activation of glutamate NMDA receptors in rat striatum. J. Neurochem. 74, 2470-2477 (2000).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유