Method Article
İnsan İsteyerek Pluripotent Kök Hücre seçme ve ayırma Kolonileri Yetişkin Fibroblastlar gelen reprogrammed
Bu Makalede
Özet
Biz retroviral Oct3 / 4, Sox2, Klf4 ve c-myc (OSKM) kodlayan vektörler ve canlı boyama ile doğru yeniden programlanması hiPSC belirlenmesi kullanarak insan kaynaklı pluripotent kök hücreler (hiPSC) Tra-içine insan somatik hücre verimli yeniden programlama için bir protokol sunmak 1-81 antikor.
Özet
Burada 1-3 sodyum butirat varlığında Oct3 / 4, Sox2, Klf4 ve c-myc (OSKM) kodlayan retroviral vektörlerinin kullanılmasıyla insan kaynaklı hücreler pluripotent kök (hiPSC) içine insan yetişkin fibroblastlar yeniden programlanması bir protokol sunulmuştur. Biz geç geçit yeniden programlamak için bu yöntem kullanılır (> p10), FA hasta türetilen insan yetişkin fibroblastları (GM03665, Coriell depo). Yeniden programlanması yaklaşım, virüs içeren ortam varlığında fibroblastlann tekrarlanan santrifüj kullanılarak yüksek verimli transdüksiyon protokolü içerir. Reprogrammed hiPSC koloniler Tra-1-81 canlı immun kullanılarak belirlendi, pluripotent hücreler bir yüzey belirteci olmayan reprogrammed fibroblastlar ayrılır ve elle 4,5 pasajlanmağa. Bunlar daha sonra hiPSC Matrigel plakaları aktarılır ve doğrudan yeniden programlanması plakadan, besleyici içermeyen koşullar içinde büyütülmüştür. Birinci geçit başlayarak, hiPSC koloniler iEK-l karakteristiği gösterilmektedirike morfolojisi. Bu protokolü kullanmak seçilen kolonilerin fazla% 70 başarıyla genişledi ve hücre hatları içine kurulabilir. Kurulan hiPSC hatları yüzey işaretleyicileri TRA-1-60 ve SSEA-4, hem de Nükleer belirteçler Oct3 / 4, Sox2 ve Nanog dahil olmak üzere karakteristik pluripotency belirteçler gösterilmiştir. Burada sunulan protokolü kurulmuş ve Friedreich ataksisi hastalar ve kontrol bireyler 6, insan yenidoğan fibroblastlar, yanı sıra insan keratinositleri elde yetişkin fibroblastlar kullanılarak test edilmiştir.
Protokol
1. Virüs üretim ve iletimi
- DMEM ortamı (DMEM yüksek glikoz,% 10 FBS inaktive ısı, 2 mM L-glutamin, antibiyotik) 10 ml ~ 7-6 8x10 cm başına 10 plakası bir yoğunlukta plakası Phoenix Ampho hücreleri. 37 gece kuvöz ve kültür Yeri ° C,% 5 CO 2.
- 12, bir vektör kodlama ug ya Oct3 / 4, Sox2, Klf4, c-myc, veya GFP geni (Addgene plazmidler 17.217, 17.218, 17.219, 17.220) ve 35 ul Fugene 6. Kullanılarak sonraki gün transfekte Phoenix hücreleri DMEM ortamı (DMEM yüksek glikoz, 2 mM L-glutamin, hiçbir FBS ve antibiyotikler), 500 ul içinde transfeksiyonuyla karışımı hazırlayın. 20 dakika inkübe edin. Yavaşça% 70-80 konfluent Phoenix hücreleri içeren 10 cm tabak içine DNA kompleksleri Pipeti.
- 8 saat penisilin ve streptomisin içeren DMEM ortamı (DMEM yüksek glikoz,% 10 FBS inaktive ısı, 2 mM L-glutamin) ile birlikte post-transfeksiyon - ortam 6 yerini alır.
- Daha sonra, toplamak virüs içeren 12 medya 4 kez haralıklarla, tüm bölümlerini birleştirmek ve müstakil hücreleri ve enkaz (viral partikülleri içeren ortam da ise dondurulması tavsiye edilmez, bulaşıcı aktivitesini kaybetmeden 2 hafta boyunca buzdolabında muhafaza edilebilir) kaldırmak için filtre 0.45 mikron kullanarak filtrelenmiş.
- Retroviral medya koleksiyonu son gününden önce dondurulmuş bir stok 24 h retroviral iletimi, plaka insan yetişkin fibroblastlarının (pasaj 10, Coriell Laboratories) için. Tohum DMEM yüksek glikoz in oyuk başına yoğunluğu 1x10 5 hücreleri azından 6-de jelatin kaplı levhalar üzerine hücreleri,% 10 FBS, 2 mM L-glutamin, penisilin, streptomisin ve gerekli olmayan amino asitler.
- Phoenix hücrelerden elde edilen viral parçacıklar içeren ortam ile bir sonraki gün ikame DMEM ortamı. Için 1600g azından fibroblast kültürleri ve santrifüj 6-kuyulu plakanın her oyuğuna 6 mg / ml arasında polybrene ile desteklenmiş viral ortamı (1 ml, her Oct4, Sox2, Klf4, ve c-myc ortam, 4 ml toplam) ekleyin 20 de 1 H ° C. Yaklaşık 12 saat after iletimi, fibroblast kültür ortamı ile viral ortamı değiştirin. 24 saat aralıklarla viral enfeksiyon ve santrifüjleme 3 kez gerçekleştirmek.
- Son enfeksiyondan sonra 48 saat DMEM medyada Kültür fibroblastlar. GFP ifade retroviral bir ortam ile paralel transductions ile enfeksiyon kontrol edilmesi. Şekil 1, insan fibroblast santrifüjleme-kolaylaştırılmaktadır retroviral bir enfeksiyon etkinliğini göstermektedir.
2. Yeniden programlama
- Her sıra jelatin ~ 2x10 5 hücre yoğunluğunda MEF hücreleri tohumlayarak γ-ışınlanmış MEF besleyici katmanları ile 6 oyuklu plakalar hazırlamak fibroblast büyüme ortamında 6 kuyulu plakanın muamele. Ertesi gün fibroblast büyüme ortamında başına iyi ~ yoğunlukta, tripsin / EDTA ve tohum onları 1.2x10 4% 0.05 ile enfekte insan fibroblastları ayrıldı.
- Ertesi gün iEK medya (DMEM/F12,% 20 Nakavt Serum Replacement, non-esansiyel amino asitler, penicilli ile medya yerinen / streptomisin, 2 mM L-glutamin, 0.1 mM β-merkaptoetanol, 20 ng / ml bazal fibroblast büyüme faktörü (bFGF), yeniden programlanması ilk 7 gün süre ile 0.5 mM sodyum butirat ile desteklenmiş. Günlük medya değiştirin.
- Günlük transdük hücrelerinde morfolojik değişiklikler izleyin. HIPS benzeri hücreler kolonileri yaklaşık 5 oluşmaya başlayacak - 10 gün besleyici hücreler üzerine transdük fibroblastlar aktardıktan sonra. HiPSC koloniler yaklaşık 14 izole edilmeye hazır - 28 gün MEF besleyici hücreler bunları kaplama sonra.
3. HiPSC koloniler izolasyonu
- HiPSC koloniler almadan önce bir gün fibroblast büyüme ortamında γ-ışınlanmış MEF besleyici hücreler (kuyu başına ~ 4x10 4 hücreleri) ile 24-iyi plakaları hazırlamak. Bu aşamada hiPSC koloniler de Matrigel ve mTeSR1 orta kullanarak besleyici özgür kültür transfer edilebilir.
- HiPSC koloniler izolasyon öncesinde fibroblast büyüme Mediu kaldırarak MEF plakaları hazırlamakm ve FBS izlerini kaldırmak için PBS ile MEFS durulama. Daha sonra her oyuğa 7,8 ila 10 uM ROCK inhibitörü Y27632 ile 0.5 ml iEK ortamı (veya Matrigel kuyucuklar durumunda orta mTeSR1) ilave edilir.
- Gerekirse, laminar flow hood (- C Şekil 2A) monte mikroskop altında 21 gauge iğne ile hiPSC kolonileri çevreleyen fibroblastlar kaldırın. PBS ile plakaları durulayın ve Tra-1-81 StainAlive spesifik antikor (1:200, Stemgent) içeren taze iEK medya ekleyin. Sonra 30 dk., 10 uM ROCK inhibitörü ile desteklenmiş taze iEK medya ile antikor içeren medya değiştirin. Floresan mikroskop altında plakaları inceleyin ve mark-Tra 1-81 objektif bir belirteç (Şekil 2B) kullanan pozitif koloniler.
- Şekil 2E ve F. gösterildiği gibi 21 gauge iğne ile birkaç küçük parçalar halinde bir laminer kaputu mikroskop altında Tra-1-81 pozitif hiPSC koloniler, Kes
- Ind içine hiPSC kolonilerinin bir otomatik pipet (P200) transferi parçaları kullanarakMEFS veya Matrigel ile 24-kuyulu plakanın ividual kuyu. Olmayan kalça hücrelerinin transferi kaçının. Bir 37 ° C,% 5 CO2 inkübatöründe plakaları yerleştirin ve hiPSC koloniler 24-36 saat boyunca yapışabilen.
- Değişim iEK veya mTeSR1 (Matrigel yetişen koloniler için) medya günlük. Doğru embriyonik kök benzeri morfolojiye sahip hiPSC koloniler 24 sıra tabağa ilk transferini 48 saat sonra görünür olacaktır.
- El geçit hiPSC koloniler her 6 - 12-iyi ve daha sonra bir 6-iyi plaka üzerine 8 gün.
- Klonal genleşme ve hiPSC hatları kurduktan sonra, Şekil 3 'de gösterildiği gibi immünsitokimya kullanılarak pluripotency belirteçler TRA-1-60, SSEA-4, Oct3 / 4, Sox2 ve Nanog ekspresyon analiz. Genomik bütünlük ve karyotip ve teratom oluşumu analizleri 6,9 kullanılarak elde edilen hatların farklılaşma potansiyeli değerlendirin.
4. Temsilcisi Sonuçlar
Retrovirüs içeren medya i ile verimli iletimibaşarılı bir şekilde yeniden programlama için kritik. Bu, Şekil 1 'de gösterildiği gibi etkinliğini izlemek için virüsü her bir deney yeniden programlanması ifade eden bir GFP kullanılarak tamamını transfeksiyon / enfeksiyonu işlemi yürütmek için tavsiye edilir. Tipik olarak 0.5 aralığında olduğu non-konsantre viral ortamı kullanılarak, insan fibroblastlann iletimi yoluyla, 10 içinde açıklandığı gibi GFP eksprese eden virüs titreleri, tespit - 5 x 10 ml (VP / ml) başına 7 viral partiküllerin.
Fibroblast son enfeksiyonu sonrası gibi erken 2 gün olarak morfolojisi değiştirin. Tripsinize insan fibroblastları dikkatle MEF besleyici hücreler bunları tohum önce sayılmalıdır. Her hücre hattı farklı büyüme özelliği gösteren ve tohum yoğunluğu yeniden programlama verimliliği için önemlidir çünkü 3 farklı yoğunluklarda (6x10 3, 1.2x10 4, 6 ve plakanın yanı tek başına 2.5x10 4) tohum hücreleri tavsiye edilir. Için kullanılan sodyum butiratİlk 7 - yeniden programlama 14 gün hiPSC formasyonu yaklaşık 5 kat verimliliğini artırır. Sık sık, enfekte fibroblastlar yüksek yoğunlukta ekildi, özellikle fibroblast benzeri hücreler bir kültür çanak sarmak ve Şekil 2A gösterildiği gibi hiPSC koloniler kapsayabilir. Bu durumda, fibroblast tabaka dikkatlice kaldırdı ve hiPSC koloniler (Şekil 2B) ortaya çıkarmak için kaldırılabilir. Daha sonra, hiPSC koloniler iEK ortam ile durulanmış ve Tra-1-81 antikoru ile boyanmış edilmelidir. Fibroblast hücreleri bağlı olarak, yaklaşık 20 - iPSC benzeri morfolojisi ile gösteren koloniler% 40 Tra-1-81 antikoru ile leke yapmaz. 24 - Belirlenen hiPSC koloniler önümüzdeki 12 içinde bir tabak transfer edilebilir. Uzun süreli inkübasyon hiPSCs hızlı bir farklılaşma neden olacaktır. Koloniler elle MEF besleyici hücre veya Matrigel-kaplı levhalar ya üzerine pasajlanmağa devam edilebilir. Genişleme kurulan sonra hiPSC klonlar pluripoten ifadesi için immünsitokimya (ICC) kullanılarak test edilmelidirŞekil 3'te gösterildiği gibi cy markers. Ayrıca, oluşturulan iPS hücre hatları ayrıntılı bir moleküler karakterizasyonu içermelidir: RT-PCR, 9 susturmak transgenlerin bir pluripotency genler ve analizlerin promotorlerde DNA demetilasyon gösterilmesi kullanarak pluripotency gen ekspresyon analizi.

Şekil 1.. GFP retroviral medya ile üst üste iki enfeksiyonlarından sonra GFP ifade retrovirüs. (A, B), FA hasta türetilen İnsan yetişkin fibroblast (GM03665, Coriell depo) görüntülenmiştir kullanılarak belirlenir viral iletimi verimliliği. (C, D) İnsan fibroblastlar doğrudan 1600g az 1 saat için 6 oyuklu plakalar üzerine hücrelerinin santrifüj GFP retroviral ortam aynı partiden ile enfekte edilmiştir. Görüntüler enfeksiyondan sonra 48 saat ele geçirildi.

Şekil 2. HiPSC koloniler izole edilmesi ve belirlenmesi. (A) fibroblastlar çevrili hiPSCs içeren bir tabak Faz kontrastlı görüntü. Hücreler embriyonik kök medyada 21 gün kültüre edildi. Çevreleyen fibroblast tabakası uzaklaştırıldıktan sonra (B, C) aynı hiPSC koloni. (D) Doğru reprogrammed hiPSC koloniler Tra-1-81 yüzey işaretleyici antikor ile canlı boyama ile tespit edilir, steril bir iğne (E, F) kullanarak kesin ve 24 kuyulu plakanın ayrı kuyu aktarılır.
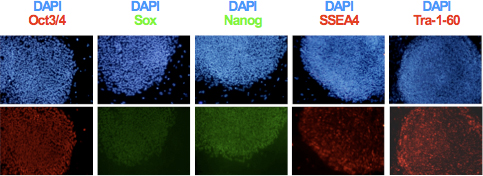
Şekil 3. Pluripotency belirli bir belirteç Oct3 / 4, Nanog, Sox2, SSEA4 ve hiPSCs in Tra-1-60 ekspresyonu immünsitokimya ile tespit edildi.
Tartışmalar
Özellikle nörolojik ve nörodejeneratif hastalıkların insan, okuyan, özellikle yeterli insan hücresel modelleri erişilememesi nedeniyle zor olmuştur. Farklı hücre tiplerine bunları ayırt etmek için oluşturulan pluripotent kök hücreleri ve potansiyel kolayca elde edilebilen somatik hücreleri yeniden programlamayı yeteneği genetik hastalıkların hücresel modeller oluşturmak için bir olasılık açtı. Ayrıca, iPSCs rejeneratif tıp gelecekte bir çok ümit vericidir. Bu nedenle, pluripotency için somatik hücreleri yeniden programlama, güvenilir, verimli ve güvenli yöntemler geliştirmek ve optimize etmek esastır.
Terapötik uygulamalar açısından bakıldığında, o ana genomunda yer kaplayan mutasyonlar yoksun iPSC nesil güvenli yaklaşımlar geliştirmek için çok önemlidir. Böyle vektörler epizomal transfeksiyon olarak yeniden programlanması hücrelerinin genomunun içine kalıcı değişikliklere yol açmadan yeniden programlanması somatik hücre yöntemleri, vergilendirilebilir tra kullanımınsposons, adenoviral enfeksiyon ve mRNA veya protein doğrudan teslim zaten 11-15 kurulmuştur. Şimdiye kadar bu transgen ücretsiz yöntemleri kullanarak yeniden programlama verimliliği düşük ve yeniden programlanan somatik hücre karakteri, türü ve yaşına bağlıdır. Bu nedenle, bu protokoller geç geçişi yeniden programlama için uygun değildir, erişkin somatik hücre sık hücre depoları yatırılır. Ayrıca, birden fazla iPSC hatlarının detaylı karakterizasyonu sağlayacak ve insan hastalıkların yeni modeller kurmak ve transkripsiyon faktörlerinin viral teslim kullanarak somatik hücreleri yeniden programlama, yüksek hacimli ilaç ekranları yapmak için uygun bir strateji olabilir. 20 den fazla bilimsel Bugüne kadar modeli, insan nörolojik ve nöromüsküler hastalıklar için hastaya özgü iPSCs nesil bildirdi. Biri dışında tüm durumlarda iPSCs lentiviral veya retroviral transdüksiyon 16 kullanılarak elde edilmiştir.
Bizim veriler göstermektedir ki inci dayanan basit bir protokolOSKM transkripsiyon faktörlerinin e retroviral teslimat verimli bir şekilde daha yüksek bir geçit yetişkin insan fibroblastlar, yeniden programlanması için kullanılabilir. 10 cm plaka üzerinde Phoenix hücrelerinin tek bir transfeksiyon ile elde edilen virüs miktarının 10'dan fazla yeniden programlanması deneyler için yeterli olur. Yetişkin fibroblastların bizim yeniden programlama protokolünde üç önemli adım vardır: dramatik transdüksiyon etkinliğini artırır iletimi sırasında ek bir santrifüj adım kolaylaştırdı (i) yüksek verimli viral iletilmesi; (ii) gönderiliyor MEFS üzerine transdük fibroblast yoğunluğu ve ( iii) doğrudan besleyici içermeyen kültür transfer edilebilir potansiyel olarak tamamen yeniden programlanması kolonilerin seçimi kolaylaştırmak için Tra-1-81 işaretleyici antikoru ile canlı boyama kullanın. Yeniden programlama verimliliği önemli ölçüde yeniden programlama ikinci haftasında sodyum butirat kullanılarak geliştirilmiştir. Dahası, iPSC koloniler daha büyük bir kısmını kültürlenmiştir gözlemlenmiştirilacın varlığını genişletti ve tamamen yeniden programlanması iPSC satırlara kurulabilir.
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Bu çalışma FA Araştırma İttifak ve Arnold Aile Vakfı ve Kök Hücreler ve MD Anderson Kanser Merkezi Gelişimsel Biyoloji Merkezi'nden bir pilot hibe ile desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif | Şirket | Katalog numarası | |
| DMEM | Invitrogen | 11965 | |
| DMEM/F12 | Invitrogen | 11330 | |
| KSR | Invitrogen | 10828 | |
| Non-esansiyel aminoasit | Invitrogen | 11140 | |
| Sodyum butirat | Sigma | B5887 | |
| Y27632 | Stemgent | 04-0012 | |
| bFGF | Stemgent | 03-0002 | |
| Tra-1-81 antikoru | Stemgent | 09-0069 | |
| Oct3 / 4 antikoru | Santa Cruz | sc-8628 | |
| Nanog antikoru | Hücre Sinyal Teknoloji | 4903S | |
| Tra-1-60 antikoru | Millipore | MAB4360 | |
| Sox2 antikoru | Hücre Sinyal Teknoloji | 3579S | |
| SSEA4 | Millipore | MAB4304 | |
| CF1 MEFS | Globalstem | GSC-6201G | |
| Amaç işaretleyici | Nikon | MBW10010 | |
| Matrigel | BD Biosciences | 354277 | |
| mTeSR1 | StemCell Teknolojileri | 05850 | |
| β-merkaptoetanol | Sigma | M7522 | |
| Fugene 6 | Roche | 11814443001 | |
| polybrene | Sigma | H9268 | |
| Nesne belirteci | Nikon | MBW10010 |
Referanslar
- Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., Yamanaka, S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Mali, P., Chou, B. K., Yen, J., Ye, Z., Zou, J., Dowey, S., Brodsky, R. A., Ohm, J. E., Yu, W., Baylin, S. B., Yusa, K., Bradley, A., Meyers, D. J., Mukherjee, C., Cole, P. A., Cheng, L. Butyrate greatly enhances derivation of human induced pluripotent stem cells by promoting epigenetic remodeling and the expression of pluripotency-associated genes. Stem Cells. 28, 713-720 (2011).
- Wernig, M., Meissner, A., Foreman, R., Brambrink, T., Ku, M., Hochedlinger, K., Bernstein, B. E., Jaenisch, R. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature. 448, 318-324 (2007).
- Lowry, W. E., Richter, L., Yachechko, R., Pyle, A. D., Tchieu, J., Sridharan, R., Clark, A. T., Plath, K. Generation of human induced pluripotent stem cells from dermal fibroblasts. Proc. Natl. Acad. Sci. U.S.A. 105, 2883-2888 (2008).
- Dick, E., Matsa, E., Bispham, J., Reza, M., Guglieri, M., Staniforth, A., Watson, S., Kumari, R., Lochmuller, H., Young, L., Darling, D., Denning, C. Two new protocols to enhance the production and isolation of human induced pluripotent stem cell lines. Stem Cell Res. 6, 158-167 (2011).
- Ku, S., Soragni, E., Campau, E., Thomas, E. A., Altun, G., Laurent, L. C., Loring, J. F., Napierala, M., Gottesfeld, J. M. Friedreich's ataxia induced pluripotent stem cells model intergenerational GAATTC triplet repeat instability. Cell Stem Cell. 7, 631-637 (2010).
- Emre, N., Vidal, J. G., Elia, J., O'Connor, E. D., Paramban, R. I., Hefferan, M. P., Navarro, R., Goldberg, D. S., Varki, N. M., Marsala, M., Carson, C. T. The ROCK inhibitor Y-27632 improves recovery of human embryonic stem cells after fluorescence-activated cell sorting with multiple cell surface markers. PLoS One. 5, e12148-e12148 (2011).
- Watanabe, K., Ueno, M., Kamiya, D., Nishiyama, A., Matsumura, M., Wataya, T., Takahashi, J. B., Nishikawa, S., Muguruma, K., Sasai, Y. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nat. Biotechnol. 25, 681-686 (2007).
- Maherali, N., Hochedlinger, K. Guidelines and techniques for the generation of induced pluripotent stem cells. Cell Stem Cell. 3, 595-605 (2008).
- Yu, J., Thomson, J. A. Induced Pluripotent Stem Cell Derivation. Essentials of Stem Cell Biology. Lanza, R. , Elsevier Inc. 331-337 (2009).
- Yu, J., Hu, K., Smuga-Otto, K., Tian, S., Stewart, R., Slukvin, I. I., Thomson, J. A. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324, 797-801 (2009).
- Woltjen, K., Michael, I. P., Mohseni, P., Desai, R., Mileikovsky, M., Hamalainen, R., Cowling, R., Wang, W., Liu, P., Gertsenstein, M., Kaji, K., Sung, H. K., Nagy, A. piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells. Nature. 458, 766-770 (2009).
- Zhou, W., Freed, C. R. Adenoviral gene delivery can reprogram human fibroblasts to induced pluripotent stem cells. Stem Cells. 27, 2667-2674 (2009).
- Warren, L., Manos, P. D., Ahfeldt, T., Loh, Y. H., Li, H., Lau, F., Ebina, W., Mandal, P. K., Smith, Z. D., Meissner, A., Daley, G. Q., Brack, A. S., Collins, J. J., Cowan, C., Schlaeger, T. M., Rossi, D. J. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell Stem Cell. 7, 618-630 (2010).
- Kim, D., Kim, C. H., Moon, J. I., Chung, Y. G., Chang, M. Y., Han, B. S., Ko, S., Yang, E., Cha, K. Y., Lanza, R., Kim, K. S. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Han, S. S., Williams, L. A., Eggan, K. C. Constructing and deconstructing stem cell models of neurological disease. Neuron. 70, 626-644 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır