Method Article
Colonies sélectionner et isoler de l'homme cellules souches pluripotentes induites à partir de fibroblastes adultes Reprogrammed
Dans cet article
Résumé
Nous présentons un protocole de reprogrammation efficace des cellules somatiques humaines dans l'homme cellules souches pluripotentes induites (hiPSC) en utilisant des vecteurs rétroviraux codant Oct3 / 4, Sox2, Klf4 et c-myc (OSKM) et l'identification des hiPSC correctement reprogrammé par coloration en direct avec des Tra 1-81 anticorps.
Résumé
On présente ici un protocole de reprogrammation fibroblastes humains adultes humaines en cellules souches pluripotentes induites (hiPSC) en utilisant des vecteurs rétroviraux encodant Oct3 / 4, Sox2, Klf4 et c-myc (OSKM) en présence de sodium 1-3 butyrate. Nous avons utilisé cette méthode pour reprogrammer passage tardif (> p10) fibroblastes adultes humaines dérivées de patients l'ataxie de Friedreich (GM03665, Coriell Repository). L'approche reprogrammation comprend protocole de transduction hautement efficace en utilisant une centrifugation répétitif de fibroblastes en présence d'un milieu contenant de virus. Les colonies hiPSC reprogrammées ont été identifiés à l'aide immunomarquage direct pour Tra-1-81, un marqueur de surface de cellules pluripotentes, séparés à partir de fibroblastes non-reprogrammés manuellement et passages 4,5. Ces hiPSC ont ensuite été transférés sur des plaques de Matrigel et cultivés dans des conditions exemptes de desserte, directement à partir de la plaque de reprogrammation. A partir du premier passage, les colonies hiPSC démontrer caractéristique HES-lmorphologie ike. En utilisant ce protocole, plus de 70% des colonies sélectionnées peuvent être élargi avec succès et mis en place dans des lignées cellulaires. Les lignes établies hiPSC affiché caractéristiques des marqueurs de pluripotence, y compris les marqueurs de surface TRA-1-60 et SSEA-4, ainsi que des marqueurs nucléaires Oct3 / 4, Sox2 et Nanog. Le protocole présenté ici a été établi et testé à l'aide des fibroblastes adultes obtenus chez des patients ataxie de Friedreich et de contrôle des individus, des fibroblastes humains 6 nouveau-nés, ainsi que les kératinocytes humains.
Protocole
1. La production de virus et de la transduction
- Plate Phoenix cellules Ampho à une densité de ~ 7-8x10 6 pour plaque de 10 cm dans 10 ml de milieu DMEM (DMEM taux élevé de glucose, 10% de la chaleur FBS inactivé, 2 mM de L-glutamine, pas d'antibiotiques). Placer dans l'incubateur et de la culture une nuit à 37 ° C, 5% de CO 2.
- Le jour suivant, la transfection de cellules en utilisant Phoenix 12 ug d'un vecteur codant soit Oct3 / 4, Sox2, Klf4, c-myc, ou GFP gène (Addgene plasmides 17217, 17218, 17219, 17220) et 35 ul Fugène 6. Préparer le mélange de transfection dans 500 pi de milieu DMEM (DMEM taux élevé de glucose, 2 mM de L-glutamine, sans FBS et des antibiotiques). Incuber 20 min. Doucement pipeter complexes d'ADN dans les plaques de 10 cm contenant 70-80% confluentes cellules Phoenix.
- Remplacez le support de 6 à 8 h post-transfection avec du milieu DMEM (DMEM taux élevé de glucose, 10% de la chaleur FBS inactivé, 2 mM de L-glutamine) contenant de la pénicilline et la streptomycine.
- Par la suite, de recueillir contenant le virus des médias 4 fois en 12 heuresintervalles, de combiner toutes les parties et filtré en utilisant un filtre de 0,45 um pour éliminer les cellules individuelles et les débris (médias contenant des particules virales peuvent être conservés dans le réfrigérateur pendant 2 semaines sans perdre activité infectieuse, mais la congélation n'est pas recommandée).
- Pour rétroviraux fibroblastes de transduction de la plaque, les adultes de l'homme (passage 10, Coriell Laboratories) à partir d'un stock de 24 h congelés avant le dernier jour de la collecte des médias rétroviral. Ensemencer les cellules sur 6 et la gélatine des plaques recouvertes de les 1x10 densité 5 cellules par puits dans du DMEM taux élevé de glucose, 10% de FBS, 2 mM de L-glutamine, pénicilline, la streptomycine et non-acides aminés essentiels.
- Le substitut lendemain milieu DMEM avec les médias contenant des particules virales obtenues à partir de cellules de Phoenix. Ajouter des médias viraux (1 ml de chaque Oct4, Sox2, Klf4, et c-myc médias, 4 ml au total) additionnée de 6 mg / ml de polybrène dans chaque puits de la plaque à 6 puits des cultures de fibroblastes et de centrifugeuses à 1600g pour 1h à 20 ° C. Environ 12 h after la transduction, de remplacer les médias virales avec un milieu de culture des fibroblastes. Effectuer une infection virale et la centrifugation 3 fois à intervalles de 24 h.
- Fibroblastes Culture en milieu DMEM pour 48 h après l'infection. Dernière Vérifier l'efficacité de l'infection par transductions parallèles avec un média rétroviraux exprimant la GFP. La figure 1 illustre l'efficacité de la centrifugation facilitée par infection rétrovirale des fibroblastes humains.
2. Reprogrammation
- Préparer plaques à 6 puits avec γ-irradiés couches nourricières du MEF en ensemençant les cellules MEF à une densité de ~ 2x10 5 cellules par puits de la gélatine traitée plaque de 6 puits dans le milieu de croissance des fibroblastes. Le lendemain, diviser infectés fibroblastes humains en utilisant 0,05% de trypsine / EDTA et les épépiner à la densité de ~ 1.2x10 4 par puits dans le milieu de croissance des fibroblastes.
- Le lendemain, remplacer le support avec les médias hES (DMEM/F12, remplacement 20% de sérum Knockout, non-acides aminés essentiels, pénicillesn / streptomycine, 2 mM de L-glutamine, 0,1 mM β-mercaptoéthanol, 20 ng / ml de facteur de croissance des fibroblastes de base (bFGF), supplémenté avec 0,5 mM de butyrate de sodium pour les 7 premiers jours de la reprogrammation. Changer les médias tous les jours.
- Surveiller les changements morphologiques dans les cellules transduites par jour. Les colonies de cellules de type HIPS va commencer à émerger d'environ 5 - 10 jours après le transfert des fibroblastes transduits sur des cellules nourricières. Les colonies hiPSC sont prêts à être isolé d'environ 14 - 28 jours après leur étalement sur les cellules nourricières MEF.
3. Isolement des colonies hiPSC
- Une journée avant de reprendre les colonies hiPSC préparer des plaques 24 puits avec γ-irradiés cellules nourricières du MEF (environ 4x10 4 cellules par puits) dans la croissance des fibroblastes à moyen terme. A ce stade colonies hiPSC peuvent également être transférées à la culture chargeur gratuitement en utilisant le Matrigel et moyennes mTeSR1.
- Avant l'isolement des colonies hiPSC préparer les plaques du MEF en supprimant la croissance des fibroblastes Medium et le rinçage avec du PBS MEF pour éliminer les traces de FBS. Par la suite, ajoutez 0,5 ml de milieu de hES (ou mTeSR1 moyenne dans le cas de Matrigel puits revêtus) avec 10 inhibiteur de ROCK uM Y27632 à chaque 7,8 bien.
- Si nécessaire, retirez les fibroblastes entourant les colonies hiPSC avec une aiguille de calibre 21 sous un microscope monté dans une hotte à flux laminaire (Figure 2A - C). Rincer les plaques avec du PBS et ajouter de nouvelles des médias hES contenant l'anticorps Tra-1-81 StainAlive spécifique (1:200, Stemgent). Après 30 min., De remplacer le support contenant l'anticorps avec les médias hES frais supplémenté avec 10 uM inhibiteur de ROCK. Examiner les plaques sous la marque de microscope à fluorescence et TRA-1-81 colonies positives en utilisant un marqueur objectif (figure 2D).
- Couper les Tra-1-81 colonies positives hiPSC sous un microscope dans une hotte laminaire, en plusieurs petits morceaux en utilisant une aiguille de calibre 21 comme indiqué dans la figure 2E et F.
- En utilisant une pipette de transfert automatique des fragments (P200) de colonies hiPSC en indpuits ividual de la plaque de 24 puits avec MEF ou Matrigel. Éviter de transférer des non-hanches cellules. Placez les plaques à 37 ° C, 5% de CO 2 incubateur et permettre aux colonies hiPSC se fixer pendant 24-36 h.
- Changement HES ou mTeSR1 (pour les colonies cultivées sur Matrigel) les médias tous les jours. Les colonies hiPSC avec correcte HES-morphologie sera visible 48 h après le transfert initial sur une plaque de 24 puits.
- Manuellement le passage des colonies hiPSC tous les 6 à 8 jours SUR UNE de 12 puits et ensuite sur une plaque à 6 puits.
- Après expansion clonale et d'établir les lignes hiPSC, analyser l'expression des marqueurs de pluripotence TRA-1-60, AESS-4, Oct3 / 4, Sox2 et Nanog utilisant immunocytochimie comme le montre la figure 3. Évaluer l'intégrité du génome et le potentiel de différenciation des lignées obtenues à l'aide du caryotype et analyses formation de tératome 6,9.
4. Les résultats représentatifs
Transduction efficace avec un rétrovirus contenant les médias is critique pour reprogrammation réussie. Il est recommandé de procéder à l'ensemble de la transfection / infection en utilisant une procédure de GFP exprimer virus chaque expérience unique reprogrammation de surveiller l'efficacité comme le montre la figure 1. Le titre du virus exprimant la GFP déterminée, tel que décrit dans 10, dans la transduction des fibroblastes humains en utilisant non concentrées support virales était généralement dans la plage de 0,5 à 5 x 10 7 particules virales par ml (pv / ml).
Fibroblastes changer la morphologie dès 2 jours après la dernière infection. Trypsinisées fibroblastes humains doivent être soigneusement comptés avant de les semer sur les cellules nourricières du MEF. Il est recommandé de cellules de semence à 3 densités différentes (6x10 3, 1.2x10 4, 2,5.10 4 pour seul puits d'une plaque à 6 puits) puisque chaque lignée cellulaire démontre caractéristique de croissance et de densité différentes semis est essentielle pour l'efficacité de la reprogrammation. Le butyrate de sodium utilisé pour leinitial de 7 - 14 jours de la reprogrammation augmente l'efficacité de la formation hiPSC environ 5 fois. Souvent, surtout quand les fibroblastes infectés ont été ensemencées à une densité plus élevée, les cellules fibroblast-like peut recouvrir une boîte de culture et de couvrir les colonies hiPSC comme le montre la figure 2A. Dans ce cas, la couche de fibroblastes peut être levée en douceur et enlevé pour découvrir les colonies hiPSC (figure 2B). Par la suite, les colonies hiPSC doit être rincée avec hES médias et colorées avec Tra-1-81 anticorps. Selon les cellules de fibroblastes, d'environ 20 à 40% des colonies démontrant avec iPSC-morphologie ne se colorent pas avec Tra-1-81 anticorps. Identifiés colonies hiPSC peut être transférée d'une plaque dans les 12 prochaines - 24h. Une incubation prolongée se traduira par une différenciation rapide des hiPSCs. Les colonies peuvent être repiquées sur manuellement, soit des cellules nourricières du MEF ou Matrigel plaques enduites. Après l'expansion établie clones hiPSC devrait être testé à l'aide immunocytochimie (ICC) pour l'expression de pluripotency marqueurs comme l'a démontré dans la figure 3. En outre, une caractérisation moléculaire détaillée des lignes générées iPS cellules devraient inclure: l'analyse de l'expression du gène pluripotence par RT-PCR, la démonstration de la déméthylation de l'ADN dans les promoteurs des gènes de pluripotence et des analyses des transgènes silencing 9.

Figure 1. L'efficacité de la transduction virale déterminée à l'aide rétrovirus GFP exprimer. (A, B) des fibroblastes adultes humains provenant des patients l'ataxie de Friedreich (GM03665, Coriell Repository) ont été visualisées après deux infections consécutives à des médias GFP rétroviraux. (C, D) Des fibroblastes humains ont été infectés avec le même lot des médias GFP rétroviraux suivis par centrifugation des cellules directement sur les plaques de 6 puits pour 1h à 1600g. Les images ont été capturées 48h après l'infection.

Figure 2. Identification et isolement de colonies hiPSC. (A) l'image en contraste de phase d'une plaque contenant hiPSCs entourés par les fibroblastes. Les cellules ont été cultivées pendant 21 jours sur hES médias. (B, C) de la colonie même hiPSC après enlèvement de la couche de fibroblastes entourant. (D) correctement reprogrammées colonies hiPSC sont identifiés par la coloration en direct avec un anticorps marqueur Tra-1-81 de surface, découpé à l'aide d'une aiguille stérile (E, F) et transféré à des puits séparés d'une plaque de 24 puits.
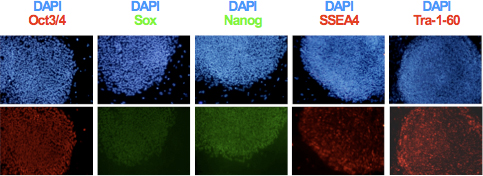
Figure 3. Expression des marqueurs de pluripotence spécifiques Oct3 / 4, Nanog, Sox2, SSEA4 et Tra-1-60 en hiPSCs a été déterminée par immunocytochimie.
Discussion
Étude des maladies humaines, notamment neurologiques et neurodégénératives, a été particulièrement difficile en raison de l'inaccessibilité de l'homme des modèles cellulaires adéquats. La capacité de reprogrammer des cellules somatiques faciles à obtenir en cellules souches pluripotentes induites et la possibilité de les différencier en divers types cellulaires a ouvert une possibilité de créer des modèles cellulaires de maladies génétiques. En outre, CSPi tenir une grande promesse pour l'avenir de la médecine régénérative. Par conséquent, il est essentiel de développer et d'optimiser des méthodes fiables, efficaces et sûrs de reprogrammation des cellules somatiques à la pluripotence.
Du point de vue d'applications thérapeutiques, il est crucial de développer des approches sécuritaires de la génération qui n'ont pas iPSC mutations empreinte dans le génome de l'hôte. Méthodes de cellules somatiques de reprogrammation sans introduire des modifications permanentes dans le génome de cellules reprogrammées comme transfection de vecteurs épisomiques, l'utilisation de excisable transposons, l'infection adénovirale, et la livraison directe de l'ARNm ou de protéines ont déjà été établis 11-15. Jusqu'à présent l'efficacité de reprogrammation en utilisant ces méthodes transgène-libres est faible et dépend de la nature, le type et l'âge des cellules somatiques reprogrammées. Par conséquent, ces protocoles ne sont pas adaptés pour la reprogrammation passage tardif, les cellules somatiques adultes souvent déposés dans des dépôts de cellules. En outre, afin de permettre la caractérisation détaillée des lignes iPSC multiples et d'établir de nouveaux modèles de maladies humaines et de procéder à de dépistage de drogues à haut débit, la reprogrammation des cellules somatiques en utilisant la livraison de facteurs de transcription virale est une stratégie adéquate. À ce jour, plus de 20 études ont rapporté la génération de patients spécifiques à CSPi modèle de l'homme des maladies neurologiques et neuromusculaires. Dans tous les cas sauf un les CSPi ont été générés en utilisant la transduction rétrovirale lentiviral ou 16.
Nos données démontrent qu'un protocole simple basé sur ee livraison rétroviral de facteurs de transcription OSKM peut être utilisé pour reprogrammer efficacement des fibroblastes humains adultes, même un passage de grande. La quantité de virus obtenus à partir d'une transfection de cellules unique Phoenix sur plaque de 10 cm est suffisant pour plus de 10 expériences de reprogrammation. Il ya trois étapes essentielles dans notre protocole de reprogrammation de fibroblastes adultes: (i) la transduction virale très efficace facilitée par une étape de centrifugation supplémentaire lors de la transduction qui augmente considérablement l'efficacité de la transduction, la densité de semis (ii) du fibroblaste transduites sur le MEF et ( iii) l'utilisation de la coloration en direct avec l'anticorps Tra-1-81 marqueur pour faciliter la sélection des colonies potentiellement entièrement reprogrammé qui peuvent être directement transférés à chargeur sans cultures. L'efficacité de la reprogrammation est significativement améliorée en utilisant le butyrate de sodium pendant la deuxième semaine de la reprogrammation. En outre, nous avons observé qu'une plus grande fraction des colonies iPSC cultivées dans leprésence de la drogue peut être étendu et mis en place dans les lignes entièrement reprogrammé IPSC.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Ce travail a été soutenu par l'ataxie de Friedreich Alliance de recherche et une subvention pilote de la famille Arnold Fondation et le Centre pour les cellules souches et la biologie du développement au MD Anderson Cancer Center.
matériels
| Name | Company | Catalog Number | Comments |
| Réactif | Entreprise | Le numéro de catalogue | |
| DMEM | Invitrogen | 11965 | |
| DMEM/F12 | Invitrogen | 11330 | |
| KSR | Invitrogen | 10828 | |
| Non-essentiels acides aminés | Invitrogen | 11140 | |
| Le butyrate de sodium | Sigma | B5887 | |
| Y27632 | Stemgent | 04-0012 | |
| bFGF | Stemgent | 03-0002 | |
| Tra-1-81 anticorps | Stemgent | 09-0069 | |
| Oct3 / 4 d'anticorps | Santa Cruz | sc-8628 | |
| Nanog anticorps | Cell Technology de signalisation | 4903S | |
| Tra-1-60 anticorps | Millipore | MAB4360 | |
| Sox2 anticorps | Cell Technology de signalisation | 3579S | |
| SSEA4 | Millipore | MAB4304 | |
| CF1 MEF | Globalstem | CGC-6201G | |
| Objectif marqueur | Nikon | MBW10010 | |
| Matrigel | BD Biosciences | 354277 | |
| mTeSR1 | StemCell Technologies | 05850 | |
| β-mercaptoéthanol | Sigma | M7522 | |
| Fugène 6 | Roche | 11814443001 | |
| polybrène | Sigma | H9268 | |
| Marqueur d'objet | Nikon | MBW10010 |
Références
- Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., Yamanaka, S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Mali, P., Chou, B. K., Yen, J., Ye, Z., Zou, J., Dowey, S., Brodsky, R. A., Ohm, J. E., Yu, W., Baylin, S. B., Yusa, K., Bradley, A., Meyers, D. J., Mukherjee, C., Cole, P. A., Cheng, L. Butyrate greatly enhances derivation of human induced pluripotent stem cells by promoting epigenetic remodeling and the expression of pluripotency-associated genes. Stem Cells. 28, 713-720 (2011).
- Wernig, M., Meissner, A., Foreman, R., Brambrink, T., Ku, M., Hochedlinger, K., Bernstein, B. E., Jaenisch, R. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature. 448, 318-324 (2007).
- Lowry, W. E., Richter, L., Yachechko, R., Pyle, A. D., Tchieu, J., Sridharan, R., Clark, A. T., Plath, K. Generation of human induced pluripotent stem cells from dermal fibroblasts. Proc. Natl. Acad. Sci. U.S.A. 105, 2883-2888 (2008).
- Dick, E., Matsa, E., Bispham, J., Reza, M., Guglieri, M., Staniforth, A., Watson, S., Kumari, R., Lochmuller, H., Young, L., Darling, D., Denning, C. Two new protocols to enhance the production and isolation of human induced pluripotent stem cell lines. Stem Cell Res. 6, 158-167 (2011).
- Ku, S., Soragni, E., Campau, E., Thomas, E. A., Altun, G., Laurent, L. C., Loring, J. F., Napierala, M., Gottesfeld, J. M. Friedreich's ataxia induced pluripotent stem cells model intergenerational GAATTC triplet repeat instability. Cell Stem Cell. 7, 631-637 (2010).
- Emre, N., Vidal, J. G., Elia, J., O'Connor, E. D., Paramban, R. I., Hefferan, M. P., Navarro, R., Goldberg, D. S., Varki, N. M., Marsala, M., Carson, C. T. The ROCK inhibitor Y-27632 improves recovery of human embryonic stem cells after fluorescence-activated cell sorting with multiple cell surface markers. PLoS One. 5, e12148-e12148 (2011).
- Watanabe, K., Ueno, M., Kamiya, D., Nishiyama, A., Matsumura, M., Wataya, T., Takahashi, J. B., Nishikawa, S., Muguruma, K., Sasai, Y. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nat. Biotechnol. 25, 681-686 (2007).
- Maherali, N., Hochedlinger, K. Guidelines and techniques for the generation of induced pluripotent stem cells. Cell Stem Cell. 3, 595-605 (2008).
- Yu, J., Thomson, J. A. Induced Pluripotent Stem Cell Derivation. Essentials of Stem Cell Biology. Lanza, R. , Elsevier Inc. 331-337 (2009).
- Yu, J., Hu, K., Smuga-Otto, K., Tian, S., Stewart, R., Slukvin, I. I., Thomson, J. A. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324, 797-801 (2009).
- Woltjen, K., Michael, I. P., Mohseni, P., Desai, R., Mileikovsky, M., Hamalainen, R., Cowling, R., Wang, W., Liu, P., Gertsenstein, M., Kaji, K., Sung, H. K., Nagy, A. piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells. Nature. 458, 766-770 (2009).
- Zhou, W., Freed, C. R. Adenoviral gene delivery can reprogram human fibroblasts to induced pluripotent stem cells. Stem Cells. 27, 2667-2674 (2009).
- Warren, L., Manos, P. D., Ahfeldt, T., Loh, Y. H., Li, H., Lau, F., Ebina, W., Mandal, P. K., Smith, Z. D., Meissner, A., Daley, G. Q., Brack, A. S., Collins, J. J., Cowan, C., Schlaeger, T. M., Rossi, D. J. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell Stem Cell. 7, 618-630 (2010).
- Kim, D., Kim, C. H., Moon, J. I., Chung, Y. G., Chang, M. Y., Han, B. S., Ko, S., Yang, E., Cha, K. Y., Lanza, R., Kim, K. S. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Han, S. S., Williams, L. A., Eggan, K. C. Constructing and deconstructing stem cell models of neurological disease. Neuron. 70, 626-644 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon