Method Article
Seleção e isolamento de colônias de células-tronco pluripotentes induzidas a partir de fibroblastos adultos reprogramado
Neste Artigo
Resumo
Nós apresentamos um protocolo para a reprogramação eficiente de células somáticas humanas em células-tronco pluripotentes induzidas (hiPSC) usando vetores retrovirais codificando OCT3 / 4, Sox2, KLF4 e c-myc (OSKM) e identificação de hiPSC corretamente reprogramado pela coloração ao vivo com tradi- 1-81 anticorpo.
Resumo
Apresentamos aqui um protocolo de reprogramação fibroblastos humanos adultos em humanos células pluripotentes induzidas estaminais (hiPSC) utilizando vectores retrovirais que codificam OCT3 / 4, Sox2, KLF4 e c-myc (OSKM) na presença de butirato de sódio 1-3. Usamos este método para reprogramar passagem tardia (> p10) fibroblastos humanos adultos provenientes de paciente ataxia de Friedreich (GM03665, Coriell Repository). A abordagem de reprogramação inclui protocolo de transdução altamente eficiente utilizando centrifugação repetitiva de fibroblastos na presença de vírus que contêm meios de comunicação. As colónias hiPSC reprogramadas foram identificadas utilizando imunomarcação vivo para Tra-1-81, um marcador de superfície de células pluripotentes, separados a partir de fibroblastos não-reprogramadas e manualmente passadas 4,5. Estes hiPSC foram então transferidas para placas de Matrigel e cultivadas em condições isentas de alimentação, directamente a partir da placa de reprogramação. A partir da primeira passagem, as colónias hiPSC demonstrar característica HES-lmorfologia ike. Usando este protocolo mais do que 70% das colónias seleccionadas pode com sucesso ser expandido e estabelecido em linhas celulares. As linhas estabelecidas hiPSC exibido característicos marcadores de pluripotência incluindo marcadores de superfície TRA-1-60 e SSEA-4, bem como marcadores nucleares OCT3 / 4, Sox2 e Nanog. O protocolo apresentado aqui tenha sido estabelecida e testadas usando fibroblastos adultos obtidos a partir de pacientes com AF e indivíduos de controlo 6, fibroblastos humanos recém-nascidos, bem como queratinócitos humanos.
Protocolo
1. Produção de vírus e de transdução
- Plate Phoenix células ampho a uma densidade de 8x10 ~ 7-6 por placa de 10 cm em 10 ml de meio DMEM (DMEM glucose elevada, 10% de FBS inactivado calor, 2 mM de L-glutamina, sem antibióticos). Lugar na incubadora e da cultura durante a noite a 37 ° C, 5% de CO 2.
- No dia seguinte, transfectar células Phoenix, utilizando 12 ug de um vector de codificação quer OCT3 / 4, Sox2, KLF4, c-myc, ou GFP gene (Addgene plasmídeos 17.217, 17.218, 17.219, 17.220) e 35 uL Fugene 6. Preparar a mistura de transfecção em 500 uL de meio DMEM (DMEM glucose elevada, 2 mM de L-glutamina, sem FBS e antibióticos). Incubar 20 min. Suavemente pipetar complexos de DNA para as placas de 10 cm contendo 70-80% de células confluentes Phoenix.
- Substituir meios 6-8 h pós-transfecção com meio DMEM (DMEM glucose elevada, 10% de FBS inactivado calor, 2 mM de L-glutamina) contendo penicilina e estreptomicina.
- Subsequentemente, recolher-vírus contendo meios 4 vezes em 12 hintervalos, combinar todas as porções e filtrou-se através de um filtro de 0,45 para remover as células destacadas e detritos (meio contendo partículas virais podem ser mantidos no frigorífico durante 2 semanas sem perder a actividade infecciosa, no entanto congelação não é recomendada).
- Para retrovirais de transdução, de placas fibroblastos humanos adultos (passagem 10, Coriell Laboratories) a partir de um estoque congelado h 24 anteriores ao último dia da coleção de mídia retroviral. De sementes as células em 6-bem gelatina placas cobertas, na densidade de 1x10 5 células por poço em DMEM glucose elevada, 10% de FBS, 2 mM de L-glutamina, penicilina, estreptomicina e não-aminoácidos essenciais.
- O substituto dia seguinte DMEM mídia com a mídia contendo partículas virais obtidos a partir de células de Phoenix. Adicionar meios virais (1 ml de cada Oct4, Sox2, KLF4, e c-myc meios de comunicação, 4 ml no total) suplementado com 6 ug / ml de polibreno em cada poço da placa de 6 poços das culturas de fibroblastos e centrifugar a 1600g para 1h a 20 ° C. Aproximadamente 12 h after a transdução, substituir os meios de comunicação viral com meio de cultura de fibroblastos. Realizar infecção viral e centrifugação 3 vezes em intervalos de 24 h.
- Fibroblastos Cultura em meio DMEM por 48 horas após a infecção passada. Verificar a eficiência da infecção por transduções paralelas com um meio de retrovirais que expressam GFP. A Figura 1 ilustra a eficiência de infecção-centrifugação facilitada retroviral de fibroblastos humana.
2. Reprogramação
- Prepare 6 placas de poços com γ irradiados camadas alimentadoras MEF por sementeira de células MEF, a uma densidade de aproximadamente 2x10 5 células por poço de 6 a gelatina tratada placa bem em meio de crescimento de fibroblastos. No dia seguinte dividir infectadas fibroblastos humanos usando 0,05% de tripsina / EDTA e de sementes de los na densidade de ~ 1.2x10 4 por poço em meio de crescimento de fibroblastos.
- No dia seguinte, substituir a mídia com CTeh mídia (DMEM/F12, substituição de soro de 20% Knockout, não-aminoácidos essenciais, penicillin / estreptomicina, 2 mM de L-glutamina, 0,1 mM de β-mercaptoetanol, 20 ng / Factor de Crescimento de Fibroblasto ml basal (bFGF), suplementado com 0,5 mM de butirato de sódio para os primeiros 7 dias após a reprogramação. Alterar media diária.
- Monitorizar as alterações morfológicas nas células transduzidas diária. As colónias de células semelhantes HIPS vai começar a emergir aproximadamente 5 - 10 dias após a transferência dos fibroblastos transduzidas para células de alimentação. As colónias hiPSC está pronto para ser isolado cerca de 14 - 28 dias após plaqueamento das células alimentadoras MEF.
3. Isolamento de colónias hiPSC
- Um dia antes da colheita das colónias hiPSC preparar placas de 24 poços com γ irradiados células MEF alimentador (4x10 ~ de 4 células por poço) em meio de crescimento de fibroblastos. Nesta fase colónias hiPSC também podem ser transferidos para a cultura alimentador livre usando Matrigel e médio mTeSR1.
- Antes de isolamento de colónias hiPSC preparar placas MEF através da remoção de fibroblastos crescimento medium e enxaguamento MEFs com PBS para remover vestígios de FBS. Subsequentemente adicionar 0,5 ml CTeh médio (ou mTeSR1 médio no caso de Matrigel poços revestidos) com 10 uM ROCHA inibidor Y27632 a cada 7,8 poço.
- Se necessário, remova os fibroblastos ao redor das colônias hiPSC com uma agulha de calibre 21 sob um microscópio montado em uma capela de fluxo laminar (Figura 2A - C). Lavam-se as placas com PBS e adicionar meios frescos TEh contendo o anticorpo Tra-1-81 StainAlive específico (1:200, Stemgent). Depois de 30 min., Substituir meios que contêm o anticorpo com meios frescos TEh suplementadas com 10 inibidor ROCHA uM. Examinar as placas sob o microscópio fluorescente e marca Tra-1-81 colónias positivas usando um marcador objectivo (Figura 2D).
- Corte os Tra-1-81 colónias positivas hiPSC sob um microscópio em uma capa laminar, em vários pequenos pedaços usando uma agulha de calibre 21, como mostrado na Figura 2E e F.
- Usando uma pipeta automática fragmentos (P200) de transferência de colônias hiPSC em indpoços ividual da placa de 24 poços com MEFs ou Matrigel. Evitar a transferência de células não-HIPS. Colocar as placas em um 37 ° C, 5% de CO 2 incubadora e permitir que as colónias hiPSC para anexar para 24-36 h.
- Mudança CTeh ou mTeSR1 (para colônias cultivadas em Matrigel) media diária. As colónias hiPSC com a morfologia HES-correcta como será visível 48 h após a transferência inicial para uma placa de 24 poços.
- Manualmente passagem colónias hiPSC cada 6 - 8 dias para um 12-bem e, subsequentemente, numa placa de 6 poços.
- Após a expansão clonal e que estabelece as linhas hiPSC, analisar a expressão de marcadores de pluripotência TRA-1-60, SSEA-4, OCT3 / 4, Sox2 e Nanog utilizando imunocitoquímica como mostrado na Figura 3. Avaliar a integridade genômica e potencial de diferenciação das linhas obtidas utilizando o cariótipo e análises teratoma formação 6,9.
4. Os resultados representativos
Transdução eficiente com retrovirus contendo mídia is crítico para a reprogramação. Recomenda-se para conduzir o procedimento de transfecção / infecção inteiro usando um GFP expressando vírus cada experiência única reprogramação para monitorar a eficácia, como mostrado na Figura 1. O título do vírus expressando GFP determinado, como descrito em 10, através da transdução de fibroblastos humanos utilizando meios não-concentrados virais foi tipicamente na gama de 0,5-5 x 10 7 partículas virais por ml (VP / ml).
Fibroblastos alterar a morfologia tão cedo quanto 2 dias após a última infecção. Tripsinizadas fibroblastos humanos devem ser cuidadosamente contadas antes, semeando-os nas células alimentadoras do MEF. Recomenda-se a células de semente menos 3 densidades diferentes (6x10 3, 4 1.2x10, 2.5x10 4 por único poço de uma placa de 6 poços) uma vez que cada linha de células demonstra característica de crescimento diferente e densidade de semeadura é crítica para a eficiência de reprogramação. Butirato de sódio utilizado para ainicial de 7 - 14 dias de reprogramação aumenta a eficiência de formação de hiPSC aproximadamente 5 vezes. Frequentemente, especialmente quando fibroblastos infectados foram semeadas a densidade mais elevada, as células de fibroblasto-like pode overgrow um prato de cultura e cobrir colónias hiPSC como mostrado na Figura 2A. Neste caso, a camada de fibroblastos podem ser cuidadosamente levantado e retirado para descobrir colónias hiPSC (Figura 2B). Subsequentemente, as colónias hiPSC deve ser lavado com HES meios de comunicação e coradas com Tra-1-81 de anticorpos. Dependendo das células de fibroblasto, cerca de 20 - 40% de colónias demonstrando com iPSC-like morfologia não mancham com Tra-1-81 de anticorpos. Identificados colónias hiPSC pode ser transferido a partir de uma placa de dentro 12 próxima - 24h. Incubação prolongada irá resultar em diferenciação rápida de hiPSCs. As colónias pode ser manualmente passadas para tanto células alimentadoras MEF ou Matrigel placas revestidas. Após a expansão estabelecido clones hiPSC devem ser testados usando imunocitoquímica (ICC) para a expressão de pluripotency marcadores como demonstrado na Figura 3. Além disso, uma caracterização molecular detalhada das geradas linhas de células iPS deve incluir: análises da expressão do gene pluripotência utilizando RT-PCR, na demonstração da desmetilação DNA com os promotores de genes pluripotência e análises dos transgenes silenciamento 9.

Figura 1. A eficiência de transdução virai determinada utilizando retrovírus GFP expressando. (A, B) fibroblastos humanos adultos derivados de paciente Friedreich ataxia (GM03665, Coriell Repository) foram visualizadas após duas infecções consecutivos com meios GFP retrovirais. (C, D) fibroblastos humanos foram infectadas com o mesmo lote de os meios de comunicação GFP retrovirais seguido por centrifugação das células directamente sobre as placas de 6 poços durante 1 hora à 1600g. As imagens foram capturadas 48h após a infecção.

Figura 2. Identificação e isolamento de colónias hiPSC. (A) da imagem de contraste de fase de uma placa contendo hiPSCs rodeadas por fibroblastos. As células foram cultivadas durante 21 dias em CTeh meios de comunicação. (B, C) colónia O mesmo hiPSC após a remoção da camada de fibroblastos circundante. (D) A correcta reprogramadas colónias hiPSC são identificados através de coloração vivo com Tra-1-81 superfície anticorpo marcador, cortados com uma agulha estéril (E, F) e transferidos para poços separados de uma placa de 24 cavidades.
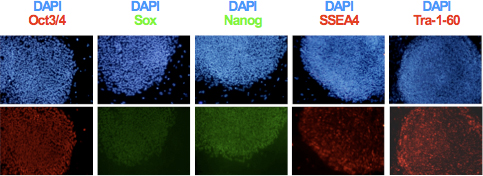
Figura 3. Expressão dos marcadores específicos pluripotência OCT3 / 4, Nanog, Sox2, SSEA4 e Tra-1-60 em hiPSCs foi determinada por imunocitoquímica.
Discussão
O estudo de doenças humanas, especialmente neurológicas e neurodegenerativas, foi particularmente difícil devido à falta de acesso aos humanos adequados modelos de celulares. A capacidade de reprogramar células somáticas de fácil obtenção em células tronco pluripotentes induzidas e potencial para diferenciá-las em diversos tipos celulares abriu uma possibilidade de criar modelos celulares de doenças genéticas. Além disso, iPSCs realizar uma grande promessa para o futuro da medicina regenerativa. Portanto, é essencial para desenvolver e otimizar métodos confiáveis, eficientes e seguros de reprogramação de células somáticas de pluripotência.
Do ponto de vista de aplicações terapêuticas, é fundamental para desenvolver abordagens seguras de geração iPSC faltando pegada mutações no genoma do hospedeiro. Métodos de células somáticas de reprogramação sem a introdução de alterações permanentes no genoma de células reprogramadas tais como a transfecção de vectores epissomais, a utilização de coletável transposons, infecção adenoviral e entrega direto de mRNA ou de proteínas já foram estabelecidas 11-15. Até agora a eficiência de reprogramação utilizando estes métodos transgene livres é baixa e depende do tipo de caracteres, e da idade de células somáticas reprogramadas. Por conseguinte, estes protocolos não são adequados para a reprogramação passagem tarde, as células somáticas adultas frequentemente depositado em depósitos de células. Além disso, para permitir a caracterização detalhada das linhas de IPSC múltiplos e para estabelecer novos modelos de doenças humanas e para conduzir telas de alto rendimento de drogas, de reprogramação de células somáticas, utilizando entrega virais dos factores de transcrição é uma estratégia adequada. Até agora mais de 20 estudos relatou a geração de paciente-específicas iPSCs a modelo humano doenças neurológicas e neuromusculares. Em todos os casos, mas uma das iPSCs foram gerados utilizando transdução retroviral lentiviral ou 16.
Os nossos dados demonstram que um protocolo simples baseado em the entrega retroviral de factores de transcrição OSKM pode ser utilizado de forma eficiente reprogramar fibroblastos humanos adultos, mesmo de uma passagem elevada. A quantidade de vírus obtido a partir de uma transfecção única de células Phoenix em 10 centímetros da placa é suficiente para mais de 10 experiências de reprogramação. Existem três passos críticos no nosso protocolo de reprogramação de fibroblastos adultos: (i) a transdução altamente eficiente viral facilitada por um passo de centrifugação adicional durante a transdução que aumenta dramaticamente a eficiência de transdução, (ii) densidade semeadura do fibroblasto transduzidas para o MEFs e ( iii) utilização de coloração vivo com o anticorpo Tra-1-81 marcador para facilitar a selecção de colónias potencialmente totalmente reprogramadas que podem ser directamente transferidos para alimentador-free culturas. A eficiência de reprogramação é significativamente aumentada, usando butirato de sódio durante a segunda semana de reprogramação. Além disso, observou-se que uma maior fração das colônias cultivadas no IPSCpresença da droga pode ser expandido e estabelecida em totalmente reprogramadas linhas IPSC.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pela Aliança de Friedreich Ataxia Research e uma subvenção piloto da Família Arnold Foundation e O Centro de Células-Tronco e Biologia do Desenvolvimento no MD Anderson Cancer Center.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagente | Companhia | Número de Catálogo | |
| DMEM | Invitrogen | 11965 | |
| DMEM/F12 | Invitrogen | 11330 | |
| KSR | Invitrogen | 10828 | |
| Aminoácidos não essenciais | Invitrogen | 11140 | |
| Butirato de sódio | Sigma | B5887 | |
| Y27632 | Stemgent | 04-0012 | |
| bFGF | Stemgent | 03-0002 | |
| Tra-1-81 anticorpo | Stemgent | 09-0069 | |
| OCT3 / 4 anticorpo | Santa Cruz | sc-8628 | |
| Nanog anticorpo | Cell Technology Sinalização | 4903S | |
| Tra-1-60 anticorpo | Millipore | MAB4360 | |
| Sox2 anticorpo | Cell Technology Sinalização | 3579S | |
| SSEA4 | Millipore | MAB4304 | |
| CF1 MEFs | Globalstem | GSC-6201G | |
| Marcador objetivo | Nikon | MBW10010 | |
| Matrigel | BD Biosciences | 354277 | |
| mTeSR1 | StemCell Technologies | 05850 | |
| β-mercaptoetanol | Sigma | M7522 | |
| Fugene 6 | Roche | 11814443001 | |
| polibrene | Sigma | H9268 | |
| Marcador de objeto | Nikon | MBW10010 |
Referências
- Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., Yamanaka, S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Mali, P., Chou, B. K., Yen, J., Ye, Z., Zou, J., Dowey, S., Brodsky, R. A., Ohm, J. E., Yu, W., Baylin, S. B., Yusa, K., Bradley, A., Meyers, D. J., Mukherjee, C., Cole, P. A., Cheng, L. Butyrate greatly enhances derivation of human induced pluripotent stem cells by promoting epigenetic remodeling and the expression of pluripotency-associated genes. Stem Cells. 28, 713-720 (2011).
- Wernig, M., Meissner, A., Foreman, R., Brambrink, T., Ku, M., Hochedlinger, K., Bernstein, B. E., Jaenisch, R. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature. 448, 318-324 (2007).
- Lowry, W. E., Richter, L., Yachechko, R., Pyle, A. D., Tchieu, J., Sridharan, R., Clark, A. T., Plath, K. Generation of human induced pluripotent stem cells from dermal fibroblasts. Proc. Natl. Acad. Sci. U.S.A. 105, 2883-2888 (2008).
- Dick, E., Matsa, E., Bispham, J., Reza, M., Guglieri, M., Staniforth, A., Watson, S., Kumari, R., Lochmuller, H., Young, L., Darling, D., Denning, C. Two new protocols to enhance the production and isolation of human induced pluripotent stem cell lines. Stem Cell Res. 6, 158-167 (2011).
- Ku, S., Soragni, E., Campau, E., Thomas, E. A., Altun, G., Laurent, L. C., Loring, J. F., Napierala, M., Gottesfeld, J. M. Friedreich's ataxia induced pluripotent stem cells model intergenerational GAATTC triplet repeat instability. Cell Stem Cell. 7, 631-637 (2010).
- Emre, N., Vidal, J. G., Elia, J., O'Connor, E. D., Paramban, R. I., Hefferan, M. P., Navarro, R., Goldberg, D. S., Varki, N. M., Marsala, M., Carson, C. T. The ROCK inhibitor Y-27632 improves recovery of human embryonic stem cells after fluorescence-activated cell sorting with multiple cell surface markers. PLoS One. 5, e12148-e12148 (2011).
- Watanabe, K., Ueno, M., Kamiya, D., Nishiyama, A., Matsumura, M., Wataya, T., Takahashi, J. B., Nishikawa, S., Muguruma, K., Sasai, Y. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nat. Biotechnol. 25, 681-686 (2007).
- Maherali, N., Hochedlinger, K. Guidelines and techniques for the generation of induced pluripotent stem cells. Cell Stem Cell. 3, 595-605 (2008).
- Yu, J., Thomson, J. A. Induced Pluripotent Stem Cell Derivation. Essentials of Stem Cell Biology. Lanza, R. , Elsevier Inc. 331-337 (2009).
- Yu, J., Hu, K., Smuga-Otto, K., Tian, S., Stewart, R., Slukvin, I. I., Thomson, J. A. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324, 797-801 (2009).
- Woltjen, K., Michael, I. P., Mohseni, P., Desai, R., Mileikovsky, M., Hamalainen, R., Cowling, R., Wang, W., Liu, P., Gertsenstein, M., Kaji, K., Sung, H. K., Nagy, A. piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells. Nature. 458, 766-770 (2009).
- Zhou, W., Freed, C. R. Adenoviral gene delivery can reprogram human fibroblasts to induced pluripotent stem cells. Stem Cells. 27, 2667-2674 (2009).
- Warren, L., Manos, P. D., Ahfeldt, T., Loh, Y. H., Li, H., Lau, F., Ebina, W., Mandal, P. K., Smith, Z. D., Meissner, A., Daley, G. Q., Brack, A. S., Collins, J. J., Cowan, C., Schlaeger, T. M., Rossi, D. J. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell Stem Cell. 7, 618-630 (2010).
- Kim, D., Kim, C. H., Moon, J. I., Chung, Y. G., Chang, M. Y., Han, B. S., Ko, S., Yang, E., Cha, K. Y., Lanza, R., Kim, K. S. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Han, S. S., Williams, L. A., Eggan, K. C. Constructing and deconstructing stem cell models of neurological disease. Neuron. 70, 626-644 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados