Method Article
大人の線維芽細胞から再プログラムヒト人工多能性幹細胞のコロニーを選択し、分離
要約
我々はとレトロOCT3 / 4、Sox2の、KLF4およびc-myc(OSKM)をコードするベクターとライブ染色により正しく再プログラムhiPSCの識別を用いたヒト人工多能性幹細胞(hiPSC)TRA-にヒト体細胞の効率的なリプログラミングのためのプロトコルを提示1から81抗体。
要約
ここに我々は1-3ナトリウム、酪酸の存在下でOCT3 / 4、Sox2の、KLF4およびc-myc(OSKM)をコードするレトロウイルスベクターを用いたヒト人工多能性幹細胞(hiPSC)にヒト成人線維芽細胞を再プログラミングのプロトコルを提示します。我々は、フリードライヒ失調症患者(GM03665、コーリエル医学リポジトリ)から派生した遅く通路(> P10)ヒト成人線維芽細胞を再プログラムするためにこのメソッドを使用していました。プログラミングのアプローチは、ウイルス含有培地の存在下で線維芽細胞の反復的な遠心分離を用いた高効率伝達プロトコルが含まれています。書き換えhiPSCコロニーがTRA-1-81、多能性細胞の表面マーカーのライブ免疫染色を用いて同定した、非書き換え線維芽細胞から分離し、手動で4,5継代。これらのhiPSCその後、マトリゲルプレートに移し、直接プログラミングプレートから、フィーダーフリーの条件下で増殖させた。最初の通過から始めて、hiPSCのコロニーは、hES-L特性を実証IKE形態。このプロトコルを使用して、選択したコロニーの70%以上が正常に拡大し、細胞株に確立することができます。確立されhiPSC行は表面マーカーTRA-1-60及びSSEA-4と同様に、核のマーカーOCT3 / 4、Sox2、及びNanogの特徴を含む多能性マーカーを表示されます。ここで紹介するプロトコルが確立され、フリードライヒ失調症患者と対照個体6、人間の新生児線維芽細胞と同様に、ヒトケラチノサイトから得られた成人の繊維芽細胞を用いてテストされています。
プロトコル
1。ウイルスの生産と伝達
- DMEM培地(DMEM高グルコース、不活化10%FBS、熱、2 mM L-グルタミン、抗生物質なし)10ml中〜7-8×10 6%10 cmのプレートの密度でプレートフェニックス周りに細胞。 37一晩インキュベーターや文化の場所°C、5%CO 2。
- ベクトル符号化OCT3 / 4、Sox2の、KLF4、c-mycの、またはGFP遺伝子(プラスミドAddgene 17217、17218、17219、17220)、35μlのFuGENE 6トランスのいずれかの12μgを用いて次の日にトランスフェクションフェニックス細胞。 DMEM培地(DMEM高グルコース、2 mM L-グルタミン、無FBSおよび抗生物質)500μlのトランスフェクションミックスを調製する。 20分インキュベートします。穏やかに70から80パーセントコンフルエントフェニックス細胞を含む10 cmのプレートにDNA複合体をピペット。
- 8時間ペニシリンおよびストレプトマイシンを含むDMEM培地(DMEM高グルコース、不活化10%FBS、熱、2 mM L-グルタミン)のトランスフェクション後 - メディア6を交換してください。
- その後、ウイルスを含む培地に4回12時間で収集間隔は、すべての部分を組み合わせて、剥離した細胞と破片を(ウイルス粒子を含むメディアがしかし凍結が推奨されていない場合は、感染活動を失うことなく2週間冷蔵庫に保管することができます)を削除する0.45μmフィルターを用いて濾過した。
- レトロウイルスのメディアコレクションの最後の日前に凍結ストックの24時間からレトロウイルス形質導入、プレートヒト成人線維芽細胞(流路10、コーリエル医学研究所)のために。シードは、DMEM高グルコースで、ウェルあたり1×10 5細胞の密度で6ウェルゼラチン覆われたプレート上で細胞を、10%FBS、2mMのL-グルタミン、ペニシリン、ストレプトマイシンおよび非必須アミノ酸。
- フェニックスの細胞から得られたウイルス粒子を含有する培地で翌日代替DMEM培地。のために1600グラムで、線維芽細胞の培養と遠心機の6ウェルプレートの各ウェルにポリブレン6μg/ mlのを補充したウイルスのメディア(それぞれのOct4、Sox2の、KLF4、およびc-mycのメディアを1 ml、4 mlの合計)を追加20℃、1hの約12時間AFTER伝達、線維芽細胞培養培地でウイルスのメディアを交換してください。 24時間間隔でウイルス感染し、遠心分離を3回実行します。
- 最後に、感染後48時間DMEM培地で培養線維芽細胞。 GFPを発現するレトロウイルス媒体と並行して伝達経路による感染の効率を確認してください。図1は、ヒト線維芽細胞の遠心分離促進レトロウイルス感染の効率を示しています。
2。再プログラミング
- 線維芽細胞増殖培地中で〜2×10 5細胞をウェルあたりの処理ゼラチン6ウェルプレートの密度でMEF細胞を播種することによってγ線照射したMEFフィーダー層6ウェルプレートを準備します。次の日は、線維芽細胞の増殖培地中でウェル当たり1.2×10〜4の密度で0.05%トリプシン/ EDTAとシードそれらを使用して、ヒト線維芽細胞に感染し分割します。
- 次の日は、hES培地(DMEM/F12、20%ノックアウト血清代替物、非必須アミノ酸、penicilliを使用してメディアを交換するN /ストレプトマイシン、2mMのL-グルタミン、0.1mMのβ-メルカプトエタノール、20 ng / mlの基底繊維芽細胞成長因子(bFGF)、リプログラミングの最初の7日間の0.5 mMの酪酸ナトリウムを添加した。毎日のメディアを変更します。
- 毎日の形質細胞の形態学的変化を監視します。 HIPSのような細胞のコロニーは、約5パッケージをemergeすることを開始します - 10日間のフィーダー細胞に形質導入した線維芽細胞を転送した後。 hiPSCコロニーは約14を分離する準備ができました - 28日MEFフィーダー細胞上にめっきした後。
3。 hiPSCコロニーの単離
- hiPSCコロニーをピッキング前日は、線維芽細胞の増殖培地中でγ線照射したMEFフィーダー細胞(ウェル当たり〜4×10 4細胞)を24ウェルプレートを準備します。この段階でhiPSCコロニーは、マトリゲルとmTeSR1媒体を使用してフィーダーフリーの培養に転送することができます。
- hiPSCコロニーの分離前には、線維芽細胞成長mediuを削除することにより、MEFプレートを準備mとFBSの痕跡を削除するには、PBSでMEFSをすすぐ。その後、各ウェルに7,8に10μMのROCK阻害剤Y27632で0.5ミリリットルのhES培地(またはマトリゲル被覆したウェルの場合mTeSR1培地)を追加します。
- 必要に応じて、層流フード( - C図2A)に搭載された顕微鏡下で21ゲージ針でhiPSCコロニーを周囲の線維芽細胞を削除します。 PBSでプレートをすすぎ、TRA-1から81 StainAlive特異抗体(1:200、Stemgent)を含む新鮮なヒトESメディアを追加します。後30分、10μMROCK阻害剤を添加した新鮮なヒトESメディアで抗体を含有する培地を交換してください。蛍光顕微鏡と客観的なマーカー(図2D)を使用してマークTRA-1から81までの正のコロニーの下に板を調べます。
- 図2E及びFに示すように、21ゲージ針を用いていくつかの小さな部分に層流フードで顕微鏡下でTRA-1から81までの正のhiPSCコロニーを、カット
- INDにhiPSCコロニーの自動ピペット(P200)転送の断片を使用して、MEFのまたはマトリゲルを含む24ウェルプレートのウェルにividual。非HIPSセルを転送することは避けてください。 37℃、5%CO 2インキュベーター内でプレートを置き、hiPSCコロニーが24から36時間アタッチすることができます。
- ヒトESまたはmTeSR1(マトリゲル上に成長したコロニーのための)メディアを毎日変更します。正しいHES-のような形態を有するhiPSCコロニーは24ウェルプレートへの初期転送した後、48時間表示されます。
- 6ウェルプレート12ウェル、その後、上に8日 - 手動で通過hiPSCコロニー毎に6。
- クローン性増殖とhiPSCラインを確立した後、図3に示すように、免疫細胞化学を用いた多能性マーカーTRA-1-60、SSEA-4、OCT3 / 4、Sox2、及びNanogの発現を分析します。核型と奇形腫形成の分析6,9を用いて得られた線のゲノムの完全性と分化能を評価します。
4。代表的な結果
レトロウイルス含有培地iの効率的な伝達の成功したリプログラミングの重要な。これは、図1に示すように、効率性を監視するウイルスごとに、単一のプログラミング実験を発現してGFPを用いて全体のトランスフェクション/感染症の手順を行うことをお勧めします。一般的に0.5の範囲であった非濃縮ウイルスメディアを用いたヒト線維芽細胞の情報伝達を介して、10で説明したようにGFP発現ウイルスの力価は、決定- 5×10ミリリットル(VP / ml)のあたり7ウイルス粒子。
線維芽細胞は2日最後の感染後できるだけ早く形態を変更します。トリプシン処理ヒト線維芽細胞は、慎重にMEFフィーダー細胞上に播種する前にカウントする必要があります。これは、各細胞株以来、3つの異なる密度(6×10 3、1.2×10 4、6ウェルプレートの1ウェルあたり2.5×10 4)で種子細胞に推奨されている別の成長特性および播種密度は、プログラミングの効率化のために重要であるを示しています。使用される酪酸ナトリウム最初の7 - プログラミングの14日間hiPSC形成の約5倍の効率を向上させます。頻繁に、感染した線維芽細胞を高い密度で播種した場合は特に、線維芽細胞様細胞は培養皿の生い茂る、図2Aに示すようにhiPSCコロニーをカバーすることができます。このケースでは、線維芽細胞層は慎重に持ち上げてhiPSCコロニー(図2B)を明らかにするために削除することができます。その後、hiPSCコロニーはヒトESメディアでリンスし、TRA-1から81抗体で染色する必要があります。線維芽細胞に応じて、約20 - IPSCのような形態を実証するコロニーの40%は、TRA-1-81抗体で染色されません。 24 - 識別hiPSCコロニーは、次の12内のプレートから転送することができます。長時間のインキュベーションは、hiPSCsの急速な分化になります。コロニーは、手動でMEFフィーダー細胞またはマトリゲルをコートしたプレートのどちらかに継代することができます。展開が確立した後hiPSCクローンpluripotenの発現のための免疫細胞化学(ICC)を使用してテストする必要がありますCYマーカーは、図3に示した。さらに、生成されたiPS細胞の詳細な分子特性を含める必要があります:RT-PCR、9サイレンシングの導入遺伝子の多能性遺伝子および分析のプロモーターのDNAメチル化のデモを使用して多能性遺伝子発現の解析を。

図1。 GFPを発現するレトロウイルスを用いて決定し、ウイルス形質導入の効率が向上します。(A、B)がフリードライヒ失調症患者(GM03665、コーリエル医学リポジトリ)由来のヒト成人線維芽細胞は、GFPレトロウイルスメディアを持つ2つの連続した感染症の後に可視化した。 (C、D)ヒト線維芽細胞は、1600グラムで直接1hの6ウェルプレート上での細胞の遠心分離に続いてGFPレトロウイルス媒体の同じバッチで感染させた。画像は、感染後48時間捕獲された。

図2。 hiPSCコロニーの同定および単離(A)線維芽細胞に囲まれたhiPSCsを含むプレートの位相コントラスト画像。細胞はヒトESメディアで21日間培養した。周囲の線維芽細胞層を除去した後(B、C)と同じhiPSCコロニー。 (D)が正しく書き換えhiPSCコロニーはTRA-1から81の表面マーカー抗体を用いたライブ染色により識別され、無菌の注射針(E、F)を使用してカットし、24ウェルプレートの個々のウェルに移した。
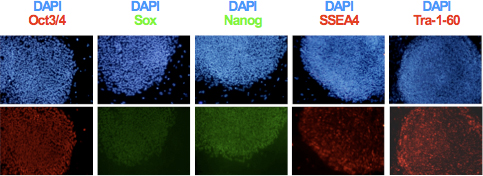
図3。多能性特異的なマーカーOCT3 / 4、Nanogの、レトロウイルスベクター、SSEA4とhiPSCsでTRA-1-60の発現は、免疫細胞化学によって決定された。
ディスカッション
特に神経系と神経ヒトの疾患、勉強、特に十分なヒト細胞モデルの到達不能に起因する困難されています。多様な種類の細胞にそれらを区別するために誘導多能性幹細胞および潜在的に容易に得られる体細胞を再プログラムする能力は、遺伝性疾患の細胞モデルを作成する可能性を開いた。さらに、性IPSCは、再生医療の将来非常に有望なものである。したがって、多能性に体細胞を再プログラミングの信頼性の高い効率的で安全な方法を開発し、最適化することが不可欠です。
治療への応用の観点から、それが宿主ゲノムにフットプリントの変異を欠いているIPSC世代の安全なアプローチを開発することが重要です。そのようなエピソームベクトルのトランスフェクションとして再プログラム細胞のゲノムに恒久的な変化を導入することなくプログラミング体細胞の方法は、切除可能TRAの使用nsposons、アデノウイルス感染症、およびmRNAまたはタンパク質の直接配信は、すでに11-15確立されている。これまでのところ、これらの遺伝子フリーの方法を使用してプログラミング効率が低く、再プログラム体細胞の性質、種類、年齢に依存しています。したがって、これらのプロトコルは遅れて通路を再プログラミングには適していません、成人の体細胞は、頻繁にセルリポジトリに堆積させた。また、複数のIPSCラインの詳細な特性を有効にするとヒトの疾患の新しいモデルを確立し、転写因子のウイルス送達を使用して、体細胞の再プログラミング、高スループットの薬物画面を実施するためには、適切な戦略である。 20以上の研究を最新の状態にすると、モデルの人間の神経と神経筋疾患の患者特有のiPSCsの生成を報告した。すべてが1つのケースで性IPSCは、レンチウイルスまたはレトロウイルス形質導入16を使用して生成された。
我々のデータは単純なプロトコルが目に基づいて実証するOSKM転写因子のレトロウイルスの電子配信を効率的にも高い通路の成人ヒト線維芽細胞を再プログラムすることができます。 10cmのプレート上にフェニックス細胞の単一トランスフェクションから得られたウイルスの量は、10以上のプログラミング実験のために十分である。成人線維芽細胞の我々のプログラミングプロトコルの3つの重要なステップがあります。劇的に伝達の効率を向上させる情報伝達中に追加の遠心分離工程によって容易に(i)の非常に効率的なウイルスの形質導入し、(ii)播種MEFの上に導入線維芽細胞の密度と( ⅲ)直接フィーダーフリーの培養液に移すことができる潜在的に完全に書き換えコロニーの選択を容易にするために、TRA-1から81までのマーカー抗体を用いたライブ染色の使用しています。プログラミングの効率が大幅に再プログラミング第2週に酪酸ナトリウムを使用することによって強化されています。さらに、IPSCコロニーの大きい画分がで培養することが観察薬剤の存在は完全に再プログラムIPSC行に拡大し、確立することができます。
開示事項
著者らは、開示することは何もありません。
謝辞
この作品は、フリードライヒ失調研究アライアンスとアーノルドファミリー財団とMDアンダーソンがんセンターの幹細胞と再生科学総合研究センターからのパイロット助成金によって支えられている。
資料
| Name | Company | Catalog Number | Comments |
| 試薬 | 会社 | カタログ番号 | |
| DMEM | インビトロジェン | 11965 | |
| DMEM/F12 | インビトロジェン | 11330 | |
| KSR | インビトロジェン | 10828 | |
| 非必須アミノ酸 | インビトロジェン | 11140 | |
| 酪酸ナトリウム | シグマ | B5887 | |
| Y27632 | Stemgent | 04から0012 | |
| bFGFの | Stemgent | 03から0002 | |
| TRA-1-81抗体 | Stemgent | 09から0069 | |
| Oct3 / 4の抗体 | サンタクルス | SC-8628 | |
| NANOG抗体 | に:Cell Signaling Technology | 4903S | |
| TRA-1-60抗体 | ミリポア | MAB4360 | |
| Sox2の抗体 | に:Cell Signaling Technology | 3579S | |
| SSEA4 | ミリポア | MAB4304 | |
| CF1のMEF | Globalstem | GSC-6201G | |
| 客観的マーカー | ニコン | MBW10010 | |
| マトリゲル | BDバイオサイエンス | 354277 | |
| mTeSR1 | StemCellテクノロジーズ | 05850 | |
| β-メルカプトエタノール | シグマ | M7522 | |
| FuGENE 6トランスフェ | ロシュ社 | 11814443001 | |
| ポリブレン | シグマ | H9268 | |
| オブジェクトマーカー | ニコン | MBW10010 |
参考文献
- Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., Yamanaka, S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Mali, P., Chou, B. K., Yen, J., Ye, Z., Zou, J., Dowey, S., Brodsky, R. A., Ohm, J. E., Yu, W., Baylin, S. B., Yusa, K., Bradley, A., Meyers, D. J., Mukherjee, C., Cole, P. A., Cheng, L. Butyrate greatly enhances derivation of human induced pluripotent stem cells by promoting epigenetic remodeling and the expression of pluripotency-associated genes. Stem Cells. 28, 713-720 (2011).
- Wernig, M., Meissner, A., Foreman, R., Brambrink, T., Ku, M., Hochedlinger, K., Bernstein, B. E., Jaenisch, R. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature. 448, 318-324 (2007).
- Lowry, W. E., Richter, L., Yachechko, R., Pyle, A. D., Tchieu, J., Sridharan, R., Clark, A. T., Plath, K. Generation of human induced pluripotent stem cells from dermal fibroblasts. Proc. Natl. Acad. Sci. U.S.A. 105, 2883-2888 (2008).
- Dick, E., Matsa, E., Bispham, J., Reza, M., Guglieri, M., Staniforth, A., Watson, S., Kumari, R., Lochmuller, H., Young, L., Darling, D., Denning, C. Two new protocols to enhance the production and isolation of human induced pluripotent stem cell lines. Stem Cell Res. 6, 158-167 (2011).
- Ku, S., Soragni, E., Campau, E., Thomas, E. A., Altun, G., Laurent, L. C., Loring, J. F., Napierala, M., Gottesfeld, J. M. Friedreich's ataxia induced pluripotent stem cells model intergenerational GAATTC triplet repeat instability. Cell Stem Cell. 7, 631-637 (2010).
- Emre, N., Vidal, J. G., Elia, J., O'Connor, E. D., Paramban, R. I., Hefferan, M. P., Navarro, R., Goldberg, D. S., Varki, N. M., Marsala, M., Carson, C. T. The ROCK inhibitor Y-27632 improves recovery of human embryonic stem cells after fluorescence-activated cell sorting with multiple cell surface markers. PLoS One. 5, e12148-e12148 (2011).
- Watanabe, K., Ueno, M., Kamiya, D., Nishiyama, A., Matsumura, M., Wataya, T., Takahashi, J. B., Nishikawa, S., Muguruma, K., Sasai, Y. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nat. Biotechnol. 25, 681-686 (2007).
- Maherali, N., Hochedlinger, K. Guidelines and techniques for the generation of induced pluripotent stem cells. Cell Stem Cell. 3, 595-605 (2008).
- Yu, J., Thomson, J. A. Induced Pluripotent Stem Cell Derivation. Essentials of Stem Cell Biology. Lanza, R. , Elsevier Inc. 331-337 (2009).
- Yu, J., Hu, K., Smuga-Otto, K., Tian, S., Stewart, R., Slukvin, I. I., Thomson, J. A. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324, 797-801 (2009).
- Woltjen, K., Michael, I. P., Mohseni, P., Desai, R., Mileikovsky, M., Hamalainen, R., Cowling, R., Wang, W., Liu, P., Gertsenstein, M., Kaji, K., Sung, H. K., Nagy, A. piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells. Nature. 458, 766-770 (2009).
- Zhou, W., Freed, C. R. Adenoviral gene delivery can reprogram human fibroblasts to induced pluripotent stem cells. Stem Cells. 27, 2667-2674 (2009).
- Warren, L., Manos, P. D., Ahfeldt, T., Loh, Y. H., Li, H., Lau, F., Ebina, W., Mandal, P. K., Smith, Z. D., Meissner, A., Daley, G. Q., Brack, A. S., Collins, J. J., Cowan, C., Schlaeger, T. M., Rossi, D. J. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell Stem Cell. 7, 618-630 (2010).
- Kim, D., Kim, C. H., Moon, J. I., Chung, Y. G., Chang, M. Y., Han, B. S., Ko, S., Yang, E., Cha, K. Y., Lanza, R., Kim, K. S. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Han, S. S., Williams, L. A., Eggan, K. C. Constructing and deconstructing stem cell models of neurological disease. Neuron. 70, 626-644 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved