Method Article
Выбор и изоляция Колонии человека индуцированных плюрипотентных стволовых клеток из взрослых Перепрограммированный Фибробласты
В этой статье
Резюме
Мы представляем протокол для эффективного перепрограммирования соматических клеток человека в человека индуцированных плюрипотентных стволовых клеток (hiPSC) с использованием ретровирусных векторов, кодирующих Oct3 / 4, Sox2, Klf4 и с-тус (OSKM) и определение правильно перепрограммировать hiPSC живой окрашивания Тра- 1-81 антител.
Аннотация
Здесь мы представляем протокола перепрограммирования фибробластов человека взрослого человека в индуцированные плюрипотентные стволовые клетки (hiPSC) с использованием ретровирусных векторов, кодирующих Oct3 / 4, Sox2, Klf4 и с-тус (OSKM) в присутствии бутират натрия 1-3. Мы использовали этот метод, чтобы перепрограммировать конце прохода (> p10), человеческие фибробласты взрослого, полученных от пациента атаксия Фридрейха (GM03665, Coriell Repository). Перепрограммирования подход включает в себя высокоэффективный трансдукции протокол, используя повторяющиеся центрифугирования фибробластов в присутствии вируса средах. Перепрограммировать колонии hiPSC были определены с использованием живых иммуногистохимическое TRA-1-81, поверхность маркера плюрипотентных клеток, отделенных от не-перепрограммировать фибробласты и вручную пассировать 4,5. Эти hiPSC затем были переданы Матригель пластин и вырос в питатель без условий, непосредственно от перепрограммирования пластины. Начиная с первого прохода, hiPSC колонии демонстрируют характерный ГЭС-лАйк морфологии. Используя этот протокол более 70% выбранных колоний может быть успешно расширили и установили в клеточных линиях. Установленные hiPSC отображаемых строк характеристика маркеров плюрипотентности включая поверхностные маркеры TRA-1-60 и SSEA-4, а также ядерных маркеров Oct3 / 4, Sox2 и Nanog. Протокол, представленные здесь была создана и протестирована с использованием взрослых фибробластов, полученных от больных атаксией Фридрейха и контроля лиц 6 человек новорожденного фибробластов, а также человеческих кератиноцитов.
протокол
1. Производство вирусов и трансдукция
- Пластина Phoenix Ampho клеток при плотности ~ 7-8x10 6 на 10 см пластины в 10 мл DMEM среде (DMEM высокий уровень глюкозы, 10% FBS тепло инактивированная, 2 мМ L-глутамина, не антибиотики). Место в инкубаторе и культуры в течение ночи при 37 ° C, 5% СО 2.
- На следующий день трансфекции клеток с помощью Phoenix 12 мкг вектора кодировки или Oct3 / 4, Sox2, Klf4, с-тус, или GFP ген (Addgene плазмиды 17217, 17218, 17219, 17220) и 35 мкл Fugene 6. Подготовить трансфекции смеси в 500 мкл DMEM среде (DMEM высокий уровень глюкозы, 2 мМ L-глутамина, не FBS и антибиотиков). Инкубировать 20 мин. Осторожно пипетировать ДНК комплексов в 10 см, чашки, содержащие 70-80% сливной клетки Феникс.
- Замените СМИ 6 - 8 часов после трансфекции DMEM среде (DMEM высокий уровень глюкозы, 10% FBS тепло инактивированная, 2 мМ L-глютамин), содержащих пенициллин и стрептомицин.
- Впоследствии сбор содержащих вирус СМИ 4 раза в 12 часовпромежутки времени, объединить все части и фильтруется с помощью 0,45 мкм фильтр для удаления отдельных клеток и мусора (сред, содержащих вирусные частицы могут храниться в холодильнике в течение 2 недель, не теряя при инфекционной активности, однако замораживание не рекомендуется).
- Для ретровирусной трансдукции, плиты человеческие фибробласты взрослого человека (проход 10, Coriell Laboratories) из замороженных акции за 24 часа до последнего дня ретровирусных сбор средств массовой информации. Семенной клетки на 6-и желатин покрыты пластины в концентрации 1x10 5 клеток на лунку в DMEM высокий уровень глюкозы, 10% FBS, 2 мМ L-глутамина, пенициллин, стрептомицин и незаменимых аминокислот.
- Следующий день заменить DMEM СМИ со средами, содержащими вирусных частиц, полученных из клеток Феникс. Добавить вирусных СМИ (1 мл каждого Oct4, Sox2, Klf4, и с-тус СМИ, 4 мл общего числа) дополнено с 6 мкг / мл polybrene в каждую лунку 6-а пластина культуры фибробластов и центрифуги на 1600G для 1 час при 20 ° C. Около 12 часов афтер трансдукции, заменить вирусной среде с фибробластов культуральной среде. Выполните вирусной инфекции и центрифугирования 3 раза в течение 24 ч интервалом.
- Культуры фибробластов в DMEM СМИ в течение 48 часов после последнего инфекции. Проверьте эффективность заражения параллельно с преобразователями ретровирусных СМИ выразить GFP. На рисунке 1 показана эффективность центрифугирования, способствовало ретровирусного заражения человека фибробластов.
2. Перепрограммирование
- Подготовить 6 хорошо пластин с γ-облученных слоях MEF подачи путем посева клеток MEF при плотности ~ 2x10 5 клеток на лунку желатин лечение 6 хорошо пластины фибробластов среднего роста. На следующий день разделить инфицированных человеческих фибробластов использованием 0,05% трипсин / ЭДТА и семя их плотность ~ 1.2x10 4 процента и в среде роста фибробластов.
- На следующий день заменить средства массовой информации с ЭСК СМИ (DMEM/F12, 20% Замена нокаут сыворотки, не незаменимые аминокислоты, Кисточкип / стрептомицин, 2 мМ L-глутамина, 0,1 мМ β-меркаптоэтанол, 20 нг / мл базальной фактор роста фибробластов (bFGF), дополненный 0,5 мМ бутират натрия для первых 7 дней после перепрограммирования. Изменение массовой информации ежедневно.
- Мониторинг морфологических изменений в трансдуцированных клетки ежедневно. Колонии бедра, как и клетки начинают появляться примерно 5 - 10 дней после передачи трансдуцированных фибробластов на фидерных клеток. HiPSC колонии готовы быть изолированы примерно 14 - 28 дней после того, как нанесение их на клетках MEF подачи.
3. Выделение hiPSC колонии
- За день до сбора hiPSC колонии подготовить 24-луночных планшетах с γ-облученных MEF фидерных клеток (~ 4x10 4 клеток на лунку) в среднем рост фибробластов. На этом этапе hiPSC колонии также может быть передан подачи свободную культуру использования Матригель и mTeSR1 среды.
- До изоляции hiPSC колонии подготовить MEF пластин путем удаления фибробластов рост mediuм и полоскания MEFs с PBS для удаления следов FBS. Затем добавляют 0,5 мл ЭСК среды (или mTeSR1 среды в случае Матригель лунок) с 10 мкМ ROCK ингибитор Y27632 в каждую лунку по 7,8.
- При необходимости удалите фибробластов окружающих hiPSC колонии с 21 иглы под микроскопом установлены в капоте ламинарного течения (рис. 2A - C). Промыть пластины с PBS и добавить свежие СМИ ЭСК содержащие TRA-1-81 StainAlive специфических антител (1:200, Stemgent). Через 30 мин., Замените носитель, содержащий антитела со свежими СМИ ЭСК с добавлением 10 мкМ ингибиторов ROCK. Изучить пластин под флуоресцентным микроскопом и отметить TRA-1-81 положительных колоний использованием цель маркер (рис. 2D).
- Разрежьте Тра-1-81 положительных hiPSC колонии под микроскопом в ламинарном капот, на несколько небольших частей использованием 21-иглу, как показано на рисунке 2Е и F.
- Использование автоматической пипетки (P200) передача фрагментов hiPSC колоний в индividual скважин 24-луночного планшета с MEFs или Матригель. Избегайте передачи без бедра клеток. Установите плиты в 37 ° C, 5% СО 2 инкубатора и позволяет hiPSC колонии приложить на 24-36 час.
- Изменение ЭСК или mTeSR1 (для колоний, выросших на Матригель) средства массовой информации ежедневно. HiPSC колонии ЭСК правильной морфологией будут видны через 48 ч после первой передачи на 24-луночного планшета.
- Вручную прохождения hiPSC колоний каждые 6 - 8 дней на 12-и, а затем на 6-луночного планшета.
- После клональной экспансии и установления hiPSC линии, анализ экспрессии маркеров плюрипотентности TRA-1-60, SSEA-4, Oct3 / 4, Sox2 и Nanog использованием иммуноцитохимии, как показано на рисунке 3. Оценка целостности генома и дифференциации потенциальных полученных линий с использованием кариотип и тератомы формирование анализы 6,9.
4. Представитель Результаты
Эффективность трансдукции с ретровирус содержащие СМИ яс критическим для успешного перепрограммирования. Рекомендуется проводить весь трансфекции / инфекции процедуры с использованием GFP выражения вирус каждый перепрограммирования эксперимент для мониторинга эффективности, как показано на рисунке 1. Титр вируса выражения GFP определяется, как описано в 10, через трансдукции фибробластов человека с использованием не-концентрированный вирусные средства массовой информации обычно находится в диапазоне 0,5 - 5 х 10 7 вирусных частиц на мл (VP / мл).
Фибробласты изменить морфологию уже через 2 дня после последнего инфекции. Трипсинизированных фибробластов человека должны быть тщательно рассчитывал до посева их в клетки MEF подачи. Рекомендуется семена клетки в 3 различных плотностей (6x10 3, 1.2x10 4, 2.5x10 4 на одной скважине на 6 и пластины) с каждой клеточной линии демонстрирует различные характерные роста и плотности посева имеет решающее значение для эффективности перепрограммирования. Бутират натрия используются дляпервые 7 - 14 дней перепрограммирования повышает эффективность hiPSC образование примерно в 5 раз. Часто, особенно при инфицированных фибробластов были посеяны на более высокую плотность, фибробластоподобных клетки могут перерасти культуры блюдо и накройте hiPSC колонии, как показано на рисунке 2А. В этом случае слой фибробластов можно осторожно поднимать и удалить, чтобы раскрыть hiPSC колонии (рис. 2В). Впоследствии hiPSC колоний следует промыть ЭСК СМИ и окрашивали TRA-1-81 антитела. В зависимости от фибробластов, примерно 20 - 40% колоний демонстрации с IPSC морфологией не пятно TRA-1-81 антитела. Выявленные hiPSC колонии могут быть переданы от пластины в течение ближайших 12 - 24 часов. Длительный инкубационный приведет к быстрой дифференциации hiPSCs. Колонии можно вручную или пассировать на MEF фидерных клеток или Матригель покрытие пластин. После расширения установлены hiPSC клоны должны быть проверены с использованием иммуноцитохимии (ICC) для выражения pluripotenсу маркеры, как показано на рисунке 3. Кроме того, детально молекулярная характеристика созданные клетки иПК линии должна включать в себя: анализ экспрессии генов плюрипотентности использованием RT-PCR, демонстрация деметилирования ДНК на промоутеров генов плюрипотентности и анализ трансгенов глушителей 9.

Рисунок 1. Эффективность вирусной трансдукции определяется с помощью GFP выражения ретровируса. (A, B) фибробласты взрослого человека, полученных от пациента атаксия Фридрейха (GM03665, Coriell Repository) были визуализированы после двух последовательных инфекций GFP ретровирусных СМИ. (C, D) Фибробласты человека были заражены той же партии GFP ретровирусные средства массовой информации с последующим центрифугированием клеток непосредственно на 6-луночных планшетах в течение 1 ч при 1600G. Изображения были захвачены 48 часов после заражения.

Рисунок 2. Выявление и изоляция hiPSC колонии. (A) фазового контраста изображения пластины, содержащей hiPSCs окружении фибробластов. Клетки культивировали в течение 21 дней на ЭСК СМИ. (B, C) То же hiPSC колонии после удаления окружающих фибробластов слоя. (D) Правильно перепрограммировать hiPSC колонии определенных живых окрашивания TRA-1-81 поверхность маркеров антител, сократить использование стерильной иглой (E, F) и передаются в отдельных скважинах из 24-луночного планшета.
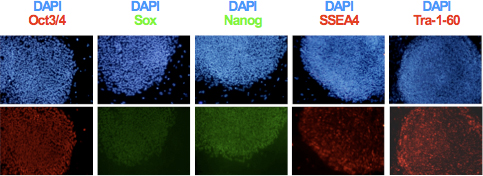
Рисунок 3. Экспрессия маркеров плюрипотентности Oct3 / 4, Nanog, Sox2, SSEA4 и TRA-1-60 hiPSCs определялась иммуноцитохимия.
Обсуждение
Изучение человеческих болезней, особенно неврологических и нейродегенеративных, была особенно сложной в связи с недоступностью адекватного человека клеточных моделях. Возможность перепрограммировать легко получить соматических клеток в индуцированные плюрипотентные стволовые клетки, и потенциал, чтобы дифференцировать их в различные типы клеток, открыли возможность для создания клеточных моделей генетических заболеваний. Кроме того, иПСК держать большие надежды в будущее регенеративной медицины. Поэтому важно развивать и оптимизировать надежных, эффективных и безопасных методов перепрограммирования соматических клеток плюрипотентности.
С точки зрения терапевтического применения, крайне важно развивать безопасные подходы IPSC поколению не хватает след мутаций в геном хозяина. Методы перепрограммирования соматических клеток без внесения постоянных изменений в геноме перепрограммировать клетки, такие как трансфекция эписомной векторов, использование подакцизных траnsposons, аденовирусная инфекция, а прямые поставки РНК или белков, которые уже были созданы 11-15. До сих пор эффективность перепрограммирования с помощью этих трансгенов без методов низка и зависит от характера, типа и возраста перепрограммировать соматические клетки. Таким образом, эти протоколы не подходят для перепрограммирования конце прохода, взрослые соматические клетки часто хранение в ячейку хранилища. Кроме того, чтобы дать подробную характеристику нескольких строк IPSC и создание новых моделей болезней человека и провести высокой пропускной способностью экраны наркотиков, перепрограммирования соматических клеток использованием вирусных доставки транскрипционных факторов является адекватной стратегии. На сегодняшний день более чем 20 исследованиях сообщалось поколения конкретного пациента иПСК для моделирования человеческих неврологических и нервно-мышечных заболеваний. Во всех случаях, кроме одного иПСК были получены с использованием лентивирусов или ретровирусной трансдукции 16.
Наши данные показывают, что простой протокол, основанный на гоэлектронная доставка ретровирусных OSKM транскрипционных факторов может быть использован для эффективного перепрограммировать фибробласты взрослого человека, даже высокого прохода. Количество вируса получены из одного трансфекции клеток Phoenix на 10 см пластины достаточно для более чем 10 перепрограммирования экспериментов. Существуют три важных шагов в нашей перепрограммирования протокола взрослых фибробластов: (I) высокоэффективное вирусной трансдукции способствовал дополнительный шаг центрифугирования при трансдукции, что резко повышает эффективность трансдукции, (II) плотность посева трансдуцированных фибробластов на MEFs и ( в) использовать живых окрашивания TRA-1-81 маркер антител для облегчения выбора потенциально полностью перепрограммировать колонии, которые могут быть непосредственно переданы подачи без культуры. Эффективность перепрограммирования значительно усилить с помощью бутират натрия в течение второй недели перепрограммирования. Кроме того, мы обнаружили, что большую долю IPSC колонии культивировали вналичие наркотиков может быть расширен и создана в полном перепрограммировать IPSC линий.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Эта работа была поддержана Атаксия Фридрейха Research Alliance и пилот грант Арнольд Family Foundation и Центр стволовых клеток и биологии развития в MD Anderson Cancer Center.
Материалы
| Name | Company | Catalog Number | Comments |
| Реагент | Компания | Номер в каталоге | |
| DMEM | Invitrogen | 11965 | |
| DMEM/F12 | Invitrogen | 11330 | |
| KSR | Invitrogen | 10828 | |
| Номера для незаменимых аминокислот | Invitrogen | 11140 | |
| Бутират натрия | Сигма | B5887 | |
| Y27632 | Stemgent | 04-0012 | |
| bFGF | Stemgent | 03-0002 | |
| TRA-1-81 антитела | Stemgent | 09-0069 | |
| Oct3 / 4 антител | Санта-Крус | SC-8628 | |
| Nanog антител | Сотовые технологии передачи сигналов | 4903S | |
| TRA-1-60 антитела | Millipore | MAB4360 | |
| Sox2 антител | Сотовые технологии передачи сигналов | 3579S | |
| SSEA4 | Millipore | MAB4304 | |
| CF1 MEFs | Globalstem | GSC-6201G | |
| Цель маркера | Nikon | MBW10010 | |
| Матригель | BD Biosciences | 354277 | |
| mTeSR1 | StemCell технологии | 05850 | |
| β-меркаптоэтанол | Сигма | M7522 | |
| Fugene 6 | Roche | 11814443001 | |
| polybrene | Сигма | H9268 | |
| Объект маркер | Nikon | MBW10010 |
Ссылки
- Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., Yamanaka, S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Mali, P., Chou, B. K., Yen, J., Ye, Z., Zou, J., Dowey, S., Brodsky, R. A., Ohm, J. E., Yu, W., Baylin, S. B., Yusa, K., Bradley, A., Meyers, D. J., Mukherjee, C., Cole, P. A., Cheng, L. Butyrate greatly enhances derivation of human induced pluripotent stem cells by promoting epigenetic remodeling and the expression of pluripotency-associated genes. Stem Cells. 28, 713-720 (2011).
- Wernig, M., Meissner, A., Foreman, R., Brambrink, T., Ku, M., Hochedlinger, K., Bernstein, B. E., Jaenisch, R. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature. 448, 318-324 (2007).
- Lowry, W. E., Richter, L., Yachechko, R., Pyle, A. D., Tchieu, J., Sridharan, R., Clark, A. T., Plath, K. Generation of human induced pluripotent stem cells from dermal fibroblasts. Proc. Natl. Acad. Sci. U.S.A. 105, 2883-2888 (2008).
- Dick, E., Matsa, E., Bispham, J., Reza, M., Guglieri, M., Staniforth, A., Watson, S., Kumari, R., Lochmuller, H., Young, L., Darling, D., Denning, C. Two new protocols to enhance the production and isolation of human induced pluripotent stem cell lines. Stem Cell Res. 6, 158-167 (2011).
- Ku, S., Soragni, E., Campau, E., Thomas, E. A., Altun, G., Laurent, L. C., Loring, J. F., Napierala, M., Gottesfeld, J. M. Friedreich's ataxia induced pluripotent stem cells model intergenerational GAATTC triplet repeat instability. Cell Stem Cell. 7, 631-637 (2010).
- Emre, N., Vidal, J. G., Elia, J., O'Connor, E. D., Paramban, R. I., Hefferan, M. P., Navarro, R., Goldberg, D. S., Varki, N. M., Marsala, M., Carson, C. T. The ROCK inhibitor Y-27632 improves recovery of human embryonic stem cells after fluorescence-activated cell sorting with multiple cell surface markers. PLoS One. 5, e12148-e12148 (2011).
- Watanabe, K., Ueno, M., Kamiya, D., Nishiyama, A., Matsumura, M., Wataya, T., Takahashi, J. B., Nishikawa, S., Muguruma, K., Sasai, Y. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nat. Biotechnol. 25, 681-686 (2007).
- Maherali, N., Hochedlinger, K. Guidelines and techniques for the generation of induced pluripotent stem cells. Cell Stem Cell. 3, 595-605 (2008).
- Yu, J., Thomson, J. A. Induced Pluripotent Stem Cell Derivation. Essentials of Stem Cell Biology. Lanza, R. , Elsevier Inc. 331-337 (2009).
- Yu, J., Hu, K., Smuga-Otto, K., Tian, S., Stewart, R., Slukvin, I. I., Thomson, J. A. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324, 797-801 (2009).
- Woltjen, K., Michael, I. P., Mohseni, P., Desai, R., Mileikovsky, M., Hamalainen, R., Cowling, R., Wang, W., Liu, P., Gertsenstein, M., Kaji, K., Sung, H. K., Nagy, A. piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells. Nature. 458, 766-770 (2009).
- Zhou, W., Freed, C. R. Adenoviral gene delivery can reprogram human fibroblasts to induced pluripotent stem cells. Stem Cells. 27, 2667-2674 (2009).
- Warren, L., Manos, P. D., Ahfeldt, T., Loh, Y. H., Li, H., Lau, F., Ebina, W., Mandal, P. K., Smith, Z. D., Meissner, A., Daley, G. Q., Brack, A. S., Collins, J. J., Cowan, C., Schlaeger, T. M., Rossi, D. J. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell Stem Cell. 7, 618-630 (2010).
- Kim, D., Kim, C. H., Moon, J. I., Chung, Y. G., Chang, M. Y., Han, B. S., Ko, S., Yang, E., Cha, K. Y., Lanza, R., Kim, K. S. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Han, S. S., Williams, L. A., Eggan, K. C. Constructing and deconstructing stem cell models of neurological disease. Neuron. 70, 626-644 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены