Method Article
İlköğretim Rat Kortikal Nöronlar ve Glia bilaminar Co-kültür
* Bu yazarlar eşit katkıda bulunmuştur
Özet
Burada kültür sıçan kortikal nöronların glial besleyici tabakasının varlığı için bir protokol sağlar. Kültürlü nöronlar polarite kurmak ve sinapslar oluşturmak ve glia elektrofizyoloji, kalsiyum görüntüleme, hücre sağkalım deneyleri, immünhistokimya ve RNA / DNA / protein izolasyonu gibi çeşitli uygulamalarda kullanılmak üzere ayrılabilir.
Özet
Bu video glial besleyici bir tabaka, bir bilaminar ya da ko-kültür modeli olarak bilinen bir sistemin varlığı içinde kültür sıçan kortikal nöronların sürecinde size kılavuzluk edecektir. Bu sistem için uygun bir cam veya plastik büyüme substrat gerektiren çeşitli deneysel ihtiyaçlarını ve diğer tip nöron kültürü için de kullanılabilir.
Geç embriyonik evre (E17) elde Rat kortikal nöronların, cam lamelleri veya doku kültürü yemekleri besleyici tabaka, sırasıyla, yemekler ya da plastik lamelleri (manox olarak da bilinir) yetişen glia bir bakan kaplama. Özel deneysel gerekebilir kullanılan teknik, ya da iki yapılandırma arasında seçim bağlıdır, bu nöronların cam (örneğin kalsiyum görüntüleme karşı Western Blot) yetiştirilmektedir. Glial besleyici tabaka, karma glia bir astroglia zenginleştirilmiş ikincil kültür, ayrı ayrı, yeni doğmuş sıçan yavruların korteks (P2-4) nöronal önce hazırlanandiseksiyonu.
Nöronların bir kültür ile karşılaştırıldığında bu kültürü sisteminin en büyük avantajı sadece nöronal büyüme, hayatta kalma ve daha doğru in vivo beyin ortamında benzer glial besleyici tabaka, salgılanan trofik faktörler tarafından sağlanan farklılaşma destek. Ayrıca, ortak kültür, nöronal-glial etkileşimleri 1 incelemek için kullanılabilir .
Aynı zamanda, yerleşik diğer yöntemler 1 karşılaştırılabilir neredeyse saf nöronal bir tabaka önde gelen farklı yollarla (düşük yoğunluklu kültür, mitoz inhibitörleri Ayrıca, serum ve optimize edilmiş kültür ortamı kullanım eksikliği), nöronal tabaka glia kirlenme önlenir -3. Nöronlar, kültür sırasında herhangi bir zamanda kolayca glial tabakası ayrılır ve elektrofizyoloji 4, hücresel ve moleküler biyoloji 5-8, biyokimya 5, görüntüleme ve mikrofon arasında değişen farklı deneysel uygulamalar için kullanılır .roscopy 4,6,7,9,10. Bazı hücre hatları süreçleri uzatmak rağmen, fonksiyonel sinapsların 11 nöronal hücre hatlarında görülmez bir süreç oluşturmak için birincil nöronların akson ve dendritler uzanır.
Bu ortak kültür sistemi kullanılarak kültür sıçan hipokampal nöron ayrıntılı bir protokol daha önce 4,12,13 tarif edilmiştir. Burada ayrıntılı kortikal nöronların uygun modifiye edilmiş bir protokol. Yaklaşık 20x10 6 hücre, her bir sıçan embriyo kurtarıldı gibi, bu yöntem, nöronların (ama son derece homojen bir nöronal nüfus endişe) çok sayıda gerektiren deneyler için yararlıdır. Nöronlar ve glia hazırlanması planlanan bir zamanda belirli bir şekilde olması gerekir. Biz adım adım kültür sıçan kortikal nöronların için protokol yanı sıra kültür glial hücreler nöronlar destek sağlayacaktır.
Protokol
1. Glia Diseksiyon (kaplama nöronlar ~ 2 hafta önce)
- % 70 etanol diseksiyonu steril aletler için hazırlamak için, (Tablo VI cerrahi aletler ile ilgili ayrıntıları görmek Çözülme buz 4 ml soğuk diseksiyon orta 60 mm yemekleri (beyin başına bir yemek), yer ve% 2,5 'tripsin ve DNaz .)
- 100 mm steril bir tabak içinde 2-4 gün eski yavrular ve yer başkanları başını kesmek için büyük bir makas kullanın.
- Deri yoluyla bir orta hat kesme ve deri kafatası açığa çıkarmak için geri çekmek için orta makas kullanın. Beyin dokusu altında zarar vermeden, bir orta hat kesme ve kafatası ile iki yan keser kavisli makas kullanın. Beyinde açığa çıkarmak için üst kafatası çıkarın.
- Beyin ayıklayın ve 4 ml soğuk diseksiyon orta içeren kendi 60 mm çanak yerleştirin (kompozisyon için tabloya bakınız). Stereomikroskopta (Leica ZOOM 2000, zoom kontrolü: 7-30) altında tabak yerleştirin ve hemisferlerin ayrı No.5 forseps kullanımı, orta beyin kaldırmak, ve kabuğu off menenjlerin.
- Soğuk diseksiyon orta ile yeni bir 60 mm çanak disseke tüm serebral korteks toplayın ve kavisli makas ile doku kıyma.
- Kıyılmış doku, 15 ml steril bir tüpe aktarın. Getirin ve soğuk diseksiyon orta hacmi 4.5 mL% 2.5 tripsin 500 mcL ekleyin. Parafilm tüp sarın ve her 5 dakikada bir inversiyon ile karıştırılarak, 15 dakika boyunca 37 ° C su banyosu içinde yüzer.
(Not: Buraya kadar 5 beyin kullanırken biz genellikle takip protokolü açıklamak; daha fazla yavrular kullanılması halinde, hacimler uygun bir şekilde ayarlanması gerekebilir)
- Tripsin içeren diseksiyon orta taşınan hacmi en aza indirerek, yeni bir 15 ml tüp doku aktarın. Taze diseksiyon orta 4.8mL hacmi getirin ve 60 ug / mL (stok solüsyonu: 3 mg DNaz ve 5 mg MgSO4 diseksiyon orta 2 ml) bir nihai konsantrasyonu ulaşmak için 200 mcL DNaz ekleyin. ~ 20 defa 5 ml steril bir pipetlemeyin ile hafifçe Karışımte, daha sonra 10 ml (kompozisyon için tablo II) glia kaplama orta eklemek.
- 4-5 dakika razı doku büyük parça izin ver, sonra hücre süspansiyonu% 80 50ml tüp transferi. Glia kaplama orta ek bir 2-3 mL (ve gerekirse küçük bir pipet kullanarak) ile doku öğütme Tekrar, tekrar, doku yerleşmek için izin ve önceki koleksiyonu için en üst% 80 ekleyin. G (veya IEC Centra CL2 santrifüj 1300 rpm) 280 15 dakika glia kaplama orta ve santrifüj ile toplam hacmi 20 mL getirin.
- Süpernatantı aspire ve glia kaplama orta hücre pelet (kabaca kullanılan yavruların sayısına bağlı olarak 5-7 ml kullanarak) tekrar süspansiyon haline getirin, sonra disseke her beyin için 10 ml için ek kaplama orta eklemek. Her biri 75 cm 2 balonuna (yani bir şişesi ortalama beyin) ve plaka hücre süspansiyonu 10 ml karıştırın .
- 37 bir inkübatör seti kültür şişeler Taşı ° C CO2 (% 5-10'u, sodyum bicarbona orantılıorta te içerik). Her 3-4 gün sonra 24-48 saat sonra kültür ortamı değiştirin.
2. İkincil Glia (48 saat önce kaplama nöronlar)
- Manox lamelleri (nöronlar yemekleri kaplama olacak) her yıkanmış ve otoklavlanmış manox çevresinde 3 küçük damla erimiş paraplast balmumu ekleyerek hazırlayın. Hücreler manox bu yan kaplama olacak. Bizim manox piyasada bulunan kültür ekler yerine kullanılacak olsa da, üzerinden delinmiş ~ 50 2 mm delik plastik (bakınız tablo VI reaktiflerin) kesilen el yapımı yeniden kullanılabilir ~ 60 mm ekler.
- Şiddetle herhangi bir unattached hücreleri çıkarmak için her şişeyi sallayarak, birincil glia PBS iki kez yıkayın. Konfluent birincil glia Her şişesi yaklaşık 10 milyon astroglia sağlayacaktır, bu nedenle düzenli Deneme başına 2-4 şişeler kullanın.
- % 0.05 'tryspin-EDTA (9 mL PBS içinde seyreltilmesi 1 mL10X,% 0.5' lik tripsin-EDTA stok solüsyonu) ile hücreleri ayırın. Kombine biri 50 ml konik tüp içine 2 matara hücreleri ve glia kaplama orta eşit miktarda (Tablo II reaktiflerin). 280 gr az 15 dakika santrifüj Süpernatantı aspire ve glia kaplama orta birkaç mL glia pelet çözülür.
- Hematocytometer kullanarak hücreleri sayın ve gerektiği gibi hücre süspansiyonu seyreltik (~ 1x10 6 hücre / ml); levha (60mm yemekleri (nöronlar lamelleri kaplama edilecektir), ya da manox lamelleri ya hücreler nöronlar üzerindeki kaplama olacak eğer 60 mm yemekleri). Hücreler yemek veya glia kaplama orta kullanarak manox başına 500.000 hücre kaplama olmalıdır. Manox lamelleri, sonra 2 saat glia kaplama orta flip manox ve batığın hücreleri sonra bir damla damla moda hücre plaka 600 mcL durumda.
- Nöronal lamelleri için ikincil glia 60 mm yemekleri hazırlarken nöronal diseksiyonu önceki akşam N2.1 orta değiştirmek.
3. Nöronal Diseksiyonve Kültür
- Fiziksel olarak ayrı hücre tabakaları ve hücre kazıma önlemek amacıyla, her steril lamel çevresinde 3 küçük erimiş paraplast balmumu damla ekleyerek cam lamelleri (15 mm çap) hazırlayın. Hücreler lamel bu yan kaplama olacak.
- Coat plaka veya 0.5 mg / ml polylysine (ya poli-L-lisin veya borat tamponu içinde çözünmüş poli-D-lizin bkz. tablo VI) lamelleri 2 saat veya gece boyunca. Steril su ile 2-3 kez yıkayın ve tamamen kurumasını bekleyin. Not: lamelleri lamelleri doku kültür kaplarına yerleştirilir kolayca oluşabilir poli-lizin veya hücre kaplama, kaplama sırasında dökülüp / çözümleri yayılmasını önlemek için hidrofobik bir petri kabına yerleştirilir.
- Glia diseksiyon (adım 1.1) olarak nöronal diseksiyon için hazırlayın. 17 günlük gebe sıçan Euthanize,% 70 etanol ile kürk sprey ve rahim maruz deri yoluyla mediale kesmek. Tüm fetusların çıkarın ve bir koyunSteril 100 mm çanak.
- Hızla kendi 60 mm çanak soğuk diseksiyon orta (4 ml) ile her kafa koyarak, incelemek ve her fetusun başını kesmek. Biz normalde her E17 fetüs yaklaşık 20 milyon nöron türetilmiştir Deneme başına 4-5 fetusların teşrih. Eğer daha fazla embriyoların ihtiyaç vardır, tüm prosedürü (adım 3,4-3,12) daha son 90-100 dakika daha olmadığından emin olun.
- Stereomikroskopta ve No.1/No.5 forseps kullanarak serebral korteks, deri ve kafatası açık çekerek, beyin açılan, hemisferlerin ayıran ve orta beyin ve meninksler çıkarmadan izole eder.
- Soğuk diseksiyon orta ile yeni bir 60 mm çanak tüm disseke korteks toplayın ve eğri makas ile doku ~ 1 mm parçalar halinde kıyma.
- Kıyılmış doku, 15 ml steril bir tüpe aktarın. Getirin ve soğuk diseksiyon orta hacmi 4.5 mL% 2.5 tripsin 500 mcL ekleyin. 15 minu Parafilm tüp sarın ve 36 ° C su banyosu içinde yüzentersine çevirerek her 5 dakikada bir karıştırma tes.
- Tripsin içeren diseksiyon orta taşınan hacmi en aza indirerek, yeni bir 15 ml tüp doku aktarın. 4.8 ml taze diseksiyon orta getirin ve 60 ug / ml final konsantrasyonda ulaşmak için 200 mcL DNaz ekleyin. Karışım steril 5 veya 2 ml pipet ile yaklaşık 10 kez bir yangın cilalı (soğuk) Pasteur pipeti dokusunun en ayırmak kullanarak gerekli olan bu adımı tekrarlayın. 4-5 dakika razı sonra (eğer varsa, genellikle çok az doku) kalan parçaları izin.
- Doku yerleşmiş adet geride bırakarak üst tek hücre süspansiyonu çıkarın ve eşit bir nöron kaplama orta hacmi (Tablo III) ile bu çözüm yeni bir tüp yerleştirmek. Iyi ama yavaşça karıştırın, daha sonra hücre sayımı, 15 mm lamelleri (200 mcL 35.000 hücrelerin her biri) ya da 60 mm yemekleri (3 mL 1x10 6 hücre) levha gerektiği gibi. Inkübatör (36,5 ° C,% 5-10 CO2) hücreleri aktarın.
- 3-4 saat combin sonrae nöron tabakası ve ikincil glia aşağıdaki gibidir. 60 mm yemekleri nöronlar için, hücreleri ile sıcak DMEM yıkama, serum serbest orta 4ml (N2, tablo IV) orta değiştirmek ve glia ile bir manox her plaka (glial hücreler nöronlar bakmalıdır) ekleyin . Aşağı bakacak şekilde nöronlar nöronal lamelleri, ikincil glia her 60 mm çanak transferi 3 ila 5 lamelleri.
- 24 saat nöronlar kaplama sonra, glia silahların yayılmasını önlemek için, her bir çanak sitozin-β-D-arabinofuranoside 10 mcM eklemek. Biz 4 mM stok solüsyonları hazırlıyoruz, N2 orta ile 1:10 seyreltilmiş ve 25 uL / mL her bir çanak seyreltilmiş çözüm ekleyin.
- Hücreler genellikle tam zamanı istenen farklılaşma aşamasında baglidir, 7-10 gün sonra kültür deneyler için kullanılır; sağkalım açısından önemli bir azalma olmadan 4 hafta boyunca büyümüş edilmiştir. İlk haftadan sonra, bir buçuk medya hacmi her hafta değiştirilmesi tavsiye edilir.
4. Temsilcisi Sonuçlar:
Birkaç saat sonra nöronlar yüzeye bağlı lamelliopodia uzatmak başlar. Süreçler uzatmak (Şekil 2A) ve kültürün birkaç gün içinde polarize devam ediyor ve uzun akson ve dendritler (Şekil 2B boyama map2) açıkça görülebilir. Nöronlar dendritik milleri daha ayrıntılı hale olgun ve sinaptik rehber geliştirmek; birçok dendritik dikenler kaplama yaklaşık 2-3 hafta sonra görünür (Şekil 2C) 11.
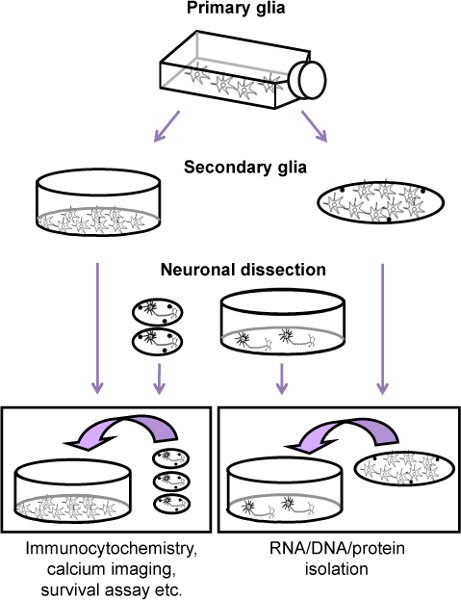
Şekil 1 glial besleyici bir tabaka (ikincil glia) ile birlikte kültür sıçan kortikal nöronlar için prosedürün Akış şeması. Öncelikle, nöronal diseksiyonu 11 gün önce bir ilköğretim glia kültürü yenidoğan sıçanlarda (P2-4) hazırlanır. Konfluent hücreleri (nöron diseksiyonu birincil glia ve iki gün önce kaplama yaklaşık dokuz gün sonra), astrositler Mech.anically yemekleri veya manox oligodendrosit prekürsör hücreler ve mikroglia ve kaplama ya (ikincil glia) ayrılır. Nöronlar sonra korteks E17 embriyo ve lamelleri veya yemekleri (poli-lizin kaplamalı) ya kaplama elde edilir. Dört saat sonra kaplama, nöronal tabaka ikincil glia eklenir.

Şekil 2 kültürlerin örnekleri çeşitli aşamalarında (örneğin 5 saat 12 SAYI SAYI 21). Rakamlar farklı zaman noktalarında lamelleri kortikal nöronların temsili görüntüler. Nöronlara eklendikten sonra substrat nöronlar lamelliopodia uzatmak başlar. Faz kontrastlı görüntü birkaç genişletilmiş neurites kaplama beş saat sonra (A) gösterir. Ortadaki görüntü (B, Cook ve ark 2010, izni ile) sabit ve nöronal dendritik işaretleyici map2 ile boyanmış 12 SAYI kortikal nöronların gösterir. Hoechst boyama counterstai olarak kullanılanning. Nöronlar dendritik dikenler olgun olarak da (C) görünür hale gelir. Ölçek barlar: A, B = 25 mm, C = 10 mikron.
Tartışmalar
Bu protokol nöronlar deneysel analizi için kolayca izole edilmesi için izin verirken, glia hücreleri varlığında kültür sıçan birincil kortikal nöronlar için bir yöntem sağlar. Sağlıklı bir nöronal fenotip glia destek gelişimi sırasında fizyolojik ilgili bir şekilde deneysel tedaviler de modüle nöronal cevapları. Ayrıca, böylece inflamatuar mikrogliyal stimülasyon önlenmesi, bu hücre popülasyonu seçici astrositlerde zenginleştirilmiş olur nöronlar kültür önce birincil glia Pasajlanması. Ancak, belirli deney türleri için, glial hücrelerde farklı oranlarda ek glia kültürleri böylece bu hücresel kompozisyon optimize etmek için yapılabilir, istenen olabilir. Bu protokol ayrıca hipokampus gibi diğer beyin bölgelerinden elde edilen kültür nöronların, özellikle deneysel taleplerine uygun adapte olabilir
Bu tekniğin başlıca kaygıları bakteriyel devam önlenmesi,sanayi dallarını ve glial nöronal tabaka haline yayılmasının önlenmesi. Bu sistem, bu nedenle steril teknikler özellikle her aşamada kritik olan, antibiyotik ajanlar dahil değildir. Glial proliferasyon yanı sıra anti-mitotik ajan sitozin arabinofuranoside, düşük yoğunluklu kaplama ve serum serbest kültür ortamı ile engellenir, bu protokol astrositler, nöronal tabakası 1,4 hücrelerin% 3-5 daha fazla oluşturan ve% 1'den daha az mikroglia tespit edilmelidir. Immunopanning veya diğer teknikler, hatta bu düşük glia kontaminasyon 4 kaldırmak için kullanılabilir .
Arzu edilir analizi için tek tip izole Bu teknik aynı zamanda yapışık hücre tiplerinin herhangi bir ko-kültür çeşitliliği için modifiye edilebilir. Örneğin, bu sistem başarıyla Ca 2 osteoblastlar etkilerini analiz etmek için uyarlanmıştır kemik metastatik kanser hücrelerini 14 + sinyalizasyon.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Yazarlar, bu protokolün arıtma ve yıllar boyunca destek için NIH (DA19808 OM için DA15014) katkıda önceki laboratuar üyeleri teşekkür ederim. Anna Abt 1 "neuroAIDS Disiplinlerarası ve Translasyonel Araştırma Eğitimi" (T32-MH078795) bir adam, bu yüzden, bu çalışma, Ruth L. Kirschstein Ulusal Araştırma Servisi Ödülü 5T32MH079785 altında Ulusal Sağlık Enstitüleri tarafından kısmen desteklenmiştir.
Referanslar
- Cook, A. Interactions between chemokines: regulation of fractalkine/CX3CL1 homeostasis by SDF/CXCL12 in cortical neurons. J. Biol. Chem. 285, 10563-10563 (2010).
- Nicolai, J., Burbassi, S., Rubin, J., Meucci, O. CXCL12 inhibits expression of the NMDA receptor's NR2B subunit through a histone deacetylase-dependent pathway contributing to neuronal survival. Cell. Death. Dis. 1, e33-e33 (2010).
- Sengupta, R. Morphine increases brain levels of ferritin heavy chain leading to inhibition of CXCR4-mediated survival signaling in neurons. J. Neurosci. 29, 2534-2544 (2009).
- Meucci, O. Chemokines regulate hippocampal neuronal signaling and gp120 neurotoxicity. Proc. Natl. Acad. Sci. U. S. A. 95, 14500-14500 (1998).
- Khan, M. Z. Regulation of neuronal P53 activity by CXCR 4. Mol. Cell. Neurosci. 30, 58-66 (2005).
- Patel, J. P. Modulation of neuronal CXCR4 by the micro-opioid agonist DAMGO. J. Neurovirol. 12, 492-500 (2006).
- Shimizu, S. Role of the transcription factor E2F1 in CXCR4-mediated neurotoxicity and HIV neuropathology. Neurobiol. Dis. 25, 17-26 (2007).
- Khan, M. Z. The chemokine receptor CXCR4 regulates cell-cycle proteins in neurons. J. Neurovirol. 9, 300-314 (2003).
- Khan, M. Z. The chemokine CXCL12 promotes survival of postmitotic neurons by regulating Rb protein. Cell. Death. Differ. 15, 1663-1672 (2008).
- Khan, M. Z., Vaidya, A., Meucci, O. CXCL12-mediated regulation of ANP32A/Lanp, a component of the inhibitor of histone acetyl transferase (INHAT) complex, in cortical neurons. J. Neuroimmune. Pharmacol. 6, 163-170 (2011).
- Dotti, C. G., Sullivan, C. A., Banker, G. A. The establishment of polarity by hippocampal neurons in culture. J. Neurosci. 8, 1454-1468 (1988).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat. Protoc. 1, 2406-2415 (2006).
- Goslin, K., Banker, G., Goslin, K., Banker, G. . Culturing Nerve Cells. , 339-370 (1998).
- D'Ambrosio, J., Fatatis, A. Osteoblasts modulate Ca2+ signaling in bone-metastatic prostate and breast cancer cells. Clin. Exp. Metastasis. 26, 955-964 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır