Method Article
Bilaminäre Co-Kultur von primären Ratten-kortikalen Neuronen und Glia
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier bieten wir Ihnen ein Protokoll für die Kultivierung von Ratten kortikalen Neuronen in der Gegenwart eines Glia-Feeder-Schicht. Die kultivierten Neuronen zu etablieren Polarität und erstellen Synapsen, und kann von der Glia für den Einsatz in verschiedenen Anwendungen, wie zB Elektrophysiologie, Kalzium-Imaging, das Überleben der Zelle Assays, Immunzytochemie und RNA / DNA / Protein-Isolierung getrennt werden.
Zusammenfassung
Dieses Video wird Sie durch den Prozess der Kultivierung Ratte kortikalen Neuronen in der Gegenwart eines Glia-Feeder-Schicht, ein System als zweischichtige oder Co-Kultur-Modell bekannt zu führen. Dieses System eignet sich für eine Vielzahl von experimentellen Anforderungen erfordern entweder ein Glas oder Kunststoff Aufwachssubstrats und kann auch für die Kultur des anderen Typen von Neuronen verwendet werden.
Rat kortikalen Neuronen aus dem späten Embryonalstadium (E17) gewonnen werden, auf Deckgläser oder Gewebekulturschalen vor einer Feeder-Schicht von Gliazellen auf dem Geschirr oder Kunststoff Deckgläser (bekannt als Thermanox) gewachsen, bzw. vergoldet. Die Wahl zwischen den beiden Konfigurationen hängt von den spezifischen experimentellen Technik verwendet, die gegebenenfalls verlangen, oder nicht, sind die Neuronen auf Glas (z. B. Calcium-Imaging im Vergleich zu Western-Blot) gewachsen. Die Glia-Feeder-Schicht, eine Astroglia angereicherte sekundäre Kultur des gemischten Glia, getrennt von den Rinden der neugeborenen Ratte Welpen (P2-4), die vor der neuronalenDissektion.
Ein großer Vorteil dieser Kultur-System als eine Kultur der Neuronen im Vergleich nur die Unterstützung der neuronalen Wachstum, Überleben und die Differenzierung von trophischen Faktoren aus der Glia-Feeder-Schicht, die genauer ähnelt das Gehirn Umwelt in vivo sezerniert zur Verfügung gestellt. Darüber hinaus kann die Co-Kultur verwendet werden, um neuronal-glialen Interaktionen 1-Studie sein.
Zur gleichen Zeit ist Glia Kontamination in der neuronalen Ebene mit unterschiedlichen Mitteln (low density Kultur, Zugabe von Mitosehemmer, Mangel an Serum und die Verwendung von optimierten Kulturmedium) führen zu einem nahezu reinen neuronalen Ebene, vergleichbar mit anderen etablierten Methoden 1 verhindert -3. Neuronen können leicht von den Gliazellen Schicht jederzeit getrennt während der Kultur und für verschiedene experimentelle Anwendungen von Elektrophysiologie 4, Zell-und Molekularbiologie 5-8, Biochemie 5, Bildgebung und microscopy 4,6,7,9,10. Der primäre Neuronen verlängern Axone und Dendriten bilden funktionelle Synapsen 11, ein Vorgang, der nicht in neuronalen Zelllinien beobachtet wird, obwohl einige Zelllinien Prozesse erstrecken.
Ein detailliertes Protokoll der Kultivierung Ratte Hippocampus-Neuronen mit dieser Co-Kultur-System wurde zuvor 4,12,13 beschrieben. Hier haben wir ausführlich ein modifiziertes Protokoll für kortikale Neuronen geeignet. Wie etwa 20x10 6 Zellen voneinander Rattenembryo zurückgewonnen werden, ist diese Methode besonders nützlich für Experimente erfordern eine große Anzahl von Neuronen (nicht aber über ein sehr homogenes neuronalen betroffene Bevölkerung). Die Aufstellung von Neuronen und Gliazellen muss in einer Zeit-spezifischen Art und Weise geplant werden. Wir werden die Schritt-für-Schritt-Protokoll für die Kultivierung Ratte kortikalen Neuronen sowie Kultivierung Gliazellen um die Neuronen zu unterstützen.
Protokoll
1. Glia Dissection (~ 2 Wochen vor dem Ausplattieren Neuronen)
- Zur Vorbereitung auf die Dissektion statt sterile Instrumente in 70% Ethanol, 4 ml kalte Dissektion mittel-bis 60 mm Schalen (ein Gericht pro Kopf), und legen um 2,5% Trypsin und DNase auf Eis zu tauen (siehe Details über chirurgische Instrumente in der Tabelle VI ).
- Verwenden Sie große Schere auf 2-4 Tage alte Jungtiere und Ort Köpfe in einem 100 mm sterile Schüssel zu enthaupten.
- Verwenden Sie Medium Schere zu einer Mittellinie Schnitt durch die Haut machen und ziehen Sie die Haut an den Schädel freizulegen. Verwenden einer gebogenen Schere zu einer Mittellinie geschnitten und zwei seitliche Schnitte durch den Schädel zu machen, ohne dabei das Hirngewebe darunter. Entfernen Sie die obere Schädel das Gehirn freizulegen.
- Auszug des Gehirns und legen Sie sie in eine eigene 60 mm Schale mit 4 ml kalte Dissektion Medium (siehe Tabelle I für Komposition). Die Schale unter einem Stereomikroskop (Leica ZOOM 2000, Zoom-Steuerung: 7-30) und die Nutzung No.5 Pinzette auf die Halbkugeln zu trennen, entfernen Sie das Mittelhirn, und schälen off der Hirnhäute.
- Sammeln Sie alle seziert zerebralen Kortex in ein frisches 60 mm Schale mit kalter Sezierung mittel-und Hackfleisch, das Gewebe mit einer gebogenen Schere.
- Übertragen Sie die zerkleinerte Gewebe in eine sterile 15-ml-Tube. Bringen Sie das Volumen auf 4,5 ml mit kaltem Dissektion mittel-und fügen Sie 500 ul von 2,5% Trypsin. Wickeln Sie den Schlauch in Parafilm und Schwimmer in einem 37 ° C Wasserbad für 15 Minuten, Mischen durch Umdrehen alle 5 Minuten.
(Anmerkung: hier haben wir das Protokoll wir in der Regel bei der Verwendung von bis zu 5 Gehirn beschreiben, wenn mehr Jungen verwendet werden, Volumina können müssen entsprechend angepasst werden)
- Transfer des Gewebes auf ein neues 15-ml-Tube, die Minimierung der Menge von Trypsin-haltigen Präparation Medium über. Bringen Sie die Lautstärke auf 4.8mL mit frischen Dissektion Medium und mit 200 ul DNase zu einer Endkonzentration von 60 ug / mL (Stammlösung: 3 mg DNase und 5 mg MgSO4 in 2 ml Medium Dissektion) zu erreichen. Man reibt vorsichtig ~ 20 Mal mit einer sterilen 5 ml Pipettete, dann fügen Sie 10 ml Glia Plating-Medium (siehe Tabelle II für Komposition).
- Lassen Sie große Stücke von Gewebe für 4-5 Minuten absetzen, dann überweisen Sie den oberen 80% der Zellsuspension auf eine 50 ml Tube. Wiederholen Sie das Gewebe Verreiben mit einer zusätzlichen 2-3 ml Glia Plating Medium (und mit einem kleineren Pipette falls erforderlich); wieder, damit die Gewebe zu regeln, und fügen Sie die Top 80% auf den vorherigen Erhebung. Bringen Sie das Gesamtvolumen auf 20 ml mit Glia plating mittel-und Zentrifuge für 15 Minuten bei 280 g (oder 1300 rpm in einer IEC Centra CL2 Zentrifuge).
- Saugen Sie den Überstand und Zellpellet in Glia Plating Medium (etwa mit 5-7 ml je nach Anzahl der Welpen verwendet werden), dann fügen Sie zusätzliche Beschichtung Medium, um 10 ml für jedes Gehirn seziert haben. Gut mischen und Platte 10 ml Zellsuspension in je 75 cm 2-Kolben (dh ein Gehirn pro Flasche).
- Bewegen Kulturflaschen in einen Inkubator eingestellt bei 37 ° C (5 bis 10% CO2, proportional zu den Natrium-bicarbonate Inhalt des Mediums). Ändern Kulturmedium nach 24-48 Stunden, dann alle 3-4 Tage.
2. Sekundäre Glia (48 Stunden vor dem Ausplattieren Neuronen)
- Bereiten Thermanox Deckgläser (wenn Neuronen auf dem Geschirr wird vergoldet werden) durch Zugabe von 3 kleinen Tropfen von geschmolzenem Wachs Paraplast um den Umfang der jeweils gewaschen und autoklaviert Thermanox. Die Zellen werden auf dieser Seite des Thermanox beschichtet werden. Unsere Thermanox sind handgefertigt wiederverwendbare ~ 60 mm Einsätze aus Kunststoff (siehe Tabelle VI von Reagenzien) mit ~ 50 2 mm Löcher gebohrt durchtrennt, obwohl im Handel erhältlich Kultur und fügt stattdessen verwendet werden können.
- Waschen Sie die primären Gliazellen mit PBS zweimal kräftig geschüttelt jedem Kolben keine ungebundene Zellen zu entfernen. Jeder Kolben mit konfluenten primären Gliazellen liefert rund 10 Millionen Astroglia, weshalb wir regelmäßig 2-4 Flaschen pro Experiment.
- Lösen Sie die Zellen mit 0,05% tryspin-EDTA (1 mL10X 0,5% Trypsin-EDTA-Stammlösung in 9 ml PBS verdünnt). Combine der Zellen, die aus 2 Flaschen in einem 50 ml konischen Röhrchen und füge eine gleiche Menge an Glia Plating-Medium (siehe Tabelle II von Reagenzien). Zentrifuge für 15 Minuten bei 280 g. Saugen Sie den Überstand und die Auflösung der Glia Pellet in wenigen mL Glia Plating Medium.
- Zählen Sie die Zellen mit einer Zählkammer und verdünnen die Zellsuspension nach Bedarf (~ 1x10 6 Zellen / ml); Platte die Zellen entweder auf 60mm Gerichte (wenn Neuronen auf Deckgläsern wird vergoldet werden), oder auf Thermanox Deckgläser (wenn Neuronen wird vergoldet werden 60 mm Platten). Die Zellen sollten auf 500.000 Zellen pro Schale oder Thermanox mit Glia plating ausplattiert werden. Im Falle der Thermanox Deckgläser, Platte 600 ul der Zellen in einem tropfenweise, dann nach 2 Stunden Flip Thermanox und tauchen Zellen in Glia Plating Medium.
- Wenn der Vorbereitung 60 mm Gerichte der sekundären Glia für die neuronale Deckgläser, ändern mittel-bis N2.1 am Abend vor dem neuronalen Dissektion.
3. Neuronale Dissectionund Kultur
- Bereiten Sie Deckgläschen (15 mm Durchmesser) durch Zugabe von 3 kleinen Tropfen von geschmolzenem Wachs Paraplast um den Umfang der jeweils sterile Deckgläschen, um die physikalische Trennung der Zellschichten und verhindern, dass Zellen Schaben. Die Zellen werden auf dieser Seite des Deckglases beschichtet werden.
- Coat Platten oder Deckgläser mit 0,5 mg / mL Polylysin (entweder Poly-L-Lysin oder Poly-D-Lysin in Borat-Puffer, siehe Tabelle VI) für 2 Stunden oder über Nacht. Waschen mit sterilem Wasser 2-3 mal und vollständig trocknen lassen. Hinweis: Deckgläser sind in eine hydrophobe Petrischale gelegt, damit kein / Verbreitung der Lösungen während der Beschichtung mit Poly-Lysin oder Zelle Beschichtung, die leicht auftreten können, wenn die Deckgläser in Gewebekulturschalen platziert werden.
- Bereiten Sie sich auf die neuronalen Dissektion wie für die Glia Dissektion (Schritt 1.1). Euthanize eine 17-tägige trächtigen Ratten, Spray das Fell mit 70% Ethanol, und schneiden medial durch die Haut in die Gebärmutter freizulegen. Entfernen Sie alle Föten und legen Sie sie in einemsterile 100 mm Schale.
- Schnell kostenlos analysieren und zu enthaupten jeden Fetus, indem jeder Kopf in seine eigene 60 mm Schale mit kalter Sezierung Medium (4 ml). Wir normalerweise sezieren 4-5 Feten pro Experiment etwa 20 Millionen Neuronen aus jedem E17 Fötus stammen. Wenn mehr Embryonen benötigt werden, stellen Sie sicher, dass das gesamte Verfahren (aus Schritt von 3,4 bis 3,12) nicht länger als 90-100 Minuten.
- Mit einem Stereomikroskop und No.1/No.5 Pinzette isolieren den zerebralen Kortex durch Ziehen öffnen Sie die Haut und Schädel, Extrahieren des Gehirns, die Trennung der Hemisphären, und das Entfernen des Mittelhirns und der Hirnhäute.
- Sammeln Sie alle seziert Kortex in ein frisches 60 mm Schale mit kalter Sezierung mittel-und Hackfleisch, das Gewebe mit einer gebogenen Schere in ca. 1 mm große Stücke.
- Übertragen Sie die zerkleinerte Gewebe in eine sterile 15-ml-Tube. Bringen Sie das Volumen auf 4,5 ml mit kaltem Dissektion mittel-und fügen Sie 500 ul von 2,5% Trypsin. Wickeln Sie den Schlauch in Parafilm und Schwimmer in einem 36 ° C Wasserbad für 15 Minutes, Mischen durch Umdrehen alle 5 Minuten.
- Transfer des Gewebes auf ein neues 15-ml-Tube, die Minimierung der Menge von Trypsin-haltigen Präparation Medium über. Bringt auf 4,8 mL mit frischen Dissektion Medium und mit 200 ul DNase zu einer Endkonzentration von 60 ug / mL zu erreichen. Man reibt etwa 10-mal mit einer sterilen 5 oder 2 ml-Pipette, wiederholen Sie diesen Schritt nach Bedarf mit einem feuerpolierte (kalt) Pasteurpipette auf die meisten Gewebe zu distanzieren. Dann lassen restlichen Stücke des Gewebes (in der Regel nur sehr wenige, wenn überhaupt) für 4-5 Minuten absetzen können.
- Entfernen Sie die obere Ein-Zell-Suspension während hinterlassen angesiedelt Gewebestücke, und legen Sie diese Lösung in ein neues Röhrchen mit dem gleichen Volumen von Neuron Plating-Medium (siehe Tabelle III). Gut mischen, aber sanft, dann zählen die Zellen; Platte auf 15 mm Deckgläser (35.000 Zellen in jeweils 200 ul) oder 60 mm Schalen (1x10 6 Zellen jeweils in 3 mL) nach Bedarf. Transfer-Zellen in den Inkubator (36,5 ° C, 5-10% CO2).
- Nach 3-4 Stunden Combine das Neuron-Schicht und der sekundären Glia wie folgt. Für Neuronen auf 60 mm Geschirr, waschen Sie die Zellen mit warmem DMEM, ändern Sie die mittel-bis 4 ml serumfreiem Medium (N2, siehe Tabelle IV), und fügen Sie eine Thermanox mit Glia zu jeder Platte (Gliazellen sollte nach den Neuronen). Für neuronale Deckgläser, Transfer von 3 bis 5 Deckgläser zu je 60 mm-Schale von sekundären Glia, mit den Neuronen nach unten.
- 24 Stunden nach dem Ausplattieren der Neurone, fügen Sie 10 uM von Cytosin-β-D-arabinofuranosid zu jedem Gericht, um Glia-Proliferation zu verhindern. Wir bereiten 4 mM Stammlösungen verdünnt 1:10 mit N2-Medium, und 25 uL / ml verdünnte Lösung zu jedem Gericht.
- Die Zellen sind in der Regel für Experimente nach 7-10 Tagen in Kultur verwendet, obwohl genaue Zeit hängt von der gewünschten Differenzierung der Bühne, sie wurden für bis zu 4 Wochen ohne eine signifikante Abnahme der Überlebensrate gestiegen. Nach der ersten Woche, ist es empfehlenswert, eine halbe Volumen von Medien ersetzt jede Woche.
4. Repräsentative Ergebnisse:
Ein paar Stunden nach Neuronen an das Substrat gebunden, fangen sie an lamelliopodia verlängern. Prozesse weiter zu verlängern (Abb. 2A) und polarisieren über mehrere Tage in Kultur, und erweitert Axone und Dendriten sind deutlich sichtbar (Abb. 2B; MAP2-Färbung). Als Neuronen reifen dendritischen Dornen werden aufwendiger und entwickeln sie synaptische Kontakte, etwa 2-3 Wochen nach dem Ausplattieren viele dendritischen Dornen sichtbar sind (Abb. 2C) 11.
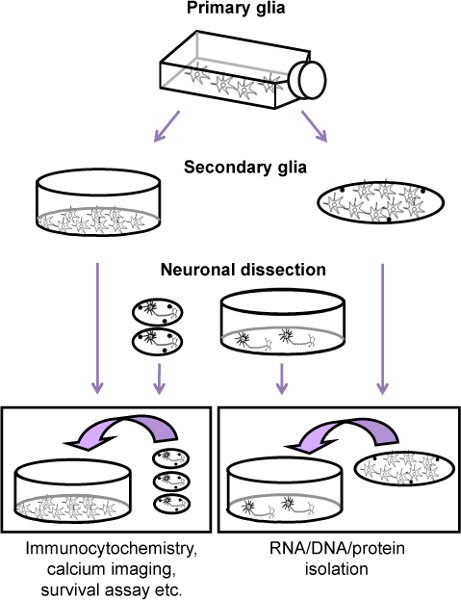
Abbildung 1. Flussdiagramm des Verfahrens zur Kultivierung von Ratten kortikalen Neuronen zusammen mit einer glialen Feeder-Schicht (sekundäre Glia). Zuerst 11 Tage vor dem neuronalen Dissektion, ist eine primäre Glia Kultur von neugeborenen Ratten (P2-4) vorbereitet. Wenn die Zellen konfluent sind (ca. 9 Tage nach dem Ausplattieren der primären Gliazellen und zwei Tage vor der neuronalen Dissektion), sind Astrozyten mechanically von Oligodendrozyten-Vorläuferzellen und Mikrogliazellen und verchromt entweder auf dem Geschirr oder Thermanox (sekundäre Glia) getrennt. Neuronen sind dann aus dem Kortex von E17 Embryonen und vergoldet entweder auf Deckgläsern oder Gerichten (mit Poly-Lysin) erhalten. Vier Stunden nach dem Ausplattieren, ist die neuronale Ebene auf die sekundären Gliazellen aufgenommen.

Abbildung 2 Beispiele für Kulturen in verschiedenen Stadien (zB 5 Stunden, 12 DIV, 21 DIV).. Die Zahlen sind repräsentativ Bilder von kortikalen Neuronen auf Deckgläsern zu unterschiedlichen Zeitpunkten. Nach Neuronen zu befestigen das Substrat Neuronen beginnen lamelliopodia verlängern. Phasenkontrast-Bild zeigt ein paar längere Neuriten 5 Stunden nach dem Ausplattieren (A). Das Bild in der Mitte (B, von Cook et al. 2010, mit freundlicher Genehmigung) zeigt 12 DIV kortikalen Neuronen fixiert und immunhistochemisch mit dem neuronalen dendritischen Marker MAP2. Hoechst-Färbung wurde als counterstai verwendetNing. Als Neuronen reifen dendritischen Dornen auch sichtbar werden (C). Maßstab: A, B = 25 um, C = 10 pm.
Diskussion
Dieses Protokoll sieht ein Verfahren zur Kultivierung Ratte primären kortikalen Neuronen in Gegenwart von Gliazellen, während gleichzeitig die Neuronen auf einfache Weise für die experimentelle Analyse isoliert werden. Die Glia-Unterstützung Entwicklung eines gesunden neuronalen Phänotyp, während auch modulierende neuronale Reaktionen auf experimentelle Behandlungen in einem physiologisch relevanten Art und Weise. Zusätzlich kann durch die Passage der primären Gliazellen vor Kultivierung mit Neuronen dieser Zellpopulation wird selektiv in Astrozyten angereicherte und verhindert dadurch entzündliche Mikroglia-Stimulation. Für bestimmte Arten von Experimenten können jedoch unterschiedliche Anteile von Gliazellen gewünscht wird, werden damit zusätzliche Glia Kulturen durchgeführt werden kann, diese zelluläre Zusammensetzung zu optimieren. Dieses Protokoll kann auch für die Kultivierung Neuronen aus anderen Hirnregionen ableiten, wie der Hippocampus, angepasst werden, um insbesondere experimentellen Anforderungen fit
Hauptanliegen dieser Technik die Verhinderung bakterieller contAminierung und die Verhinderung Gliawucherung in der neuronalen Ebene. Dieses System beinhaltet keine Antibiotika, damit sterile Techniken besonders kritisch in allen Phasen sind. Gliawucherung wird durch die Zugabe des anti-mitotische Agent Cytosin arabinofuranosid, die niedrige Dichte Beschichtung und der Serum-freien Kulturmedium verhinderte, nach diesem Protokoll Astrozyten sollte nicht mehr als 3-5% der Zellen in den neuronalen Schicht 1,4 komponieren und weniger als 1% Mikroglia sollte erkannt werden. Immunopanning oder andere Techniken können verwendet werden, um auch diese geringe Glia Kontamination 4 zu entfernen sein.
Diese Technik kann auch für Co-Kultivierung einer Vielzahl von adhärenten Zelltypen verändert werden bei der Isolierung eines einzigen Typs für die Analyse ist wünschenswert. Zum Beispiel wurde das System erfolgreich für die Analyse der Auswirkungen von Osteoblasten auf Ca 2 + angepasst Signalisierung in Knochen-Metastasen Krebszellen 14.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren danken früheren Labor Mitglieder, die Verfeinerung des Protokolls und der NIH für die Unterstützung im Laufe der Jahre (DA19808 und DA15014 zu OM) beigetragen. Anna Abt 1 ist ein Fellow des "Interdisciplinary und Translational Research Training in NeuroAIDS" (T32-MH078795); damit dieser Arbeit wurde zum Teil durch die National Institutes of Health unter Ruth L. Kirschstein National Research Service Award 5T32MH079785 unterstützt.
Referenzen
- Cook, A. Interactions between chemokines: regulation of fractalkine/CX3CL1 homeostasis by SDF/CXCL12 in cortical neurons. J. Biol. Chem. 285, 10563-10563 (2010).
- Nicolai, J., Burbassi, S., Rubin, J., Meucci, O. CXCL12 inhibits expression of the NMDA receptor's NR2B subunit through a histone deacetylase-dependent pathway contributing to neuronal survival. Cell. Death. Dis. 1, e33-e33 (2010).
- Sengupta, R. Morphine increases brain levels of ferritin heavy chain leading to inhibition of CXCR4-mediated survival signaling in neurons. J. Neurosci. 29, 2534-2544 (2009).
- Meucci, O. Chemokines regulate hippocampal neuronal signaling and gp120 neurotoxicity. Proc. Natl. Acad. Sci. U. S. A. 95, 14500-14500 (1998).
- Khan, M. Z. Regulation of neuronal P53 activity by CXCR 4. Mol. Cell. Neurosci. 30, 58-66 (2005).
- Patel, J. P. Modulation of neuronal CXCR4 by the micro-opioid agonist DAMGO. J. Neurovirol. 12, 492-500 (2006).
- Shimizu, S. Role of the transcription factor E2F1 in CXCR4-mediated neurotoxicity and HIV neuropathology. Neurobiol. Dis. 25, 17-26 (2007).
- Khan, M. Z. The chemokine receptor CXCR4 regulates cell-cycle proteins in neurons. J. Neurovirol. 9, 300-314 (2003).
- Khan, M. Z. The chemokine CXCL12 promotes survival of postmitotic neurons by regulating Rb protein. Cell. Death. Differ. 15, 1663-1672 (2008).
- Khan, M. Z., Vaidya, A., Meucci, O. CXCL12-mediated regulation of ANP32A/Lanp, a component of the inhibitor of histone acetyl transferase (INHAT) complex, in cortical neurons. J. Neuroimmune. Pharmacol. 6, 163-170 (2011).
- Dotti, C. G., Sullivan, C. A., Banker, G. A. The establishment of polarity by hippocampal neurons in culture. J. Neurosci. 8, 1454-1468 (1988).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat. Protoc. 1, 2406-2415 (2006).
- Goslin, K., Banker, G., Goslin, K., Banker, G. . Culturing Nerve Cells. , 339-370 (1998).
- D'Ambrosio, J., Fatatis, A. Osteoblasts modulate Ca2+ signaling in bone-metastatic prostate and breast cancer cells. Clin. Exp. Metastasis. 26, 955-964 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten