Method Article
Didermique co-culture de neurones de rat corticale primaire et des cellules gliales
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici nous fournissons un protocole de neurones de rat en culture corticaux, en présence d'une couche nourricière gliales. Les neurones cultivés en place de polarité et de créer des synapses, et peut être séparée de la glie pour une utilisation dans diverses applications, telles que l'électrophysiologie, imagerie calcique, tests de survie cellulaire, immunocytochimie, et de l'ARN / ADN / isolement des protéines.
Résumé
Cette vidéo va vous guider dans le processus de neurones de rat en culture corticaux, en présence d'une couche nourricière gliales, un système connu comme un bilaminaire ou co-culture de modèle. Ce système est approprié pour une variété de besoins expérimentaux nécessitant soit un verre ou de plastique et substrat de croissance peut également être utilisé pour la culture des autres types de neurones.
Neurones corticaux de rat obtenu à partir de la phase tardive embryonnaires (E17) sont étalées sur des lamelles de verre ou de boîtes de culture tissulaire face à une couche nourricière de cellules gliales cultivées sur des lamelles en plastique ou des plats (connu sous le nom Thermanox), respectivement. Le choix entre les deux configurations dépend de la technique expérimentale utilisée spécifiques, qui peuvent exiger, ou non, que les neurones sont cultivés sur le verre (par exemple l'imagerie calcique par rapport Western blot). La couche nourricière gliales, les astrocytes une culture enrichie de cellules gliales secondaires mixtes, est préparé séparément à partir du cortex des ratons nouveau-nés (P2-4) avant le neuronaledissection.
Un avantage majeur de ce système de culture par rapport à une culture de neurones est seulement le soutien de la croissance neuronale, la survie et la différenciation fournies par des facteurs trophiques sécrétés de la couche nourricière gliales, qui ressemble plus précisément l'environnement du cerveau in vivo. Par ailleurs, la co-culture peut être utilisée pour étudier les interactions neuronales-gliales 1.
Dans le même temps, la contamination glie dans la couche de neurones est empêchée par des moyens différents (culture à faible densité, l'ajout d'inhibiteurs mitotiques, le manque de sérum et de l'utilisation de milieu de culture optimisé) conduisant à une couche pratiquement pure neuronale, comparable à d'autres méthodes établies 1 -3. Les neurones peuvent être facilement séparées de la couche gliales à tout moment pendant la culture et utilisés pour différentes applications allant de l'électrophysiologie expérimentale 4, biologie cellulaire et moléculaire 5-8, 5 biochimie, l'imagerie et le microroscopy 4,6,7,9,10. Les neurones primaires s'étendent axones et dendrites de former des synapses fonctionnelles 11, un processus qui n'est pas observée dans les lignées cellulaires neuronales, même si certaines lignées cellulaires ne s'étendent processus.
Un protocole détaillé de neurones de rat en culture hippocampe en utilisant ce système de co-culture a été décrit précédemment 4,12,13. Ici, nous détaillons un protocole modifié adapté pour les neurones corticaux. Comme environ 20x10 6 cellules sont récupérées à partir de chaque embryon de rat, cette méthode est particulièrement utile pour des expériences nécessitant un grand nombre de neurones (mais pas préoccupé par une population très homogène neuronale). La préparation des neurones et cellules gliales doit être planifiée dans des délais spécifiques. Nous allons fournir le protocole étape par étape pour la culture de neurones de rat corticale ainsi que la culture de cellules gliales pour soutenir les neurones.
Protocole
1. Dissection GLIA (~ 2 semaines avant neurones placage)
- Pour se préparer à la place des outils de dissection stériles dans 70% d'éthanol, ajouter 4 ml de dissection moyennes froide pour boîtes de 60 mm (un seul plat par cerveau), et au lieu de 2,5% de trypsine et de DNase sur la glace à dégeler (voir détails sur les outils chirurgicaux dans le tableau VI ).
- Utilisez des ciseaux grande pour décapiter 2-4 jours chiots anciens et les chefs placer dans un plat de 100 mm stérile.
- Utilisez des ciseaux à moyen et à faire une coupe médiane à travers la peau et tirez la peau pour exposer le crâne. Utilisez des ciseaux courbes pour faire une coupe médiane et deux coupes latérales à travers le crâne, sans endommager le dessous du tissu cérébral. Retirez le crâne supérieure à exposer le cerveau.
- Extrait du cerveau et de le placer dans sa propre parabole de 60 mm contenant 4 ml de dissection froide moyenne (voir tableau I pour la composition). Placer le plat sous un stéréomicroscope (Leica ZOOM 2000, le zoom de contrôle: 7-30) et l'utilisation des pinces No.5 de séparer les hémisphères, retirez le mésencéphale, et le zeste d'off les méninges.
- Collecter toutes les cortex cérébraux disséqués dans une nouvelle parabole de 60 mm avec support de dissection froide, et émincer le tissu avec des ciseaux courbes.
- Transférer les tissus hachés à un tube de 15 ml stérile. Porter le volume à 4,5 ml avec le milieu de dissection froide et ajouter 500 ul de trypsine 2,5%. Envelopper le tube dans Parafilm et le faire flotter dans un bain d'eau à 37 ° C pendant 15 minutes, le mélange par inversion toutes les 5 minutes.
(Remarque: ici, nous décrivons le protocole nous suivons généralement lorsque vous utilisez un maximum de 5 cerveaux; si plus chiots sont utilisés, les volumes peuvent avoir besoin d'être ajustées de façon appropriée)
- Transférer le tissu pour une nouvelle tube de 15 ml, en minimisant le volume de milieu de dissection trypsine contenant reportés. Porter le volume à 4.8mL avec un milieu de dissection fraîche et ajouter 200 uL DNase pour atteindre une concentration finale de 60 ug / ml (solution stock: 3 mg de DNase et de 5 mg MgSO4 dans 2 mL de milieu de dissection). Triturer doucement à environ 20 fois avec une pipette stérile 5 mlte, puis ajouter 10 ml de milieu d'étalement glie (voir tableau II pour la composition).
- Autoriser les gros morceaux de tissus de se contenter de 4-5 minutes, puis transférer les 80% supérieurs de la suspension cellulaire dans un tube de 50ml. Répétez la trituration des tissus avec un supplément de 2-3 ml de milieu d'étalement glie (et en utilisant une petite pipette si nécessaire), de nouveau, permettent de régler le tissu, et ajouter le sommet de 80% à la collection précédente. Porter le volume total à 20 ml avec le milieu plaquage glie et centrifuger pendant 15 minutes à 280 g (ou 1300 rpm dans une centrifugeuse IEC Centra CL2).
- Aspirer le surnageant et remettre en suspension les cellules gliales dans le milieu de plaquage granulés (environ 5-7 ml à l'aide en fonction du nombre de chiots utilisé), puis ajoutez milieu d'étalement supplémentaires afin d'avoir 10 mL pour chaque cerveau disséqué. Mélangez bien et plaque de 10 ml de suspension cellulaire dans chaque flacon de 75 cm2 (c'est à dire un cerveau par flacon).
- Déplacer flacons de culture à un incubateur réglé à 37 ° C (5 à 10% de CO2; proportionnelle à la bicarbona de sodiumTE contenu du milieu). Changement de culture après 24-48 heures, puis tous les 3-4 jours.
2. Glia secondaire (48 heures avant neurones placage)
- Préparer Thermanox lamelles (si les neurones seront étalées sur des boîtes) en y ajoutant 3 gouttes de cire fondue Paraplast autour de la circonférence de chaque Thermanox lavés et stérilisés en autoclave. Les cellules seront plaqués sur ce côté de l'Thermanox. Notre Thermanox sont faits à la main insère mm réutilisable ~ 60 coupé à partir de plastique (voir tableau VI de réactifs) avec ~ 50 mm 2 trous forés à travers, bien que la culture du commerce et inserts peuvent être utilisés à la place.
- Laver les cellules gliales primaires avec du PBS deux fois, secouer vigoureusement chaque flacon pour enlever toutes les cellules seules. Chaque fiole avec gliales primaires confluentes fournira environ 10 millions d'astrocytes, donc nous utilisons régulièrement 2-4 flacons par expérience.
- Détacher les cellules avec 0,05% trypsine-EDTA (1 mL10X solution à 0,5% des stocks de trypsine-EDTA dilué dans 9 ml de PBS). Combinir les cellules à partir de 2 flacons dans un tube conique 50 ml et ajouter une quantité égale de milieu d'étalement glie (voir tableau II de réactifs). Centrifuger pendant 15 minutes à 280 g. Aspirer le surnageant et dissoudre le culot glie dans quelques ml de milieu plaquage glie.
- Compter les cellules en utilisant un hématocytomètre et diluer la suspension de cellules que nécessaire (~ 1x10 6 cellules / ml); plaque de cellules soit sur 60mm plats (si les neurones seront plaquées sur des lamelles), ou sur des lamelles Thermanox (si les neurones seront plaqués sur les boîtes de 60 mm). Les cellules doivent être plaquées à 500 000 cellules par boîte ou en utilisant Thermanox milieu d'étalement glie. Dans le cas de Thermanox lamelles, plaque 600 ul de cellules dans un goutte à goutte, puis après deux heures de conférence et Thermanox cellules plonger dans un milieu de plaquage glie.
- Si la préparation des boîtes de 60 mm de glie secondaire pour lamelles neuronale, les changements à moyen et à N2.1 le soir avant la dissection neuronale.
3. Dissection neuronaleet de la Culture
- Préparer des lamelles de verre (15 mm de diamètre) en y ajoutant 3 gouttes de cire fondue Paraplast autour de la circonférence de chaque lamelle stérile, afin de séparer physiquement les couches de cellules et éviter gratter cellule. Les cellules seront plaquées de ce côté de la lamelle.
- Plaques ou lamelles Manteau avec 0,5 mg / ml polylysine (soit poly-L-lysine ou la poly-D-lysine dissoute dans du tampon borate; voir tableau VI) pendant 2 heures ou jusqu'au lendemain. Laver à l'eau stérile 2-3 fois et laisser sécher complètement. Remarque: des lamelles sont placées dans un plat de Pétri hydrophobe pour éviter de renverser / épandage des solutions lors de revêtement avec revêtement poly-lysine ou de cellules, qui peuvent facilement se produire si les lamelles sont placées dans des boîtes de culture tissulaire.
- Préparez-vous à la dissection des neurones que pour la dissection glie (étape 1.1). Euthanasier un rat de 17 jours enceinte, de pulvérisation de la fourrure à l'éthanol 70%, et couper médial par la peau pour exposer l'utérus. Retirez tous les fœtus et les placer dans unstériles 100 mm plat.
- Rapidement disséquer libre et décapitent chaque fœtus, en plaçant chaque tête dans ses propres parabole de 60 mm avec support de dissection froide (4 ml). Normalement, nous disséquer des fœtus 4-5 par expérience que d'environ 20 millions de neurones sont issus de chaque fœtus E17. Si plusieurs embryons sont nécessaires, assurez-vous que toute la procédure (de l'étape 03/04 au 03/12) ne dure pas plus de 90-100 minutes.
- L'utilisation d'un stéréomicroscope et No.1/No.5 pince isoler le cortex cérébral en tirant ouvrir la peau et le crâne, l'extraction du cerveau, qui sépare les deux hémisphères, et la suppression du mésencéphale et des méninges.
- Collecter toutes les cortex disséqués dans une nouvelle parabole de 60 mm avec support de dissection froide, et émincer le tissu avec des ciseaux courbes en morceaux ~ 1 mm.
- Transférer les tissus hachés à un tube de 15 ml stérile. Porter le volume à 4,5 ml avec le milieu de dissection froide et ajouter 500 ul de trypsine 2,5%. Envelopper le tube dans Parafilm et le faire flotter dans un bain d'eau à 36 ° C pendant 15 minuTES, mélanger par inversion toutes les 5 minutes.
- Transférer le tissu pour une nouvelle tube de 15 ml, en minimisant le volume de milieu de dissection trypsine contenant reportés. Porter à 4,8 ml avec le milieu de dissection fraîche et ajouter 200 uL DNase pour atteindre une concentration finale de 60 ug / ml. Triturer environ 10 fois avec une solution stérile de 5 ou 2 pipettes ml; répétez cette étape nécessaire à l'aide d'un feu-poli (froid) pipette Pasteur à dissocier la plupart des tissus. Puis laissez morceaux restants de tissu (généralement très peu, voire aucun) à régler pendant 4-5 minutes.
- Retirez la partie supérieure seule cellule de suspension tout en laissant derrière morceaux de tissu réglé, et le lieu de cette solution dans un nouveau tube avec un volume égal de milieu plaquage neurone (voir tableau III). Mélangez bien, mais doucement, puis compter les cellules; plaque sur 15 mm lamelles (35 000 cellules dans chacune des 200 uL) ou boîtes de 60 mm (1x10 6 cellules dans chacune des 3 ml) en tant que de besoin. Transfert aux cellules de l'incubateur (36,5 ° C, CO2 5-10%).
- Après 3-4 heures Combine de la couche de neurones et la glie secondaires comme suit. Pour les neurones sur les boîtes de 60 mm, se laver les cellules avec du DMEM chaude, le changement à moyen et à 4 ml de milieu sans sérum (N2, voir tableau IV), et ajouter une Thermanox avec glie à chaque plaque (cellules gliales doit être orientée vers les neurones). Pour des lamelles de neurones, le transfert de 3 à 5 lamelles à chaque plat de 60 mm de glie secondaire, avec les neurones vers le bas.
- 24 heures après plaquage des neurones, ajouter 10 uM de la cytosine-β-D-arabinofuranoside à chaque plat, afin de prévenir la prolifération glie. Nous préparons quatre solutions mères mM, diluer 1:10 avec support N2, et ajouter 25 Ul / ml de solution diluée à chaque plat.
- Les cellules sont généralement utilisés pour des expériences après 7-10 jours de culture, bien que le temps exact dépend du stade de différenciation voulue, ils ont été cultivés pendant 4 semaines sans une baisse significative de la survie. Après la première semaine, il est recommandé que la moitié du volume des médias sera remplacé chaque semaine.
4. Les résultats représentatifs:
Quelques heures après les neurones ont attaché au substrat, ils commencent à étendre lamelliopodia. Processus de continuer à s'allonger (figure 2A) et polariser sur plusieurs jours dans la culture, et des axones et des dendrites étendu sont clairement visibles (figure 2B; MAP2 coloration). Comme les neurones matures du tonnelles dendritiques deviennent plus élaborées et qu'ils développent des contacts synaptiques; environ 2-3 semaines après le placage de nombreuses épines dendritiques sont visibles (figure 2C) 11.
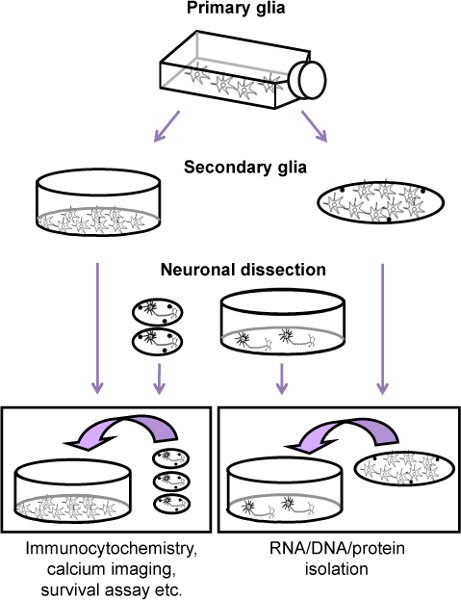
Figure 1. Organigramme de la procédure de neurones de rat en culture corticaux avec une couche nourricière gliales (cellules gliales secondaire). Tout d'abord, 11 jours avant la dissection des neurones, cellules gliales une culture primaire est préparé à partir de rats nouveau-nés (P2-4). Lorsque les cellules sont confluentes (environ neuf jours après l'étalement de la glie primaire et deux jours avant la dissection neuronale), les astrocytes sont mécaanically séparé de cellules précurseurs des oligodendrocytes et microglie et plaqués, soit sur des plats ou Thermanox (glie secondaire). Les neurones sont alors obtenus à partir du cortex de E17 embryons et plaqué soit sur des lamelles ou des plats (recouvertes de poly-lysine). Quatre heures après l'étalement, la couche de neurones est ajouté à la glie secondaire.

Figure 2 Exemples de cultures à des stades différents (par exemple 5 heures, 12 DIV; 21 DIV).. Les chiffres sont des images représentatives de neurones corticaux sur des lamelles à différents moments. Après neurones joindre au substrat neurones commencent à étendre lamelliopodia. Image au contraste de phase montre une neurites quelques prolongée à cinq heures après l'étalement (A). L'image dans le milieu (B, à partir de Cook et al. 2010, avec permission) montre 12 neurones corticaux DIV fixe et immunocolorées avec le marqueur neuronal MAP2 dendritiques. Coloration de Hoechst a été utilisé comme un counterstaiNing. Comme les neurones matures épines dendritiques aussi devenir visibles (C). Barres d'échelle: A, B = 25 um; C = 10 um.
Discussion
Ce protocole prévoit un procédé de culture primaires de rat neurones corticaux, en présence de cellules gliales, tout en permettant aux neurones pour être facilement isolé pour analyse expérimentale. L'appui au développement d'un phénotype glie santé neuronale, tout en modulant les réponses neuronales à des traitements expérimentaux de manière physiologiquement pertinents. De plus, par passage de la glie primaire avant la culture avec les neurones de cette population cellulaire devient sélective enrichie dans les astrocytes, empêchant ainsi la stimulation inflammatoires microgliales. Pour certains types d'expériences, cependant, des proportions différentes de cellules gliales peuvent être désirée, donc des cultures gliales supplémentaires peuvent être effectués pour optimiser cette composition cellulaire. Ce protocole peut également être adapté pour les neurones en culture issus de d'autres régions cérébrales, telles que l'hippocampe, pour s'adapter notamment les demandes d'expérimentation
Les principales préoccupations de cette technique comprennent la prévention cont bactérienneamination et prévenir la prolifération gliale dans la couche de neurones. Ce système ne tient pas compte des agents antibiotiques, donc des techniques stériles sont particulièrement critiques à toutes les étapes. Prolifération gliale est empêché par l'ajout de l'agent anti-mitotique cytosine arabinofuranoside, le placage de faible densité et le milieu de culture sans sérum; suivant ce protocole doit composer astrocytes pas plus de 3-5% des cellules dans la couche de 1,4 neuronale et moins de 1% microglie devrait être détectée. Immunopanning ou d'autres techniques peuvent être utilisés pour éliminer cette contamination, même faible glie 4.
Cette technique peut également être modifié pour la co-culture toute variété de types de cellules adhérentes en isoler un seul type d'analyse est souhaitable. Par exemple, ce système a été adapté avec succès pour analyser les effets des ostéoblastes sur le Ca 2 + signalisation dans les cellules du cancer des os métastatique 14.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Les auteurs remercient les membres de laboratoire antérieurs qui ont contribué au raffinement de ce protocole et le NIH pour le soutien au fil des ans (et DA19808 DA15014 à l'OM). Anna Abt 1 est un membre de la "formation à la recherche interdisciplinaire et translationnelle NeuroSIDA" (T32-MH078795); donc, ce travail a été soutenu en partie par les Instituts nationaux de santé en vertu de Ruth L. Kirschstein National Research Service Award 5T32MH079785.
Références
- Cook, A. Interactions between chemokines: regulation of fractalkine/CX3CL1 homeostasis by SDF/CXCL12 in cortical neurons. J. Biol. Chem. 285, 10563-10563 (2010).
- Nicolai, J., Burbassi, S., Rubin, J., Meucci, O. CXCL12 inhibits expression of the NMDA receptor's NR2B subunit through a histone deacetylase-dependent pathway contributing to neuronal survival. Cell. Death. Dis. 1, e33-e33 (2010).
- Sengupta, R. Morphine increases brain levels of ferritin heavy chain leading to inhibition of CXCR4-mediated survival signaling in neurons. J. Neurosci. 29, 2534-2544 (2009).
- Meucci, O. Chemokines regulate hippocampal neuronal signaling and gp120 neurotoxicity. Proc. Natl. Acad. Sci. U. S. A. 95, 14500-14500 (1998).
- Khan, M. Z. Regulation of neuronal P53 activity by CXCR 4. Mol. Cell. Neurosci. 30, 58-66 (2005).
- Patel, J. P. Modulation of neuronal CXCR4 by the micro-opioid agonist DAMGO. J. Neurovirol. 12, 492-500 (2006).
- Shimizu, S. Role of the transcription factor E2F1 in CXCR4-mediated neurotoxicity and HIV neuropathology. Neurobiol. Dis. 25, 17-26 (2007).
- Khan, M. Z. The chemokine receptor CXCR4 regulates cell-cycle proteins in neurons. J. Neurovirol. 9, 300-314 (2003).
- Khan, M. Z. The chemokine CXCL12 promotes survival of postmitotic neurons by regulating Rb protein. Cell. Death. Differ. 15, 1663-1672 (2008).
- Khan, M. Z., Vaidya, A., Meucci, O. CXCL12-mediated regulation of ANP32A/Lanp, a component of the inhibitor of histone acetyl transferase (INHAT) complex, in cortical neurons. J. Neuroimmune. Pharmacol. 6, 163-170 (2011).
- Dotti, C. G., Sullivan, C. A., Banker, G. A. The establishment of polarity by hippocampal neurons in culture. J. Neurosci. 8, 1454-1468 (1988).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat. Protoc. 1, 2406-2415 (2006).
- Goslin, K., Banker, G., Goslin, K., Banker, G. . Culturing Nerve Cells. , 339-370 (1998).
- D'Ambrosio, J., Fatatis, A. Osteoblasts modulate Ca2+ signaling in bone-metastatic prostate and breast cancer cells. Clin. Exp. Metastasis. 26, 955-964 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon