Method Article
ثنائي الصفائح المشارك ثقافة الجرذ الخلايا العصبية الابتدائية القشرية والدبقية
* These authors contributed equally
In This Article
Summary
هنا نقدم مشروع بروتوكول لزراعة الخلايا العصبية الفئران القشرية في وجود طبقة المغذية الدبقية. الخلايا العصبية مثقف إقامة قطبية وخلق نقاط الاشتباك العصبي ، ويمكن فصلها عن الدبقية لاستخدامها في مختلف التطبيقات ، مثل الكهربية ، والتصوير الكالسيوم والمقايسات بقاء الخلية ، وكيمياء سيتولوجية مناعية ، وRNA / DNA / عزل بروتين.
Abstract
This video will guide you through the process of culturing rat cortical neurons in the presence of a glial feeder layer, a system known as a bilaminar or co-culture model. This system is suitable for a variety of experimental needs requiring either a glass or plastic growth substrate and can also be used for culture of other types of neurons.
Rat cortical neurons obtained from the late embryonic stage (E17) are plated on glass coverslips or tissue culture dishes facing a feeder layer of glia grown on dishes or plastic coverslips (known as Thermanox), respectively. The choice between the two configurations depends on the specific experimental technique used, which may require, or not, that neurons are grown on glass (e.g. calcium imaging versus Western blot). The glial feeder layer, an astroglia-enriched secondary culture of mixed glia, is separately prepared from the cortices of newborn rat pups (P2-4) prior to the neuronal dissection.
A major advantage of this culture system as compared to a culture of neurons only is the support of neuronal growth, survival, and differentiation provided by trophic factors secreted from the glial feeder layer, which more accurately resembles the brain environment in vivo. Furthermore, the co-culture can be used to study neuronal-glial interactions1.
At the same time, glia contamination in the neuronal layer is prevented by different means (low density culture, addition of mitotic inhibitors, lack of serum and use of optimized culture medium) leading to a virtually pure neuronal layer, comparable to other established methods1-3. Neurons can be easily separated from the glial layer at any time during culture and used for different experimental applications ranging from electrophysiology4, cellular and molecular biology5-8, biochemistry5, imaging and microscopy4,6,7,9,10. The primary neurons extend axons and dendrites to form functional synapses11, a process which is not observed in neuronal cell lines, although some cell lines do extend processes.
A detailed protocol of culturing rat hippocampal neurons using this co-culture system has been described previously4,12,13. Here we detail a modified protocol suited for cortical neurons. As approximately 20x106 cells are recovered from each rat embryo, this method is particularly useful for experiments requiring large numbers of neurons (but not concerned about a highly homogenous neuronal population). The preparation of neurons and glia needs to be planned in a time-specific manner. We will provide the step-by-step protocol for culturing rat cortical neurons as well as culturing glial cells to support the neurons.
Protocol
1. تشريح الدبقية (~ 2 أسابيع قبل طلاء الخلايا العصبية)
- للتحضير للأدوات معقمة في مكان تشريح الايثانول 70 ٪ ، إضافة 4 مل المتوسطة تشريح الأطباق الباردة ل60 ملم (طبق واحد في الدماغ) ، والمكان 2.5 ٪ والتربسين الدناز على الجليد إلى الذوبان (انظر تفاصيل حول الأدوات الجراحية في الجدول السادس ).
- استخدام مقص لقطع رأس كبير 2-4 الجراء عمر يوم ورؤساء مكان في صحن معقمة 100 ملم.
- استخدام مقص المتوسطة لاجراء خفض خط الوسط من خلال الجلد وسحب الجلد لفضح الجمجمة. استخدام مقص منحنية لاجراء خفض خط الوسط واثنين من التخفيضات الوحشي من خلال الجمجمة ، دون الإضرار تحت أنسجة المخ. إزالة الجمجمة العليا لفضح الدماغ.
- استخراج الدماغ ووضعه في طبق خاص بها 60 ملم تحتوي على 4 مل المتوسطة تشريح الباردة (انظر الجدول الأول للتكوين). وضع صحن تحت stereomicroscope (لايكا ZOOM 2000 ، والتكبير التحكم : 70-30) واستخدام ملقط No.5 للفصل بين نصفي الكرة الأرضية ، وإزالة المخ الأوسط ، وقشر سوما يليها السحايا.
- جمع كل القشور تشريح الدماغ في طبق الطازجة 60 ملم مع تشريح المتوسطة الباردة ، واللحم المفروم مع النسيج المقص منحنية.
- نقل الأنسجة المفروم إلى الأنبوب عقيمة 15 مليلتر. تحقيق وحدة التخزين إلى 4.5 مل مع تشريح المتوسطة الباردة وإضافة 500 ميكرولتر من التربسين 2.5 ٪. التفاف أنبوب في Parafilm وتطفو في حوض الماء ° 37 مئوية لمدة 15 دقيقة ، عن طريق خلط انعكاس كل 5 دقائق.
(ملاحظة : نحن هنا تصف البروتوكول نتبع عادة عند استخدام ما يصل الى 5 العقول ، وإذا كان يتم استخدام مزيد من الجراء ، وحدات التخزين قد تحتاج إلى تعديل مناسب)
- نقل الأنسجة لأنبوب جديد 15 مل ، والتقليل من حجم متوسط تشريح التربسين المحتوية على ترحيلها. تحقيق وحدة التخزين ل4.8mL المتوسطة مع تشريح جديدة وإضافة 200 الدناز ميكرولتر من أجل التوصل إلى تركيز النهائي من 60 ميكروغرام / مل (محلول المخزون : 3 ملغ من الدناز و 5 ملغ في 2 مل MgSO4 المتوسطة تشريح). متمزج بلطف ~ 20 مرات مع 5 مل العقيمة الماصةالشركة المصرية للاتصالات ، ثم إضافة 10 مل من المتوسط الطلاء الدبقية (انظر الجدول الثاني للتكوين).
- السماح للقطع الكبيرة من الأنسجة لتسوية لمدة 4-5 ، ثم نقل أعلى من 80 ٪ من الخلية لتعليق أنبوب 50mL. كرر سحن الأنسجة مع مل 2-3 إضافية من الطلاء الدبقية المتوسطة (أصغر واستخدام ماصة إذا لزم الأمر) ، ومرة أخرى ، والسماح لتسوية الأنسجة ، وإضافة إلى أعلى من 80 ٪ من المجموعة السابقة. جعل إجمالي حجم إلى 20 مل مع الطلاء الدبقية المتوسطة والطرد المركزي لمدة 15 دقيقة عند 280 غرام (أو 1300 دورة في الدقيقة في جهاز طرد مركزي IEC CL2 سنترا).
- نضح في وطاف resuspend الكرية خلية في المتوسط الطلاء الدبقية (باستخدام 5-7 مل تقريبا اعتمادا على عدد من الجراء المستخدمة) ؛ ثم إضافة المتوسطة تصفيح إضافية من أجل الحصول على 10 مل لكل تشريح الدماغ. مزيج جيد وطبق 10 مل من تعليق كل خلية في دورق 75 سم 2 (أي واحد في الدماغ القارورة).
- نقل قوارير الثقافة لمجموعة حاضنة عند 37 درجة مئوية (من 5 إلى 10 ٪ CO2 ؛ يتناسب مع bicarbona الصوديومالشركة المصرية للاتصالات مضمون متوسطة). تغيير الثقافة المتوسطة بعد 24-48 ساعة ، ثم كل 3-4 أيام.
2. الثانوية الدبقية (قبل 48 ساعة من الخلايا العصبية الطلاء)
- إعداد thermanox coverslips (إذا كان سيتم مطلي الخلايا العصبية على الأطباق) وذلك بإضافة 3 قطرات صغيرة من شمع ذاب paraplast حول محيط كل غسلها وتعقيمها thermanox. وسيتم مطلي الخلايا على هذا الجانب من thermanox. thermanox لدينا هي قابلة لإعادة الاستخدام اليدوية إدراج ~ 60 ملم قطع من البلاستيك (انظر الجدول السادس من الكواشف) مع فتحات 50 مم 2 ~ من خلال حفر ، على الرغم من الثقافة المتاحة تجاريا جيدا ويمكن استخدام إدراج بدلا من ذلك.
- غسل الدبقية الأولية مع مرتين في برنامج تلفزيوني ، تهز بقوة كل قارورة لإزالة أي خلايا غير مرتبط. سيكون على كل قارورة مع الدبقية الأولية متموجة توفير نحو 10 ملايين دبق نجمي الخلايا ، وبالتالي فإننا بانتظام استخدام قوارير 2-4 في التجربة.
- فصل الخلايا مع 0.05 ٪ tryspin - EDTA (1 mL10X 0.5 ٪ محلول المخزون التربسين - EDTA المخفف في 9 مل من PBS). نقل الركاب والحمولاتشمال شرق الخلايا في الفترة من 2 الى واحد قوارير أنبوب 50 مل المخروطية وإضافة مبلغ مساو من الطلاء المتوسطة الدبقية (انظر الجدول الثاني من الكواشف). الطرد المركزي لمدة 15 دقيقة في 280 غرام. نضح في وطاف حل بيليه الدبقية في مل قليلة من الطلاء الدبقية المتوسطة.
- عد الخلايا باستخدام عدادة الكريات وتمييع تعليق الخلية حسب الحاجة (~ 1x10 6 خلية / مل) ؛ لوحة الخلايا إما على 60mm الأطباق (إذا كان سيتم مطلي الخلايا العصبية على coverslips) ، أو على coverslips thermanox (إذا كان سيتم مطلي على الخلايا العصبية أطباق 60 ملم). وينبغي مطلي الخلايا في الخلايا لكل 500،000 صحن أو باستخدام thermanox الدبقية المتوسطة الطلاء. في حالة coverslips thermanox ، لوحة 600 ميكروليتر من الخلايا بطريقة قطرة قطرة ، ثم بعد 2 ساعة thermanox الوجه ويغرق في الخلايا الدبقية المتوسطة الطلاء.
- إذا كان إعداد أطباق 60 ملم الدبقية الثانوية للcoverslips العصبية ، وتغير المتوسط إلى N2.1 المساء قبل تشريح العصبية.
3. تشريح العصبيةوالثقافة
- إعداد coverslips الزجاج (15 مم) وذلك بإضافة 3 قطرات صغيرة من شمع ذاب paraplast حول محيط كل ساترة معقمة ، وذلك لفصل طبقات الخلية ومنع تجريف الخلية. وسيتم مطلي الخلايا على هذا الجانب من ساترة.
- لوحات معطف أو coverslips مع متعدد الليزين ملغ / مل 0.5 (إما بولي - L - يسين أو بولي - D - يسين الذائبة في المخزن بورات ، انظر الجدول السادس) لمدة 2 ساعة أو بين عشية وضحاها. تغسل بماء معقم 2-3 مرات ، والسماح لتجف تماما. ملاحظة : توضع في صحن coverslips بتري مسعور لتفادي إراقة / نشر الحلول خلال طلاء مع طلاء بولي يسين أو الخلية ، والتي يمكن أن تحدث بسهولة إذا توضع في أطباق coverslips زراعة الأنسجة.
- تحضير للتشريح العصبية بالنسبة للتشريح الدبقية (الخطوة 1.1). الموت ببطء فأر 17 يوما حاملا ، رش الفراء مع الايثانول 70 ٪ ، وخفض إعلامي من خلال الجلد للكشف عن الرحم. إزالة جميع الأجنة ووضعها فيمعقمة طبق بقطر 100 ملم.
- تشريح بسرعة حرة وقطع رأس كل جنين ، ووضع الرأس في كل منها 60 ملم مع طبق متوسط تشريح الباردة (4 مل). نحن عادة تشريح الأجنة 4-5 في التجربة كما هي مشتقة حوالي 20 مليون خلية عصبية من كل جنين E17. إذا كان هناك حاجة لمزيد من الأجنة ، تأكد من أن الإجراء بأكمله (من الخطوة 3،4-3،12) لا تستمر لأكثر من 9-10 دقائق.
- باستخدام ملقط No.1/No.5 stereomicroscope وعزل قشرات الدماغي عن طريق سحب فتح الجلد والجمجمة ، واستخراج الدماغ ، التي تفصل بين نصفي الكرة الأرضية ، وإزالة المخ الأوسط والسحايا.
- جمع كل القشور تشريح في طبق الطازجة 60 ملم مع تشريح المتوسطة الباردة ، واللحم المفروم والأنسجة مع مقص منحني إربا ~ 1 مم.
- نقل الأنسجة المفروم إلى الأنبوب عقيمة 15 مليلتر. تحقيق وحدة التخزين إلى 4.5 مل مع تشريح المتوسطة الباردة وإضافة 500 ميكرولتر من التربسين 2.5 ٪. التفاف أنبوب في Parafilm وتطفو في حوض الماء ° 36 مئوية لمدة 15 من minuالاحصائيين ، والخلط من جانب انعكاس كل 5 دقائق.
- نقل الأنسجة لأنبوب جديد 15 مل ، والتقليل من حجم متوسط تشريح التربسين المحتوية على ترحيلها. جلب إلى 4.8 مل مع المتوسطة تشريح جديدة وإضافة 200 الدناز ميكرولتر من أجل التوصل إلى تركيز النهائي من 60 ميكروغرام / مل. متمزج ما يقرب من 10 مرات مع ماصة معقمة 5 مل أو 2 ، كرر هذه الخطوة حسب الضرورة لاطلاق النار باستخدام ملمع (الباردة) ماصة باستير أن تنأى معظم الأنسجة. ثم السماح القطع المتبقية من الأنسجة (عموما قليلة جدا ، إن وجدت) لتسوية ل 4-5 دقائق.
- إزالة العلوي وحيدة الخلية تعليق مخلفا وراءه قطعة من النسيج استقر ، ووضع هذا الحل في أنبوب جديد مع حجم مساو من طلاء الخلايا العصبية المتوسطة (انظر الجدول الثالث). تخلط جيدا ولكن برفق ، ثم عد الخلايا ؛ لوحة في 15 coverslips ملم (35،000 الخلايا في كل 200 ميليلتر) أو 60 ملم الأطباق (1x10 6 خلايا في كل من 3 مل) حسب الحاجة. نقل الخلايا إلى الحاضنة (36.5 درجة مئوية ، 5-10 ٪ CO2).
- بعد 3-4 ساعات COMBIN ه طبقة الخلايا العصبية والدبقية الثانوية على النحو التالي. عن الخلايا العصبية على أطباق من عيار 60 مم ، وغسل الخلايا مع DMEM الحارة ، وتغير على المدى المتوسط و4mL المتوسطة مجانا المصل (N2 ، انظر الجدول الرابع) ، وأضيف thermanox مع كل لوحة لالدبقية (الخلايا الدبقية ينبغي مواجهة الخلايا العصبية). لcoverslips العصبية ، ونقل 3-5 coverslips إلى كل طبق 60 ملم الدبقية الثانوية ، مع الخلايا العصبية لأسفل.
- بعد 24 ساعة من الطلاء على الخلايا العصبية ، إضافة 10 ميكرومتر من السيتوزين - β - D - arabinofuranoside إلى كل طبق ، من أجل منع الانتشار الدبقية. نحن نستعد 4 الحلول الأسهم ملم ، مع تمييع 01:10 المتوسطة N2 ، واضافة 25 UL / مليلتر من المحلول المخفف إلى كل طبق.
- وهي تستخدم عادة لتجارب الخلايا بعد 7-10 أيام في الثقافة ، وعلى الرغم من أن الوقت المحدد يتوقف على مرحلة التمايز المطلوب ، وقد تم تربيتها لمدة تصل إلى 4 أسابيع دون حدوث انخفاض كبير في البقاء على قيد الحياة. بعد الأسبوع الأول ، فمن المستحسن أن يتم استبدال نصف حجم وسائل الاعلام في كل أسبوع.
= "jove_title"> 4. ممثل النتائج :
بعد بضع ساعات من الخلايا العصبية والتي تعلق على الركيزة ، فإنها تبدأ في تمديد lamelliopodia. لا تزال العمليات لإطالة (الشكل 2A) ، واستقطاب أكثر من عدة أيام في الثقافة ، ومحاور عصبية ممتدة والتشعبات مرئية بوضوح (الشكل 2B ؛ MAP2 تلطيخ). باسم الخلايا العصبية الجذعية الناضجة والعرش يصبح أكثر تفصيلا وانهم تطوير الاتصالات متشابك ، حوالي 2-3 أسابيع بعد طلاء العمود الفقري شجيري كثير مرئية (الشكل 2C) 11.
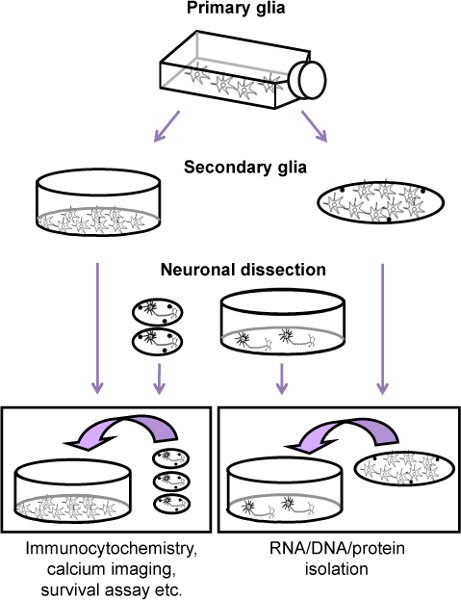
الشكل 1. مخطط تدفق الداخلي لزراعة الخلايا العصبية الفئران القشرية جنبا الى جنب مع الطبقة المغذية الدبقية (الدبقية الثانوية). أولا ، قبل 11 يوما من تشريح العصبية ، مستعدة ثقافة الدبقية الأولية من الفئران حديثي الولادة (P2 - 4). عندما كانت الخلايا متموجة (حوالي تسعة أيام بعد الطلاء والدبقية الابتدائي وقبل يومين من تشريح الخلايا العصبية) ، النجمية والميكانيكيةفصل anically من الخلايا الدبقية الصغيرة والسلائف oligodendrocyte وإما مطلية أو على أطباق thermanox (الدبقية الثانوية). ويتم الحصول على الخلايا العصبية ثم من قشرات E17 من الاجنة ومطلي إما على coverslips أو على أطباق (مغلفة يسين بولي). بعد أربع ساعات من الطلاء ، ويتم إضافة طبقة الخلايا العصبية إلى الدبقية الثانوية.

الشكل 2 أمثلة من الثقافات في مختلف المراحل (مثلا 5 ساعات و 12 DIV ؛ DIV 21). الأرقام هي صور ممثل العصبونات القشرية على coverslips في نقاط زمنية مختلفة. بعد الخلايا العصبية نعلق على الخلايا العصبية الركيزة البدء في توسيع نطاق lamelliopodia. المرحلة صورة النقيض يظهر neurites القليلة الموسعة بعد خمس ساعات من الطلاء (A). الصورة في الوسط (B ، وآخرون من كوك. عام 2010 ، مع إذن) يبين العصبونات DIV 12 القشرية الثابتة وimmunostained مع علامة العصبية شجيري MAP2. وقد استخدم هويشت تلطيخ باعتبارها counterstaiنينغ. باسم الخلايا العصبية الناضجة العمود الفقري شجيري أيضا أن تصبح مرئية (C). أشرطة النطاق : A ، B = 25 ميكرومتر ؛ C = 10 ميكرون.
Discussion
يوفر هذا البروتوكول طريقة لزراعة الخلايا العصبية الفئران القشرية الأولية في وجود خلايا الدبقية ، بينما يسمح لتكون الخلايا العصبية معزولة بسهولة لأغراض التحليل التجريبي. لدعم التنمية دبق النمط الظاهري العصبية a صحية ، في حين أن الاستجابات العصبية تحوير أيضا لعلاجات تجريبية بطريقة مناسبة من الناحية الفسيولوجية. بالإضافة إلى ذلك ، من خلال الركض في الدبقية الأساسي قبل زراعة الخلايا العصبية مع هذه الفئة من السكان الخلية يصبح المخصب بشكل انتقائي في الخلايا النجمية ، وبالتالي منع تحفيز دبقية التهابات. لأنواع معينة من التجارب ، ومع ذلك ، قد يكون المطلوب بنسب مختلفة من الخلايا الدبقية ، وبالتالي يمكن إجراء الثقافات الدبقية إضافية لتحسين هذه التركيبة الخلوية. ويمكن أيضا أن يكون هذا البروتوكول تكييفها لزراعة الخلايا العصبية المستمدة من مناطق أخرى من الدماغ ، مثل الحصين ، لتتناسب مع متطلبات معينة تجريبية
الاهتمامات الرئيسية لهذه التقنية تشمل منع تابع البكتيريةأمينة ومنع الانتشار الدبقية في طبقة الخلايا العصبية. هذا النظام لا تشمل عوامل المضادات الحيوية ، وبالتالي عقيمة تقنيات بالغة الأهمية لا سيما في جميع المراحل. يتم منع الانتشار الدبقية بإضافة عامل لمكافحة الإنقسامية السيتوزين arabinofuranoside ، والطلاء منخفض الكثافة والمتوسطة الثقافة المصل الحرة ؛ عقب هذه الخلايا النجمية البروتوكول ينبغي أن يؤلف ما لا يزيد عن 3-5 ٪ من الخلايا في طبقة الخلايا العصبية 1،4 وينبغي أن يتم الكشف عن الخلايا الدبقية الصغيرة أقل من 1 ٪. Immunopanning أو يمكن استخدام تقنيات أخرى لإزالة هذا التلوث حتى الدبقية منخفضة 4.
ويمكن أيضا أن يتم تعديل هذه التقنية لمجموعة متنوعة شارك في زراعة أي من أنواع الخلايا الملتصقة عند عزل نوع واحد لهذا التحليل هو مرغوب فيه. على سبيل المثال ، تم تكييف هذا النظام بنجاح لتحليل آثار بانيات على الكالسيوم 2 + يشير في خلايا السرطان النقيلي العظام 14.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
الكتاب أشكر أعضاء المختبر السابقين الذين ساهموا في صقل هذا البروتوكول والمعاهد الوطنية للصحة للحصول على الدعم على مر السنين (DA19808 وDA15014 إلى OM). آنا أبت 1 هو زميل في "تدريب والبحوث متعددة التخصصات في neuroAIDS بالحركة" (T32 - MH078795) ، وبالتالي تم دعم هذا العمل في جزء من المعاهد الوطنية للصحة تحت L. روث الجائزة الوطنية كيرشتاين خدمة أبحاث 5T32MH079785.
References
- Cook, A. Interactions between chemokines: regulation of fractalkine/CX3CL1 homeostasis by SDF/CXCL12 in cortical neurons. J. Biol. Chem. 285, 10563-10563 (2010).
- Nicolai, J., Burbassi, S., Rubin, J., Meucci, O. CXCL12 inhibits expression of the NMDA receptor's NR2B subunit through a histone deacetylase-dependent pathway contributing to neuronal survival. Cell. Death. Dis. 1, e33-e33 (2010).
- Sengupta, R. Morphine increases brain levels of ferritin heavy chain leading to inhibition of CXCR4-mediated survival signaling in neurons. J. Neurosci. 29, 2534-2544 (2009).
- Meucci, O. Chemokines regulate hippocampal neuronal signaling and gp120 neurotoxicity. Proc. Natl. Acad. Sci. U. S. A. 95, 14500-14500 (1998).
- Khan, M. Z. Regulation of neuronal P53 activity by CXCR 4. Mol. Cell. Neurosci. 30, 58-66 (2005).
- Patel, J. P. Modulation of neuronal CXCR4 by the micro-opioid agonist DAMGO. J. Neurovirol. 12, 492-500 (2006).
- Shimizu, S. Role of the transcription factor E2F1 in CXCR4-mediated neurotoxicity and HIV neuropathology. Neurobiol. Dis. 25, 17-26 (2007).
- Khan, M. Z. The chemokine receptor CXCR4 regulates cell-cycle proteins in neurons. J. Neurovirol. 9, 300-314 (2003).
- Khan, M. Z. The chemokine CXCL12 promotes survival of postmitotic neurons by regulating Rb protein. Cell. Death. Differ. 15, 1663-1672 (2008).
- Khan, M. Z., Vaidya, A., Meucci, O. CXCL12-mediated regulation of ANP32A/Lanp, a component of the inhibitor of histone acetyl transferase (INHAT) complex, in cortical neurons. J. Neuroimmune. Pharmacol. 6, 163-170 (2011).
- Dotti, C. G., Sullivan, C. A., Banker, G. A. The establishment of polarity by hippocampal neurons in culture. J. Neurosci. 8, 1454-1468 (1988).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat. Protoc. 1, 2406-2415 (2006).
- Goslin, K., Banker, G., Goslin, K., Banker, G. . Culturing Nerve Cells. , 339-370 (1998).
- D'Ambrosio, J., Fatatis, A. Osteoblasts modulate Ca2+ signaling in bone-metastatic prostate and breast cancer cells. Clin. Exp. Metastasis. 26, 955-964 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved