Method Article
Non-ventriküler Plazmid Enjeksiyon ve Elektroporasyon Postnatal Rat Beyin Gen Teslimat
Özet
Bu protokol, belli bir alanda yaşayan kemirgen beyin için genetik yapıları teslim olmayan bir viral yöntem açıklanır. Yöntemi plazmid hazırlanması, mikropipet imalat, yenidoğan sıçan yavru cerrahi, yapı mikroenjeksiyon, ve oluşur In vivo Elektroporasyon.
Özet
Transgenik hayvanlar oluşturulması, in vivo olarak ilgi çekici bir gen fonksiyonları okuyor standart bir yaklaşımdır. Ancak, birçok nakavt veya transgenik hayvanlar değiştirilmiş gen ifade ya da tüm organizmanın silinir bu durumda uygulanabilir değildir. Ayrıca, telafi edici mekanizmaların çeşitli genellikle sonuçları yorumlamak zor. Telafi edici etkileri ya zamanlama gen ekspresyonu veya transfekte hücrelerinin miktarını sınırlayarak kontrol altına alınabilir.
Postnatal olmayan ventriküler mikroenjeksiyon ve in vivo elektroporasyon yöntemi, yeni doğan kemirgen beyin ilgi küçük bir bölgeye doğrudan genler, siRNA veya boya molekülleri hedeflenen teslim sağlar . Geleneksel ventrikül enjeksiyon tekniği aksine, bu yöntem, göçmen olmayan hücre tiplerinin transfeksiyon sağlar. Burada açıklanan yöntem vasıtasıyla transfekte Animals in vivo görüntüleme veya akut beyin dilimleri elektrofizyolojik deneylerde, örneğin, iki foton kullanılabilir.
Protokol
1. Giriş
Transgenik hayvanlar oluşturulması, genlerin fonksiyonlarının incelenmesi, canlı hayvanlar 1 ve unraveling hastalığın mekanizması 2,3 yanı sıra hücrelerin 4 özellikleri işlemek için güçlü bir yöntem. Ancak, prosedür, bu nedenle bu tür viral enjeksiyon 5, elektroporasyonu 6 ve utero elektroporasyon 7,8 neonatal ventriküler enjeksiyonu gibi alternatif gen teslimat yöntemleri kullanmak dair teminat, son derece zaman alıcı ve pahalı oldukça zahmetli. ;, Örneğin kortikal ilgi alanında yerel bir ifade deseni oluşturmak olanağı göçmen olmayan hücre tiplerinin yerinde transfeksiyon non-viral genetik yapıları kullanımı: doğum sonrası ventriküler olmayan enjeksiyon ve elektroporasyon yöntemi özel bir takım avantajları vardır astrositler.
Bu video, CMV artırıcı (pCAG-EGFP) 9 tavuk beta aktin organizatörü altında gelişmiş yeşil flüoresan protein plazmid bir kodlama kullanılarak yenidoğan sıçan beyin, doğum sonrası gen teslim ayrıntılı bir prosedür ortaya koymaktadır. Biz ince cam pipetler stereotaktik bir cihaz üzerinde imalat ve montajı mikroenjektör plazmid içeren enjeksiyon solüsyonu hazırlanması göstermektedir. Sonra biz, enjeksiyon prosedür hakkında ve forseps elektrotlar ve in vivo porator kullanarak elektroporasyon hakkında, ameliyat gerçekleştirme hakkında izofluran ile sıçan yavrular bayıltmadan hakkında konuşmak . Son olarak, beklenen sonuçları, bakış açıları ve bu deneyler sırasında ortaya çıkabilecek zorlukları kısaca tartışacağız.
2. Elektroporasyon için Plazmid Hazırlık
- Biz genellikle 10 ul 200 ul ince duvar tüp plazmid enjeksiyon çözüm hazırlar. Bu çözüm çeşitli deneyler için yeterli olacaktır.
- Biz 1 ul 10X PBS (Malzeme ve ekipman) ve% 0,1 'Hızlı Yeşil su solüsyonu (Malzeme ve ekipman) 1 ul ul plazmid çözüm 8 (Malzeme ve ekipman) karıştırın.
- Plazmid enjeksiyon çözüm nihai konsantrasyonu mg / ml 1 ile 3 arasında olmalıdır. DNA konsantrasyonu yüksek cam kapiller ince ucu ile enjeksiyon için çok viskoz ise plazmid DNA düşük konsantrasyonlarda, transfeksiyon verimliliği azaltacaktır.
3. Cam İğne Hazırlık
- Cam pipet hazırlanması için, biz, maksimum parametreleri çekerek ısıtma ve filament ile kılcal borosilikat cam (Malzeme ve ekipman) ve dik bir elektrot cam çektirmesi (Malzeme ve ekipman) kullanın.
- Daha sonra ucu çapı 10-20 mikron ulaşmak için bir kağıt parçası kullanarak pipet ucu bölünürler.
- Biz mikroskop amacı altında ucu çapı ve şekli kontrol edin.
4. Mikroenjektör Montaj
- Kılcal ince bir polimer (Malzeme ve ekipman) (Malzeme ve ekipman), mineral yağı ile (Malzeme ve ekipman) yaklaşık 1 / 3 dolgu hacminin 10 ul Hamilton şırınga kullanma. Hava kabarcıkları kaçının!
- Sonra biz, mineral yağ ile cam pipet doldurmak ve Hamilton şırıngaya pipet yerleştirin. Hava kabarcıkları kaçının!
- Cam pipet ile şırınga sonra (bkz. Malzeme ve ekipman) bir denetleyici bağlı mikroenjektör sabittir.
- Stereotaktik aleti (Malzeme ve ekipman) sabit mikroenjeksiyon kurulum bize plazmid enjeksiyon solüsyonu ile güvenle cam pipet ucu tüpe imkanı bulursunuz.
- Ucu çözüm yüzeye değdiğinde, 1 ile daha fazla ya da 2 mm daldırma ve mikro enjektör denetleyicisi kullanarak enjeksiyon karışımı yaklaşık 1 ul pipet doldurun.
5. Bayıltmadan hayvan
Tüm işlemler burada sunulan hayvan deneyleri için Helsinki düzenlemelerin Üniversitesi göre yapıldı.
- Her deneme için izofluran yaklaşık 2 ml (Malzeme ve ekipman) ile gaz sızdırmaz bir şırınga (Malzeme ve ekipman) doldurun.
- Şırınga, hava akımının kaynağına bağlı anestezi birimi (Malzeme ve ekipman) sabit değil, hayvan kutusu ve maske stereotaktik kurulum sabit.
- Anestezi ünitesi, hava akımı yaklaşık 250 ml / dk ve izofluran düzeyi% 4'e ayarlayın.
- Biz, 2-5 dakika süreyle hayvan kutuya yavru sıçan yerleştirin.
- Yavru durur taşırken, stereotaktik kurulum bağlı ısıtma yastığı (Malzeme ve ekipman) üzerine yerleştirin.
- Kullanıcı yavru kafa rostral parçası bayıltmadan maske içine yerleştirin.
- Için 5 ila 10 dakika sürerderin anestezi girmek için yavru.
- Anestezi derinliği bir kuyruk tutam kontrol edin ve yaklaşık% 2,0-1,5 izofluran girişi azaltmak.
6. Cerrahi, Mikroenjeksiyon ve Elektroporasyon
- % 70 etanol ile yavru kafasına cilt davranın.
- (Malzeme ve ekipman), küçük makas (Malzeme ve ekipman) ve ince forseps kullanarak, alnında yavru bir ense cilt kesti.
- Yanlara doğru bükün ve deri parçaları, hafif baş ve cilt fiksasyon için kafatasının işitsel orifisleri kulak bar çekin.
- Binoküler bir mikroskop kullanarak, kafatası bregma noktayı bulmak.
- Stereotaktik koordinatları kullanarak ilgi bölge tanımlayın.
- Bu bölgenin üstüne enjeksiyon pipet yerleştirin ve kafatası yüzeye enjeksiyon solüsyonu 25-50 nl bırakarak işaretlemek.
- Delinmiş alanda sıvı görünene kadar nazik ve dikkatli bir kafatası, mikroskop altında, yüksek hızlı bir cerrahi matkap (Malzeme ve ekipman) ile işaretlenmiş bir noktada delin.
- Daha iyi iletkenlik elde etmek için geçerli iletken jel ile kafatası tarafta bir electropotation forseps elektrotlar (Malzeme ve ekipman) (Malzeme ve ekipman) sabitleyin.
- Küçük tampon kullanarak deliğe damla sıvı (Malzeme ve ekipman) çıkarın ve enjeksiyon yeri koordinatlarına göre delik cam iğne batırın.
- 25 ile 100 nl 5 ila 20 nl / sn hızda enjeksiyon solüsyonu infüze.
- Pipet hızla kaldırmak ve hemen electroporate. Elektroporasyon 1 Hz frekansta 99 V 50 ms ve genlik süresi beş dikdörtgen darbeler uygulayarak yapılır.
- Elektrotlar ve kulak çubukları çıkartın.
- Dilsiz (Malzeme ve ekipman) ve keskin bir forseps ve cerrahi konuları (Malzeme ve ekipman) bir kombinasyonu kullanılarak kesilmiş deri diker.
- Anestezi sonrası kurtarma yardım etmek için 15-30 dakika sıcak odasına yavru yerleştirin.
- Sonra yavru anne kafesine geri koymak.
7. Temsilcisi Sonuçlar
Başarılı bir şekilde transfekte hücreler transgen ifadesi elektroporasyon yaklaşık 10 saat sonra görünür ve birkaç hafta boyunca sabit kalacaktır.
Biz yukarıda anlatıldığı gibi derin kortikal katmanları veya postnatal günde 2 (P2) Wistar sıçan yavrular striatum bölge içine ya da plazmid microinjected ve in vivo elektroporasyon yapılan. Beyin dilimleri (kalınlığı 400 mikron) 2 ila 6 gün sonra kesilir (P4-P8) (HEPES Earle Dengeli Tuz Çözeltisi tamponlu) dilimleme soğuk ortamda 10 vibrotome kullanarak. Görüntü elde etme, oda sıcaklığında dilimleme orta Zeiss Axioplan 2 LSM5 Pascal konfokal mikroskop (Zeiss, Almanya) kullanılarak gerçekleştirildi.
Derin kortikal katmanları ve striatumda enjeksiyon siteleri EGFP ifade çapı (Şekil 1A, B) yaklaşık 200-300 mikron kompakt bir bölgede bulunan birçok transfekte hücreleri içeriyordu. Transfekte hücreler içinde, EGFP ifade düzeyi, farklı şekillerde (Şekil 1D) ve akson demetleri (Şekil 1E) dikenler ile dendritler de dahil olmak üzere ince hücresel süreçler (Şekil 1C) görüntüleme izin için yeterince yüksek. EGFP elektroporasyon sonra hücre canlılığı yanı sıra sağlam bir istikrar aksonların distal parçaları gibi kortikal terminalleri (Şekil 1F) (1.5-2 mm hücre gövdeleri) izleme izin verdi.
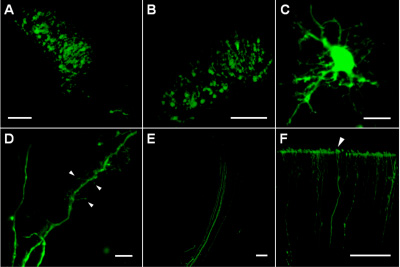
Şekil 1 (A) başarıyla striatum bölgede plazmid enjeksiyon yeri tasvir P4 sıçan beyin hücreleri transfekte. (B) P5 sıçan beyin derin kortikal tabakalar halinde transfekte hücreleri (kortikal yüzey altında yaklaşık 1000 mm). (C) P8 sıçan beyin striatum bölgede transfekte hücresi. (D) P8 sıçan beyin striatum bölgede transfekte hücre Dendritik süreçler; oklar dendritik dikenler ve filopodia farklı türlerini belirtir. (E) teminat yolağı içinde transfekte hücrelerinin Aksonlar. (F) P8 sıçan korteks (ok ucu) pial yüzey sonlandırma Aksonlar. Ölçek çubukları, A, B, E ve F 100 mikron, 10 mikron, C ve D
Tartışmalar
Yaşayan kemirgen beyin içine gen teslimat yöntemleri ve doğum sonrası elektroporasyon 6 için, son zamanlarda, utero elektroporasyon 7,8,11,12 kurulan ve. Ancak, bu yöntemlerin çeşitli uygulamalar için sınırlayıcı olabilir plazmid DNA, intraventriküler enjeksiyon dayanmaktadır. Örneğin, bu yöntemleri, hipokampus, ne de kortikal astrositler gibi göçmen olmayan hücre tiplerinin transfeksiyon gibi belirli beyin bölgelerindeki hücrelerini hedef izin vermez. Non-ventriküler enjeksiyon elektroporasyon ile birleştiğinde, ilk serebellar nöron 13 gen teslimat için kullanılmıştır . Bizim protokol sıçan beynin diğer bölgeleri için bir uzantısı olmayan ventriküler yöntemi göstermektedir. Biz bizim metodolojik yaklaşım postnatal sıçan beyin 5 içinde sınırlı ilgi alanlarına gen teslimi viral yöntem yararlı bir alternatif olduğunu öneriyoruz.
Bu yöntemin avantajlarına rağmen, bazı zorluklar aşağıda tartışıldığı gibi beklenebilir.
Hayvanın 1.Optimal yaşı
Mümkün olduğunda, genç yenidoğan sıçan yavrular, transfeksiyon etkinliğini ve yavrusunun hayatta kalması hem cerrahi sonrası artırmak için bir araç olarak kullanmak olmalıdır. Belirli bir alanda bu yaş 14 beyin atlası kullanılabilir elde stereotaktik koordinatları kullanarak beyin tekrarlanabilir hedef zor olduğu gibi bizim ellerde, P0 yavrular çok küçük. Buna ek olarak, P0 yavrular ince ve hassas bir cilde sahip dikiş engel olabilir. , P0-P2 hayvanlara kıyasla, P3 ve P4 cerrahi ve stereotaktik manipülasyon açısından en uygun, ama, ameliyat sırasında nöbetleri ve nefes kesintilere neden olabilir izofluran anestezi karşı aşırı duyarlılık vardır. Böylece, en iyi seçenek, ameliyat sırasında, öngörülebilir ve tekrarlanabilir microinjections için yeterince büyük P1-P2 sıçan yavrularının.
Mikroenjeksiyon ile 2.Possible sorunlar
Küçük hacimlerde çözüm (25-100 nl) karşıt bir basınç uygular, beyin dokusu ince cam ucu ile enjekte edildiğinde, hava kabarcıkları veya kaçakları dikkatle kaçınılması olduğunu kritik öneme sahiptir. Bu önlemek için transfeksiyon verimlilik dramatik bir azalmaya neden olabilir.
Stereotaktik koordinatları için 3.Precision sınırları
Stereotaktik koordinatları hassas rağmen, 0,3 mm tekrarlanabilirlik 15 yaşında bir sınırı vardır. Aynı yaş ve kilo hayvanlar kullanarak deneyimimiz CA1 hipokampal alan tekrarlanabilir hedefleme için yeterli 0,2-0,1 mm bu sınırı azaltmak mümkündür.
Teşekkürler
Ekaterina Karelina için film müziği, video kayıt, CAG-EGFP plazmid hazırlanması için 3D animasyon ve Dr. Peter Blaesse Ivan Molotkov yardım için teşekkür ederim.
Finlandiya Uluslararası Hareketlilik, Finlandiya Kültür Vakfı ve Finlandiya Akademisi Merkezi hibe destek verdi.
Malzemeler
| Name | Company | Catalog Number | Comments | |
| 2A-sa dumb Tweezers, 115mm | equipment | XYtronic | XY-2A-SA | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Biological Temperature Controller with stainless steel heating pad | equipment | Supertech | TMP-5b | |
| Borosilicate tube with filament | material | Sutter Instrument Co. | BF120-69-10 | Glass needle |
| Disposable drills | material | Meisinger | HP 310 104 001 001 008 | |
| Dulbeco’s PBS 10X | reagent | Sigma-Aldrich | D1408 | |
| Dumont #5 forceps, 110 mm | equipment | Fine Science Tools | 91150-20 | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Ealing micr–lectrode puller | equipment | Ealing | 50-2013 | Vertical electrode glass puller |
| Ethilon monofil polyamide 6-0 FS-3 16 mm 3/8c | material | Johnson & Johnson | EH7177H | Surgical threads |
| Exmire micro syringe 10.0 ml | equipment | Exmire | MS*GLLX00 | Gas-tight syringe |
| Fast Green | reagent | Sigma-Aldrich | F7252 | |
| Forceps electrodes | equipment | BEX | LF650P3 | Treat with 70% ethanol for disinfection prior to use |
| Foredom drill control | equipment | Foredom | FM3545 | Surgical drill power supply and control. Currently available analogue is micromotor kit K.1070 (Foredom) |
| Foredom micro motor handpiece | equipment | Foredom | MH-145 | Currently available analogue is micromotor kit K.1070 (Foredom) |
| Gas anesthesia platform for mice | equipment | Stoelting Co. | 50264 | Assembled on stereotaxic instrument |
| Isoflurane | reagent | Baxter Internationl Inc. | FDG9623 | |
| Micro dressing forceps, 105 mm | equipment | Aesculap | BD302R | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Microfil | material | World Precision Instruments, Inc. | MF34G-5 | Micro syringe filling capillaries |
| Mineral oil | reagent | Sigma-Aldrich | M8410 | |
| NanoFil Syringe 10 microliter | equipment | World Precision Instruments, Inc. | NANOFIL | Hamilton syringe |
| plasmid CAG-EGFP | reagent | Extracted and purified with EndoFree Plasmid Maxi Kit (Qiagen) and dissolved in nuclease free water to concentration 1.5 mg/ml | ||
| Pulse generator CUY21Vivo-SQ | equipment | BEX | CUY21Vivo-SQ | |
| Schiller electrode gel | reagent | Schiller AG | 2.158000 | Conductive gel |
| Small animal stereotaxic instrument | equipment | David Kopf Instruments | 900 | |
| St–lting mouse and neonatal rat adaptor | equipment | Stoelting Co. | 51625 | Assembled on stereotaxic instrument.Treat earbars with 70% ethanol for disinfection before use in surgical manipulations |
| Student iris scissors, straight 11.5 cm | equipment | Fine Science Tools | 91460-11 | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Sugi absorbent swabs 17 x 8 mm | material | Kettenbach | 31602 | Surgical tampons |
| UMP3 microsyringe pump and Micro 4 microsyringe pump controller | equipment | World Precision Instruments, Inc. | UMP3-1 | Microinjector and controller |
| Univentor 400 Anesthesia Unit | equipment | Univentor | 8323001 |
Referanslar
- Gerlai, R., Clayton, N. S. Analyzing hippocampal function in transgenic mice: an ethological perspective. Trends Neurosci. 22, 47-51 (1999).
- McGowan, E., Eriksen, J., Hutton, M. A decade of modeling Alzheimer's disease in transgenic mice. Trends Genet. 2, 281-289 (2006).
- Cryan, J. F., Holmes, A. The ascent of mouse: advances in modeling human depression and anxiety. Nat. Rev. Drug Discov. 4, 775-790 (2005).
- Wells, T., Carter, D. A. Genetic engineering of neural function in transgenic rodents: towards a comprehensive strategy. J. Neurosci. Methods. 108, 111-130 (2001).
- Pilpel, N. reproducible transduction of select forebrain regions by targeted recombinant virus injection into the neonatal mouse brain. J. Neurosci. Methods. 182, 55-63 (2009).
- Boutin, C. Efficient in vivo electroporation of the postnatal rodent forebrain. PLoS One. 3, e1883-e1883 (2008).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol. 240, 237-246 (2001).
- Saito, T. In vivo electroporation in the embryonic mouse central nervous system. Nat. Protoc. 1, 1552-1558 (2006).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc. Natl. Acad. Sci. U S A. 101, 16-22 (2004).
- De Simoni, A., Yu, L. M. Preparation of organotypic hippocampal slice cultures: interface method. Nat. Protoc. 1, 1439-1445 (2006).
- Walantus, W. In utero intraventricular injection and electroporation of E15 mouse embryos. J. Vis. Exp. , (2007).
- Walantus, W., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E16 rat embryos. J. Vis. Exp. , (2007).
- Umeshima, H., Hirano, T., Kengaku, M. Microtubule-based nuclear movement occurs independently of centrosome positioning in migrating neurons. Proc. Natl. Acad. Sci. U S A. 104, 16182-16187 (2007).
- Ashwell, K., Paxinos, G. . Atlas of the Developing Rat Nervous System. , (2008).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır