Method Article
Livraison de gènes au cerveau de rat postnatal par des non-ventriculaire injection Plasmide et électroporation
Dans cet article
Résumé
Ce protocole décrit une méthode non virale de la livraison des constructions génétiques à une certaine zone du cerveau de rongeur vivant. La méthode consiste à la préparation de plasmides, de fabrication micropipette, la chirurgie néonatale chez le rat nouveau-nés, la microinjection de la construction, et In vivo Électroporation.
Résumé
Création d'animaux transgéniques est une approche standard dans l'étude de fonctions d'un gène d'intérêt in vivo. Toutefois, de nombreux KO ou des animaux transgéniques ne sont pas viables dans les cas où le gène modifié qui est exprimé ou supprimés dans l'organisme entier. Par ailleurs, une variété de mécanismes compensatoires font qu'il est souvent difficile d'interpréter les résultats. Les effets compensatoires peuvent être atténuées par le calendrier soit l'expression du gène ou de limiter la quantité de cellules transfectées.
La méthode de non-ventriculaire postnatale microinjection et électroporation in vivo permet l'administration ciblée de gènes, siRNA ou des molécules de colorant directement à une petite région d'intérêt dans le cerveau de rongeurs nouveau-né. Contrairement à la technique du ventricule injection classique, cette méthode permet la transfection de types de cellules non-migrateurs. Animaux transfectées au moyen de la méthode décrite ici peut être utilisé, par exemple, pour deux photons en imagerie in vivo ou dans des expériences électrophysiologiques sur tranches de cerveau aigu.
Protocole
1. Présentation
Création d'animaux transgéniques est une méthode puissante d'investigation des fonctions des gènes chez les animaux vivants et pour une maladie de mécanisme de démêler 2,3 ainsi que pour la manipulation des propriétés des cellules 4. Toutefois, la procédure est assez laborieuse, extrêmement longue et coûteuse, ce qui justifie l'utilisation de méthodes alternatives de livraison de gènes viraux tels que l'injection 5, injection ventriculaire néonatale avec électroporation in utero 6 et 7,8 électroporation. La méthode de non-ventriculaire postnatale injection et électroporation a un ensemble unique d'avantages: l'utilisation des non-viraux constructions génétiques; possibilité de créer un profil d'expression locale dans la zone d'intérêt, dans la transfection in situ de types de cellules non-migrateurs, par exemple corticale astrocytes.
Dans cette vidéo, nous démontrons la procédure détaillée de la livraison de gènes dans le cerveau post-natal chez le rat nouveau-né en utilisant un plasmide codant pour la protéine fluorescente verte améliorée par un promoteur de l'actine de poulet bêta avec CMV Enhancer (pCAG-EGFP) 9. Nous illustrons la préparation de la solution injectable contenant le plasmide, la fabrication de pipettes en verre mince et de montage de l'microinjecteur sur un instrument stéréotaxique. Puis on parle de anesthésiant ratons avec l'isoflurane, sur l'exécution de la chirurgie, au sujet de la procédure d'injection et sur les électroporation en utilisant des électrodes et les pinces de porator vivo. Enfin, nous examinons brièvement les résultats anticipés, des perspectives et des difficultés qui peuvent surgir lors de ces expériences.
2. Préparation de plasmide pour l'électroporation
- Nous préparent généralement 10 pl de la solution injectable dans un plasmide de 200 ul paroi du tube mince. Cette solution est suffisante pour plusieurs expériences.
- Nous mélangeons 8 ul de la solution de plasmide (voir Matériel et équipement) avec 1 pl de la PBS 10X (voir Matériel et équipement) et 1 ul de 0,1% de solution d'eau vert rapide (voir Matériel et équipement).
- La concentration finale du plasmide dans la solution injectable doit être comprise entre 1 et 3 pg / pl. Des concentrations plus faibles d'ADN plasmidique permettra de réduire l'efficacité de transfection, tandis que la concentration élevée d'ADN seront trop visqueux pour être injecté à travers la pointe fine du verre capillaire.
3. Préparation aiguille de verre
- Pour la préparation pipette en verre, nous utilisons verre borosilicate capillaire avec un filament (voir Matériel et équipement) et un extracteur électrode verticale en verre (voir Matériel et équipement) sur un maximum de traction et de chauffage des paramètres.
- Nous avons ensuite briser la pointe de la pipette à l'aide d'un morceau de papier pour atteindre une pointe de 10 à 20 um de diamètre.
- Nous vérifions la diamètre de la pointe et la forme sous l'objectif du microscope.
4. Microinjecteur Assemblage
- L'utilisation d'un mince de polymère capillaire (voir Matériel et équipement), nous remplissons environ 1 / 3 du volume d'une seringue de 10 ul de Hamilton (voir Matériels et équipements) avec de l'huile minérale (voir Matériel et équipement). Eviter les bulles d'air!
- Ensuite, nous remplir la pipette en verre avec de l'huile minérale et d'insérer la pipette dans la seringue Hamilton. Eviter les bulles d'air!
- La seringue en verre pipette est ensuite fixé sur le microinjecteur connecté à un contrôleur (voir Matériel et équipement).
- La configuration microinjection fixé sur un instrument stéréotaxique (voir Matériel et équipement) nous permet en toute sécurité Immerger l'embout de la pipette en verre dans le tube avec la solution injectable de plasmide.
- Lorsque la pointe touche la surface de la solution, Dip It mm plus de 1 ou 2 et de remplir la pipette avec environ 1 ul du mélange par injection en utilisant les micro-injecteur contrôleur.
5. Animaux anesthésiant
Toutes les procédures présentées ici ont été effectués selon les règlements de l'Université de Helsinki pour les expérimentations animales.
- Pour chaque expérience, nous remplissons une seringue étanche au gaz (voir Matériels et équipements) avec environ 2 ml de l'isoflurane (voir Matériel et équipement).
- Que la seringue est fixée sur l'appareil d'anesthésie (voir Matériel et équipement) connecté à la source de flux d'air, la cage et le masque fixé sur l'installation stéréotaxique.
- Sur l'unité d'anesthésie, nous ajustons le flux d'air à environ 250 ml / min et le niveau de l'isoflurane à 4%.
- Nous plaçons le raton dans la case des animaux pendant 2-5 minutes.
- Quand le chiot cesse en mouvement, il place sur le coussin chauffant (voir Matériel et équipement) attaché à la configuration stéréotaxique.
- Placer une partie rostrale de la tête du chiot dans le masque anesthésiant.
- Il faut de 5 à 10 minutes pour lechiot à entrer dans le anesthésie profonde.
- Vérifiez profondeur d'anesthésie avec un pincement de la queue et la diminution de l'afflux d'isoflurane à environ 1,5 à 2,0%.
6. La chirurgie, la microinjection et électroporation
- Traiter la peau sur la tête de chiot avec l'éthanol à 70%.
- L'utilisation de petits ciseaux (voir Matériel et équipement) et des pinces fines (voir Matériel et équipement), coupez la peau d'une peau du chiot à son front.
- Bend morceaux de peau sur le côté et tirez légèrement l'oreille barres dans les orifices auditifs du crâne de la tête et la fixation de peau.
- L'utilisation d'un microscope binoculaire, nous localiser le point bregma sur le crâne.
- Identifier la région d'intérêt en utilisant les coordonnées stéréotaxiques.
- Position de la pipette d'injection-dessus de cette région et le marquer par la chute de 25 à 50 nl de la solution injectable sur la surface du crâne.
- Percer le crâne doucement et soigneusement au point marqué à l'aide d'une perceuse à haute vitesse chirurgicale (voir Matériel et équipement), sous le microscope jusqu'à ce liquide apparaît dans la zone forée.
- Fixer une pince électroporation électrodes (voir Matériel et équipement) sur les côtés du crâne avec un gel conducteur de courant (voir Matériel et équipement) pour assurer une meilleure conductivité.
- Retirez la goutte de liquide par le trou percé à l'aide de tampons de petite taille (voir Matériel et équipement) et trempette l'aiguille de verre pour le trou selon les coordonnées du site d'injection.
- Faire infuser 25 à 100 nl de la solution injectable au taux de 5 à 20 nl / sec.
- Enlever rapidement la pipette et électroporation immédiatement. L'électroporation est effectuée en appliquant cinq impulsions rectangle avec la durée de 50 ms et d'amplitude de 99 V à la fréquence de 1 Hz.
- Retirer les électrodes et les barres d'oreille.
- Coudre la peau coupée en utilisant une combinaison d'une pince-muets (voir Matériel et équipement) et tranchants et les fils chirurgicaux (voir Matériel et équipement).
- Placer le chiot dans la chambre chaude pendant 15-30 minutes à l'aide de sa récupération après l'anesthésie.
- Puis remettre le chiot à la cage de sa mère.
7. Les résultats représentatifs
L'expression du transgène dans les cellules transfectées avec succès apparaîtra environ 10 heures après l'électroporation, et elle restera stable pendant plusieurs semaines.
Nous microinjectés le plasmide soit dans de profondes couches corticales ou de la région du striatum jour postnatal 2 (P2) ratons Wistar et exécuté dans l'électroporation in vivo comme décrit ci-dessus. Tranches de cerveau (400 um d'épaisseur) ont été coupées au bout de 2 à 6 jours (P4-P8) en utilisant un vibrotome en milieu de tranchage à froid (Hepes tamponné Solution saline équilibrée de Earle) 10. L'acquisition des images a été réalisée à l'aide Zeiss Axioplan 2 LSM5 Pascal microscope confocal (Zeiss, Allemagne) dans le milieu de tranchage à la température ambiante.
Les sites d'injection dans les couches profondes du cortex et le striatum contient de nombreuses cellules transfectées exprimant l'EGFP qui étaient situés dans une région compacte d'environ 200 à 300 um de diamètre (figure 1A, B). Dans les cellules transfectées, le niveau d'expression EGFP est suffisamment élevé pour permettre l'imagerie des processus cellulaires minces (figure 1C), y compris les dendrites avec des épines de formes différentes (figure 1D) et les faisceaux des axones (figure 1E). La stabilité robuste de EGFP ainsi que la viabilité des cellules après l'électroporation a permis le traçage parties distales des axones (jusqu'à 1,5 à 2 mm du corps cellulaire) tels que les terminaux corticale (figure 1F).
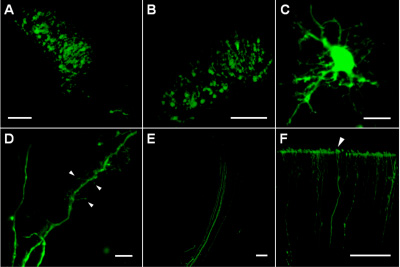
La figure 1 (A). Succès des cellules transfectées dans la région de striatum de cerveau de rat P4 délimitant le site d'injection de plasmide. (B) Les cellules transfectées dans les couches corticales profondes (environ 1000 um dessous de la surface corticale) du cerveau de rat P5. (C) une cellule transfectée dans la région de striatum de cerveau de rat P8. (D) des processus dendritiques d'une cellule transfectée dans la région de striatum de cerveau de rat P8; flèches indiquent les différents types d'épines dendritiques et filopodes. (E) Les axones des cellules transfectées sein voie collatérale. (F) Les axones se terminant à la surface de la pie-mère P8 cortex de rat (flèche). Barres d'échelle sont de 100 um sur A, B, E et F; 10 um sur les C et D.
Discussion
Les méthodes de livraison de gènes dans le cerveau de rongeurs vivants sont bien établies pour l'électroporation in utero 7,8,11,12 et, plus récemment, par électroporation postnatale 6. Cependant, ces méthodes sont basées sur l'injection intraventriculaire de l'ADN plasmidique, qui peut être limitant pour plusieurs applications. Par exemple, ces méthodes ne permettent pas de cibler des cellules dans certaines régions du cerveau telles que l'hippocampe, ni la transfection de ces types de cellules non-migratoires comme les astrocytes corticaux. Non-ventriculaire d'injection couplé avec l'électroporation a été utilisée pour la livraison de gènes dans les neurones du cervelet 13. Notre protocole illustre l'extension de la non-ventriculaire méthode pour d'autres régions du cerveau de rat. Nous proposons que notre approche méthodologique est une alternative utile à des méthodes de livraison de gènes viraux aux zones réglementées d'intérêt au sein de cerveau de rat postnatale 5.
Malgré les avantages de la méthode actuelle, certaines difficultés peuvent être attendus comme discuté ci-dessous.
L'âge de l'animal 1.Optimal
Lorsque c'est possible, les jeunes ratons nouveau-nés doivent être utiliser, comme moyen d'augmenter l'efficacité de transfection et la survie des petits à la fois après la chirurgie. Dans nos mains, la P0 chiots sont trop petits car il est difficile de cibler de manière reproductible une certaine zone du cerveau en utilisant stéréotaxique coordonnées obtenues à partir de l'atlas du cerveau disponible pour cet âge de 14 ans. En outre, les chiots ont P0 peau fine et tendre qui peuvent nuire à la couture. Le P3 et P4 sont plus pratique en termes de manipulations chirurgicales et stéréotaxique par rapport à P0-P2 animaux, mais ils ont une hypersensibilité à l'isoflurane qui peut provoquer des convulsions et des interruptions de la respiration pendant la chirurgie. Ainsi, la meilleure option est ratons P1-P2 qui sont prévisibles pendant la chirurgie et assez grand pour microinjections reproductibles.
Problèmes 2.Possible avec microinjection
Lorsque les petits volumes de solution (25-100 nl) sont injectés à travers la pointe de verre mince pour les tissus du cerveau exerce une pression adverse, il est essentiel que les bulles d'air ou des fuites sont soigneusement évités. Le défaut pour éviter ceux-ci peuvent causer une diminution spectaculaire de l'efficacité de la transfection.
Limites pour les 3.Precision coordonnées stéréotaxiques
Malgré la précision des coordonnées stéréotaxiques, ils ont une limite à 0,3 reproductibilité de 15 mm. Dans notre expérience dans l'utilisation des animaux du même âge et du poids, il est possible de diminuer cette limite de 0.2 à 0.1 mm d', qui est suffisante pour cibler reproductible de la région CA1 hippocampique.
Remerciements
Nous remercions Ekaterina Karelina de l'aide pour l'enregistrement bande son pour la vidéo, Ivan Molotkov d'animation 3D et le Dr Peter Blaesse d'ACG-EGFP préparation de plasmide.
Le travail a été soutenu par des subventions du Centre de mobilité internationale de la Finlande, le finnois Fondation culturelle et l'Académie de Finlande.
matériels
| Name | Company | Catalog Number | Comments | |
| 2A-sa dumb Tweezers, 115mm | equipment | XYtronic | XY-2A-SA | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Biological Temperature Controller with stainless steel heating pad | equipment | Supertech | TMP-5b | |
| Borosilicate tube with filament | material | Sutter Instrument Co. | BF120-69-10 | Glass needle |
| Disposable drills | material | Meisinger | HP 310 104 001 001 008 | |
| Dulbeco’s PBS 10X | reagent | Sigma-Aldrich | D1408 | |
| Dumont #5 forceps, 110 mm | equipment | Fine Science Tools | 91150-20 | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Ealing micr–lectrode puller | equipment | Ealing | 50-2013 | Vertical electrode glass puller |
| Ethilon monofil polyamide 6-0 FS-3 16 mm 3/8c | material | Johnson & Johnson | EH7177H | Surgical threads |
| Exmire micro syringe 10.0 ml | equipment | Exmire | MS*GLLX00 | Gas-tight syringe |
| Fast Green | reagent | Sigma-Aldrich | F7252 | |
| Forceps electrodes | equipment | BEX | LF650P3 | Treat with 70% ethanol for disinfection prior to use |
| Foredom drill control | equipment | Foredom | FM3545 | Surgical drill power supply and control. Currently available analogue is micromotor kit K.1070 (Foredom) |
| Foredom micro motor handpiece | equipment | Foredom | MH-145 | Currently available analogue is micromotor kit K.1070 (Foredom) |
| Gas anesthesia platform for mice | equipment | Stoelting Co. | 50264 | Assembled on stereotaxic instrument |
| Isoflurane | reagent | Baxter Internationl Inc. | FDG9623 | |
| Micro dressing forceps, 105 mm | equipment | Aesculap | BD302R | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Microfil | material | World Precision Instruments, Inc. | MF34G-5 | Micro syringe filling capillaries |
| Mineral oil | reagent | Sigma-Aldrich | M8410 | |
| NanoFil Syringe 10 microliter | equipment | World Precision Instruments, Inc. | NANOFIL | Hamilton syringe |
| plasmid CAG-EGFP | reagent | Extracted and purified with EndoFree Plasmid Maxi Kit (Qiagen) and dissolved in nuclease free water to concentration 1.5 mg/ml | ||
| Pulse generator CUY21Vivo-SQ | equipment | BEX | CUY21Vivo-SQ | |
| Schiller electrode gel | reagent | Schiller AG | 2.158000 | Conductive gel |
| Small animal stereotaxic instrument | equipment | David Kopf Instruments | 900 | |
| St–lting mouse and neonatal rat adaptor | equipment | Stoelting Co. | 51625 | Assembled on stereotaxic instrument.Treat earbars with 70% ethanol for disinfection before use in surgical manipulations |
| Student iris scissors, straight 11.5 cm | equipment | Fine Science Tools | 91460-11 | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Sugi absorbent swabs 17 x 8 mm | material | Kettenbach | 31602 | Surgical tampons |
| UMP3 microsyringe pump and Micro 4 microsyringe pump controller | equipment | World Precision Instruments, Inc. | UMP3-1 | Microinjector and controller |
| Univentor 400 Anesthesia Unit | equipment | Univentor | 8323001 |
Références
- Gerlai, R., Clayton, N. S. Analyzing hippocampal function in transgenic mice: an ethological perspective. Trends Neurosci. 22, 47-51 (1999).
- McGowan, E., Eriksen, J., Hutton, M. A decade of modeling Alzheimer's disease in transgenic mice. Trends Genet. 2, 281-289 (2006).
- Cryan, J. F., Holmes, A. The ascent of mouse: advances in modeling human depression and anxiety. Nat. Rev. Drug Discov. 4, 775-790 (2005).
- Wells, T., Carter, D. A. Genetic engineering of neural function in transgenic rodents: towards a comprehensive strategy. J. Neurosci. Methods. 108, 111-130 (2001).
- Pilpel, N. reproducible transduction of select forebrain regions by targeted recombinant virus injection into the neonatal mouse brain. J. Neurosci. Methods. 182, 55-63 (2009).
- Boutin, C. Efficient in vivo electroporation of the postnatal rodent forebrain. PLoS One. 3, e1883-e1883 (2008).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol. 240, 237-246 (2001).
- Saito, T. In vivo electroporation in the embryonic mouse central nervous system. Nat. Protoc. 1, 1552-1558 (2006).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc. Natl. Acad. Sci. U S A. 101, 16-22 (2004).
- De Simoni, A., Yu, L. M. Preparation of organotypic hippocampal slice cultures: interface method. Nat. Protoc. 1, 1439-1445 (2006).
- Walantus, W. In utero intraventricular injection and electroporation of E15 mouse embryos. J. Vis. Exp. , (2007).
- Walantus, W., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E16 rat embryos. J. Vis. Exp. , (2007).
- Umeshima, H., Hirano, T., Kengaku, M. Microtubule-based nuclear movement occurs independently of centrosome positioning in migrating neurons. Proc. Natl. Acad. Sci. U S A. 104, 16182-16187 (2007).
- Ashwell, K., Paxinos, G. . Atlas of the Developing Rat Nervous System. , (2008).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon