Method Article
非心室プラスミド注入し、エレクトロポレーションにより産後のラット脳への遺伝子デリバリー
要約
このプロトコルは、生きている齧歯類の脳の特定領域に遺伝子構築物の送達の非ウイルス方法を説明します。方法は、プラスミド調製、マイクロピペットの製造、新生児ラット子犬手術、コンストラクトのマイクロインジェクション、および構成されています in vivoでエレクトロポレーション。
要約
トランスジェニック動物の作成 は、 生体内で目的の遺伝子の機能を研究する上で標準的なアプローチです。しかし、多くのノックアウトまたはトランスジェニック動物は、改変された遺伝子が発現したり、生物全体に削除されるような場合に実行可能ではありません。また、代償機構の様々な、しばしばそれが困難な結果を解釈すること。補償効果はどちらのタイミング遺伝子発現またはトランスフェクトされた細胞の量を制限することによって軽減することができます。
出生後の非心室マイクロインジェクションの方法および in vivoエレクトロポレーションでは、直接新生児げっ歯類の脳への関心の小さな領域への遺伝子、siRNAや色素分子の標的送達することができます。従来の心室の注入法とは対照的に、このメソッドは非遊走細胞の種類のトランスフェクションすることができます。ここで説明する方法によりトランスフェクトされた動物は、in vivoイメージングや急性脳スライスの電気生理学的実験で、例えば、二光子のために、使用することができます。
プロトコル
1。はじめ
トランスジェニック動物の作成 は、動物1を生きているのとセル4のプロパティを操作するためだけでなく、病気のメカニズム2,3を解明するための遺伝子機能の研究の強力な方法です。しかし、手順はこのように、ウイルス注射5、エレクトロポ6のと子宮内エレクトロポレーション7,8 における新生児心室の注入などの代替遺伝子の配信方法を使用することに対する保証、、非常に時間がかかり、高価ではなく、骨の折れるです。 、関心のある領域での局所発現パターンを作成する可能性、非遊走細胞の種類の in situトランスフェクションでは 、例えば、皮質の非ウイルス性遺伝子構築物の使用:出生後の非心室注射とエレクトロポレーションの方法には利点のユニークなセットを持っていますアストロサイト。
このビデオでは、CMVエンハンサー(pCAG - EGFP)9ニワトリβアクチンプロモーターの下で増強緑色蛍光蛋白質をコードするプラスミドを用いて新生仔ラットの脳に生後遺伝子送達の詳細な手順を示しています。我々は、薄いガラスピペットの製造と定位楽器でインジェクターの組み立て、プラスミド含有注射液の調製を例示する。その後、我々は、注入の手順について、および鉗子の電極と生体の porator で使用してエレクトロポレーションについて、手術を行うについて、イソフルランと仔ラットをanaesthetizingについて話す。最後に、我々は簡単にこれらの実験中に発生する可能性のある予想される結果、視点や難しさを議論する。
2。エレクトロポレーションのためのプラスミドの調製
- 我々は通常、200μlの薄壁管のプラスミド注射液10μlを用意する。このソリューションは、いくつかの実験で十分です。
- 我々は、10 × PBSを1μl(材料および機器を参照)と0,1%ファストグリーンの水溶液1μl(材料および機器を参照)(材料および機器を参照)プラスミド溶液8μlを混合する。
- 注射液中のプラスミドの最終濃度は、μg/μLの1〜3であることが必要。高いDNA濃度はキャピラリーガラスの細いチップを通して注入のために粘性が高いとなる一方のプラスミドDNAを低濃度では、トランスフェクション効率が低下します。
3。ガラス針の準備
- ガラスピペットの準備のために、我々は、パラメータを引っ張ると加熱最大でフィラメント(材料および機器を参照)と垂直電極のガラスプラー(材料および機器を参照)とキャピラリーホウケイ酸ガラスを使用してください。
- 我々は、その後、直径が先端10から20ミクロンを達成するために一枚の紙を使用して、ピペットの先端を破る。
- 我々は、顕微鏡対物下の先端径と形状を確認してください。
4。組み立てマイクロインジェクター
- 我々は鉱物油で(材料および機器を参照)の約1 / 3の10μlハミルトンシリンジの容積のを埋めるキャピラリー薄いポリマーを(材料および機器を参照)を使用する(材料および機器を参照)。空気の泡を避ける!
- その後、我々は、鉱物油とガラスピペットを記入し、ハミルトンシリンジにピペットを挿入する。空気の泡を避ける!
- ガラスピペットと注射器は、コントローラ(材料および機器を参照)に接続されているインジェクターに固定されています。
- 定位装置(材料および機器を参照)に固定されたマイクロインジェクションのセットアップは、私たちは安全にプラスミド注射液をチューブにガラスピペットの先端を浸漬することができます。
- 先端が溶液の表面に触れると、1または2ミリによって、さらにそれを浸し、マイクロインジェクタコントローラを用いて射出ミックスの約1μlのピペットをご記入ください。
5。 Anaesthetizing動物
ここに示すすべての手順は、動物実験のためのヘルシンキ規制の大学に従って行った。
- 各実験では、我々は(材料および機器を参照)イソフルランの約2 mlをガスタイトシリンジを(材料および機器を参照)埋める。
- シリンジよりも空気の流れの源に接続されている麻酔装置(材料および機器を参照)、定位の設定に固定された動物のボックスとマスクで固定されています。
- 麻酔ユニットに、我々は約250 ml /分、4%のイソフルランレベルに空気の流れを調整する。
- 我々は2-5分のための動物ボックスに子犬ラットを置きます。
- 子犬停止が移動する場合は、定位のセットアップに取り付けられた加熱パッド(材料および機器を参照)の上に置きます。
- anaesthetizingマスクにの子犬の頭の吻側部を置きます。
- それは5〜10分かかります深い麻酔を入力する子犬。
- テールピンチで麻酔の深さをチェックして2.0〜約1.5%のイソフルランの流入を減少させる。
6。手術、マイクロインジェクションやエレクトロポレーション
- 70%エタノールでの子犬の頭の上に肌を扱う。
- 小さなはさみ(材料および機器を参照)と細いピンセットを使って(材料および機器を参照)、その額に子犬の首筋から皮膚をカット。
- 横に皮膚片を曲げ、少し頭と皮膚の固定のための頭蓋骨の耳の開口部に耳のバーを引き出します。
- 双眼顕微鏡を用いて、我々は、頭蓋骨のブレグマのポイントを探します。
- 定位座標を用いて関心領域を識別します。
- この地域上記インジェクションピペットを置き、頭蓋骨の表面に注射液の25〜50 NLをドロップすることによって、それをマーク。
- 液体は、掘削領域に表示されるまで、顕微鏡下(材料および機器を参照)、高速外科ドリルを使用して印を付けた点で優しく、慎重に頭蓋骨をドリル。
- 優れた導電性を達成するために、現在の導電性ゲルと頭蓋骨の両側にelectropotationの鉗子の電極を(材料および機器を参照してください)(材料および機器を参照)を修正。
- 小さなタンポンを使用してドリル穴から液滴を削除する(材料および機器を参照)、注射部位の座標に応じて穴にガラス針をディップ。
- 5〜20 NL /秒の速度で注射液の25から100 nlのを吹き込む。
- 迅速にピペットを削除し、直ちにエレクトロ。エレクトロポレーションは、1 Hzの周波数で99 Vの50ミリ秒と振幅の持続時間と5の矩形パルスを印加することによって行われます。
- 電極と耳のバーを取り外します。
- ダム(材料および機器を参照)とシャープなピンセットと手術用のスレッド(材料および機器を参照)の組み合わせを使用してカット肌を縫う。
- 麻酔後にその回復を助けるために15〜30分間のウォーム室に子犬を置きます。
- その後、母親のケージに子犬バックを置く。
7。代表的な結果
うまくトランスフェクトした細胞における導入遺伝子の発現は、エレクトロポレーション後約10時間表示され、そしてそれは数週間安定です。
我々はどちら生後2日目の深い皮質層または線条体領域(P2)にWistarラットの仔のプラスミドをマイクロインジェクションし、前述のように生体内エレクトロポレーションで実行されます 。脳スライス(厚さ400μmのは)2〜6日後にカットされた(P4 - P8)冷たいスライス培地でvibrotome(HEPESはアールの平衡塩類溶液をバッファリング)10を使用。画像取得は、室温でスライス培地でツァイスAxioplan 2 LSM5パスカル共焦点顕微鏡(Zeiss、ドイツ)を用いて行った。
深い皮質層と線条体における注入部位は、直径約200〜300ミクロン(図1A、B)のコンパクトな領域に位置されたEGFPを発現する多くのトランスフェクションされた細胞が含まれている。トランスフェクションした細胞内で、EGFPの発現レベルは、異なる形状(図1D)と軸索の束(図1E)の棘を持つ樹状突起を含む薄い細胞のプロセス(図1C)のイメージングを可能にする十分に高いです。 EGFPと同様にエレクトロポレーション後の細胞生存率の堅牢な安定性は、このような皮質の端末(図1F)のような軸索の遠位部(最大1.5〜2ミリメートルの細胞体から)トレースできました。
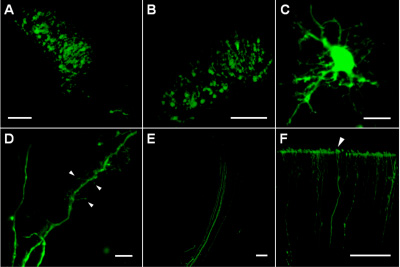
図1(A)が正常にプラスミド注射部位の輪郭を描くP4のラット脳の線条体領域内のセルをトランスフェクション。 (B)P5ラットの脳の深い皮質層にトランスフェクトされた細胞(皮質表面下約1000μmの)。 P8ラット脳の線条体領域での(C)トランスフェクトされた細胞。 (D)P8ラット脳の線条体領域でのトランスフェクトされた細胞の樹状突起を、矢印は樹状突起スパインおよびフィロポディアの異なる種類を示している。 (E)側副路内にトランスフェクションされた細胞の軸索。 (F)の軸索は、P8ラット皮質(矢じり)の軟膜表面で終端する。 CとDには10μm、スケールバーはA、B、E及びFは100μmです
ディスカッション
生きている齧歯類の脳への遺伝子送達の方法は、当生後エレクトロ6について、最近では、 子宮内エレクトロポレーション7,8,11,12 のために確立されています。しかし、これらの方法はいくつかのアプリケーションのために制限されることがありますプラスミドDNA、の脳室内注入に基づいています。例えば、これらのメソッドは、海馬、また皮質アストロサイトなどの非遊走細胞の種類のトランスフェクションなどの特定の脳領域で細胞を標的とすることはできません。エレクトロポレーションと相まって、非心室注入は、最初の小脳ニューロン13に遺伝子送達のために使用されていました。我々のプロトコルは、ラットの脳の他の地域のための非心室方式の拡張を示しています。我々は方法論的アプローチは、生後ラットの脳5内の関心の制限区域への遺伝子送達のウイルスの方法に有用な代替手段であることを提案する。
本方法の利点にもかかわらず、いくつかの困難は、後述するように期待されることがあります。
動物の1.Optimal年齢
可能な場合には、若い新生ラット仔は手術後にトランスフェクションの有効性と子犬の生存の両方を向上させる手段として、使用してください。それがこの14歳のために利用できる脳地図から得られる定位座標を用いて脳内で再現性の特定の領域をターゲットにすることは困難であるとして、私たちの手で、P0子犬が小さすぎます。さらに、P0子犬は縫製を妨げる可能性が薄いと柔らかい肌をしている。 P0 - P2動物と比較して、P3とP4は、手術や定位操作の面で最も便利ですが、手術中に発作と呼吸の中断を引き起こす可能性がイソフルラン麻酔に過敏症を持っている。このように、最善の選択肢は、手術中に予測可能で再現可能なmicroinjectionsのための十分な大きさであるP1 - P2仔ラットです。
マイクロインジェクションによる2.Possible問題
解決策(25〜100 NL)の小さなボリュームが反対の圧力が及ぼす脳組織に細いガラスチップを介して注入されると、それは気泡や漏れが注意深く回避されていることが重要です。これらを避けるために障害がトランスフェクション効率の劇的な低下を引き起こす可能性があります。
定位座標の3.Precision限界
定位座標の精度にもかかわらず、彼らは、0.3mmの再現性15で制限されています。同じ年齢と体重の動物を用いて我々の経験では、CA1海馬領域の再現性の標的に十分である0.2〜0.1ミリメートルにこの制限値を小さくすることが可能です。
謝辞
私たちは、ビデオのサウンドトラックの録音、CAG - EGFPプラスミド調製のための3DアニメーションとピーターBlaesse用イワンMolotkovのヘルプはエカテリーナKarelinaに感謝。
作業は、フィンランドの国際的なモビリティ、フィンランド文化財団とフィンランドアカデミーのセンターからの補助金によって支えられている。
資料
| Name | Company | Catalog Number | Comments | |
| 2A-sa dumb Tweezers, 115mm | equipment | XYtronic | XY-2A-SA | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Biological Temperature Controller with stainless steel heating pad | equipment | Supertech | TMP-5b | |
| Borosilicate tube with filament | material | Sutter Instrument Co. | BF120-69-10 | Glass needle |
| Disposable drills | material | Meisinger | HP 310 104 001 001 008 | |
| Dulbeco’s PBS 10X | reagent | Sigma-Aldrich | D1408 | |
| Dumont #5 forceps, 110 mm | equipment | Fine Science Tools | 91150-20 | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Ealing micr–lectrode puller | equipment | Ealing | 50-2013 | Vertical electrode glass puller |
| Ethilon monofil polyamide 6-0 FS-3 16 mm 3/8c | material | Johnson & Johnson | EH7177H | Surgical threads |
| Exmire micro syringe 10.0 ml | equipment | Exmire | MS*GLLX00 | Gas-tight syringe |
| Fast Green | reagent | Sigma-Aldrich | F7252 | |
| Forceps electrodes | equipment | BEX | LF650P3 | Treat with 70% ethanol for disinfection prior to use |
| Foredom drill control | equipment | Foredom | FM3545 | Surgical drill power supply and control. Currently available analogue is micromotor kit K.1070 (Foredom) |
| Foredom micro motor handpiece | equipment | Foredom | MH-145 | Currently available analogue is micromotor kit K.1070 (Foredom) |
| Gas anesthesia platform for mice | equipment | Stoelting Co. | 50264 | Assembled on stereotaxic instrument |
| Isoflurane | reagent | Baxter Internationl Inc. | FDG9623 | |
| Micro dressing forceps, 105 mm | equipment | Aesculap | BD302R | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Microfil | material | World Precision Instruments, Inc. | MF34G-5 | Micro syringe filling capillaries |
| Mineral oil | reagent | Sigma-Aldrich | M8410 | |
| NanoFil Syringe 10 microliter | equipment | World Precision Instruments, Inc. | NANOFIL | Hamilton syringe |
| plasmid CAG-EGFP | reagent | Extracted and purified with EndoFree Plasmid Maxi Kit (Qiagen) and dissolved in nuclease free water to concentration 1.5 mg/ml | ||
| Pulse generator CUY21Vivo-SQ | equipment | BEX | CUY21Vivo-SQ | |
| Schiller electrode gel | reagent | Schiller AG | 2.158000 | Conductive gel |
| Small animal stereotaxic instrument | equipment | David Kopf Instruments | 900 | |
| St–lting mouse and neonatal rat adaptor | equipment | Stoelting Co. | 51625 | Assembled on stereotaxic instrument.Treat earbars with 70% ethanol for disinfection before use in surgical manipulations |
| Student iris scissors, straight 11.5 cm | equipment | Fine Science Tools | 91460-11 | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Sugi absorbent swabs 17 x 8 mm | material | Kettenbach | 31602 | Surgical tampons |
| UMP3 microsyringe pump and Micro 4 microsyringe pump controller | equipment | World Precision Instruments, Inc. | UMP3-1 | Microinjector and controller |
| Univentor 400 Anesthesia Unit | equipment | Univentor | 8323001 |
参考文献
- Gerlai, R., Clayton, N. S. Analyzing hippocampal function in transgenic mice: an ethological perspective. Trends Neurosci. 22, 47-51 (1999).
- McGowan, E., Eriksen, J., Hutton, M. A decade of modeling Alzheimer's disease in transgenic mice. Trends Genet. 2, 281-289 (2006).
- Cryan, J. F., Holmes, A. The ascent of mouse: advances in modeling human depression and anxiety. Nat. Rev. Drug Discov. 4, 775-790 (2005).
- Wells, T., Carter, D. A. Genetic engineering of neural function in transgenic rodents: towards a comprehensive strategy. J. Neurosci. Methods. 108, 111-130 (2001).
- Pilpel, N. reproducible transduction of select forebrain regions by targeted recombinant virus injection into the neonatal mouse brain. J. Neurosci. Methods. 182, 55-63 (2009).
- Boutin, C. Efficient in vivo electroporation of the postnatal rodent forebrain. PLoS One. 3, e1883-e1883 (2008).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol. 240, 237-246 (2001).
- Saito, T. In vivo electroporation in the embryonic mouse central nervous system. Nat. Protoc. 1, 1552-1558 (2006).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc. Natl. Acad. Sci. U S A. 101, 16-22 (2004).
- De Simoni, A., Yu, L. M. Preparation of organotypic hippocampal slice cultures: interface method. Nat. Protoc. 1, 1439-1445 (2006).
- Walantus, W. In utero intraventricular injection and electroporation of E15 mouse embryos. J. Vis. Exp. , (2007).
- Walantus, W., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E16 rat embryos. J. Vis. Exp. , (2007).
- Umeshima, H., Hirano, T., Kengaku, M. Microtubule-based nuclear movement occurs independently of centrosome positioning in migrating neurons. Proc. Natl. Acad. Sci. U S A. 104, 16182-16187 (2007).
- Ashwell, K., Paxinos, G. . Atlas of the Developing Rat Nervous System. , (2008).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved