Method Article
Gene Lieferung in Postnatale Rattengehirn von Non-ventrikuläre Plasmid Injektion und Elektroporation
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine nicht-virale Methode der Lieferung von Gen-Konstrukte zu einem bestimmten Bereich des Gehirns lebende Nagetier. Die Methode besteht aus Plasmid-Präparation, Mikropipette Fertigung, neugeborenen Ratten pup Chirurgie, Mikroinjektion des Konstrukts und In vivo Elektroporation.
Zusammenfassung
Erstellung von transgenen Tieren ist ein Standard-Ansatz bei der Untersuchung von Funktionen eines Gens von Interesse in vivo. Allerdings sind viele Knockout oder transgenen Tieren, die nicht in den Fällen, wo das modifizierte Gen exprimiert oder gelöscht wird in den gesamten Organismus lebensfähig. Darüber hinaus eine Vielzahl von Kompensationsmechanismen machen es oft schwierig, die Ergebnisse zu interpretieren. Die kompensatorische Effekte können entweder durch Timing der Genexpression oder die Begrenzung der Höhe von transfizierten Zellen vermindert werden.
Die Methode der postnatalen nicht ventrikuläre Mikroinjektion und in vivo Elektroporation ermöglicht die gezielte Verabreichung von Genen, siRNA oder Farbstoffmoleküle direkt auf eine kleine Region des Interesses an der neugeborenen Nagern Gehirn. Im Gegensatz zu herkömmlichen ventrikuläre Injektionstechnik ermöglicht diese Methode die Transfektion von nicht-wandernde Zelltypen. Tiere mit Hilfe der hier beschriebenen Methode transfiziert kann, zum Beispiel für Zwei-Photonen werden in-vivo-Bildgebung oder in elektrophysiologischen Experimenten an akuten Hirnschnitten.
Protokoll
1. Einführung
Erstellung von transgenen Tieren ist eine leistungsfähige Methode zur Untersuchung von Genfunktionen in lebenden Tieren 1 und zur Enträtselung Krankheitsmechanismus 2,3 sowie für die Manipulation von Eigenschaften der Zellen 4. Allerdings ist das Verfahren ziemlich aufwendig, extrem zeitaufwendig und teuer, so rechtfertigt die Verwendung von alternativen Gentransfer-Methoden wie virale Injektion 5, neonatalen ventrikulären Injektion mit Elektroporation 6 und in utero Elektroporation 7,8. Die Methode der postnatalen nicht ventrikuläre Injektion und Elektroporation hat eine einzigartige Reihe von Vorteilen: Nutzung von nicht-viralen Gen-Konstrukte, die Möglichkeit zu einem lokalen Expressionsmuster in den Bereich von Interesse zu schaffen; in situ Transfektion von nicht-wandernde Zelltypen, wie zB kortikale Astrozyten.
In diesem Video zeigen wir die Einzelheiten des Verfahrens der postnatalen Gentransfer auf die Neugeborenen Rattenhirn mit einem Plasmid kodiert für das Enhanced Green Fluorescent Protein unter chicken beta-Aktin-Promotor mit CMV-Enhancer (pCAG-EGFP) 9. Wir erläutern die Herstellung der Plasmid-haltigen Injektionslösung, die Herstellung von dünnen Glas-Pipetten und Montage der Mikroinjektor auf einem stereotaktischen Instrument. Dann reden wir über betäubende Rattenjungen mit Isofluran, über die Durchführung der Operation, über das Injektionsverfahren und über die Elektroporation mit einer Pinzette Elektroden und die in vivo porator. Schließlich diskutieren wir kurz die zu erwartenden Ergebnisse, Perspektiven und Schwierigkeiten, die während dieser Experimente entstehen können.
2. Plasmid-Präparation für die Elektroporation
- Wir bereiten meistens 10 ul der Plasmid-Injektionslösung in einer 200 ul dünnwandige Rohr. Diese Lösung ist ausreichend für mehrere Experimente.
- Wir mischen 8 ul der Plasmid-Lösung (siehe Materialien und Geräte) mit 1 ul des 10X PBS (siehe Materialien und Ausrüstung) und 1 ul 0,1% Fast Green-Wasser-Lösung (siehe Materialien und Ausrüstung).
- Die Endkonzentration des Plasmids in der Injektionslösung sollte zwischen 1 und 3 ug / ul werden. Niedrigere Konzentrationen von Plasmid-DNA verringert die Transfektionseffizienz, während die höheren DNA-Konzentration wird zu viskos für die Injektion durch die dünne Spitze der Glaskapillare.
3. Glasnadel Vorbereitung
- Für die Glaspipette Vorbereitung, verwenden wir Borosilikatglas Kapillare mit einem Filament (siehe Materialien und Ausrüstung) und eine vertikale Elektrode Glas Abzieher (siehe Materialien und Geräte) auf maximale Zugkraft und Heizung Parameter.
- Wir brechen dann die Spitze der Pipette mit einem Stück Papier, um einen Tipp 10-20 um im Durchmesser erreichen.
- Wir überprüfen die Spitze Durchmesser und Form unter dem Mikroskop-Objektiv.
4. Mikroinjektor Assembling
- Mit einer dünnen Polymerschicht Kapillare (siehe Materialien und Ausrüstung) füllen wir ca. 1 / 3 des Volumens einer 10 ul Hamilton-Spritze (siehe Materialien und Ausrüstung) mit Mineralöl (siehe Materialien und Ausrüstung). Vermeiden Sie Luftblasen!
- Dann füllen wir die Glaspipette mit Mineralöl und legen Sie die Pipette in die Hamilton-Spritze. Vermeiden Sie Luftblasen!
- Die Spritze mit Glaspipette wird dann auf dem Mikroinjektor verbunden mit einem Festwert (siehe Materialien und Ausrüstung).
- Die Mikroinjektion Setup auf einem stereotaktischen Instrument (siehe Materialien und Ausrüstung) fixiert ermöglicht es uns, gefahrlos tauchen die Spitze der Glaspipette in das Rohr mit dem Plasmid Injektionslösung.
- Wenn die Spitze die Oberfläche der Lösung berührt, tauchen sie durch 1 oder 2 mm und füllen Sie die Pipette mit etwa 1 ul der Injektion Mix mit dem Mikro-Injektor-Controller.
5. Narkotisierende Tier
Alle Verfahren vorgestellt wurden hier entsprechend der University of Helsinki Regelungen für Tierversuche durchgeführt.
- Für jedes Experiment, füllen wir eine gasdichte Spritze (siehe Materialien und Geräte) mit ca. 2 ml von Isofluran (siehe Materialien und Ausrüstung).
- Als die Spritze in der Anästhesie-Einheit (siehe Materialien und Ausrüstung) verbunden, um den Luftstrom Quelle festgelegt ist, das Tier-Box und die Maske auf stereotaktische Setup fixiert.
- Auf dem Narkosegerät, passen wir den Luftstrom auf etwa 250 ml / min und die Isofluran-Ebene, um 4%.
- Wir legen Jungtier in das Tier-Box für 2-5 Minuten.
- Wenn der Welpe nicht mehr bewegt, legen Sie es auf dem Heizkissen (siehe Materialien und Geräte) an den stereotaktischen Setup.
- Legen Sie eine rostralen Teil der Welpe den Kopf in die betäubende Maske.
- Es dauert 5 bis 10 Minuten für dieWelpen, die tiefe Narkose geben.
- Überprüfen Narkose Tiefe mit einem Schwanz kneifen und eine Verringerung der Isofluran Zufluss über 1,5 bis 2,0%.
6. Chirurgie, Mikroinjektion und Elektroporation
- Behandeln Sie die Haut an den Welpen den Kopf mit dem 70% Ethanol.
- Mit einer kleinen Schere (siehe Materialien und Ausrüstung) und dünnen Pinzette (siehe Materialien und Ausrüstung), schneiden Sie die Haut von einem scruff der Welpe seine Stirn.
- Beugen Hautstücke seitwärts und ziehen Ohr Bars leicht in klanglicher Öffnungen des Schädels für Kopf und Haut-Fixierung.
- Mit einem Binokular, suchen wir die Bregma Punkt auf dem Schädel.
- Identifizieren Sie die Region von Interesse mit der stereotaktischen Koordinaten.
- Positionieren Sie den Injektionspipette über diesem Bereich, und markieren Sie durch Fallenlassen 25-50 nl der Injektionslösung auf der Kopfoberfläche.
- Drill des Schädels sanft und vorsichtig an der markierten Stelle mit einem High-Speed-chirurgische Bohrer (siehe Materialien und Geräte) unter dem Mikroskop, bis die Flüssigkeit wird in die gebohrten Gebiet.
- Vereinbaren Sie einen electropotation Pinzette Elektroden (siehe Materialien und Geräte) an den Seiten des Schädels mit aktuellen leitfähiges Gel (siehe Materialien und Ausrüstung), um eine bessere Leitfähigkeit zu erreichen.
- Entfernen Sie die Flüssigkeit Drop aus dem Bohrloch mit kleinen Tampons (siehe Materialien und Ausrüstung) und tauchen Sie das Glas Nadel in das Loch nach den Koordinaten der Injektionsstelle.
- Infuse von 25 bis 100 nl der Injektionslösung in Höhe von 5 bis 20 nl / sec.
- Schnelles Entfernen der Pipette und elektroporieren sofort. Elektroporation ist durch die Anwendung fünf Rechteck-Impulsen mit der Dauer von 50 ms und Amplitude von 99 V bei einer Frequenz von 1 Hz durchgeführt.
- Entfernen Sie Elektroden und Ohr Bars.
- Nähen Sie den Schnitt der Haut durch eine Kombination eines stummen (siehe Materialien und Ausrüstung) und scharfen Zangen und chirurgische Fäden (siehe Materialien und Ausrüstung).
- Platzieren Sie den Welpen in die warme Kammer für 15-30 Minuten, um ihre Erholung nach der Narkose zu unterstützen.
- Dann legen Sie den Welpen zurück zu seiner Mutter in den Käfig.
7. Repräsentative Ergebnisse
Die Expression des Transgens in den erfolgreich transfizierten Zellen erscheinen etwa 10 Stunden nach der Elektroporation, und es bleibt für mehrere Wochen stabil.
Wir mikroinjiziert das Plasmid entweder in tiefen kortikalen Schichten oder Striatum Region postnatalen Tag 2 (P2) Wistar Rattenjungen und durchgeführt in vivo Elektroporation wie oben beschrieben. Hirnschnitten (400 um Dicke) wurden nach 2 bis 6 Tage verkürzt (P4-P8) mit einem vibrotome in kaltes Schneiden Medium (Hepes gepuffert Earle Balanced Salt Solution) 10. Bildaufnahme erfolgte mit Zeiss Axioplan 2 LSM5 Pascal konfokalen Mikroskop (Zeiss, Deutschland) in der Slicing-Medium bei Raumtemperatur.
Die Injektionsstellen in tiefen kortikalen Schichten und Striatum enthielt viele transfizierten Zellen, die EGFP, dass in einem kompakten Region von etwa 200-300 &mgr; m im Durchmesser (Abbildung 1A, B) befanden. Innerhalb transfizierten Zellen, die EGFP Expression ausreichend hoch, um Bildgebung von dünnen zellulären Prozessen (Abbildung 1C) mit Dendriten mit Stacheln in verschiedenen Formen (Abbildung 1D) und Axon-Bundles (Abb. 1E) zu ermöglichen. Die robuste Stabilität des EGFP als auch die Lebensfähigkeit der Zellen nach der Elektroporation erlaubt Tracing distalen Teile der Axone (bis 1,5-2 mm vom Zellkörper) wie kortikale Terminals (Abbildung 1F).
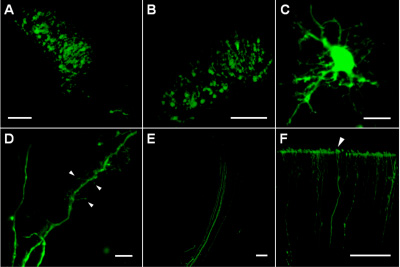
Abbildung 1. (A) erfolgreich Zellen in das Striatum Region P4 Rattenhirn Abgrenzung der Plasmid Injektionsstelle transfiziert. (B) transfizierten Zellen in tiefen kortikalen Schichten (ca. 1000 um unten kortikalen Oberfläche) P5 Rattenhirn. (C) A transfizierten Zelle in das Striatum Region P8 Rattenhirn. (D) Dendritische Prozesse einer transfizierten Zelle in das Striatum Region P8 Rattenhirn; Pfeile zeigen verschiedene Arten von dendritischen Dornen und Filopodien. (E) Axone von transfizierten Zellen innerhalb Kollateralweg. (F) Axone enden an der Pia-Oberfläche P8 Rattencortex (Pfeilspitze). Scale-Bars sind 100 um auf A, B, E und F; 10 um auf C und D.
Diskussion
Methoden der Gentransfer in lebende Nagetier Gehirn sind gut für die in utero Elektroporation 7,8,11,12 gegründet und seit kurzem auch für die postnatale Elektroporation 6. Allerdings sind diese Methoden auf intraventrikuläre Injektion der Plasmid-DNA, die für mehrere Anwendungen kann die Begrenzung basiert. Zum Beispiel, haben diese Methoden nicht zulassen, dass Targeting-Zellen in bestimmten Bereichen des Gehirns wie Hippocampus, noch die Transfektion von solchen nicht-wandernde Zelltypen als kortikale Astrozyten. Non-ventrikuläre Injektion mit Elektroporation gekoppelt wurde zum ersten Mal für den Gentransfer in zerebellären Neuronen 13 verwendet. Unser Protokoll zeigt die Erweiterung der nicht-ventrikuläre Methode auch für andere Regionen der Rattenhirn. Wir schlagen vor, dass unser methodischer Ansatz eine sinnvolle Alternative zu viralen Methoden der Gentransfer in geschützte Bereiche von Interesse innerhalb postnatalen Rattenhirn 5 ist.
Trotz der Vorteile des vorliegenden Verfahrens, kann einige Schwierigkeiten zu erwarten wie unten besprochen werden.
1.Optimal Alter von Tier
Wenn möglich, sollten jüngere neugeborenen Ratten Welpen zu verwenden, als Mittel, um sowohl die Transfektion Wirksamkeit und Überlebensrate der Jungtiere nach der Operation zu erhöhen. In unseren Händen sind die P0 Welpen zu klein, als es schwierig ist, reproduzierbar Ziel einen bestimmten Bereich im Gehirn mit stereotaktischen Koordinaten aus dem Gehirn-Atlas für das Alter von 14 Jahren erhalten. Darüber hinaus haben die P0 Welpen dünne und zarte Haut, dass das Nähen beeinträchtigen können. Die P3 und P4 sind am bequemsten im Hinblick auf die chirurgische und stereotaktische Eingriffe zu P0-P2 Tieren verglichen, aber sie haben Überempfindlichkeit gegenüber Isofluran-Narkose, die Anfälle und Atemaussetzer während der Operation führen kann. So ist die beste Option P1-P2 Rattenjungen die vorhersehbar während der Operation und groß genug für reproduzierbare microinjections sind.
2.Possible Probleme mit Mikroinjektion
Wenn kleine Mengen an Lösung (25-100 nl) durch dünne Glas-Spitze bis zum Hirngewebe injiziert übt einen Gegendruck, ist es entscheidend, dass Luftblasen oder Leckagen sorgfältig vermieden werden. Die Nichtbeachtung dieser zu vermeiden kann es zu einer dramatischen Abnahme der Transfektionseffizienz.
3.Precision Grenzwerte für stereotaktischen Koordinaten
Trotz der Präzision der stereotaktischen Koordinaten, haben sie eine Grenze bei 0,3 mm Reproduzierbarkeit 15. In unserer Erfahrung im Umgang mit Tieren im gleichen Alter und Gewicht ist es möglich, diese Grenze zu 0,2-0,1 mm ausreichend für reproduzierbare Ausrichtung der CA1 des Hippocampus Bereich zu verringern.
Danksagungen
Wir danken Ekaterina Karelina für die Hilfe bei der Aufnahme Soundtrack für das Video, Ivan Molotkov für 3D-Animation und Dr. Peter Blaesse für CAG-EGFP Plasmid-Präparation.
Die Arbeit wurde durch Zuschüsse aus dem Zentrum für Internationale Mobilität von Finnland, Finnish Cultural Foundation und der Academy of Finland unterstützt.
Materialien
| Name | Company | Catalog Number | Comments | |
| 2A-sa dumb Tweezers, 115mm | equipment | XYtronic | XY-2A-SA | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Biological Temperature Controller with stainless steel heating pad | equipment | Supertech | TMP-5b | |
| Borosilicate tube with filament | material | Sutter Instrument Co. | BF120-69-10 | Glass needle |
| Disposable drills | material | Meisinger | HP 310 104 001 001 008 | |
| Dulbeco’s PBS 10X | reagent | Sigma-Aldrich | D1408 | |
| Dumont #5 forceps, 110 mm | equipment | Fine Science Tools | 91150-20 | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Ealing micr–lectrode puller | equipment | Ealing | 50-2013 | Vertical electrode glass puller |
| Ethilon monofil polyamide 6-0 FS-3 16 mm 3/8c | material | Johnson & Johnson | EH7177H | Surgical threads |
| Exmire micro syringe 10.0 ml | equipment | Exmire | MS*GLLX00 | Gas-tight syringe |
| Fast Green | reagent | Sigma-Aldrich | F7252 | |
| Forceps electrodes | equipment | BEX | LF650P3 | Treat with 70% ethanol for disinfection prior to use |
| Foredom drill control | equipment | Foredom | FM3545 | Surgical drill power supply and control. Currently available analogue is micromotor kit K.1070 (Foredom) |
| Foredom micro motor handpiece | equipment | Foredom | MH-145 | Currently available analogue is micromotor kit K.1070 (Foredom) |
| Gas anesthesia platform for mice | equipment | Stoelting Co. | 50264 | Assembled on stereotaxic instrument |
| Isoflurane | reagent | Baxter Internationl Inc. | FDG9623 | |
| Micro dressing forceps, 105 mm | equipment | Aesculap | BD302R | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Microfil | material | World Precision Instruments, Inc. | MF34G-5 | Micro syringe filling capillaries |
| Mineral oil | reagent | Sigma-Aldrich | M8410 | |
| NanoFil Syringe 10 microliter | equipment | World Precision Instruments, Inc. | NANOFIL | Hamilton syringe |
| plasmid CAG-EGFP | reagent | Extracted and purified with EndoFree Plasmid Maxi Kit (Qiagen) and dissolved in nuclease free water to concentration 1.5 mg/ml | ||
| Pulse generator CUY21Vivo-SQ | equipment | BEX | CUY21Vivo-SQ | |
| Schiller electrode gel | reagent | Schiller AG | 2.158000 | Conductive gel |
| Small animal stereotaxic instrument | equipment | David Kopf Instruments | 900 | |
| St–lting mouse and neonatal rat adaptor | equipment | Stoelting Co. | 51625 | Assembled on stereotaxic instrument.Treat earbars with 70% ethanol for disinfection before use in surgical manipulations |
| Student iris scissors, straight 11.5 cm | equipment | Fine Science Tools | 91460-11 | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Sugi absorbent swabs 17 x 8 mm | material | Kettenbach | 31602 | Surgical tampons |
| UMP3 microsyringe pump and Micro 4 microsyringe pump controller | equipment | World Precision Instruments, Inc. | UMP3-1 | Microinjector and controller |
| Univentor 400 Anesthesia Unit | equipment | Univentor | 8323001 |
Referenzen
- Gerlai, R., Clayton, N. S. Analyzing hippocampal function in transgenic mice: an ethological perspective. Trends Neurosci. 22, 47-51 (1999).
- McGowan, E., Eriksen, J., Hutton, M. A decade of modeling Alzheimer's disease in transgenic mice. Trends Genet. 2, 281-289 (2006).
- Cryan, J. F., Holmes, A. The ascent of mouse: advances in modeling human depression and anxiety. Nat. Rev. Drug Discov. 4, 775-790 (2005).
- Wells, T., Carter, D. A. Genetic engineering of neural function in transgenic rodents: towards a comprehensive strategy. J. Neurosci. Methods. 108, 111-130 (2001).
- Pilpel, N. reproducible transduction of select forebrain regions by targeted recombinant virus injection into the neonatal mouse brain. J. Neurosci. Methods. 182, 55-63 (2009).
- Boutin, C. Efficient in vivo electroporation of the postnatal rodent forebrain. PLoS One. 3, e1883-e1883 (2008).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol. 240, 237-246 (2001).
- Saito, T. In vivo electroporation in the embryonic mouse central nervous system. Nat. Protoc. 1, 1552-1558 (2006).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc. Natl. Acad. Sci. U S A. 101, 16-22 (2004).
- De Simoni, A., Yu, L. M. Preparation of organotypic hippocampal slice cultures: interface method. Nat. Protoc. 1, 1439-1445 (2006).
- Walantus, W. In utero intraventricular injection and electroporation of E15 mouse embryos. J. Vis. Exp. , (2007).
- Walantus, W., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E16 rat embryos. J. Vis. Exp. , (2007).
- Umeshima, H., Hirano, T., Kengaku, M. Microtubule-based nuclear movement occurs independently of centrosome positioning in migrating neurons. Proc. Natl. Acad. Sci. U S A. 104, 16182-16187 (2007).
- Ashwell, K., Paxinos, G. . Atlas of the Developing Rat Nervous System. , (2008).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten