Method Article
Гена Доставка в послеродовой мозга крысы по Non-желудочковой плазмиды инъекция и Электропорация
Резюме
Этот протокол описывает невирусных способ доставки генетических конструкций в определенной области живой мозг грызуна. Метод состоит из плазмиды подготовки, микропипетки изготовления, новорожденных крысят хирургии, микроинъекции построить, и В естественных условиях Электропорации.
Аннотация
Создание трансгенных животных является стандартным подходом в изучении функции гена в живом организме. Однако многие нокаутом или трансгенных животных, не являются жизнеспособными в тех случаях, когда изменение ген экспрессируется или удалены во всем организме. Более того, различные компенсаторные механизмы часто затрудняют интерпретацию результатов. Компенсационных эффектов можно избежать, либо сроках экспрессии генов или ограничение количества трансфекции клеток.
Метод постнатального не-желудочковой микроинъекции и в естественных условиях электропорация позволяет адресной доставки генов, миРНК или молекул красителя непосредственно в небольшой области интереса к новорожденному мозга грызунов. В отличие от обычной техники инъекции желудочка, этот метод позволяет трансфекции немигрирующих типов клеток. Животные трансфекции с помощью метода, описанного здесь, может использоваться, например, для двухфотонного в естественных изображений или в электрофизиологических экспериментах на острые ломтики мозга.
протокол
1. Введение
Создание трансгенных животных является мощным методом исследования функции генов в живых животных 1 и для распутывания болезнь механизм 2,3, а также для управления свойства клеток 4. Тем не менее, процедура довольно трудоемкая, чрезвычайно трудоемким и дорогим, таким образом, требующие использования альтернативных методов доставки генов, таких как вирусные инъекций 5, неонатальной инъекции желудочка с электропорации 6 и внутриутробно электропорации 7,8. Метод постнатального не-желудочковой инъекции и электропорации имеет уникальный набор преимуществ: использование невирусных генетических конструкций; возможность создания местных выражению в области интересов; на месте трансфекции немигрирующих типы клеток, например, корковый астроцитов.
В этом видео, мы демонстрируем детальную процедуру постнатального доставки генов в неонатальном мозге крыс использованием плазмиды, кодирующей для расширения зеленого флуоресцентного белка в куриной бета-актин промотора CMV усилителя (pCAG-EGFP) 9. Проиллюстрируем подготовка плазмид-содержащих раствор для инъекций, изготовление тонких стеклянных пипеток и монтаж microinjector на стереотаксической инструмента. Тогда мы говорим о обезболивающее крысят с изофлуран, о выполнении операции, о процедуре инъекции и около электропорации использованием щипцов электродов и в porator естественных условиях. Наконец, мы кратко рассмотрим ожидаемые результаты, перспективы и трудности, которые могут возникнуть в ходе этих экспериментов.
2. Плазмиды Подготовка к Электропорация
- Мы обычно готовят 10 мкл плазмиды инъекционного раствора в 200 мкл тонкие стенки трубы. Это решение вполне достаточно для нескольких экспериментов.
- Мы смешиваем 8 мкл плазмиды решения (см. материалы и оборудование) с 1 мкл 10X PBS (см. Материалы и оборудование) и 1 мкл 0,1% Быстрый зеленый водного раствора (см. Материалы и оборудование).
- Конечной концентрации плазмиды в раствор для инъекций должно быть от 1 до 3 мкг / мкл. Более низкие концентрации плазмидной ДНК снизит эффективность трансфекции, в то время как высшие концентрации ДНК будет слишком вязким для инъекций через тонкий кончик стеклянный капилляр.
3. Стекло иглы подготовка
- Для приготовления пипетки стекла, мы используем боросиликатного стеклянный капилляр с нитью (см. Материалы и оборудование) и вертикальной съемник стеклянный электрод (см. Материалы и оборудование) на максимальное тяговое и отопления параметров.
- Затем перерыв кончика пипетки использованием листа бумаги для достижения кончика 10-20 мкм в диаметре.
- Мы проверяем диаметр кончика и форму под микроскопом цели.
4. Сборка Microinjector
- Использование тонких полимерных капиллярные (см. Материалы и оборудование), мы заполняем примерно 1 / 3 объема 10 мкл Hamilton шприца (см. Материалы и оборудование) с минеральным маслом (см. Материалы и оборудование). Избегайте воздушных пузырьков!
- Затем мы заполняем стеклянную пипетку с минеральным маслом и вставьте пипетки в шприце Hamilton. Избегайте воздушных пузырьков!
- Шприц со стеклянной пипетки, затем фиксируется на microinjector подключены к контроллеру (см. Материалы и оборудование).
- Микроинъекции установки закреплены на стереотаксической документа (см. Материалы и оборудование) позволяет безопасно погрузить кончик стеклянной пипетки в пробирку с плазмидой инъекционного раствора.
- Когда наконечник касается поверхности решение, окуните его дальше, 1 или 2 мм и заполнить пипетку с приблизительно 1 мкл инъекции смеси использованием микро инжектор контроллер.
5. Обезболивающее животных
Все процедуры, представленные здесь, были выполнены в соответствии с Хельсинкским университетом правила для экспериментов на животных.
- Для каждого эксперимента, мы заполняем газонепроницаемый шприц (см. Материалы и оборудование) с приблизительно 2 мл изофлуран (см. Материалы и оборудование).
- Чем шприца закреплен на анестезию блока (см. Материалы и оборудование), подключенного к источнику воздушного потока, коробка животных и маски фиксируется на стереотаксической установки.
- На наркоз блок, мы регулируем поток воздуха примерно до 250 мл / мин и изофлуран уровне до 4%.
- Мы размещаем крысят в окне животное в течение 2-5 минут.
- Когда щенок перестает двигаться, поместите его на грелку (см. Материалы и оборудование), подключенных к стереотаксической установки.
- Место ростральной части щенка головой в обезболивающее маску.
- Это занимает от 5 до 10 минутщенка, чтобы войти в глубокий наркоз.
- Проверьте глубину анестезии с хвостом шнура и уменьшения изофлуран приток около 1,5 до 2,0%.
6. Хирургия, Микроинъекция и Электропорация
- Лечите кожу на голове щенка с 70% этанола.
- Используя небольшие ножницы (см. Материалы и оборудование) и тонких щипцов (см. Материалы и оборудование), вырезать кожу от шиворот щенка к его лбу.
- Бенд кожу части вбок и потяните ухо баров немного в звуковые отверстия черепа для головы и кожи фиксации.
- Использование бинокулярный микроскоп, мы располагаем брегмы точку на черепе.
- Определите область интереса использованием стереотаксической координат.
- Позиция инъекции пипетки над этим регионом и отметьте его, понижая 25-50 п от инъекционного раствора на поверхности черепа.
- Дрель череп мягко и внимательно на отмеченные точки, используя высокую скорость хирургические сверла (см. Материалы и оборудование) под микроскопом, пока жидкость появляется в пробуренные области.
- Fix electropotation щипцы электродами (см. Материалы и оборудование), по бокам черепа с текущей гель проводящих (см. Материалы и оборудование) для достижения лучшей проводимости.
- Удалите капли жидкости из отверстия с помощью небольших тампоном (см. Материалы и оборудование) и опустите стекло иглой отверстие в соответствии с координатами места инъекции.
- Настаивать 25 до 100 п от раствор для инъекций в размере от 5 до 20 л / сек.
- Быстро удалить пипеткой и electroporate немедленно. Электропорация осуществляется путем применения пяти импульсов прямоугольник с длительностью 50 мс и амплитудой до 99 В при частоте 1 Гц.
- Удалите электроды и ухо баров.
- Шить порезаться, используя комбинацию немой (см. Материалы и оборудование) и резкое щипцов и хирургических нитей (см. Материалы и оборудование).
- Место щенка в теплой камере в течение 15-30 минут, чтобы помочь ее восстановлению после наркоза.
- Затем положить щенка обратно в клетку его матери.
7. Представитель Результаты
Выражение трансгена в успешной трансфекции клетки появятся примерно через 10 часов после электропорации, и она будет оставаться стабильной в течение нескольких недель.
Мы microinjected плазмиды либо в глубоких слоях коры или стриатума области послеродового день 2 (P2) щенков Wistar крысах и выступал в живом электропорации как описано выше. Мозг ломтиками (400 мкм в толщину) были сокращены после 2 до 6 дней (P4-P8) с использованием vibrotome в холодной нарезки среды (Hepes буфер сбалансированный солевой раствор Эрла) 10. Image Acquisition проводили с использованием Zeiss Axioplan 2 LSM5 Паскаль конфокальной микроскопии (Zeiss, Германия) в нарезка среде при комнатной температуре.
Инъекций в глубоких слоях коры и полосатого тела содержится много трансфекции клеток, экспрессирующих EGFP которые были расположены в компактной области около 200-300 мкм в диаметре (рис. 1а, б). В трансфекции клеток, уровень EGFP выражении достаточно высока, чтобы изображение тонких клеточных процессов (рис. 1C), включая дендриты с шипами различной формы (рис. 1D) и пучки аксонов (рис. 1E). Робастной устойчивости EGFP, а также жизнеспособность клеток после электропорации позволили отслеживания дистальной части аксонов (до 1,5-2 мм от клеточных тел), таких как корковые терминалов (рис. 1F).
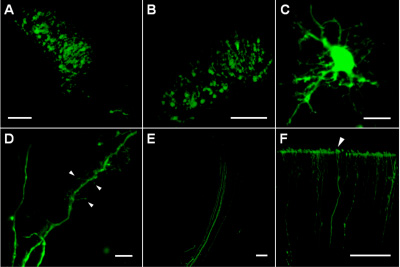
Рисунок 1. () Успешно трансфекции клеток в области полосатого тела мозга крысы P4 разграничения плазмиды месте инъекции. (B) трансфицированных клеток в глубоких слоях коры (около 1000 мкм ниже поверхности коры) мозга крысы P5. (C) трансфицированных ячейку в области полосатого тела мозга крысы P8. (D) Дендритные процессы трансфицированных ячейку в области полосатого тела мозга крысы P8; стрелки указывают различные типы дендритных шипиков и филоподий. (Е) Аксоны трансфекции клеток в залог пути. (F) Аксоны заканчиваются на пиальных поверхности P8 крысы коры (стрелки). Шкала бары 100 мкм, B, E и F, 10 мкм на С и D.
Обсуждение
Методы доставки генов в живой мозг грызуна, хорошо известны за внутриутробно электропорации 7,8,11,12 и, совсем недавно, в послеродовом электропорации 6. Однако, эти методы основаны на внутрижелудочкового введения плазмидной ДНК, которые могут быть предельными для нескольких приложений. Например, эти методы не позволяют ориентации клеток в определенных областях мозга, таких как гиппокамп, ни трансфекции таких немигрирующих типов клеток, как корковых астроцитов. Номера для инъекций желудочка в сочетании с электропорации был впервые использован для доставки генов в нейронах мозжечка 13. Наш протокол иллюстрирует расширение желудочков, не метод для других регионов мозга крыс. Мы полагаем, что наш методологический подход полезная альтернатива вирусные методы доставки генов в запретные зоны интересов в послеродовом мозга крысы 5.
Несмотря на преимущества данного метода, некоторые трудности, можно ожидать, как описано ниже.
1.Optimal возраст животного
Когда это возможно, младший новорожденных крысят должны использовать, как средство повышения эффективности трансфекции как и щенок выживание после операции. В наших руках, P0 щенков слишком малы, как трудно целевой воспроизводимо в определенной области мозга с помощью стереотаксической координат получена из атласа мозга для этого возраста 14. Кроме того, P0 щенков имеют тонкую и нежную кожу, что может препятствовать шитья. P3 и P4 наиболее удобны с точки зрения хирургического и стереотаксической манипуляции по сравнению с Р0-P2 животных, но у них есть повышенная чувствительность к изофлуран анестезии, которые могут вызвать судороги и дыхание перерывы во время операции. Таким образом, лучшим вариантом является P1-P2 крысят, которые предсказуемы во время операции и достаточно большой для воспроизводимых микроинъекций.
2.Possible проблемы с микроинъекции
При небольших объемах раствора (25-100 с.ш.) вводят через тонкий кончик стекла для тканей мозга оказывает противоположные давление, очень важно, чтобы пузырьки воздуха или утечек тщательно избегать. Неспособность, чтобы избежать этих может привести к резкому снижению эффективности трансфекции.
3.Precision ограничения для стереотаксической координаты
Несмотря на точность стереотаксической координат, у них есть лимит на 0,3 мм воспроизводимость 15. По нашему опыту использования животных того же возраста и веса можно уменьшить этот предел до 0,2-0,1 мм, что является достаточным для воспроизводимых адресности СА1 гиппокампа области.
Благодарности
Мы благодарим Екатерина Карелина на помощь с саундтреком для записи видео, Иван Молотков для 3D-анимации и д-р Питер Blaesse для CAG-EGFP плазмидной ДНК.
Работа выполнена при поддержке грантов от центра международной мобильности Финляндии, финский культурный фонд и Академия Финляндии.
Материалы
| Name | Company | Catalog Number | Comments | |
| 2A-sa dumb Tweezers, 115mm | equipment | XYtronic | XY-2A-SA | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Biological Temperature Controller with stainless steel heating pad | equipment | Supertech | TMP-5b | |
| Borosilicate tube with filament | material | Sutter Instrument Co. | BF120-69-10 | Glass needle |
| Disposable drills | material | Meisinger | HP 310 104 001 001 008 | |
| Dulbeco’s PBS 10X | reagent | Sigma-Aldrich | D1408 | |
| Dumont #5 forceps, 110 mm | equipment | Fine Science Tools | 91150-20 | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Ealing micr–lectrode puller | equipment | Ealing | 50-2013 | Vertical electrode glass puller |
| Ethilon monofil polyamide 6-0 FS-3 16 mm 3/8c | material | Johnson & Johnson | EH7177H | Surgical threads |
| Exmire micro syringe 10.0 ml | equipment | Exmire | MS*GLLX00 | Gas-tight syringe |
| Fast Green | reagent | Sigma-Aldrich | F7252 | |
| Forceps electrodes | equipment | BEX | LF650P3 | Treat with 70% ethanol for disinfection prior to use |
| Foredom drill control | equipment | Foredom | FM3545 | Surgical drill power supply and control. Currently available analogue is micromotor kit K.1070 (Foredom) |
| Foredom micro motor handpiece | equipment | Foredom | MH-145 | Currently available analogue is micromotor kit K.1070 (Foredom) |
| Gas anesthesia platform for mice | equipment | Stoelting Co. | 50264 | Assembled on stereotaxic instrument |
| Isoflurane | reagent | Baxter Internationl Inc. | FDG9623 | |
| Micro dressing forceps, 105 mm | equipment | Aesculap | BD302R | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Microfil | material | World Precision Instruments, Inc. | MF34G-5 | Micro syringe filling capillaries |
| Mineral oil | reagent | Sigma-Aldrich | M8410 | |
| NanoFil Syringe 10 microliter | equipment | World Precision Instruments, Inc. | NANOFIL | Hamilton syringe |
| plasmid CAG-EGFP | reagent | Extracted and purified with EndoFree Plasmid Maxi Kit (Qiagen) and dissolved in nuclease free water to concentration 1.5 mg/ml | ||
| Pulse generator CUY21Vivo-SQ | equipment | BEX | CUY21Vivo-SQ | |
| Schiller electrode gel | reagent | Schiller AG | 2.158000 | Conductive gel |
| Small animal stereotaxic instrument | equipment | David Kopf Instruments | 900 | |
| St–lting mouse and neonatal rat adaptor | equipment | Stoelting Co. | 51625 | Assembled on stereotaxic instrument.Treat earbars with 70% ethanol for disinfection before use in surgical manipulations |
| Student iris scissors, straight 11.5 cm | equipment | Fine Science Tools | 91460-11 | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Sugi absorbent swabs 17 x 8 mm | material | Kettenbach | 31602 | Surgical tampons |
| UMP3 microsyringe pump and Micro 4 microsyringe pump controller | equipment | World Precision Instruments, Inc. | UMP3-1 | Microinjector and controller |
| Univentor 400 Anesthesia Unit | equipment | Univentor | 8323001 |
Ссылки
- Gerlai, R., Clayton, N. S. Analyzing hippocampal function in transgenic mice: an ethological perspective. Trends Neurosci. 22, 47-51 (1999).
- McGowan, E., Eriksen, J., Hutton, M. A decade of modeling Alzheimer's disease in transgenic mice. Trends Genet. 2, 281-289 (2006).
- Cryan, J. F., Holmes, A. The ascent of mouse: advances in modeling human depression and anxiety. Nat. Rev. Drug Discov. 4, 775-790 (2005).
- Wells, T., Carter, D. A. Genetic engineering of neural function in transgenic rodents: towards a comprehensive strategy. J. Neurosci. Methods. 108, 111-130 (2001).
- Pilpel, N. reproducible transduction of select forebrain regions by targeted recombinant virus injection into the neonatal mouse brain. J. Neurosci. Methods. 182, 55-63 (2009).
- Boutin, C. Efficient in vivo electroporation of the postnatal rodent forebrain. PLoS One. 3, e1883-e1883 (2008).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol. 240, 237-246 (2001).
- Saito, T. In vivo electroporation in the embryonic mouse central nervous system. Nat. Protoc. 1, 1552-1558 (2006).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc. Natl. Acad. Sci. U S A. 101, 16-22 (2004).
- De Simoni, A., Yu, L. M. Preparation of organotypic hippocampal slice cultures: interface method. Nat. Protoc. 1, 1439-1445 (2006).
- Walantus, W. In utero intraventricular injection and electroporation of E15 mouse embryos. J. Vis. Exp. , (2007).
- Walantus, W., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E16 rat embryos. J. Vis. Exp. , (2007).
- Umeshima, H., Hirano, T., Kengaku, M. Microtubule-based nuclear movement occurs independently of centrosome positioning in migrating neurons. Proc. Natl. Acad. Sci. U S A. 104, 16182-16187 (2007).
- Ashwell, K., Paxinos, G. . Atlas of the Developing Rat Nervous System. , (2008).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены