Method Article
تسليم الجينات إلى الدماغ الجرذ بعد الولادة من غير البطين حقن البلازميد وElectroporation
In This Article
Summary
هذا البروتوكول يصف أسلوب غير الفيروسية تسليم يبني الجينية لمنطقة معينة من الدماغ القوارض الحية. الأسلوب يتكون من إعداد البلازميد وتصنيع micropipette ، جراحة الأطفال حديثي الولادة الفئران الجرو ، microinjection للبناء ، و في الجسم الحي electroporation.
Abstract
خلق حيوانات معدلة وراثيا هو مقاربة نموذجية في دراسة وظائف الجينات ذات الأهمية في الجسم الحي. ومع ذلك ، العديد من خروج المغلوب أو حيوانات معدلة وراثيا ليست قابلة للحياة في تلك الحالات حيث يتم التعبير عن الجينات في تعديل أو حذف الكائن الحي كله. علاوة على ذلك ، مجموعة متنوعة من الآليات التعويضية غالبا ما تجعل من الصعب تفسير النتائج. ويمكن التخفيف من آثار التعويضية إما توقيت التعبير الجيني أو الحد من كمية الخلايا transfected.
طريقة microinjection غير البطين بعد الولادة ويسمح في فيفو electroporation التسليم الموجه للجينات ، أو جزيئات سيرنا صبغة مباشرة إلى منطقة صغيرة من الفائدة في الدماغ القوارض الوليد. على النقيض من البطين التقليدية تقنية الحقن ، وهذا الأسلوب يسمح ترنسفكأيشن من أنواع الخلايا غير المهاجرة. ويمكن استخدام الحيوانات transfected عن طريق الأسلوب الموصوفة هنا ، على سبيل المثال ، لفوتون اثنين في التصوير أو في التجارب المجراة على شرائح الكهربية في الدماغ الحادة.
Protocol
1. مقدمة
خلق حيوانات معدلة وراثيا هو وسيلة قوية لتحقيق وظائف الجينات في الحيوانات الحية (1) وكشف عن آلية المرض 2،3 فضلا عن التلاعب خصائص الخلايا 4. ومع ذلك ، فإن الإجراء هو شاقة نوعا ما ، الوقت طويلا ومكلفا للغاية ، ويستدعي بالتالي استخدام الطرق البديلة لتوصيل الجينات الفيروسية مثل حقن 5 ، الولدان الحقن البطيني مع electroporation 6 و 7،8 في الرحم electroporation. طريقة الحقن غير البطين بعد الولادة وelectroporation لديه مجموعة فريدة من المزايا : استخدام غير الفيروسية يبني الجينية ؛ إمكانية لخلق نمط التعبير المحلية في مجال الاهتمام ، في الموضع ترنسفكأيشن من أنواع الخلايا غير المهاجرة ، على سبيل المثال القشرية النجمية.
في هذا الفيديو ، ونحن لشرح مفصل لإجراءات توصيل الجينات إلى الدماغ بعد الولادة الفئران حديثي الولادة باستخدام بلازميد ترميز للبروتين الفلورية الخضراء في إطار تعزيز المروج الدجاج أكتين بيتا مع محسن CMV (pCAG - EGFP) 9. نحن لتوضيح إعداد الحل الحقن التي تحتوي على البلازميد ، تصنيع ماصات زجاجية رقيقة وتجميع microinjector على صك المجسم. ثم نتحدث عن anaesthetizing الفئران الوليدة مع isoflurane ، حول كيفية تنفيذ العملية ، حول إجراء الحقن وحول electroporation باستخدام الملقط الأقطاب وporator في الجسم الحي. أخيرا ، نحن نناقش بإيجاز النتائج المتوقعة ، وجهات النظر والصعوبات التي قد تنشأ خلال هذه التجارب.
2. البلازميد التحضير لElectroporation
- نحن نستعد عادة 10 ميكرولتر من الحل في حقن البلازميد 200 ميكرولتر أنبوب جدار رقيق. هذا الحل هو ما يكفي لتجارب عدة.
- نحن مزيج 8 ميكرولتر من الحل البلازميد (انظر المواد والمعدات) مع 1 ميكرولتر من برنامج تلفزيوني 10X (انظر المواد والمعدات) و 1 ميكرولتر من 0،1 ٪ حل سريع المياه الخضراء (انظر المواد والمعدات).
- وينبغي التركيز النهائي للبلازميد في حل الحقن ما بين 1 و 3 ميكروغرام / ميكرولتر. وتركيزات أقل من الحمض النووي البلازميد تقليل كفاءة ترنسفكأيشن ، في حين أن أعلى تركيز الحمض النووي سيكون لزجة جدا للحقن عن طريق التلميح رقيقة من الزجاج الشعرية.
3. الزجاج الإبرة التحضير
- لإعداد ماصة الزجاج ، ونحن نستخدم الزجاج البورسليكات الشعرية مع خيوط (انظر المواد والمعدات) والزجاج الكهربائي العمودي مجتذب (انظر المواد والمعدات) على أقصى سحب والتدفئة المعلمات.
- ثم نكسر غيض من ماصة باستخدام قطعة من الورق لتحقيق غيض 10-20 ميكرون في القطر.
- علينا التحقق من قطر الحافة والشكل تحت المجهر الهدف.
4. Microinjector تجميع
- باستخدام البوليمر رقيقة الشعرية (انظر المواد والمعدات) ونحن ملء ما يقرب من 1 / 3 من حجم حقنة هاميلتون 10 ميكرولتر (انظر المواد والمعدات) مع الزيوت المعدنية (انظر المواد والمعدات). تجنب فقاعات الهواء!
- ثم ملأنا ماصة الزجاج مع الزيوت المعدنية وتضاف الى ماصة المحقنة هاملتون. تجنب فقاعات الهواء!
- ثم يتم إصلاح المحاقن مع ماصة الزجاج على microinjector متصلا إلى وحدة تحكم (انظر المواد والمعدات).
- الإعداد microinjection الثابتة على صك المجسم (انظر المواد والمعدات) يسمح لنا أن تزج بأمان غيض من ماصة الزجاج داخل الأنبوب مع محلول الحقن البلازميد.
- عندما يلامس سطح غيض من الحل ، وتراجع أنه ملم مزيدا من 1 أو 2 وملء ماصة مع ما يقرب من 1 ميكرولتر من مزيج الحقن باستخدام محقنة الدقيقة تحكم.
5. Anaesthetizing الحيوانية
تم تنفيذ جميع الإجراءات المقدمة هنا وفقا للوائح جامعة هلسنكي للتجارب على الحيوانات.
- لكل تجربة ، ونحن ملء محقنة الغاز محكم (انظر المواد والمعدات) مع ما يقرب من 2 مل من isoflurane (انظر المواد والمعدات).
- مما هو ثابت في وحدة حقنة تخدير (انظر المواد والمعدات) متصلا تدفق الهواء مصدر ، مربع الحيوانية وقناع الثابتة على إعداد المجسم.
- على وحدة التخدير ، وعلينا أن نعدل تدفق الهواء الى 250 تقريبا مل / دقيقة وعلى مستوى isoflurane إلى 4 ٪.
- نضع الفئران الجرو في خانة الحيوان لمدة 2-5 دقائق.
- عندما يتوقف تحريك الجرو ، وضعه على لوحة التدفئة (انظر المواد والمعدات) التي تعلق على إعداد المجسم.
- المكان جزء منقاري رأس الجرو حيز قناع anaesthetizing.
- يستغرق 5 إلى 10 دقائق لالجرو للدخول في التخدير العميق.
- التحقق من عمق التخدير مع قليل الذيل وانخفاض تدفق isoflurane إلى حوالي 1.5 إلى 2.0 ٪.
6. عملية جراحية ، وMicroinjection Electroporation
- علاج الجلد على رأس الجرو مع الايثانول 70 ٪.
- باستخدام مقص صغير (انظر المواد والمعدات) وملقط رقيقة (انظر المواد والمعدات) ، وقطع الجلد من القفا من الجرو على جبهته.
- ينحني قطعة الجلد وسحب قضبان جانبية طفيفة في الأذن الفوهات أذني من الجمجمة لتثبيت الرأس والجلد.
- باستخدام مجهر مجهر ، ونحن تحديد موقع نقطة bregma على الجمجمة.
- تحديد المنطقة ذات الاهتمام باستخدام إحداثيات المجسم.
- موقف ماصة الحقن فوق هذه المنطقة وعلامة عليه من خلال إسقاط 25-50 NL من الحل الحقن على سطح الجمجمة.
- حفر الجمجمة برفق وعناية في نقطة تميز باستخدام الحفر بسرعة عالية الجراحية (انظر المواد والمعدات) تحت المجهر حتى يظهر السائل في منطقة حفر.
- يحدد للelectropotation ملقط أقطاب (انظر المواد والمعدات) على الجانبين من الجمجمة مع جل موصل الحالية (انظر مواد ومعدات) لتحقيق أفضل الموصلية.
- إزالة قطرة السائل من حفر حفرة صغيرة باستخدام الصمام (انظر المواد والمعدات) وتراجع الإبرة لثقب الزجاج وفقا لإحداثيات موقع الحقن.
- يبث 25-100 NL من الحل الحقن بمعدل من 5 إلى 20 NL / ثانية.
- إزالة بسرعة وماصة electroporate على الفور. ويتم ذلك عن طريق تطبيق Electroporation البقول المستطيل خمس سنوات مع مدة 50 مللي ثانية والسعة من 99 في الخامس من التردد 1 هرتز.
- إزالة الأقطاب الكهربائية وقضبان الأذن.
- خياطة الجلد خفض استخدام مزيج من ملقط البكم (انظر المواد والمعدات) وحاد والمواضيع الجراحية (انظر المواد والمعدات).
- ضع الجرو الى غرفة دافئة ل15-30 دقيقة للمساعدة انتعاشها بعد التخدير.
- ثم وضع الظهر الجرو قفص لأمه.
7. ممثل النتائج
والتعبير عن التحوير في الخلايا transfected بنجاح تظهر ما يقرب من 10 ساعة بعد electroporation ، وسوف تبقى مستقرة لعدة أسابيع.
microinjected نحن البلازميد إما في طبقات عميقة القشرية أو منطقة المخطط من اليوم بعد الولادة 2 (P2) الفئران الوليدة ويستار أجريت في electroporation المجراة على النحو المبين أعلاه. وقطعت شرائح الدماغ (400 ميكرومتر في السمك) بعد 2 إلى 6 أيام (P4 - P8) باستخدام vibrotome في البرد المتوسطة تشريح (Hepes مخزنة في محلول الملح المتوازن ايرلي) 10. تم تنفيذ الحصول على الصور باستخدام زايس Axioplan 2 LSM5 المجهر مبائر باسكال (زايس ، وألمانيا) في المتوسط تشريح في درجة حرارة الغرفة.
يرد مواقع الحقن في طبقات عميقة وقشري الخلايا المخطط transfected هؤلاء الذين يعربون عن EGFP التي كانت موجودة في المنطقة المدمجة حوالي 200-300 ميكرون في القطر (الشكل 1A ، B). transfected داخل الخلايا ، ومستوى التعبير EGFP عالية بما فيه الكفاية للسماح للتصوير العمليات الخلوية رقيقة (الشكل 1C) بما في ذلك العمود الفقري مع التشعبات من الأشكال المختلفة (الشكل 1D) وحزم محوار (الشكل 1E). سمح للاستقرار قوية من EGFP كذلك بقاء الخلية بعد electroporation تتبع أجزاء البعيدة من محاور (حتى 1،5-2 ملم من الهيئات الخلية) مثل محطات القشرية (الشكل 1F).
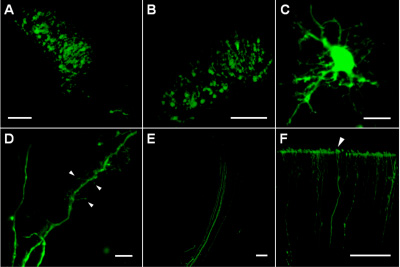
الشكل 1 (أ) transfected بنجاح الخلايا في منطقة من الدماغ المخطط الفئران P4 ترسيم البلازميد موقع الحقن. (ب) Transfected الخلايا في الطبقات العميقة القشرية (حوالي 1000 ميكرومتر تحت سطح القشرة) من دماغ الفئران P5. (C) خلية transfected في منطقة من الدماغ المخطط الفئران P8. (د) عمليات شجيري خلية transfected في منطقة من الدماغ المخطط الفئران P8 ؛ السهام تشير أنواع مختلفة من أشواك الشجيرية وأرجل كاذبة خيطية. (E) محاور عصبية من الخلايا transfected داخل الممر الجانبي. (F) محاور عصبية تنتهي عند سطح القشرة من الفئران حنوني P8 (رأس السهم). أشرطة النطاق هي 100 ميكرومتر على A ، E ، B و F ، و 10 ميكرومتر على جيم ودال.
Discussion
هي راسخة طرق توصيل الجينات في الدماغ القوارض الذين يعيشون في الرحم لelectroporation 7،8،11،12 ، وفي الآونة الأخيرة ، لelectroporation بعد الولادة 6. ومع ذلك ، تعتمد هذه الأساليب على الحقن داخل البطيني من الحمض النووي البلازميد ، والتي قد يحد من العديد من التطبيقات. على سبيل المثال ، فإن هذه الأساليب لا يسمح باستهداف خلايا الدماغ في مناطق معينة مثل الحصين ، ولا من هذا القبيل ترنسفكأيشن أنواع الخلايا غير المهاجرة كما النجمية القشرية. وقد استخدم لأول مرة غير البطين حقن مقرونا electroporation لإيصال الجين إلى الخلايا العصبية للدماغ 13. بروتوكول ملحق يوضح لنا غير البطين طريقة لمناطق أخرى من الدماغ الفئران. نقترح أن نهجنا المنهجية هو بديل لطرق مفيدة لتوصيل الجينات الفيروسية إلى المناطق المحظورة المصالح داخل دماغ الفئران بعد الولادة 5.
على الرغم من مزايا الطريقة الحالية ، قد يكون من المتوقع حدوث بعض الصعوبات التي نوقشت على النحو المبين أدناه.
1.Optimal عمر الحيوان
عندما يكون ذلك ممكنا ، ينبغي أن أصغر أنواع الجرذان الولدان يكون استخدامها ، كوسيلة لزيادة فعالية كل من ترنسفكأيشن الجرو والبقاء بعد الجراحة. في أيدينا ، والجراء P0 صغيرة جدا لأنه من الصعب أن الهدف بتكاثر منطقة معينة في الدماغ باستخدام المجسم الإحداثيات التي تم الحصول عليها من أطلس الدماغ المتاحة لهذا سن 14. بالإضافة إلى ذلك ، الجراء P0 كانت بشرتك رقيقة والعطاء التي قد تعوق الخياطة. وP3 و P4 هي الأكثر ملاءمة من حيث المعالجات الجراحية والمجسم بالمقارنة مع P0 - P2 الحيوانات ، ولكن لديهم فرط الحساسية للتخدير isoflurane التي قد تسبب نوبات انقطاع التنفس أثناء والجراحة. وبالتالي ، فإن أفضل خيار هو الفئران الوليدة P1 - P2 التي يمكن التنبؤ بها خلال عملية جراحية واسعة بما يكفي لmicroinjections استنساخه.
2.Possible مشاكل مع microinjection
عندما يتم حقن كميات صغيرة من محلول (25-100 NL) من خلال طرف زجاج رقيق إلى أنسجة المخ يمارس ضغط المعارضة ، فمن الأهمية بمكان أن يتم تجنب بعناية فقاعات الهواء أو التسرب. قد فشل في تجنب هذه تتسبب في تراجع كبير في كفاءة ترنسفكأيشن.
احداثيات الحدود 3.Precision المجسم
على الرغم من دقة إحداثيات المجسم ، لديهم الحد في استنساخ 0.3 ملم 15. في تجربتنا باستخدام حيوانات من نفس العمر والوزن فمن المحتمل أن ينخفض هذا الحد إلى 0،2-0،1 مم وهو ما يكفي لاستهداف استنساخه في منطقة قرن آمون CA1.
Acknowledgements
نشكر ايكاترينا Karelina للمساعدة في تسجيل الموسيقى التصويرية للفيديو ، إيفان Molotkov للرسوم المتحركة 3D ، والدكتور بيتر لBlaesse CAG - EGFP إعداد البلازميد.
وأيد العمل من المنح المقدمة من مركز الحراك الدولي في فنلندا ، ومؤسسة الثقافة الفنلندية وأكاديمية فنلندا.
Materials
| Name | Company | Catalog Number | Comments | |
| 2A-sa dumb Tweezers, 115mm | equipment | XYtronic | XY-2A-SA | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Biological Temperature Controller with stainless steel heating pad | equipment | Supertech | TMP-5b | |
| Borosilicate tube with filament | material | Sutter Instrument Co. | BF120-69-10 | Glass needle |
| Disposable drills | material | Meisinger | HP 310 104 001 001 008 | |
| Dulbeco’s PBS 10X | reagent | Sigma-Aldrich | D1408 | |
| Dumont #5 forceps, 110 mm | equipment | Fine Science Tools | 91150-20 | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Ealing micr–lectrode puller | equipment | Ealing | 50-2013 | Vertical electrode glass puller |
| Ethilon monofil polyamide 6-0 FS-3 16 mm 3/8c | material | Johnson & Johnson | EH7177H | Surgical threads |
| Exmire micro syringe 10.0 ml | equipment | Exmire | MS*GLLX00 | Gas-tight syringe |
| Fast Green | reagent | Sigma-Aldrich | F7252 | |
| Forceps electrodes | equipment | BEX | LF650P3 | Treat with 70% ethanol for disinfection prior to use |
| Foredom drill control | equipment | Foredom | FM3545 | Surgical drill power supply and control. Currently available analogue is micromotor kit K.1070 (Foredom) |
| Foredom micro motor handpiece | equipment | Foredom | MH-145 | Currently available analogue is micromotor kit K.1070 (Foredom) |
| Gas anesthesia platform for mice | equipment | Stoelting Co. | 50264 | Assembled on stereotaxic instrument |
| Isoflurane | reagent | Baxter Internationl Inc. | FDG9623 | |
| Micro dressing forceps, 105 mm | equipment | Aesculap | BD302R | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Microfil | material | World Precision Instruments, Inc. | MF34G-5 | Micro syringe filling capillaries |
| Mineral oil | reagent | Sigma-Aldrich | M8410 | |
| NanoFil Syringe 10 microliter | equipment | World Precision Instruments, Inc. | NANOFIL | Hamilton syringe |
| plasmid CAG-EGFP | reagent | Extracted and purified with EndoFree Plasmid Maxi Kit (Qiagen) and dissolved in nuclease free water to concentration 1.5 mg/ml | ||
| Pulse generator CUY21Vivo-SQ | equipment | BEX | CUY21Vivo-SQ | |
| Schiller electrode gel | reagent | Schiller AG | 2.158000 | Conductive gel |
| Small animal stereotaxic instrument | equipment | David Kopf Instruments | 900 | |
| St–lting mouse and neonatal rat adaptor | equipment | Stoelting Co. | 51625 | Assembled on stereotaxic instrument.Treat earbars with 70% ethanol for disinfection before use in surgical manipulations |
| Student iris scissors, straight 11.5 cm | equipment | Fine Science Tools | 91460-11 | Treat with 70% ethanol for disinfection before use in surgical manipulations |
| Sugi absorbent swabs 17 x 8 mm | material | Kettenbach | 31602 | Surgical tampons |
| UMP3 microsyringe pump and Micro 4 microsyringe pump controller | equipment | World Precision Instruments, Inc. | UMP3-1 | Microinjector and controller |
| Univentor 400 Anesthesia Unit | equipment | Univentor | 8323001 |
References
- Gerlai, R., Clayton, N. S. Analyzing hippocampal function in transgenic mice: an ethological perspective. Trends Neurosci. 22, 47-51 (1999).
- McGowan, E., Eriksen, J., Hutton, M. A decade of modeling Alzheimer's disease in transgenic mice. Trends Genet. 2, 281-289 (2006).
- Cryan, J. F., Holmes, A. The ascent of mouse: advances in modeling human depression and anxiety. Nat. Rev. Drug Discov. 4, 775-790 (2005).
- Wells, T., Carter, D. A. Genetic engineering of neural function in transgenic rodents: towards a comprehensive strategy. J. Neurosci. Methods. 108, 111-130 (2001).
- Pilpel, N. reproducible transduction of select forebrain regions by targeted recombinant virus injection into the neonatal mouse brain. J. Neurosci. Methods. 182, 55-63 (2009).
- Boutin, C. Efficient in vivo electroporation of the postnatal rodent forebrain. PLoS One. 3, e1883-e1883 (2008).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol. 240, 237-246 (2001).
- Saito, T. In vivo electroporation in the embryonic mouse central nervous system. Nat. Protoc. 1, 1552-1558 (2006).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc. Natl. Acad. Sci. U S A. 101, 16-22 (2004).
- De Simoni, A., Yu, L. M. Preparation of organotypic hippocampal slice cultures: interface method. Nat. Protoc. 1, 1439-1445 (2006).
- Walantus, W. In utero intraventricular injection and electroporation of E15 mouse embryos. J. Vis. Exp. , (2007).
- Walantus, W., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E16 rat embryos. J. Vis. Exp. , (2007).
- Umeshima, H., Hirano, T., Kengaku, M. Microtubule-based nuclear movement occurs independently of centrosome positioning in migrating neurons. Proc. Natl. Acad. Sci. U S A. 104, 16182-16187 (2007).
- Ashwell, K., Paxinos, G. . Atlas of the Developing Rat Nervous System. , (2008).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved