Method Article
Выделение ретиноидсодержащих клеток легких методом сортировки клеток
В этой статье
Резюме
Описанный ниже протокол представляет собой простой и эффективный способ выделения ретиноидсодержащих клеток из высокогетерогенных популяций клеток легких с использованием специфической ретиноидной автофлуоресценции и сортировки флуоресцентно-активируемых клеток.
Аннотация
Ретиноиды (витамин А и его метаболиты) являются важным липидным компонентом альвеолярного микроокружения, и специфический для клеточного типа метаболизм ретиноидов необходим для поддержания функционального здоровья развивающихся и взрослых легких. Клетки легких используют специфические пути, что позволяет эффективно поглощать циркулирующие ретиноиды из крови в виде ретинола (ROH) с последующим внутриклеточным ступенчатым превращением ROH в транскрипционно активные виды ретиноидов, полностью транс-ретиноевую кислоту (ATRA). ATRA-опосредованная (или ретиноид-опосредованная) передача сигналов имеет решающее значение для регуляции альвеоляризации легких, продукции сурфактанта, ангиогенеза, проницаемости и иммунитета. Важно отметить, что специфические клетки легких, включая фибробласты, могут накапливать ретиноиды в форме ретиниловых эфиров (РЗ), которые могут храниться или дополнительно мобилизоваться в виде ООЗ для переноса в соседние клетки при необходимости. Клетки, содержащие ретиноиды легких, могут быть выделены и собраны из одноклеточной суспензии переваренных легких с использованием ретиноидной аутофлуоресценции (излучение при длине волны 455 нм при возбуждении при длине волны 350 нм) и с помощью сортировки клеток, активируемых флуоресценцией (FACS). Дополнительное клеточно-специфическое мечение клеток легких красным флуоресцентным белком in vivo позволяет выделять и собирать специфические популяции клеток легких, содержащие ретиноиды. Собранные клетки могут быть непосредственно проанализированы или культивированы для дальнейшего анализа морфологии клеток, экспрессии генов и реакции на фармакологические манипуляции. Этот метод выделения и применения важен для исследований здоровья легких и повреждения легких на животных моделях, чтобы получить более глубокое представление о клеточных аспектах метаболизма ретиноидов в легких и липид-опосредованных клеточных коммуникациях.
Введение
Ретиноиды (витамин А и его метаболиты) являются важным липидным компонентом альвеолярного микроокружения, и специфический для клеточного типа метаболизм ретиноидов и передача сигналов необходимы для поддержания функционального здоровья развивающихся и взрослых легких 1,2,3,4,5,6,7,8,9,10,11 ,12,13,14. Клетки легких используют специфические пути, позволяющие эффективно поглощать циркулирующие ретиноиды пищевого происхождения из крови в виде ретинола (ROH)15,16,17,18,19 с последующим внутриклеточным ступенчатым превращением ROH в транскрипционно активные виды ретиноидов, полностью транс-ретиноевую кислоту (ATRA)20. ATRA-опосредованная (или ретиноид-опосредованная) передача сигналов достигается за счет взаимодействия ATRA с тремя различными родственными рецепторами ядерных гормонов, рецепторами ретиноевой кислоты (RARα, RARβ и RARγ21,22), и имеет решающее значение для регуляции альвеоляризации легких 23,24,25,26,27,28,29, производства сурфактанта30,31,32,33,34,35, ангиогенез36, проницаемость37 и иммунитет 38,39,40. Важно отметить, что специфические клетки легких, особенно легкие фибробласты, могут накапливать ретиноиды в форме ретиниловых эфиров (РЭ), которые могут сохраняться или далее мобилизоваться в виде ROH для переноса в соседние клетки при необходимости1.
Сложность метаболизма ретиноидов и передачи сигналов, а также клеточная сложность легких затрудняют исследования, направленные на изучение метаболизма ретиноидов в легких in vivo . Мы описали простой и надежный протокол выделения ретиноидсодержащих клеток (рис. 1) из высокогетерогенных популяций клеток легких с использованием специфической ретиноидной аутофлуоресценции (излучение при длине волны 455 нм при возбуждении при длине волны 350 нм) и с помощью сортировки клеток, активируемых флуоресценцией (FACS). Протокол не требует дополнительной маркировки клеток, за исключением окрашивания на жизнеспособность, если целью исследования является выделение и характеристика первичных живых клеток легких на основе их способности хранить ретиноиды. Это значительно сокращает время подготовки к сортировке клеток, исключает необходимость в дополнительном окрашивании, позволяет выделять высокие выходы жизнеспособных первичных клеток. Однако, если целью исследования является выделение и характеристика конкретных популяций клеток легких (фибробластов, эндотелиальных, эпителиальных или иммунных клеток), дополнительная сортировка клеток может быть выполнена после мечения отсортированных ретиноидсодержащих клеток клеточно-специфическими антителами.
Ретиноидная аутофлуоресценция использовалась в опубликованных исследованиях для установления идентичности ретиноидсодержащих клеток и/или для количественной оценки численности этих клеток в печени 41,42,43,44, поджелудочной железе 45,46, почках41,47 и легких41. Кроме того, несколько исследовательских групп сообщили об использовании флуоресценции ретиноидов для выделения с помощью FACS и изучения первичных ретиноидсодержащих клеток из живых тканей, включая печень 44,48,49,50,51,52,53 и легкое 1. В текущем протоколе мы показываем, как конкретные клеточные популяции могут быть помечены in vivo перед выделением клеток, содержащих ретиноиды, с помощью tdTomato (красный флуоресцентный белок). Спектральные характеристики tdTomato's (излучение на длине волны 581 нм при возбуждении на длине волны554 нм 54) и яркость не влияют на автофлуоресценцию ретиноидов и, следовательно, позволяют удобно добиваться специфичности клеток при сортировке. Учитывая критическую роль ненарушенного метаболизма ретиноидов и передачи сигналов в нормальном альвеолярноммикроокружении1, описанный метод выделения клеток легких является полезным инструментом в исследованиях здоровья и заболеваний легких на животных моделях для получения более глубокого понимания клеточных аспектов метаболизма ретиноидов в легких и липид-опосредованных клеточных коммуникаций in vivo.
протокол
Все описанные процедуры и эксперименты с участием мышей были проведены с одобрения Институционального комитета по уходу за животными и их использованию (IACUC) Университета Рутгерса (IACUC ID: PROTO202200111) в соответствии с критериями, изложенными в Руководстве по уходу и использованию лабораторных животных, подготовленном Национальной академией наук55.
1. Соображения и подготовка к эксперименту
- Животноводство и манипуляции
ПРИМЕЧАНИЕ: В исследованиях могут использоваться трехмесячные (10-12 недель) самцы и самки мышей. В описанных экспериментах использовали мышей с дефицитом лецитина-ацилтрансферазы (Lrat-дефицитные, Lrat-/- мыши56) на генетическом фоне C57BL/6J и однопометников соответствующего возраста (дикий тип, мыши Lrat+/+). Мышей, экспрессирующих ген tdTomato в фибробластах (мышей F-tdT), получали путем скрещивания мышей, у которых была репортерная кассета tdTomato (B6. Cg-Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J, штамм Jackson Lab #007914) с мышами Col1a2-CreER (B6. Cg-Tg(Col1a2-Cre/ERT,-ALPP)7Cpd/2J, штамм Jackson Lab #029567).- Используйте мышиную модель с экспрессией Cre, один из многих доступных вариантов для мечения популяции клеток-мишеней in vivo.
Примечание: В зависимости от выбора клетки-мишени, экспрессии Cre, эффективности Cre-опосредованной рекомбинации и специфичности клеток, исследователи могут использовать любую надежную мышиную модель Cre-экспрессии. - Используйте экспрессию трансгена tdTomato (после лечения тамоксифеном, как описано ниже) для мечения фибробластов Col1a2+ с последующим их выделением из суспензий одиночных клеток переваренного легкого, как описано ниже.
- Используйте мышиную модель с экспрессией Cre, один из многих доступных вариантов для мечения популяции клеток-мишеней in vivo.
- Кре-опосредованная рекомбинация и активация трансгена in vivo
- Индуцирование экспрессии Cre у мышей F-tdT путем внутрибрюшинного (IP) введения 2 мг тамоксифена один раз в 24 ч в течение 5 дней подряд.
- Перед инъекцией продезинфицируйте место инъекции 70% этанолом. Используйте мышей для экспериментов через 1 месяц после последней инъекции тамоксифена.
- Проверьте эффективность Cre-рекомбинации перед проведением экспериментов по сортировке. Подтвердите эффективную рекомбинацию Cre и экспрессию tdTomato путем выделения популяции клеток-мишеней фибробластов легких от мышей, получавших F-tdT, получавших тамоксифен, с использованием анти-Pdgfrα магнитных шариков и магнитно-активируемой сортировки клеток (MACS).
- Приготовление растворов, пластиковой и стеклянной посуды
ПРИМЕЧАНИЕ: Для процедур, описанных ниже, следует придерживаться асептических методов. Процедуры, включающие приготовление раствора, переваривание тканей и выделение клеток, должны проводиться под ламинарным колпаком. Растворы должны быть стерилизованы путем фильтрации с помощью фильтра 0,2 мкм; Хирургические инструменты, а также лабораторная посуда должны быть стерилизованы автоклавированием.- Под ламинарным колпаком приготовьте сбалансированный солевой раствор Хэнкса (HBSS), не содержащий кальция и магния (HBSS без Ca2+/Mg2+, содержащий 5,3 мМ KCl, 0,4 мМ KH2PO4, 4,2 мМ NaHCO3, 137,9 мМ NaCl, 0,3 мМ Na2HPO4, 5,6 мМ D-глюкозу) для перфузии легких (5 мл на мышь). Стерилизуйте раствор с помощью фильтра 0,2 мкм и наполните раствором шприц.
- Под ламинарным колпаком приготовьте сбалансированный раствор соли Хэнкса с кальцием и магнием (HBSS с Ca2+/Mg2+, содержащий 1,3 мМ CaCl2, 0,5 MgCl2·6H2O, 0,4 мМ MgSO4·7H2O, 5,3 мМ KCl, 0,4 мМ KH2PO4, 4,2 мМ NaHCO3, 137,9 мМ NaCl, 0,3 мМ Na2HPO4, 5,6 мМ D-глюкоза), содержащие 0,3 мг/мл коллагеназы IV типа и 1 мг/мл диспазы для перфузии легких (10 мл на мышь). Стерилизуйте раствор с помощью фильтра 0,2 мкм и наполните раствором шприц.
- Под ламинарным колпаком приготовьте HBSS с Ca2+/Mg2+, содержащим 0,3 мг/мл коллагеназы IV типа, 1 мг/мл диспазы и 5 мг/мл ДНКазы I для переваривания легких (10 мл на мышь). Стерилизуйте раствор с помощью фильтра 0,2 мкм и наполните раствором шприц.
- Под ламинарным колпаком заполните чашку для клеточных культур (35 мм 10 мм, одна чашка на собранное легкое от одной мыши) 2 мл стерильного HBSS с Ca2+/Mg2+. Поставьте тарелку (тарелки), содержащую HBSS с Ca2+/Mg2+ , на лед.
2. Перфузия легких, сбраживание и сбор одноклеточной суспензии
- Обезболите мышь путем введения коктейля для анестезии, содержащего 10 мг/мл кетамина и 2 мг/мл ксилазина в дозе 0,01 мл/г массы тела, путем инъекции IP.
- Убедитесь, что мышь находится в глубоком бессознательном состоянии, оценив реакцию на щипот пальца ноги. Удалите выпавшие волосы и видимую грязь / мусор с места операции, подстригите и протрите место операции, используя 70% спирт для дезинфекции.
- С помощью стерильных хирургических инструментов вскрыть брюшную и грудную полости. Разрежьте ребра и диафрагму, чтобы обнажить легкие и сердце.
ПРИМЕЧАНИЕ: Это обеспечит мгновенную смерть, так как торакотомия приведет к остановке дыхания во время анестезии мыши; При правильном выполнении эта часть процедуры займет до 3 минут от начала процедуры до грудной клетки, за которой последует смерть животного. - Разрежьте нижнюю полую вену и приложите абсорбирующую прокладку для впитывания выделившейся крови.
- Перфузируйте легкие in situ через правый желудочек сердца с помощью шприца объемом 10 мл с иглой 25 г x 1 дюйм, заполненной 5 мл стерильного HBSS без Ca2+/Mg2+. Если перфузия прошла успешно, легочная ткань станет белой.
- Перфузируйте легкие in situ с помощью шприца объемом 10 мл с иглой 25 г X 1 дюйм, заполненной 10 мл стерильного HBSS с Ca2+/Mg2+, содержащего коллагеназу IV типа (0,3 мг/мл) и диспазу (1 мг/мл).
- Извлеките легкие и перенесите их в чашку для клеточных культур (35 мм X 10 мм) с 2 мл стерильного HBSS с Ca2+/Mg2+.
- Под ламинарным капюшоном промойте легкие и измельчите их на мелкие кусочки с помощью стерильного хирургического лезвия (#20, подходит для ручки #4). Перенесите измельченное легкое в пробирку объемом 15 мл, добавив первые 5 мл HBSS с Ca2+/Mg2+ , содержащим 0,3 мг/мл коллагеназы IV типа, 1 мг/мл диспазы и 5 мг/мл ДНКазы I, в фарш и перенесите его с помощью серологической пипетки объемом 10 мл. Соберите и перенесите оставшиеся остатки измельченной ткани, промыв чашку для клеточной культуры оставшимися 5 мл HBSS с Ca2+/Mg2+ , содержащими 0,3 мг/мл коллагеназы IV типа, 1 мг/мл диспазы и 5 мг/мл ДНКазы I.
- Инкубируйте измельченную легочную ткань в HBSS с Ca2+/Mg2+ , содержащим 0,3 мг/мл коллагеназы IV типа, 1 мг/мл диспазы и 5 мг/мл ДНКазы I, на вращающемся шейкере, поддерживаемом при температуре 37 °C в течение 45 минут. С каждым из трех 15-минутных интервалов под ламинарным капюшоном пропустите измельченную ткань 10 раз через серологическую пипетку объемом 10 мл для лучшей диссоциации клеток.
- Полученную клеточную суспензию пропустите через ситечко 100 мкм, чтобы собрать отдельные клетки в пробирку объемом 50 мл, содержащую 20 мл холодного раствора для визуализации живых клеток (физиологический раствор, содержащий 20 мМ HEPES, pH 7,4), содержащего менее 5% фетальной бычьей сыворотки (FBS). Соберите клетки центрифугированием при 500 г в течение 10 мин при 4 °C.
- Аспирируйте надосадочную жидкость и ресуспендируйте клеточную гранулу в 1 мл буфера для лизирования эритроцитов и оставьте пробирку на 5 минут при комнатной температуре (ОТ) для элиминации эритроцитов. Добавьте 20 мл холодного раствора для визуализации живых клеток, содержащего менее 5% FBS. Соберите клетки центрифугированием при 500 г в течение 10 мин при 4 °C.
- Аспирируйте надосадочную жидкость и ресуспендируйте клеточную гранулу в 20 мл холодного раствора для визуализации живых клеток, содержащего менее 5% FBS. Полученную клеточную суспензию пропустите через ситечко 40 мкм, чтобы собрать отдельные клетки в пробирку объемом 50 мл, содержащую 20 мл холодного раствора для визуализации живых клеток, содержащего менее 5% FBS. Соберите клетки центрифугированием при 500 г в течение 10 мин при 4 °C.
- Аспирируйте надосадочную жидкость и ресуспендируйте клеточную гранулу в 10 мл холодного раствора для визуализации живых клеток, содержащего менее 5% FBS. Подсчитайте клетки и отрегулируйте концентрацию клеток до ~5-10 x 106 клеток/мл.
3. Выделение ретиноидсодержащих клеток легких с помощью сортировки флуоресцентно-активированных клеток (FACS)
- Возьмите аликвоту клеточной суспензии и отложите ее в сторону, чтобы использовать ее в качестве неокрашенного средства для контроля стробирования. Добавьте к оставшейся клеточной суспензии краситель для жизнеспособности SYTOX Green (разведение 1:1000, конечная концентрация 30 нМ).
- Пропустите клеточные суспензии через фильтр, прикрепленный к сборной трубке из полистирола объемом 5 мл (12 х 75 мм).
- Продолжайте выделение клеток FACS путем сортировки живых отдельных ретиноидсодержащих клеток на основе их излучения с длиной волны 455 нм. Выполните последовательную дискриминацию синглетов с помощью графика прямого рассеяния (высота прямого рассеяния/FSC-H в сравнении с прямой областью рассеяния/FSC-A). Исключение мертвых клеток по характеристикам разброса (боковой разброс) и окрашиванию с помощью SYTOX Green.
- Забирайте, сортируйте и собирайте одиночные, живые, содержащие ретиноиды клетки, используя излучение с длиной волны 455 нм при возбуждении на длине волны 350 нм.
Примечание: Используя описанную процедуру, из одного легкого мыши можно собрать около 5,105 ретиноидсодержащих клеток легких. - Выполняйте анализ данных FACS с помощью программного обеспечения для проточной цитометрии.
Результаты
Выделение ретиноидсодержащих клеток легких
Легкие мышей (от мышей Lrat+/+ и Lrat-/-) ферментативно расщепляли, а суспензии одиночных клеток готовили и подвергали FACS в соответствии с описанной выше процедурой. Сортировка клеток и сбор данных выполнялись на сортировочной системе Cytek Aurora™ Cell Sorter System под управлением программного обеспечения SpectroFlo CS версии 1.3.0 с использованием сопла 100 мкм и давления 15 фунтов на квадратный дюйм. Сначала были применены графики для прямого рассеяния (высота прямого рассеяния/FSC-H в сравнении с областью прямого рассеяния/FSC-A) для выбора и гейтинга одиночных клеток (синглетов), после чего была проведена дискриминация мертвых клеток с помощью бокового рассеивания и окрашивания SYTOX Green (рис. 2). Наконец, для сортировки целевой популяции ретиноидсодержащих клеток была выбрана отдельная популяция живых одиночных клеток с высокой автофлуоресценцией при λ = 455 нм (рис. 2A). Для подтверждения специфичности применяемой походки и общего подхода в качестве отрицательного контроля для корректировки гейтинга ретиноидной автофлуоресценции использовали суспензию клеток легких от мышей Lrat-/-. Мыши Lrat-/- не способны синтезировать РЭ и не могут накапливать ретиноиды в легких1. Примечательно, что при использовании идентичной стратегии гейтирования FACS в суспензии одиночных клеток из легких Lrat-/- не может быть обнаружена отдельная клеточная популяция с высокой аутофлуоресценцией при λ = 455 нм (рис. 2B).
После сбора первичные ретиноидные клетки легких могут быть непосредственно проанализированы или культивированы для дальнейшего анализа концентраций ретиноидов, морфологии клеток, экспрессии генов и реакции на фармакологические манипуляции (рис. 1).
Используя эту процедуру, мы смогли ранее показать, что среди ретиноидсодержащих клеток легких присутствуют различные клеточные популяции1. В частности, проведя секвенирование РНК одиночных клеток ретиноидсодержащих клеток, собранных методом FACS, мы показали, что среди этих клеток наиболее распространена группа стромальных клеток (83% от общего числа собранных клеток), за ней следуют эндотелиальные (7% от общего числа собранных клеток), эпителиальные (5% от общего числа собранных клеток) и миелоидные клетки (около 5% от общего числа собранных клеток)1. Данные о гетерогенности выделенных ретиноидсодержащих клеток легких не снижают специфичности описываемой процедуры; Скорее, эти данные подчеркивают ранее неизвестную сложность метаболизма ретиноидов в легких взрослого человека, который включает в себя фенотипически разнообразные клетки и обширную ретиноидно-опосредованную клеточную коммуникацию.
Выделение ретиноидсодержащих клеток легкого Col1a2+
Учитывая наличие гетерогенных клеточных популяций среди изолированных клеток, содержащих ретиноиды, исследователи, возможно, захотят сосредоточиться на изучении конкретного типа клеток легких, участвующих в метаболизме ретиноидов. С этой целью может быть выполнена дополнительная in vivo клеточно-специфическая маркировка популяции клеток-мишеней.
Среди высокогетерогенных популяций клеток легких субпопуляция мезенхимальных стромальных клеток легких с фибробластическими характеристиками, называемая легочными липидными интерстициальными клетками или липофибробластами легких, является преобладающим типом клеток, способных накапливать ретиноиды 1,57,58. Чтобы пометить субпопуляцию легочных фибробластов in vivo, мышей, экспрессирующих ген tdTomato в фибробластах (мыши F-tdT), получали путем скрещивания мышей, у которых была репортерная кассета tdTomato, с мышами Col1a2-CreER. Экспрессия Cre у мышей F-tdT индуцировалась путем ip-инъекции 2 мг тамоксифена один раз в 24 ч в общей сложности 5 дней подряд; Через месяц после последней инъекции тамоксифена мышей использовали для экспериментов. Такой подход позволил мечать фибробласты Col1a2+ белком tdTomato и выделять их из суспензий одиночных клеток переваренного легкого с помощью описанной выше процедуры. Подход позволяет захватывать живые (SYTOX Green negative), одиночные клетки tdTomato+ (рис. 3). Затем субпопуляция клеток, содержащих ретиноиды, может быть отделена от всех захваченных клеток tdTomato+ с использованием стратегии гейтирования, основанной на автофлуоресценции ретиноидов (рис. 3), как описано выше. Кроме того, эта процедура позволяет проводить последующую сортировку и раздельный сбор различных популяций клеток tdTomato+ на основе интенсивности сигнала флуоресценции ретиноидов на субпопуляции клеток с высоким, промежуточным и низким содержанием ретиноидов.
Эффективная рекомбинация Cre и экспрессия tdTomato были подтверждены путем выделения популяции клеток-мишеней фибробластов легких от мышей, получавших F-tdT, получавших тамоксифен (рис. 4A) с использованием анти-Pdgfrα магнитных шариков и магнитно-активируемой сортировки клеток (MACS). Кроме того, был проведен анализ ВЭЖХ для подтверждения наличия ретиноидов в отсортированных ретиноидсодержащих клетках (рис. 4В).
После сбора первичные ретиноиды-содержащие фибробласты легких могут быть непосредственно проанализированы или культивированы для дальнейшего анализа концентрации ретиноидов, морфологии клеток, экспрессии генов и реакции на фармакологические манипуляции. Например, одной из характерных особенностей легочных ретиноидсодержащих фибробластов, выделенных от животного дикого типа (Lrat+/+), является наличие липидных капель, которые можно визуализировать в культивируемых клетках с помощью стандартных иммуноцитохимических методов (рис. 4В).
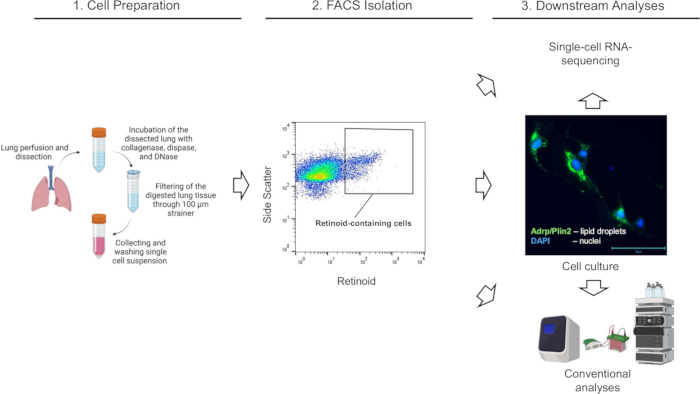
Рисунок 1: Схематическое изображение описанного экспериментального рабочего процесса. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
(Создано с помощью Biorender.com)

Рисунок 2: Выделение с помощью FACS ретиноидсодержащих клеток легких. (A) Стратегия стробирования для сортировки одиночных, живых клеток, содержащих ретиноиды (определяемых замкнутой областью) с использованием излучения при λ = 455 нм при возбуждении при λ = 350 нм из суспензий клеток легких, выделенных от мыши дикого типа C57Bl6/J (Lrat+/+). (B) Стратегия стробирования для сортировки одиночных, живых, содержащих ретиноиды клеток с использованием излучения при λ = 455 нм при возбуждении при λ = 350 нм, применяемая к суспензиям клеток легких, выделенным от мыши Lrat-/- ; на закрытой территории не обнаружено ретиноидсодержащих клеток в легких Lrat-/- ; Цифры указывают на процент закрытых ячеек. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
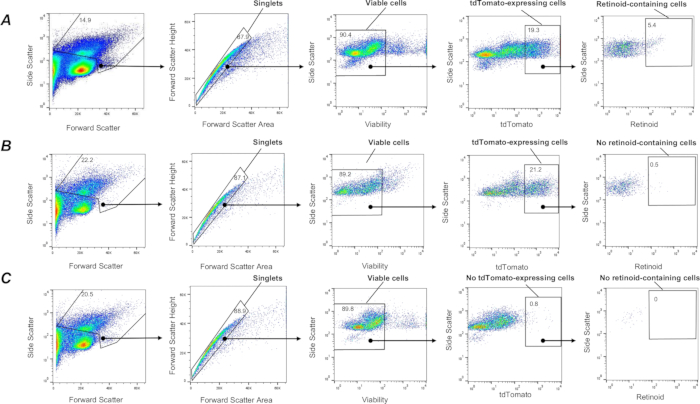
Рисунок 3: Выделение с помощью FACS ретиноидсодержащих ретиноидов легких фибробластов Col1a2+ . (A) Стратегия стробирования для сортировки одиночных, живых, содержащих ретиноиды tdTomato+ (определяемых замкнутой областью) с использованием излучения при λ = 455 нм при возбуждении при λ = 350 нм из суспензий клеток легких, выделенных от мыши F-TdTom на генетическом фоне дикого типа (C57Bl6/J). Панель (B) Стратегия стробирования для сортировки одиночных, живых клеток, содержащих ретиноиды tdTomato+ (определяемых замкнутой областью) с использованием излучения при λ = 455 нм при возбуждении при λ = 350 нм, примененная к суспензиям клеток легких, выделенным из мыши F-TdTom на фоне Lrat-/- (C57Bl6/J); на закрытой территории не обнаружено ретиноидсодержащих клеток в легких мышей F-TdTom на фоне Lrat-/- . (C) Стратегия гейтирования для сортировки одиночных, живых tdTomato+ ретиноидсодержащих клеток (определяемых замкнутой областью) с использованием излучения при λ = 455 нм при возбуждении при λ = 350 нм, применяемая к суспензиям клеток легких, выделенным из мыши tdTomato; на закрытой территории не обнаружено tdTomato+; Цифры указывают на процент закрытых ячеек. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
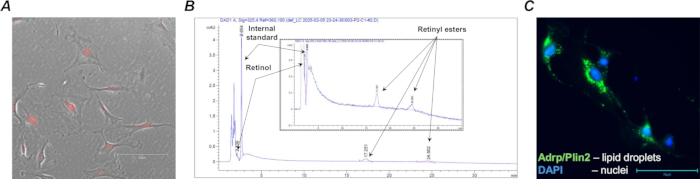
Рисунок 4: Ретиноидсодержащие фибробласты Col1a2+ / tdTomato+. (A) Репрезентативная микрофотография выделенных MACS клеток легких дикого типа (Lrat+/+) Col1a2+ / tdTomato+ в культуре; культивируемые клетки с характерной флуоресценцией tdTomato захватывали с помощью фильтра TX Red и 20-кратного увеличения; масштабная линейка составляет 150 мкм. (B) Профиль ВЭЖХ (со вставленным увеличением), показывающий характерные пики и времена удержания ретиноидных соединений (ретинола и ретиниловых эфиров), выделенных из 1,105 отсортированных ретиноидсодержащих клеток. (C) репрезентативная микрофотография выделенных FACS клеток легких дикого типа (Lrat+/+) Col1a2+ / tdTomato+ в культуре, окрашенной на жирный белок, ассоциированный с дифференцировкой липидных капель (Adrp/Perilipin 2); окрашенные клетки были захвачены с помощью фильтра GFP и 40-кратного увеличения; масштабная линейка составляет 75 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
О способности обнаруживать витамин А в тканях человека и животных и его гистологической визуализации с помощью флуоресцентной микроскопии впервые сообщалось еще в 1940-х годах. Феномен ретиноидной аутофлуоресценции был затем успешно применен в исследованиях, направленных на обнаружение высоких концентраций витамина А в тканях in vitro61 и характеристику морфогенеза эмбриональных тканей животных62 с помощью флуоресцентной микроскопии. Позже было замечено и экспериментально подтверждено, что отличительная автофлуоресценция клеточных ретиноидов (возбуждение при λ = 350 нм с характерным сине-зеленым излучением при λ = 455 нм) связана с конкретными типами клеток и, следовательно, может быть применена для выделения и характеристики этих клеток 63,64,65.
Ретиноидная аутофлуоресценция использовалась в опубликованных исследованиях для установления идентичности ретиноидсодержащих клеток и/или для количественной оценки численности этих клеток в печени 41,42,43,44, поджелудочной железе 45,46, почках41,47 и легких41. Кроме того, несколько исследовательских групп сообщили об использовании флуоресценции ретиноидов для выделения с помощью FACS и изучения первичных ретиноидсодержащих клеток из живых тканей, включая печень 44,48,49,50,51,52,53 и легкое 1.
Здесь мы описываем протокол, в котором ретиноидная аутофлуоресценция может быть использована в качестве основного признака для идентификации и сортировки клеток, содержащих ретиноиды легких, с помощью FACS. Обнаруженные флуоресцентные ретиноиды включают только ретинол и ретиниловые эфиры. Таким образом, сортировать можно только клетки, содержащие эти производные витамина А (в первую очередь ретиниловые эфиры). Кроме того, мы обеспечиваем дополнительное усовершенствование протокола, в рамках которого исследователи могут использовать дополнительные клеточно-специфические подходы к мечению для сужения клеточной специфичности. Это может быть достигнуто путем мечения ретиноидсодержащих клеток легких флюорохром-конъюгированными антителами и дополнительной сортировки1. В качестве альтернативы, дополнительная клеточно-специфическая маркировка клеток легких может быть достигнута in vivo путем экспрессии репортерных флуоресцентных белков с использованием клеточно-специфических Cre-рекомбиназных животных моделей, экспрессирующих Cre-рекомбиназу, после проверки эффективности экспрессии Cre и клеточной специфичности. Описанный здесь протокол подчеркивает использование экспрессии белка tdTomato в легочных фибробластах с помощью CO1a2 в качестве одного из многих вариантов этого подхода. Тем не менее, этот подход может быть применен к другим типам клеток легких, включая эндотелиальные, эпителиальные и миелоидные клетки, когда используется соответствующая модель экспрессии Cre.
Описанный протокол также может быть применен к выделениям клеток из поврежденных (воспаленных, фиброзных и т.д.) легких; Однако в этом случае следует учитывать несколько ограничений. Повреждения легких связаны с прогрессирующим снижением концентрации ретиноидов1, что, следовательно, может ограничивать применение данного протокола и снижать выход клеток. С другой стороны, повреждения легких связаны с активацией фибробластов и повышенной экспрессией белков внеклеточного матрикса, включая Col1a2. Учитывая, что экспрессия Cre управляется промотором Col1a2, экспрессия tdTomato может быть усилена, что влияет на количество клеток, экспрессирующих tdTomato, а также на интенсивность сигнала tdTomato в легких мышей F-tdT, которые использовались в нашем исследовании.
В совокупности описанный здесь протокол представляет собой конкретный и мощный инструмент для более глубокого понимания клеточных аспектов метаболизма ретиноидов в легких и липид-опосредованных клеточных коммуникаций in vivo.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была профинансирована грантом Национальных институтов здравоохранения/Национальным институтом сердца, легких и крови (NIH/NHLBI) R01 HL171112 (для I.S.), премией за развитие карьеры (для I.S.) от Центра Рутгерса по воздействию окружающей среды и болезням, финансируемым Национальными институтами здравоохранения/Национальным институтом наук об окружающей среде (NIH/NIEHS) P30 ES005022, и стартовые фонды от Ратгерса, Государственного университета Нью-Джерси (до I.S.). Авторы выражают признательность сотрудникам Общего ресурса иммунного мониторинга и проточной цитометрии в Институте рака Рутгерса (частично при финансовой поддержке NCI-CCSG P30CA072770-5920) за их вклад в работу, представленную в данной рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 10 mL serological pipette | Avantor/VWR | 76452-284 | |
| 100 µm strainer | Greiner Bio-One | 542000 | |
| 15 mL falcon tube | Corning | 352099 | |
| 40 µm strainer | Greiner Bio-One | 542040 | |
| 50 mL falcon tube | Corning | 352070 | |
| Cell culture dish, 35 mm ´ 10 mm | Corning | 430165 | |
| Cell sorting media | Gibco | A59688DJ | |
| Collagenase type IV | Worthington Biochemical Corporation | LS004188 | |
| Cytek Aurora Cell Sorter System | Cytek Biosciences | ||
| Dispase II | Sigma-Aldrich | D4693 | |
| DNase I | Sigma-Aldrich | DN25 | |
| Falcon brand 5-ml polypropylene round bottom tube, 12 mm ´ 75 mm | Corning | 352063 | |
| Falcon brand 5-ml polystyrene round-bottom tube with cell-strainer cap, 12 mm ´ 75 mm | Corning | 352235 | |
| FlowJo software | Becton Dickinson | flow cytometry software | |
| HBSS with Ca2+/Mg2+ | Gibco | 14925-092 | |
| HBSS without Ca2+/Mg2+ | Gibco | 14175-095 | |
| Nalgene Rapid-Flow Sterile Disposable Bottle Top Filters | ThermoFisher | 595-3320 | |
| Red Cell lysis buffer | Sigma-Aldrich | R7757 | |
| SpectroFlo CS software | Cytek Biosciences | Version 1.3.0 | |
| Surgical Design Royaltek Stainless Steel Surgical Scalpel Blades | Fisher Scientific | 22-079-683 | |
| SYTOX Green dead cell stain | Invitrogen | S34860 | |
| Tamoxifen | Sigma-Aldrich | T2859 |
Ссылки
- Shmarakov, I. O., et al. Retinoids stored locally in the lung are required to attenuate the severity of acute lung injury in male mice. Nat Commun. 14 (1), 851 (2023).
- Bogue, C. W., Jacobs, H. C., Dynia, D. W., Wilson, C. M., Gross, I. Retinoic acid increases surfactant protein mRNA in fetal rat lung in culture. Am J Physiol Lung Cell Mol Physiol. 271 (5), L862-L868 (1996).
- Ng-Blichfeldt, J. -. P., et al. Retinoic acid signaling balances adult distal lung epithelial progenitor cell growth and differentiation. EBioMedicine. 36, 461-474 (2018).
- Chen, F., et al. Prenatal retinoid deficiency leads to airway hyperresponsiveness in adult mice. J Clin Invest. 124 (2), 801-811 (2014).
- Esteban-Pretel, G., Marin, M. P., Renau-Piqueras, J., Barber, T., Timoneda, J. Vitamin A deficiency alters rat lung alveolar basement membrane: reversibility by retinoic acid. J Nutr Biochem. 21 (3), 227-236 (2010).
- Massaro, G. D., Massaro, D. Postnatal treatment with retinoic acid increases the number of pulmonary alveoli in rats. Am J Physiol. 270 (2 Pt 1), L305-L310 (1996).
- Hind, M., Maden, M. Retinoic acid induces alveolar regeneration in the adult mouse lung. Eur Respir J. 23 (1), 20-27 (2004).
- Belloni, P. N., Garvin, L., Mao, C. P., Bailey-Healy, I., Leaffer, D. Effects of all-trans-retinoic acid in promoting alveolar repair. Chest. 117 (5 Suppl 1), 235S-241S (2000).
- Veness-Meehan, K. A., Bottone, F. G., Stiles, A. D. Effects of retinoic acid on airspace development and lung collagen in hyperoxia-exposed newborn rats. Pediatr Res. 48 (4), 434-444 (2000).
- Cho, S. J., George, C. L., Snyder, J. M., Acarregui, M. J. Retinoic acid and erythropoietin maintain alveolar development in mice treated with an angiogenesis inhibitor. Am J Respir Cell Mol Biol. 33 (6), 622-628 (2005).
- Massaro, G. D., Massaro, D. Retinoic acid treatment abrogates elastase-induced pulmonary emphysema in rats. Nat Med. 3 (6), 675-677 (1997).
- Stinchcombe, S. V., Maden, M. Retinoic acid induced alveolar regeneration: critical differences in strain sensitivity. Am J Respir Cell Mol Biol. 38 (2), 185-191 (2008).
- Fraslon, C., Bourbon, J. R. Retinoids control surfactant phospholipid biosynthesis in fetal rat lung. Am J Physiol. 266 (6 Pt 1), L705-L712 (1994).
- Zachman, R. D. Role of vitamin A in lung development. J Nutr. 125 (6 Suppl), 1634s-1638s (1995).
- van Bennekum, A. M., et al. Lipoprotein lipase expression level influences tissue clearance of chylomicron retinyl ester. J Lipid Res. 40 (3), 565-574 (1999).
- Blaner, W. S., et al. Lipoprotein lipase hydrolysis of retinyl ester: possible implications for retinoid uptake by cells. J Biol Chem. 269 (24), 16559-16565 (1994).
- Trites, M. J., Febbraio, M., Clugston, R. D. Absence of CD36 alters systemic vitamin A homeostasis. Sci Rep. 10 (1), 20386 (2020).
- Wassef, L., Quadro, L. Uptake of dietary retinoids at the maternal-fetal barrier: in vivo evidence for the role of lipoprotein lipase and alternative pathways. J Biol Chem. 286 (37), 32198-32207 (2011).
- Spiegler, E., Kim, Y. -. K., Wassef, L., Shete, V., Quadro, L. Maternal-fetal transfer and metabolism of vitamin A and its precursor β-carotene in the developing tissues. Biochim Biophys Acta Mol Cell Biol Lipids. 1821 (1), 88-98 (2012).
- Kedishvili, N. Y. Enzymology of retinoic acid biosynthesis and degradation. J Lipid Res. 54 (7), 1744-1760 (2013).
- Channabasappa, S., Caldwell, S., Kanthan, R., Singh, B. Retinoid receptors are expressed in mouse and human lungs. Anat Rec. 305 (9), 2281-2289 (2022).
- Kimura, Y., et al. Retinoid receptors in the developing human lung. Clin Sci (Lond). 103 (6), 613-621 (2002).
- Yang, L., Naltner, A., Yan, C. Overexpression of dominant negative retinoic acid receptor alpha causes alveolar abnormality in transgenic neonatal lungs. Endocrinology. 144 (7), 3004-3011 (2003).
- Snyder, J. M., et al. Alveolarization in retinoic acid receptor-beta-deficient mice. Pediatr Res. 57 (3), 384-391 (2005).
- Gao, R. -. w., et al. Retinoic acid promotes primary fetal alveolar epithelial type II cell proliferation and differentiation to alveolar epithelial type I cells. In Vitro Cell Dev Biol Anim. 51 (5), 479-487 (2015).
- Dirami, G., et al. Lung retinol storing cells synthesize and secrete retinoic acid, an inducer of alveolus formation. Am J Physiol Lung Cell Mol Physiol. 286 (2), L249-L256 (2004).
- Massaro, G. D., Massaro, D., Chambon, P. Retinoic acid receptor-alpha regulates pulmonary alveolus formation in mice after, but not during, perinatal period. Am J Physiol Lung Cell Mol Physiol. 284 (2), L431-L433 (2003).
- Massaro, G. D., et al. Retinoic acid receptor-beta: an endogenous inhibitor of the perinatal formation of pulmonary alveoli. Physiol Genomics. 4 (1), 51-57 (2000).
- McGowan, S., et al. Mice bearing deletions of retinoic acid receptors demonstrate reduced lung elastin and alveolar numbers. Am J Respir Cell Mol Biol. 23 (2), 162-167 (2000).
- Yan, C., et al. Retinoic acid-receptor activation of SP-B gene transcription in respiratory epithelial cells. Am J Physiol Lung Cell Mol Physiol. 275 (2), L239-L246 (1998).
- Ghaffari, M., Whitsett, J. A., Yan, C. Inhibition of hSP-B promoter in respiratory epithelial cells by a dominant negative retinoic acid receptor. Am J Physiol Lung Cell Mol Physiol. 276 (3), L398-L404 (1999).
- Yang, L., et al. Synergy between signal transducer and activator of transcription 3 and retinoic acid receptor-α in regulation of the surfactant protein b gene in the lung. Mol Endocrinol. 18 (6), 1520-1532 (2004).
- Metzler, M. D., Snyder, J. M. Retinoic acid differentially regulates expression of surfactant-associated proteins in human fetal lung. Endocrinology. 133 (5), 1990-1998 (1993).
- George, T. N., Snyder, J. M. Regulation of surfactant protein gene expression by retinoic acid metabolites. Pediatr Res. 41 (5), 692-701 (1997).
- Naltner, A., Ghaffari, M., Whitsett, J. A., Yan, C. Retinoic acid stimulation of the human surfactant protein B promoter is thyroid transcription factor 1 site-dependent. J Biol Chem. 275 (1), 56-62 (2000).
- Ng-Blichfeldt, J. P., et al. Deficient retinoid-driven angiogenesis may contribute to failure of adult human lung regeneration in emphysema. Thorax. 72 (6), 510-521 (2017).
- Lochbaum, R., et al. Retinoic acid signalling adjusts tight junction permeability in response to air-liquid interface conditions. Cell Signal. 65, 109421 (2020).
- Mamidi, S., Hofer, T. P., Hoffmann, R., Ziegler-Heitbrock, L., Frankenberger, M. All-trans retinoic acid up-regulates prostaglandin-e synthase expression in human macrophages. Immunobiology. 217 (6), 593-600 (2012).
- Hashimoto, S., et al. Retinoic acid differentially regulates interleukin-1beta and interleukin-1 receptor antagonist production by human alveolar macrophages. Leuk Res. 22 (11), 1057-1061 (1998).
- Li, S., Lei, Y., Lei, J., Li, H. Alltrans retinoic acid promotes macrophage phagocytosis and decreases inflammation via inhibiting CD14/TLR4 in acute lung injury. Mol Med Rep. 24 (6), (2021).
- Nagy, N. E., et al. Storage of vitamin A in extrahepatic stellate cells in normal rats. J Lipid Res. 38 (4), 645-658 (1997).
- Thompson, K. C., et al. Primary rat and mouse hepatic stellate cells express the macrophage inhibitor cytokine interleukin-10 during the course of activation in vitro. Hepatology. 28 (6), 1518-1524 (1998).
- Zhang, X. Y., Sun, C. K., Wheatley, A. M. A novel approach to the quantification of hepatic stellate cells in intravital fluorescence microscopy of the liver using a computerized image analysis system. Microvasc Res. 60 (3), 232-240 (2000).
- D'Ambrosio, D. N., et al. Distinct populations of hepatic stellate cells in the mouse liver have different capacities for retinoid and lipid storage. PLoS One. 6 (9), e24993 (2011).
- Apte, M. V., et al. Periacinar stellate shaped cells in rat pancreas: identification, isolation, and culture. Gut. 43 (1), 128-133 (1998).
- Kim, N., et al. Formation of vitamin A lipid droplets in pancreatic stellate cells requires albumin. Gut. 58 (10), 1382-1390 (2009).
- Kida, Y., et al. Characterization of vitamin A-storing cells in mouse fibrous kidneys using Cygb/STAP as a marker of activated stellate cells. Arch Histol Cytol. 70 (2), 95-106 (2007).
- Ogawa, T., et al. Identification of vitamin A-free cells in a stellate cell-enriched fraction of normal rat liver as myofibroblasts. Histochem Cell Biol. 127 (2), 161-174 (2007).
- Tacke, F., Weiskirchen, R. Update on hepatic stellate cells: pathogenic role in liver fibrosis and novel isolation techniques. Expert Rev Gastroenterol Hepatol. 6 (1), 67-80 (2012).
- Bartneck, M., et al. Isolation and time lapse microscopy of highly pure hepatic stellate cells. Anal Cell Pathol (Amst). , (2015).
- Balaphas, A., et al. Optimized isolation and characterization of C57BL/6 mouse hepatic stellate cells. Cells. 11 (9), (2022).
- Kubota, H., Yao, H. L., Reid, L. M. Identification and characterization of vitamin A-storing cells in fetal liver: implications for functional importance of hepatic stellate cells in liver development and hematopoiesis. Stem Cells. 25 (9), 2339-2349 (2007).
- Larsen, A. K., et al. Autofluorescence in freshly isolated adult human liver sinusoidal cells. Eur J Histochem. 65 (4), (2021).
- Shaner, N. C., Patterson, G. H., Davidson, M. W. Advances in fluorescent protein technology. J Cell Sci. 120 (24), 4247-4260 (2007).
- National Research Council. . Guide for the Care and Use of Laboratory Animals. , (2011).
- O'Byrne, S. M., et al. Retinoid absorption and storage is impaired in mice lacking lecithin: retinol acyltransferase (LRAT). J Biol Chem. 280 (42), 35647-35657 (2005).
- McGowan, S. E., Torday, J. S. The pulmonary lipofibroblast (lipid interstitial cell) and its contributions to alveolar development. Annu Rev Physiol. 59, 43-62 (1997).
- McGowan, S. E. The lipofibroblast: more than a lipid-storage depot. Am J Physiol Lung Cell Mol Physiol. 316 (5), L869-L871 (2019).
- Meyer, K. A., Popper, H., Ragins, A. B. Histologic distribution of vitamin A in biopsy specimens of the liver. Arch Surg. 43 (3), 376-385 (1941).
- Popper, H. L. Histological demonstration of vitamin A in rats by means of fluorescence microscopy. Proc Soc Exp Biol Med. 43, 133-136 (1940).
- Van Exan, R. J., Hardy, M. H. Localization of vitamin A by autofluorescence during induced metaplastic changes in cultures of skin. In Vitro. 15 (8), 631-640 (1979).
- Schweigert, F. J., Siegling, C., Tzimas, G., Seeger, J., Nau, H. Distribution of endogenous retinoids, retinoid binding proteins (RBP, CRABPI) and nuclear retinoid X receptor beta (RXRbeta) in the porcine embryo. Reprod Nutr Dev. 42 (4), 285-294 (2002).
- Wake, K. Perisinusoidal stellate cells (fat-storing cells, interstitial cells, lipocytes), their related structure in and around the liver sinusoids, and vitamin A-storing cells in extrahepatic organs. Int Rev Cytol. 66, 303-353 (1980).
- Senoo, H., Kojima, N., Sato, M. Vitamin A-storing cells (stellate cells). Vitam Horm. 75, 131-159 (2007).
- Senoo, H., et al. Hepatic stellate cell (vitamin A-storing cell) and its relative--past, present and future. Cell Biol Int. 34 (12), 1247-1272 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены