Method Article
Isolierung von Lungen-Retinoid-haltigen Zellen durch Zellsortierung
In diesem Artikel
Zusammenfassung
Das im Folgenden beschriebene Protokoll ist eine einfache und effektive Methode zur Isolierung von Retinoid-haltigen Zellen aus hochgradig heterogenen Lungenzellpopulationen unter Verwendung spezifischer Retinoid-Autofluoreszenz und unter Anwendung einer fluoreszenzaktivierten Zellsortierung.
Zusammenfassung
Retinoide (Vitamin A und seine Metaboliten) sind ein essentieller Lipidbestandteil der alveolären Mikroumgebung, und ein zelltypspezifischer Retinoidstoffwechsel ist erforderlich, um die funktionelle Gesundheit der sich entwickelnden und erwachsenen Lunge zu erhalten. Lungenzellen nutzen spezifische Signalwege, die eine effiziente Aufnahme von zirkulierenden Retinoiden aus dem Blut als Retinol (ROH) ermöglichen, gefolgt von einer intrazellulären schrittweisen Umwandlung von ROH in die transkriptionell aktive Retinoidspezies, die all-trans-Retinsäure (ATRA). Die ATRA-vermittelte (oder Retinoid-vermittelte) Signalgebung ist entscheidend für die Regulierung der Lungenalveolarisierung, der Surfactant-Produktion, der Angiogenese, der Permeabilität und der Immunität. Wichtig ist, dass bestimmte Lungenzellen, einschließlich Fibroblasten, Retinoide in Form von Retinylestern (RE) akkumulieren können, die als ROH gelagert oder weiter mobilisiert werden können, um sie bei Bedarf auf die Nachbarzellen zu übertragen. Lungenretinoid-haltige Zellen können isoliert und aus der Einzelzellsuspension verdauter Lungen entnommen werden, indem Retinoid-Autofluoreszenz (die Emission bei 455 nm bei Anregung bei 350 nm) und fluoreszenzaktivierte Zellsortierung (FACS) verwendet wird. Die zusätzliche zellspezifische in vivo Markierung von Lungenzellen mit rot fluoreszierendem Protein ermöglicht die Isolierung und Sammlung spezifischer Retinoid-haltiger Lungenzellpopulationen. Die gesammelten Zellen können direkt analysiert oder kultiviert werden, um weitere Analysen der Zellmorphologie, der Genexpression und der Reaktionsfähigkeit auf pharmakologische Manipulationen durchzuführen. Diese Technik der Isolierung und Anwendung ist wichtig für Tiermodellstudien zur Lungengesundheit und Lungenschädigung, um einen tieferen Einblick in die zellulären Aspekte des Retinoidstoffwechsels in der Lunge und der lipidvermittelten zellulären Kommunikation zu erhalten.
Einleitung
Retinoide (Vitamin A und seine Metaboliten) sind ein essentieller Lipidbestandteil der alveolären Mikroumgebung, und ein zelltypspezifischer Retinoidstoffwechsel und -signalweg sind erforderlich, um die funktionelle Gesundheit der sich entwickelnden und erwachsenen Lunge zu erhalten 1,2,3,4,5,6,7,8,9,10,11 ,12,13,14. Lungenzellen nutzen spezifische Signalwege, die eine effiziente Aufnahme von zirkulierenden Retinoiden aus der Nahrung aus dem Blut als Retinol (ROH)15,16,17,18,19 ermöglichen, gefolgt von einer intrazellulären schrittweisen Umwandlung von ROH in die transkriptionell aktive Retinoidspezies, die all-trans-Retinsäure (ATRA)20. Die ATRA-vermittelte (oder Retinoid-vermittelte) Signalübertragung wird durch die Interaktion von ATRA mit seinen drei unterschiedlichen verwandten nuklearen Hormonrezeptoren, den Retinsäurerezeptoren (RARα, RARβ und RARγ21,22), erreicht und ist entscheidend für die Regulierung der Lungenalveolarisierung 23,24,25,26,27,28,29, der Tensidproduktion30,31,32,33,34,35, Angiogenese36, Permeabilität37 und Immunität 38,39,40. Wichtig ist, dass bestimmte Lungenzellen, insbesondere Lungenfibroblasten, Retinoide in Form von Retinylestern (RE) akkumulieren können, die als ROH gelagert oder weiter mobilisiert werden können, um sie bei Bedarf auf die Nachbarzellen zu übertragen1.
Die Komplexität des Retinoidstoffwechsels und der Signalübertragung sowie die zelluläre Komplexität der Lunge machen Studien zur Erforschung des Retinoidstoffwechsels in der Lunge in vivo zu einer Herausforderung. Wir haben ein einfaches und robustes Protokoll für die Isolierung von Retinoid-haltigen Zellen (Abbildung 1) aus sehr heterogenen Lungenzellpopulationen unter Verwendung spezifischer Retinoid-Autofluoreszenz (die Emission bei 455 nm bei Anregung bei 350 nm) und durch den Einsatz von fluoreszenzaktivierter Zellsortierung (FACS) skizziert. Das Protokoll erfordert keine zusätzliche Zellmarkierung, mit Ausnahme der Viabilitätsfärbung, wenn das Ziel der Studie darin besteht, primäre lebende Lungenzellen auf der Grundlage ihrer Fähigkeit, Retinoide zu speichern, zu isolieren und zu charakterisieren. Dies reduziert die Vorbereitungszeit für die Zellsortierung erheblich, macht zusätzliches Färben überflüssig und ermöglicht die Isolierung hoher Ausbeuten lebensfähiger Primärzellen. Besteht das Ziel der Studie jedoch darin, spezifische Lungenzellpopulationen (Fibroblasten, Endothel-, Epithel- oder Immunzellen) zu isolieren und zu charakterisieren, kann nach der Markierung der sortierten Retinoid-haltigen Zellen mit zellspezifischen Antikörpern eine zusätzliche Zellsortierung durchgeführt werden.
Die Retinoid-Autofluoreszenz wurde in veröffentlichten Studien verwendet, um die Identität von Retinoid-haltigen Zellen zu ermitteln und/oder die Häufigkeit dieser Zellen in der Leber 41,42,43,44, der Bauchspeicheldrüse45,46, den Nieren 41,47 und der Lunge zu quantifizieren41. Darüber hinaus berichteten mehrere Forschungsgruppen über die Verwendung von Retinoid-Fluoreszenz zur Isolierung durch FACS und zur Untersuchung primärer Retinoid-haltiger Zellen aus lebenden Geweben, einschließlich Leber 44,48,49,50,51,52,53 und Lunge 1. Im aktuellen Protokoll zeigen wir, wie spezifische Zellpopulationen in vivo markiert werden können, bevor Retinoid-haltige Zellen mit tdTomato (rot fluoreszierendes Protein) isoliert werden. Die spektralen Eigenschaften von tdTomato (die Emission bei 581 nm bei Anregung bei 554 nm54) und die Helligkeit beeinträchtigen die Retinoid-Autofluoreszenz nicht und machen es daher bequem, die Zellspezifität während der Sortierung zu erreichen. Angesichts der entscheidenden Rolle des unbeeinträchtigten Retinoidstoffwechsels und der Signalübertragung innerhalb der normalen alveolären Mikroumgebung1 ist die beschriebene Technik der Lungenzellisolierung ein nützliches Werkzeug in Tiermodellstudien zur Lungengesundheit und -erkrankung, um einen tieferen Einblick in die zellulären Aspekte des Retinoidstoffwechsels in der Lunge und der lipidvermittelten zellulären Kommunikation in vivo zu gewinnen.
Protokoll
Alle beschriebenen Verfahren und Versuche mit Mäusen wurden mit Genehmigung des Institutional Animal Care and Use Committee (IACUC) der Rutgers University (IACUC ID: PROTO202200111) gemäß den Kriterien des von der National Academy of Sciences erstellten Leitfadens für die Pflege und Verwendung von Labortieren55 durchgeführt.
1. Überlegungen und Vorbereitungen für den Versuch
- Tierhaltung und Manipulationen
HINWEIS: In den Studien können drei Monate alte (10-12 Wochen alte) männliche und weibliche Mäuse verwendet werden. In den beschriebenen Experimenten wurden Lecithin:Retinol-Acyltransferase-defiziente Mäuse (Lrat-defizient, Lrat-/- Mäuse56) auf einem C57BL/6J-genetischen Hintergrund und altersangepasste Wurfgeschwister (Wildtyp, Lrat+/+ Mäuse) verwendet. Mäuse, die das tdTomato-Gen in Fibroblasten exprimieren (F-tdT-Mäuse), wurden durch Kreuzung von Mäusen erzeugt, die eine tdTomato-Reporterkassette beherbergten (B6. Cg-Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J, Jackson Lab Stamm #007914) mit Col1a2-CreER-Mäusen (B6. Cg-Tg(Col1a2-Cre/ERT,-ALPP)7Cpd/2J, Jackson Lab Stamm #029567).- Verwenden Sie das Cre-exprimierende Mausmodell, eine der vielen verfügbaren Optionen, um die Zielzellpopulation in vivo zu markieren.
HINWEIS: Abhängig von der Wahl der Zielzelle, der Cre-Expression, der Effizienz der Cre-vermittelten Rekombination und der Zellspezifität können die Forscher jedes zuverlässige Cre-exprimierende Mausmodell verwenden. - Verwenden Sie die Expression des tdTomato-Transgens (nach Tamoxifen-Behandlung wie unten beschrieben), um Col1a2+ -Fibroblasten zu markieren, gefolgt von ihrer Isolierung aus Einzelzellsuspensionen der verdauten Lunge, wie unten beschrieben.
- Verwenden Sie das Cre-exprimierende Mausmodell, eine der vielen verfügbaren Optionen, um die Zielzellpopulation in vivo zu markieren.
- Cre-vermittelte Rekombination und Transgenaktivierung in vivo
- Induzieren Sie die Cre-Expression bei F-tdT-Mäusen durch intraperitoneale (IP) Injektion von 2 mg Tamoxifen einmal alle 24 Stunden an insgesamt 5 aufeinanderfolgenden Tagen.
- Desinfizieren Sie die Injektionsstelle vor der Injektion mit 70 % Ethanol. Verwenden Sie die Mäuse 1 Monat nach der letzten Tamoxifen-Injektion für Experimente.
- Überprüfen Sie die Wirksamkeit der Cre-Rekombination vor den Sortierversuchen. Bestätigung der effektiven Cre-Rekombination und tdTomato-Expression durch Isolierung der Zielzellpopulation von Lungenfibroblasten aus den mit Tamoxifen behandelten F-tdT-Mäusen unter Verwendung von anti-Pdgfrα-Magnetbeads und magnetisch-aktivierter Zellsortierung (MACS).
- Aufbereitung von Lösungen, Kunststoff- und Glaswaren
HINWEIS: Für die unten beschriebenen Verfahren sollten aseptische Techniken befolgt werden. Die Eingriffe, die Lösungsvorbereitungen, Gewebeverdauung und Zellisolierung umfassen, sollten unter der laminaren Haube durchgeführt werden. Die Lösungen sollten durch Filtration mit einem 0,2-μm-Filter sterilisiert werden; Sowohl chirurgische Instrumente als auch Laborgeräte sollten durch Autoklavieren sterilisiert werden.- Bereiten Sie unter der laminaren Haube Hanks' ausgewogene Salzlösung (HBSS), kalzium- und magnesiumfrei (HBSS ohne Ca2+/Mg2+, enthalten 5,3 mM KCl, 0,4 mM KH2PO4, 4,2 mM NaHCO3, 137,9 mM NaCl, 0,3 mM Na2HPO4, 5,6 mM D-Glucose) für die Lungenperfusion vor (5 mL pro Maus). Sterilisieren Sie die Lösung mit einem 0,2-μm-Filter und füllen Sie die Spritze mit der Lösung.
- Bereiten Sie unter der laminaren Haube die ausgewogene Salzlösung von Hanks mit Calcium- und Magnesium (HBSS mit Ca2+/Mg2+, enthält 1,3 mM CaCl2, 0,5 MgCl2·6H2O, 0,4 mM MgSO4·7H2O, 5,3 mM KCl, 0,4 mM KH2PO4, 4,2 mM NaHCO3, 137,9 mM NaCl, 0,3 mM Na2HPO4, 5,6 mM D-Glucose), enthalten 0,3 mg/ml Typ-IV-Kollagenase und 1 mg/ml Dispase für die Lungenperfusion (10 mL pro Maus). Sterilisieren Sie die Lösung mit einem 0,2-μm-Filter und füllen Sie die Spritze mit der Lösung.
- Bereiten Sie unter der laminaren Haube HBSS mit Ca2+/Mg2+ vor, das 0,3 mg/ml Typ-IV-Kollagenase, 1 mg/ml Dispase und 5 mg/ml DNase I für die Lungenverdauung enthält (10 ml pro Maus). Sterilisieren Sie die Lösung mit einem 0,2-μm-Filter und füllen Sie die Spritze mit der Lösung.
- Füllen Sie unter der laminaren Haube eine Zellkulturschale (35 mm 10 mm, eine Schale pro entnommener Lunge von einer Maus) mit 2 mL sterilem HBSS mit Ca2+/Mg2+. Stellen Sie die Schale(n), die HBSS mit Ca2+/Mg 2+ enthalten, auf Eis.
2. Lungenperfusion, Verdauung und Entnahme von einzelliger Suspension
- Betäuben Sie die Maus durch Verabreichung eines Anästhesiecocktails mit 10 mg/ml Ketamin und 2 mg/ml Xylazin in einer Dosis von 0,01 ml/g Körpergewicht per IP-Injektion.
- Stellen Sie sicher, dass sich die Maus in einem tiefen Zustand der Bewusstlosigkeit befindet, indem Sie eine Zehenkneifreaktion beurteilen. Entfernen Sie die losen Haare und sichtbaren Schmutz/Ablagerungen von der Operationsstelle, schneiden Sie sie ab und wischen Sie sie mit 70%igem Alkohol zur Desinfektion sauber.
- Öffnen Sie mit sterilen chirurgischen Instrumenten die Bauch- und Brusthöhle. Schneide die Rippen und das Zwerchfell auf, um die Lunge und das Herz freizulegen.
HINWEIS: Dies garantiert einen sofortigen Tod, da die Thorakotomie zu einem Atemstillstand führt, während die Maus betäubt wird. Bei ordnungsgemäßer Durchführung dauert dieser Teil des Eingriffs bis zu 3 Minuten vom Beginn des Eingriffs bis zur Thorakotomie, gefolgt vom Tod des Tieres. - Schneiden Sie die untere Hohlvene ab und tragen Sie ein saugfähiges Pad auf, um das freigesetzte Blut aufzunehmen.
- Perfundieren Sie die Lunge in situ durch den rechten Ventrikel des Herzens mit einer 10-ml-Spritze mit einer 25 G x 1"-Nadel, die mit 5 mL sterilem HBSS ohne Ca2+/Mg2+ gefüllt ist. Gelingt die Durchblutung, wird das Lungengewebe weiß.
- Perfundieren Sie die Lunge in situ mit einer 10-ml-Spritze mit einer 25 G x 1" Nadel, die mit 10 mL sterilem HBSS mit Ca2+/Mg2+ gefüllt ist, das Typ-IV-Kollagenase (0,3 mg/ml) und Dispase (1 mg/ml) enthält.
- Entnehmen Sie die Lunge und geben Sie sie in eine Zellkulturschale (35 mm x 10 mm) mit 2 mL sterilem HBSS mit Ca2+/Mg2+.
- Spülen Sie die Lungen unter der laminaren Haube aus und zerkleinern Sie sie mit einer sterilen chirurgischen Klinge (#20, passt auf Griff #4). Übertragen Sie die gehackte Lunge in ein 15-ml-Röhrchen, indem Sie die ersten 5 ml HBSS mit Ca2+/Mg2+ mit 0,3 mg/ml Kollagenase Typ IV, 1 mg/ml Dispase und 5 mg/ml DNase I in das gehackte Gewebe geben und mit einer serologischen 10-ml-Pipette übertragen. Sammeln und übertragen Sie die restlichen gehackten Gewebereste, indem Sie die Zellkulturschale mit den restlichen 5 ml HBSS mit Ca2+/Mg2+ waschen, die 0,3 mg/ml Kollagenase Typ IV, 1 mg/ml Dispase und 5 mg/ml DNase I enthalten.
- Inkubieren Sie das zerkleinerte Lungengewebe in HBSS mit Ca2+/Mg2+ , das 0,3 mg/ml Typ-IV-Kollagenase, 1 mg/ml Dispase und 5 mg/ml DNase I enthält, auf einem rotierenden Schüttler, der 45 Minuten lang bei 37 °C gehalten wird. In jedem der drei 15-Minuten-Intervalle wird das zerkleinerte Gewebe unter der laminaren Haube 10 Mal durch eine serologische 10-ml-Pipette geleitet, um die Zellen besser zu dissoziieren.
- Die resultierende Zellsuspension wird durch ein 100-μm-Sieb geleitet, um einzelne Zellen in ein 50-ml-Röhrchen mit 20 ml kalter Lebendzell-Bildgebungslösung (physiologische Kochsalzlösung mit 20 mM HEPES, pH 7,4) zu sammeln, die weniger als 5 % fötales Rinderserum (FBS) enthält. Die Zellen werden durch Zentrifugation bei 500 g für 10 min bei 4 °C gesammelt.
- Aspirieren Sie den Überstand und resuspendieren Sie das Zellpellet in 1 ml Lysingpuffer für rote Blutkörperchen und lassen Sie das Röhrchen 5 Minuten lang bei Raumtemperatur (RT) stehen, um die Erythrozyten zu eliminieren. Fügen Sie 20 ml kalte Lebendzell-Bildgebungslösung hinzu, die weniger als 5 % FBS enthält. Die Zellen werden durch Zentrifugation bei 500 g für 10 min bei 4 °C gesammelt.
- Aspirieren Sie den Überstand und resuspendieren Sie das Zellpellet in 20 ml kalter Lebendzell-Bildgebungslösung, die weniger als 5 % FBS enthält. Die resultierende Zellsuspension wird durch ein 40-μm-Sieb geleitet, um einzelne Zellen in ein 50-ml-Röhrchen zu füllen, das 20 ml kalte Lebendzell-Bildgebungslösung mit weniger als 5 % FBS enthält. Die Zellen werden durch Zentrifugation bei 500 g für 10 min bei 4 °C gesammelt.
- Aspirieren Sie den Überstand und resuspendieren Sie das Zellpellet in 10 ml kalter Lebendzell-Bildgebungslösung, die weniger als 5 % FBS enthält. Zählen Sie die Zellen und stellen Sie die Zellkonzentration auf ~5-10 x 106 Zellen/ml ein.
3. Isolierung von Retinoid-haltigen Lungenzellen mittels Fluoreszenz-aktivierter Zellsortierung (FACS)
- Nehmen Sie ein Aliquot der Zellsuspension und legen Sie es beiseite, um es als ungefärbte Gating-Kontrolle zu verwenden. Geben Sie den Viabilitätsfarbstoff SYTOX Green in die verbleibende Zellsuspension (1:1000 Verdünnung, Endkonzentration 30 nM).
- Führen Sie die Zellsuspensionen durch den Filter, der an dem 5 mL (12 x 75 mm) Sammelrohr aus Polystyrol befestigt ist.
- Fahren Sie mit der FACS-Zellisolierung fort, indem Sie lebende, einzelne Retinoid-haltige Zellen basierend auf ihrer Emission bei 455 nm sortieren. Führen Sie eine sequenzielle Singulett-Unterscheidung mit einem Diagramm für die Vorwärtsstreuung durch (Vorwärtsstreuhöhe/FSC-H versus Vorwärtsstreufläche/FSC-A). Schließen Sie tote Zellen durch Streucharakteristik (Seitenstreuung) und Färbung mit SYTOX Green aus.
- Gate, sortieren und sammeln Sie einzelne, lebende, Retinoid-haltige Zellen durch Emission bei 455 nm nach Anregung bei 350 nm.
HINWEIS: Mit dem beschriebenen Verfahren können etwa 5,105 Retinoid-haltige Lungenzellen aus einer Mauslunge entnommen werden. - Führen Sie FACS-Datenanalysen mit Durchflusszytometrie-Software durch.
Ergebnisse
Isolierung von Retinoid-haltigen Zellen der Lunge
Mauslungen (von Lrat+/+ und Lrat-/-) Mäusen wurden enzymatisch verdaut, und Einzelzellsuspensionen wurden hergestellt und gemäß dem oben beschriebenen Verfahren einer FACS unterzogen. Die Zellsortierung und Datenerfassung wurde auf einem Cytek Aurora™ Zellsortiersystem durchgeführt, das von der SpectroFlo CS-Software Version 1.3.0 mit einer 100-μm-Düse und einem Druck von 15 psi betrieben wurde. Zunächst wurden Plots für Vorwärtsstreuung (Vorwärtsstreuhöhe/FSC-H versus Vorwärtsstreufläche/FSC-A) angewendet, um Einzelzellen (Singuletts) auszuwählen und zu gattern, gefolgt von der Unterscheidung toter Zellen mittels Seitenstreuung und SYTOX-Grün-Färbung (Abbildung 2). Um schließlich die Zielpopulation von Retinoid-haltigen Zellen zu sortieren, wurde eine ausgeprägte Population lebender Einzelzellen mit hoher Autofluoreszenz bei λ = 455 nm ausgewählt (Abbildung 2A). Um die Spezifität des angewandten Gangbildes und des Gesamtansatzes zu bestätigen, wurde die Lungenzellsuspension der Lrat-/- Mäuse als Negativkontrolle zur Einstellung des Gatings der Retinoid-Autofluoreszenz verwendet. Lrat-/- Mäuse sind nicht in der Lage, REs zu synthetisieren und können Retinoide nicht in ihrer Lunge akkumulieren1. Bemerkenswert ist, dass bei Verwendung der identischen FACS-Gating-Strategie eine eindeutige Zellpopulation mit hoher Autofluoreszenz bei λ = 455 nm in der Einzelzellsuspension aus der Lrat-/- Lunge nicht nachgewiesen werden kann (Abbildung 2B).
Nach der Entnahme können primäre Retinoid-haltige Zellen in der Lunge direkt analysiert oder kultiviert werden, um weitere Analysen der Retinoidkonzentrationen, der Zellmorphologie, der Genexpression und des Ansprechens auf pharmakologische Manipulationen durchzuführen (Abbildung 1).
Mit diesem Verfahren konnten wir bereits früher zeigen, dass unter den retinoidhaltigen Zellen der Lunge unterschiedliche Zellpopulationen vorhanden sind1. Insbesondere zeigten wir durch die Einzelzell-RNA-Sequenzierung von FACS-gesammelten Retinoid-haltigen Zellen, dass unter diesen Zellen die Stromazellgruppe (83 % der insgesamt gesammelten Zellen) am häufigsten vorkam, gefolgt von endothelialen (7 % der insgesamt gesammelten Zellen), epithelialen (5 % der insgesamt gesammelten Zellen) und myeloischen Zellen (etwa 5 % der insgesamt gesammelten Zellen)1. Die Daten zur Heterogenität isolierter retinoidhaltiger Lungenzellen verringern nicht die Spezifität des beschriebenen Verfahrens; Vielmehr unterstreichen diese Daten eine bisher ungeahnte Komplexität des Retinoid-Metabolismus in der adulten Lunge, die phänotypisch vielfältige Zellen und eine umfangreiche Retinoid-vermittelte zelluläre Kommunikation umfasst.
Isolierung von Col1a2+-Retinoid-haltigen Zellen in der Lunge
Angesichts des Vorhandenseins heterogener Zellpopulationen unter isolierten Retinoid-haltigen Zellen möchten sich die Forscher möglicherweise auf die Untersuchung eines spezifischen Lungenzelltyps konzentrieren, der am Retinoid-Metabolismus beteiligt ist. Zu diesem Zweck kann eine zusätzliche in vivo zellspezifische Markierung der Zielzellpopulation durchgeführt werden.
Unter den höchst heterogenen Lungenzellpopulationen ist eine Subpopulation von mesenchymalen Lungenstromazellen mit fibroblastischen Eigenschaften, die als interstitielle Lungenlipidzellen oder Lungenlipofibroblasten bezeichnet werden, der vorherrschende Zelltyp, der in der Lage ist, Retinoide zu akkumulieren 1,57,58. Um eine Subpopulation von Lungenfibroblasten in vivo zu markieren, wurden Mäuse, die das tdTomato-Gen in Fibroblasten exprimieren (F-tdT-Mäuse), durch Kreuzung von Mäusen, die eine tdTomato-Reporterkassette beherbergen, mit Col1a2-CreER-Mäusen erzeugt. Die Cre-Expression in F-tdT-Mäusen wurde durch ip-Injektion von 2 mg Tamoxifen einmal alle 24 Stunden an insgesamt 5 aufeinanderfolgenden Tagen induziert; Einen Monat nach der letzten Tamoxifen-Injektion wurden die Mäuse für Experimente verwendet. Dieser Ansatz ermöglichte die Markierung von Col1a2+-Fibroblasten mit tdTomato-Protein und deren Isolierung aus Einzelzellsuspensionen der verdauten Lunge unter Verwendung eines oben beschriebenen Verfahrens. Der Ansatz ermöglicht es, lebende (SYTOX Green negative), einzelne tdTomato+ Zellen zu erfassen (Abbildung 3). Als nächstes kann eine Subpopulation von Retinoid-haltigen Zellen von allen gefangenen tdTomato+-Zellen unter Verwendung einer auf Retinoid-Autofluoreszenz basierenden Gating-Strategie (Abbildung 3), wie oben beschrieben, getrennt werden. Darüber hinaus ermöglicht dieses Verfahren die anschließende Sortierung und getrennte Sammlung verschiedener Populationen von tdTomato+-Zellen basierend auf der Intensität des Retinoid-Fluoreszenzsignals in hohe, mittlere und niedrige Retinoid-haltige Zellsubpopulationen.
Die effektive Cre-Rekombination und die tdTomato-Expression wurden durch Isolierung der Zielzellpopulation von Lungenfibroblasten aus den mit Tamoxifen behandelten F-tdT-Mäusen (Abbildung 4A) unter Verwendung von anti-Pdgfrα-Magnetbeads und magnetisch aktivierter Zellsortierung (MACS) bestätigt. Darüber hinaus wurde eine HPLC-Analyse durchgeführt, um das Vorhandensein von Retinoiden in den sortierten Retinoid-haltigen Zellen zu bestätigen (Abbildung 4B).
Nach der Entnahme können primäre Retinoid-haltige Fibroblasten in der Lunge direkt analysiert oder kultiviert werden, um weitere Analysen der Retinoidkonzentration, der Zellmorphologie, der Genexpression und des Ansprechens auf pharmakologische Manipulationen durchzuführen. Zum Beispiel ist eines der charakteristischen Merkmale von Lungenretinoid-haltigen Fibroblasten, die aus einem Wildtyp-Tier (Lrat+/+) isoliert wurden, das Vorhandensein von Lipidtröpfchen, die in kultivierten Zellen mit Hilfe von immunzytochemischen Standardtechniken sichtbar gemacht werden können (Abbildung 4C).
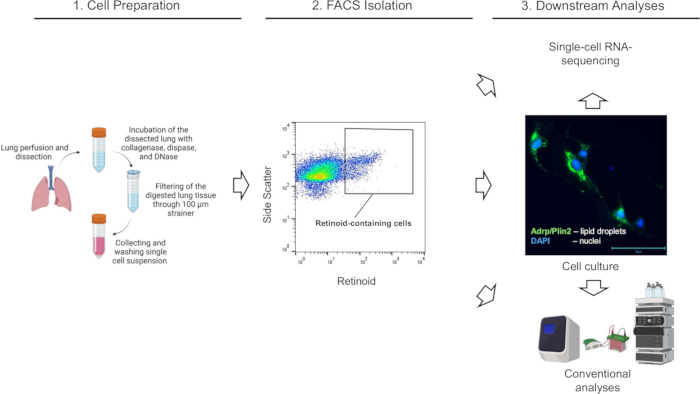
Abbildung 1: Eine schematische Darstellung des beschriebenen experimentellen Arbeitsablaufs. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
(Erstellt mit Biorender.com)

Abbildung 2: FACS-Isolierung von Retinoid-haltigen Zellen in der Lunge. (A) Eine Gating-Strategie zur Sortierung einzelner, lebender, Retinoid-haltiger Zellen (definiert durch den umschlossenen Bereich) unter Verwendung der Emission bei λ = 455 nm nach Anregung bei λ = 350 nm aus Lungenzellsuspensionen, die von einer Wildtyp-Maus mit C57Bl6/J (Lrat+/+) isoliert wurden. (B) Gating-Strategie zum Sortieren einzelner, lebender, Retinoid-haltiger Zellen unter Verwendung von Emission bei λ = 455 nm nach Anregung bei λ = 350 nm, angewendet auf Lungenzellsuspensionen, die aus einer Lrat-/- Maus isoliert wurden; der umschlossene Bereich zeigt keine nachgewiesenen Retinoid-haltigen Zellen in der Lrat-/- Lunge; Die Zahlen geben den Prozentsatz der geschlossenen Zellen an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
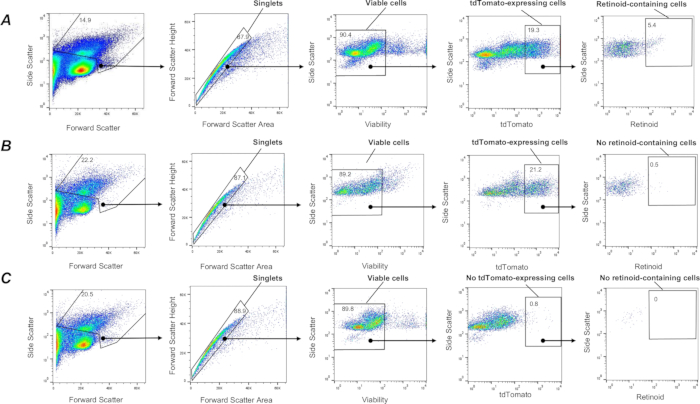
Abbildung 3: FACS-Isolierung von Retinoid-haltigen Col1a2+-Fibroblasten in der Lunge. (A) Gating-Strategie zum Sortieren einzelner, lebender, tdTomato+ Retinoid-haltiger Zellen (definiert durch den umschlossenen Bereich) unter Verwendung einer Emission bei λ = 455 nm bei Anregung bei λ = 350 nm aus Lungenzellsuspensionen, die von einer F-TdTom-Maus auf einem genetischen Wildtyp-Hintergrund (C57Bl6/J) isoliert wurden. Panel (B) Eine Gating-Strategie zum Sortieren einzelner, lebender, tdTomato+ Retinoid-haltiger Zellen (definiert durch den umschlossenen Bereich) unter Verwendung einer Emission bei λ = 455 nm nach Anregung bei λ = 350 nm, angewendet auf Lungenzellsuspensionen, die von einer F-TdTom-Maus auf einem Lrat-/- (C57Bl6/J)-Hintergrund isoliert wurden; Der umschlossene Bereich zeigt keine nachgewiesenen Retinoid-haltigen Zellen in der Lunge von F-TdTom-Mäusen auf einem Lrat-/- Hintergrund. (C) Gating-Strategie zum Sortieren einzelner, lebender, tdTomato+ Retinoid-haltiger Zellen (definiert durch den umschlossenen Bereich) unter Verwendung einer Emission bei λ = 455 nm nach Anregung bei λ = 350 nm, angewendet auf Lungenzellsuspensionen, die aus einer tdTomato-Maus isoliert wurden; Der umzäunte Bereich zeigt keine erkannte tdTomato+; Die Zahlen geben den Prozentsatz der geschlossenen Zellen an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
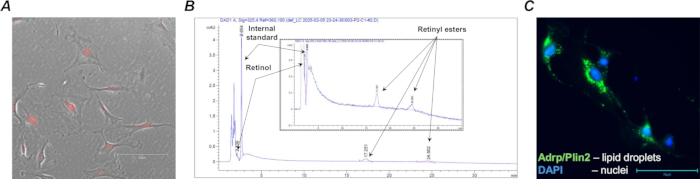
Abbildung 4: Retinoid-haltige Col1a2+ / tdTomato+ Fibroblasten. (A) Ein repräsentatives Mikrofoto von MACS-isolierten Wildtyp-(Lrat+/+) Col1a2+ / tdTomato+ Lungenzellen in Kultur; die kultivierten Zellen mit charakteristischer tdTomato-Fluoreszenz wurden mit dem TX Red-Filter und der 20-fachen Vergrößerung erfasst; Der Maßstabsbalken beträgt 150 μm. (B) Ein HPLC-Profil (mit eingefügter Vergrößerung), das die charakteristischen Peaks und Retentionszeiten von Retinoidspezies (Retinol und Retinylester) zeigt, die aus 1,105 sortierten retinoidhaltigen Zellen extrahiert wurden. (C) Ein repräsentatives Mikrofoto von FACS-isolierten Wildtyp-Col1a2+ / tdTomato+-Lungenzellen in Kultur, gefärbt auf Lipidtröpfchen-assoziiertes Fettdifferenzierungsprotein (Adrp/Perilipin 2); die gefärbten Zellen wurden mit einem GFP-Filter und einer 40-fachen Vergrößerung eingefangen; Der Maßstabsbalken beträgt 75 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Fähigkeit des Vitamin-A-Nachweises in menschlichen und tierischen Geweben und dessen histologische Visualisierung mittels Fluoreszenzmikroskopie wurde bereits in den 1940er Jahren erstmals berichtet59,60. Das Phänomen der Retinoid-Autofluoreszenz wurde dann erfolgreich auf Studien angewendet, die darauf abzielten, hohe Konzentrationen von Vitamin A in Geweben in vitro zu lokalisieren 61 und die Morphogenese von tierischen embryonalen Geweben62 mittels Fluoreszenzmikroskopie zu charakterisieren. Später wurde beobachtet und experimentell bestätigt, dass die ausgeprägte Autofluoreszenz zellulärer Retinoide (Anregung bei λ = 350 nm mit der charakteristischen blau-grünen Emission bei λ = 455 nm) mit spezifischen Zelltypen assoziiert ist und daher zur Isolierung und Charakterisierung dieser Zellen angewendet werden kann 63,64,65.
Die Retinoid-Autofluoreszenz wurde in veröffentlichten Studien verwendet, um die Identität von Retinoid-haltigen Zellen zu ermitteln und/oder die Häufigkeit dieser Zellen in der Leber 41,42,43,44, der Bauchspeicheldrüse45,46, den Nieren 41,47 und der Lunge zu quantifizieren41. Darüber hinaus berichteten mehrere Forschungsgruppen über die Verwendung von Retinoid-Fluoreszenz zur Isolierung durch FACS und zur Untersuchung primärer Retinoid-haltiger Zellen aus lebenden Geweben, einschließlich Leber 44,48,49,50,51,52,53 und Lunge 1.
Hier beschreiben wir das Protokoll, bei dem die Retinoid-Autofluoreszenz als primäres Merkmal zur Identifizierung und Sortierung von Retinoid-haltigen Zellen in der Lunge mit FACS verwendet werden kann. Zu den nachgewiesenen fluoreszierenden Retinoiden gehören nur Retinol und Retinylester. So können nur Zellen sortiert werden, die diese Vitamin-A-Derivate (hauptsächlich Retinylester) enthalten. Darüber hinaus bieten wir eine zusätzliche Weiterentwicklung des Protokolls an, bei der die Forscher zusätzliche zellspezifische Markierungsansätze verwenden können, um die Zellspezifität einzugrenzen. Dies kann durch die Markierung von Lungenretinoid-haltigen Zellen mit Fluorochrom-konjugierten Antikörpern und eine zusätzliche Sortierungerreicht werden 1. Alternativ kann eine zusätzliche zellspezifische Markierung von Lungenzellen in vivo erreicht werden, indem Reporterfluoreszenzproteine unter Verwendung zellspezifischer Cre-Rekombinase-exprimierender Tiermodelle exprimiert werden, nachdem die Effizienz der Cre-Expression und die Zellspezifität validiert wurden. Das hier beschriebene Protokoll unterstreicht die Verwendung der Co1a2-gesteuerten Expression des tdTomato-Proteins in Lungenfibroblasten als eine der vielen Optionen dieses Ansatzes. Dieser Ansatz kann jedoch auf andere Lungenzelltypen angewendet werden, einschließlich Endothel-, Epithel- und myeloische Zellen, wenn ein geeignetes Cre-Expressionsmodell verwendet wird.
Das beschriebene Protokoll kann auch auf Zellisolierungen aus der verletzten (entzündeten, fibrotischen usw.) Lunge angewendet werden; In diesem Fall sollten jedoch mehrere Einschränkungen berücksichtigt werden. Lungenverletzungen sind mit einem fortschreitenden Abfall der Retinoidkonzentrationen1 verbunden, was daher die Anwendung dieses Protokolls einschränken und die Zellausbeute verringern kann. Auf der anderen Seite sind Lungenverletzungen mit der Aktivierung von Fibroblasten und einer erhöhten Expression von extrazellulären Matrixproteinen, einschließlich Col1a2, verbunden. Da die Cre-Expression durch den Col1a2-Promotor gesteuert wird, kann die tdTomato-Expression erhöht werden, was die Anzahl der Zellen, die tdTomato exprimieren, sowie die Intensität des tdTomato-Signals in der Lunge der F-tdT-Mäuse, die in unserer Studie verwendet wurden, beeinflusst.
Zusammengenommen bietet das hier beschriebene Protokoll ein spezifisches und leistungsfähiges Werkzeug, um tiefere Einblicke in die zellulären Aspekte des Retinoidstoffwechsels in der Lunge und der lipidvermittelten zellulären Kommunikation in vivo zu gewinnen.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde finanziert durch ein Stipendium der National Institutes of Health/National Heart, Lung, and Blood Institute (NIH/NHLBI) R01 HL171112 (an I.S.), einen Karriereentwicklungspreis (an I.S.) des Rutgers Center for Environmental Exposures & Disease, finanziert von den National Institutes of Health/National Institute of Environmental Health Sciences (NIH/NIEHS) P30 ES005022, und Start-up-Fonds von Rutgers, The State University of New Jersey (an I.S.). Die Autoren danken den Mitarbeitern der Immune Monitoring and Flow Cytometry Shared Resource am Rutgers Cancer Institute (teilweise unterstützt mit Mitteln des NCI-CCSG P30CA072770-5920) für ihre Beiträge zu der in diesem Manuskript vorgestellten Arbeit.
Materialien
| Name | Company | Catalog Number | Comments |
| 10 mL serological pipette | Avantor/VWR | 76452-284 | |
| 100 µm strainer | Greiner Bio-One | 542000 | |
| 15 mL falcon tube | Corning | 352099 | |
| 40 µm strainer | Greiner Bio-One | 542040 | |
| 50 mL falcon tube | Corning | 352070 | |
| Cell culture dish, 35 mm ´ 10 mm | Corning | 430165 | |
| Cell sorting media | Gibco | A59688DJ | |
| Collagenase type IV | Worthington Biochemical Corporation | LS004188 | |
| Cytek Aurora Cell Sorter System | Cytek Biosciences | ||
| Dispase II | Sigma-Aldrich | D4693 | |
| DNase I | Sigma-Aldrich | DN25 | |
| Falcon brand 5-ml polypropylene round bottom tube, 12 mm ´ 75 mm | Corning | 352063 | |
| Falcon brand 5-ml polystyrene round-bottom tube with cell-strainer cap, 12 mm ´ 75 mm | Corning | 352235 | |
| FlowJo software | Becton Dickinson | flow cytometry software | |
| HBSS with Ca2+/Mg2+ | Gibco | 14925-092 | |
| HBSS without Ca2+/Mg2+ | Gibco | 14175-095 | |
| Nalgene Rapid-Flow Sterile Disposable Bottle Top Filters | ThermoFisher | 595-3320 | |
| Red Cell lysis buffer | Sigma-Aldrich | R7757 | |
| SpectroFlo CS software | Cytek Biosciences | Version 1.3.0 | |
| Surgical Design Royaltek Stainless Steel Surgical Scalpel Blades | Fisher Scientific | 22-079-683 | |
| SYTOX Green dead cell stain | Invitrogen | S34860 | |
| Tamoxifen | Sigma-Aldrich | T2859 |
Referenzen
- Shmarakov, I. O., et al. Retinoids stored locally in the lung are required to attenuate the severity of acute lung injury in male mice. Nat Commun. 14 (1), 851 (2023).
- Bogue, C. W., Jacobs, H. C., Dynia, D. W., Wilson, C. M., Gross, I. Retinoic acid increases surfactant protein mRNA in fetal rat lung in culture. Am J Physiol Lung Cell Mol Physiol. 271 (5), L862-L868 (1996).
- Ng-Blichfeldt, J. -. P., et al. Retinoic acid signaling balances adult distal lung epithelial progenitor cell growth and differentiation. EBioMedicine. 36, 461-474 (2018).
- Chen, F., et al. Prenatal retinoid deficiency leads to airway hyperresponsiveness in adult mice. J Clin Invest. 124 (2), 801-811 (2014).
- Esteban-Pretel, G., Marin, M. P., Renau-Piqueras, J., Barber, T., Timoneda, J. Vitamin A deficiency alters rat lung alveolar basement membrane: reversibility by retinoic acid. J Nutr Biochem. 21 (3), 227-236 (2010).
- Massaro, G. D., Massaro, D. Postnatal treatment with retinoic acid increases the number of pulmonary alveoli in rats. Am J Physiol. 270 (2 Pt 1), L305-L310 (1996).
- Hind, M., Maden, M. Retinoic acid induces alveolar regeneration in the adult mouse lung. Eur Respir J. 23 (1), 20-27 (2004).
- Belloni, P. N., Garvin, L., Mao, C. P., Bailey-Healy, I., Leaffer, D. Effects of all-trans-retinoic acid in promoting alveolar repair. Chest. 117 (5 Suppl 1), 235S-241S (2000).
- Veness-Meehan, K. A., Bottone, F. G., Stiles, A. D. Effects of retinoic acid on airspace development and lung collagen in hyperoxia-exposed newborn rats. Pediatr Res. 48 (4), 434-444 (2000).
- Cho, S. J., George, C. L., Snyder, J. M., Acarregui, M. J. Retinoic acid and erythropoietin maintain alveolar development in mice treated with an angiogenesis inhibitor. Am J Respir Cell Mol Biol. 33 (6), 622-628 (2005).
- Massaro, G. D., Massaro, D. Retinoic acid treatment abrogates elastase-induced pulmonary emphysema in rats. Nat Med. 3 (6), 675-677 (1997).
- Stinchcombe, S. V., Maden, M. Retinoic acid induced alveolar regeneration: critical differences in strain sensitivity. Am J Respir Cell Mol Biol. 38 (2), 185-191 (2008).
- Fraslon, C., Bourbon, J. R. Retinoids control surfactant phospholipid biosynthesis in fetal rat lung. Am J Physiol. 266 (6 Pt 1), L705-L712 (1994).
- Zachman, R. D. Role of vitamin A in lung development. J Nutr. 125 (6 Suppl), 1634s-1638s (1995).
- van Bennekum, A. M., et al. Lipoprotein lipase expression level influences tissue clearance of chylomicron retinyl ester. J Lipid Res. 40 (3), 565-574 (1999).
- Blaner, W. S., et al. Lipoprotein lipase hydrolysis of retinyl ester: possible implications for retinoid uptake by cells. J Biol Chem. 269 (24), 16559-16565 (1994).
- Trites, M. J., Febbraio, M., Clugston, R. D. Absence of CD36 alters systemic vitamin A homeostasis. Sci Rep. 10 (1), 20386 (2020).
- Wassef, L., Quadro, L. Uptake of dietary retinoids at the maternal-fetal barrier: in vivo evidence for the role of lipoprotein lipase and alternative pathways. J Biol Chem. 286 (37), 32198-32207 (2011).
- Spiegler, E., Kim, Y. -. K., Wassef, L., Shete, V., Quadro, L. Maternal-fetal transfer and metabolism of vitamin A and its precursor β-carotene in the developing tissues. Biochim Biophys Acta Mol Cell Biol Lipids. 1821 (1), 88-98 (2012).
- Kedishvili, N. Y. Enzymology of retinoic acid biosynthesis and degradation. J Lipid Res. 54 (7), 1744-1760 (2013).
- Channabasappa, S., Caldwell, S., Kanthan, R., Singh, B. Retinoid receptors are expressed in mouse and human lungs. Anat Rec. 305 (9), 2281-2289 (2022).
- Kimura, Y., et al. Retinoid receptors in the developing human lung. Clin Sci (Lond). 103 (6), 613-621 (2002).
- Yang, L., Naltner, A., Yan, C. Overexpression of dominant negative retinoic acid receptor alpha causes alveolar abnormality in transgenic neonatal lungs. Endocrinology. 144 (7), 3004-3011 (2003).
- Snyder, J. M., et al. Alveolarization in retinoic acid receptor-beta-deficient mice. Pediatr Res. 57 (3), 384-391 (2005).
- Gao, R. -. w., et al. Retinoic acid promotes primary fetal alveolar epithelial type II cell proliferation and differentiation to alveolar epithelial type I cells. In Vitro Cell Dev Biol Anim. 51 (5), 479-487 (2015).
- Dirami, G., et al. Lung retinol storing cells synthesize and secrete retinoic acid, an inducer of alveolus formation. Am J Physiol Lung Cell Mol Physiol. 286 (2), L249-L256 (2004).
- Massaro, G. D., Massaro, D., Chambon, P. Retinoic acid receptor-alpha regulates pulmonary alveolus formation in mice after, but not during, perinatal period. Am J Physiol Lung Cell Mol Physiol. 284 (2), L431-L433 (2003).
- Massaro, G. D., et al. Retinoic acid receptor-beta: an endogenous inhibitor of the perinatal formation of pulmonary alveoli. Physiol Genomics. 4 (1), 51-57 (2000).
- McGowan, S., et al. Mice bearing deletions of retinoic acid receptors demonstrate reduced lung elastin and alveolar numbers. Am J Respir Cell Mol Biol. 23 (2), 162-167 (2000).
- Yan, C., et al. Retinoic acid-receptor activation of SP-B gene transcription in respiratory epithelial cells. Am J Physiol Lung Cell Mol Physiol. 275 (2), L239-L246 (1998).
- Ghaffari, M., Whitsett, J. A., Yan, C. Inhibition of hSP-B promoter in respiratory epithelial cells by a dominant negative retinoic acid receptor. Am J Physiol Lung Cell Mol Physiol. 276 (3), L398-L404 (1999).
- Yang, L., et al. Synergy between signal transducer and activator of transcription 3 and retinoic acid receptor-α in regulation of the surfactant protein b gene in the lung. Mol Endocrinol. 18 (6), 1520-1532 (2004).
- Metzler, M. D., Snyder, J. M. Retinoic acid differentially regulates expression of surfactant-associated proteins in human fetal lung. Endocrinology. 133 (5), 1990-1998 (1993).
- George, T. N., Snyder, J. M. Regulation of surfactant protein gene expression by retinoic acid metabolites. Pediatr Res. 41 (5), 692-701 (1997).
- Naltner, A., Ghaffari, M., Whitsett, J. A., Yan, C. Retinoic acid stimulation of the human surfactant protein B promoter is thyroid transcription factor 1 site-dependent. J Biol Chem. 275 (1), 56-62 (2000).
- Ng-Blichfeldt, J. P., et al. Deficient retinoid-driven angiogenesis may contribute to failure of adult human lung regeneration in emphysema. Thorax. 72 (6), 510-521 (2017).
- Lochbaum, R., et al. Retinoic acid signalling adjusts tight junction permeability in response to air-liquid interface conditions. Cell Signal. 65, 109421 (2020).
- Mamidi, S., Hofer, T. P., Hoffmann, R., Ziegler-Heitbrock, L., Frankenberger, M. All-trans retinoic acid up-regulates prostaglandin-e synthase expression in human macrophages. Immunobiology. 217 (6), 593-600 (2012).
- Hashimoto, S., et al. Retinoic acid differentially regulates interleukin-1beta and interleukin-1 receptor antagonist production by human alveolar macrophages. Leuk Res. 22 (11), 1057-1061 (1998).
- Li, S., Lei, Y., Lei, J., Li, H. Alltrans retinoic acid promotes macrophage phagocytosis and decreases inflammation via inhibiting CD14/TLR4 in acute lung injury. Mol Med Rep. 24 (6), (2021).
- Nagy, N. E., et al. Storage of vitamin A in extrahepatic stellate cells in normal rats. J Lipid Res. 38 (4), 645-658 (1997).
- Thompson, K. C., et al. Primary rat and mouse hepatic stellate cells express the macrophage inhibitor cytokine interleukin-10 during the course of activation in vitro. Hepatology. 28 (6), 1518-1524 (1998).
- Zhang, X. Y., Sun, C. K., Wheatley, A. M. A novel approach to the quantification of hepatic stellate cells in intravital fluorescence microscopy of the liver using a computerized image analysis system. Microvasc Res. 60 (3), 232-240 (2000).
- D'Ambrosio, D. N., et al. Distinct populations of hepatic stellate cells in the mouse liver have different capacities for retinoid and lipid storage. PLoS One. 6 (9), e24993 (2011).
- Apte, M. V., et al. Periacinar stellate shaped cells in rat pancreas: identification, isolation, and culture. Gut. 43 (1), 128-133 (1998).
- Kim, N., et al. Formation of vitamin A lipid droplets in pancreatic stellate cells requires albumin. Gut. 58 (10), 1382-1390 (2009).
- Kida, Y., et al. Characterization of vitamin A-storing cells in mouse fibrous kidneys using Cygb/STAP as a marker of activated stellate cells. Arch Histol Cytol. 70 (2), 95-106 (2007).
- Ogawa, T., et al. Identification of vitamin A-free cells in a stellate cell-enriched fraction of normal rat liver as myofibroblasts. Histochem Cell Biol. 127 (2), 161-174 (2007).
- Tacke, F., Weiskirchen, R. Update on hepatic stellate cells: pathogenic role in liver fibrosis and novel isolation techniques. Expert Rev Gastroenterol Hepatol. 6 (1), 67-80 (2012).
- Bartneck, M., et al. Isolation and time lapse microscopy of highly pure hepatic stellate cells. Anal Cell Pathol (Amst). , (2015).
- Balaphas, A., et al. Optimized isolation and characterization of C57BL/6 mouse hepatic stellate cells. Cells. 11 (9), (2022).
- Kubota, H., Yao, H. L., Reid, L. M. Identification and characterization of vitamin A-storing cells in fetal liver: implications for functional importance of hepatic stellate cells in liver development and hematopoiesis. Stem Cells. 25 (9), 2339-2349 (2007).
- Larsen, A. K., et al. Autofluorescence in freshly isolated adult human liver sinusoidal cells. Eur J Histochem. 65 (4), (2021).
- Shaner, N. C., Patterson, G. H., Davidson, M. W. Advances in fluorescent protein technology. J Cell Sci. 120 (24), 4247-4260 (2007).
- National Research Council. . Guide for the Care and Use of Laboratory Animals. , (2011).
- O'Byrne, S. M., et al. Retinoid absorption and storage is impaired in mice lacking lecithin: retinol acyltransferase (LRAT). J Biol Chem. 280 (42), 35647-35657 (2005).
- McGowan, S. E., Torday, J. S. The pulmonary lipofibroblast (lipid interstitial cell) and its contributions to alveolar development. Annu Rev Physiol. 59, 43-62 (1997).
- McGowan, S. E. The lipofibroblast: more than a lipid-storage depot. Am J Physiol Lung Cell Mol Physiol. 316 (5), L869-L871 (2019).
- Meyer, K. A., Popper, H., Ragins, A. B. Histologic distribution of vitamin A in biopsy specimens of the liver. Arch Surg. 43 (3), 376-385 (1941).
- Popper, H. L. Histological demonstration of vitamin A in rats by means of fluorescence microscopy. Proc Soc Exp Biol Med. 43, 133-136 (1940).
- Van Exan, R. J., Hardy, M. H. Localization of vitamin A by autofluorescence during induced metaplastic changes in cultures of skin. In Vitro. 15 (8), 631-640 (1979).
- Schweigert, F. J., Siegling, C., Tzimas, G., Seeger, J., Nau, H. Distribution of endogenous retinoids, retinoid binding proteins (RBP, CRABPI) and nuclear retinoid X receptor beta (RXRbeta) in the porcine embryo. Reprod Nutr Dev. 42 (4), 285-294 (2002).
- Wake, K. Perisinusoidal stellate cells (fat-storing cells, interstitial cells, lipocytes), their related structure in and around the liver sinusoids, and vitamin A-storing cells in extrahepatic organs. Int Rev Cytol. 66, 303-353 (1980).
- Senoo, H., Kojima, N., Sato, M. Vitamin A-storing cells (stellate cells). Vitam Horm. 75, 131-159 (2007).
- Senoo, H., et al. Hepatic stellate cell (vitamin A-storing cell) and its relative--past, present and future. Cell Biol Int. 34 (12), 1247-1272 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten