Method Article
細胞選別による肺レチノイド含有細胞の単離
要約
以下に記載するプロトコルは、特異的なレチノイド自家蛍光を利用し、蛍光活性化細胞ソーティングを採用することにより、非常に不均一な肺細胞集団からレチノイド含有細胞を単離する簡単で効果的な方法です。
要約
レチノイド(ビタミンAとその代謝物)は、肺胞微小環境の必須脂質成分であり、細胞型特異的なレチノイド代謝は、発育中および成人の肺の機能的健康を維持するために必要です。肺細胞は特定の経路を利用するため、血液中の循環レチノイドをレチノール(ROH)として効率的に取り込み、その後、ROHを細胞内で段階的に転写活性なレチノイド種であるオールトランスレチノイン酸(ATRA)に変換することができます。ATRAを介した(またはレチノイドを介した)シグナル伝達は、肺胞形成、界面活性剤産生、血管新生、透過性、および免疫の調節に重要です。重要なことは、線維芽細胞を含む特定の肺細胞は、レチニルエステル(RE)の形でレチノイドを蓄積する可能性があり、それを保存したり、必要に応じてROHとしてさらに動員して隣接する細胞に移すことができます。肺レチノイド含有細胞は、レチノイド自家蛍光(350 nmでの励起に対して455 nmでの発光)を利用し、蛍光活性化セルソーティング(FACS)を使用することにより、消化された肺の単一細胞懸濁液から単離および収集できます。赤色蛍光タンパク質による肺細胞の細胞特異的 なin vivo 標識により、特定のレチノイド含有肺細胞集団を単離および収集することができます。採取した細胞は、細胞の形態、遺伝子発現、薬理学的操作に対する応答性をさらに解析するために、直接解析または培養することができます。この単離と応用の技術は、肺の健康と肺損傷の動物モデル研究にとって重要であり、肺のレチノイド代謝と脂質媒介性細胞通信の細胞的側面についてより深い洞察を得ることができます。
概要
レチノイド(ビタミンAとその代謝産物)は、肺胞微小環境の必須脂質成分であり、細胞型特異的なレチノイド代謝とシグナル伝達は、発生中および成人の肺の機能的健康を維持するために必要である1,2,3,4,5,6,7,8,9,10,11 、12、13、14。肺細胞は特定の経路を利用し、血中循環する食事由来のレチノイドをレチノール(ROH)15,16,17,18,19として効率的に取り込み、続いてROHを細胞内で段階的にROHから転写活性なレチノイド種であるオールトランスレチノイン酸(ATRA)に変換することを可能にします20.ATRA媒介(またはレチノイド媒介)シグナル伝達は、ATRAと3つの異なる同族核ホルモン受容体、レチノイン酸受容体(RARα、RARβ、およびRARγ21,22)との相互作用によって達成され、肺胞形成23,24,25,26,27,28,29、界面活性剤産生30の調節に重要である、31,32,33,34,35、血管新生36、透過性37、および免疫38,39,40。重要なことに、特定の肺細胞、特に肺線維芽細胞は、レチニルエステル(RE)の形でレチノイドを蓄積することができ、これは保存されるか、または必要に応じて隣接する細胞に移すためにROHとしてさらに動員することができる1。
レチノイド代謝とシグナル伝達の複雑さ、および肺の細胞の複雑さにより、in vivo での肺のレチノイド代謝の調査を目的とした研究は困難になっています。私たちは、特異的なレチノイド自家蛍光(350 nmで励起すると455 nmで発光する)を利用し、蛍光活性化セルソーティング(FACS)を採用することにより、非常に不均一な肺細胞集団からレチノイド含有細胞(図1)を単離するためのシンプルで堅牢なプロトコルを概説しました。このプロトコルでは、研究の目標がレチノイドを貯蔵する能力に基づいて初代生肺細胞を分離し、特徴付けることである場合、生存率染色を除いて、追加の細胞標識は必要ありません。これにより、細胞ソーティングの調製時間が大幅に短縮され、追加の染色が不要になり、生細胞の高収率の単離が可能になります。ただし、研究の目標が特定の肺細胞集団(線維芽細胞、内皮細胞、上皮細胞、または免疫細胞)を単離して特徴付けることである場合、選別されたレチノイド含有細胞を細胞特異的抗体で標識した後、追加の細胞選別を実行できます。
レチノイド自家蛍光は、レチノイド含有細胞の同一性を確立するため、および/または肝臓41、42、43、44、膵臓45、46、腎臓41、47、および肺41におけるこれらの細胞の存在量を定量化するために、公開された研究で使用されてきた.さらに、いくつかの研究グループは、レチノイド蛍光を使用してFACSによって単離し、肝臓44、48、49、50、51、52、53 、肺1などの生体組織から初代レチノイド含有細胞を研究したことを報告しています。現在のプロトコルでは、tdTomato(赤色蛍光タンパク質)を使用してレチノイド含有細胞を単離する前に、特定の細胞集団を in vivo で標識する方法を示します。tdTomatoのスペクトル特性(554 nmでの励起に対する581 nmでの発光54)および輝度は、レチノイド自家蛍光を妨げないため、ソーティング中に細胞特異性を達成するのに便利です。正常な肺胞微小環境1におけるレチノイド代謝とシグナル伝達が損なわれない重要な役割を考えると、記載されている肺細胞単離技術は、肺の健康と疾患の動物モデル研究において、肺のレチノイド代謝の細胞的側面と in vivoでの脂質媒介性細胞通信についてより深い洞察を得るための有用なツールです。
プロトコル
マウスを含むすべての記載された手順および実験は、全米科学アカデミーが作成した実験動物のケアおよび使用に関するガイド55に概説されている基準に従って、ラトガース大学の動物管理および使用委員会(IACUC)(IACUC ID:PROTO202200111)の承認を得て実施されました。
1. 実験の検討事項と準備
- 畜産と操作
注:生後3か月(10〜12週齢)の雄マウスと雌マウスを研究に使用できます。記載された実験では、C57BL/6J遺伝的背景を持つレシチン:レチノールアシルトランスフェラーゼ欠損マウス(Lrat欠損、Lrat-/-マウス56)および年齢一致同腹仔(野生型、Lrat+/+マウス)を用いた。tdTomatoレポーターカセット(B6.Cg-Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J, Jackson Lab strain #007914) とCol1a2-CreERマウス (B6.Cg-Tg(Col1A2-Cre/ERT,-ALPP)7Cpd/2J, ジャクソンラボ株 #029567).- in vivoで標的細胞集団を標識するための多くの利用可能なオプションの1つであるCre発現マウスモデルを採用します。
注:標的細胞の選択、Cre発現、Cre媒介組換えの効率、および細胞特異性に応じて、研究者は任意の信頼性の高いCre発現マウスモデルを利用できます。 - tdTomato導入遺伝子発現(後述のタモキシフェン処理時)を使用して Col1a2+ 線維芽細胞を標識し、続いて以下に説明するように消化された肺の単一細胞懸 ?? 液から単離します。.
- in vivoで標的細胞集団を標識するための多くの利用可能なオプションの1つであるCre発現マウスモデルを採用します。
- Creを介した組換えとin vivo導入遺伝子活性化
- 2 mg のタモキシフェンを 24 時間ごとに 1 回、合計 5 日間連続して腹腔内 (IP) 注射することにより、F-tdT マウスに Cre 発現を誘導します。
- 注射前に70%エタノールで注射部位を消毒してください。マウスを実験に使用して、最終的なタモキシフェン注射の1か月後。
- 選別実験の前にCre組換えの有効性を確認してください。タモキシフェン処理F-tdTマウスから抗Pdgfrα 磁気ビーズと磁気活性化セルソーティング(MACS)を用いて肺線維芽細胞の標的細胞集団を単離することにより、Cre組換えとtdTomatoの発現が効果的であることを確認しました。
- 溶液の調製、プラスチックおよびガラス製品
注:以下に説明する手順では、無菌技術に従う必要があります。溶液調製、組織消化、および細胞単離を含む手順は、層流フードの下で行う必要があります。溶液は、0.2μmフィルターを使用したろ過により滅菌する必要があります。手術器具や実験器具は、オートクレーブ滅菌する必要があります。- 層流フードの下で、カルシウムおよびマグネシウムを含まないハンクス平衡塩溶液(HBSS、Ca2+/Mg2+を含まないHBSS、5.3 mM KCl、0.4 mM KH2PO4、4.2 mM NaHCO3、137.9 mM NaCl、0.3 mM Na2HPO4、5.6 mM D-グルコースを含む)を肺灌流用(マウスあたり5 mL)に調製します。0.2 μmフィルターを使用して溶液を滅菌し、シリンジに溶液を充填します。
- 層流フードの下で、カルシウムとマグネシウム(Ca2 + / Mg2 +のHBSS、1.3 mM CaCl2、0.5 MgCl2を含むHBSS)を含むハンクスの平衡塩溶液を準備します。6H2O, 0.4 mM MgSO4·7H2O、5.3 mM KCl、0.4 mM KH2PO4、4.2 mM NaHCO3、137.9 mM NaCl、0.3 mM Na2HPO4、5.6 mM D-Glucose)、0.3 mg/mL の IV 型コラゲナーゼと 1 mg/mL の肺灌流用ディスパーゼを含む (マウスあたり 10 mL)。0.2 μmフィルターを使用して溶液を滅菌し、シリンジに溶液を充填します。
- 層状フードの下で、0.3 mg/mL の IV 型コラゲナーゼ、1 mg/mL のディスパーゼ、および 5 mg/mL の肺消化用 DNase I を含む Ca2+/Mg2+ で HBSS を調製します (マウスあたり 10 mL)。0.2 μmフィルターを使用して溶液を滅菌し、シリンジに溶液を充填します。
- 層流フードの下に、細胞培養ディッシュ(35 mm 10 mm、マウス1匹から採取した肺1枚につき1ディッシュ)に、Ca2+/Mg2+の滅菌HBSS2 mLを入れます。Ca2 + / Mg2 + のHBSSを含む皿を氷の上に置きます。
2. 肺灌流、消化、および単一細胞懸濁液の採取
- 10 mg/mL ケタミンと 2 mg/mL キシラジンを含む 10 mg/mL キシラジンを 0.01 mL/g 体重の用量で IP 注射してマウスに麻酔をかけます。
- マウスが深い意識不明の状態にあることを確認するために、つま先のつま先つまみの反応を評価します。手術部位から抜け毛や目に見える汚れ/破片を取り除き、消毒のために70%アルコールを使用して手術部位をクリップして拭き取ります。
- 滅菌済みの手術器具を使用して、腹腔と胸腔を開きます。肋骨と横隔膜を切って、肺と心臓を露出させます。
注:これにより、マウスが麻酔されている間、開胸術により呼吸が停止するため、即死が保証されます。適切に行われた場合、手順のこの部分は、手順の開始から開胸術、その後の動物の死まで最大3分かかります。 - 下大静脈を切開し、放出された血液を吸収するために吸収パッドを塗布します。
- Ca2+/Mg2+を含まない5 mLの滅菌HBSSを充填した25 G X 1インチの針を備えた10 mLシリンジを使用して、心臓の右心室を通じて肺をその場で灌流します。灌流が成功すると、肺組織は白くなります。
- IV型コラゲナーゼ(0.3 mg/mL)およびディスパーゼ(1 mg/mL)を含むCa2+/Mg2+を含む10 mLの滅菌HBSSを充填した25 G X 1インチ針を備えた10 mLシリンジを使用して、in situで肺を灌流します。
- 肺を取り出し、Ca2+/Mg2+を含む2 mLの滅菌HBSSを入れた細胞培養皿(35 mm X 10 mm)に移します。
- 層状フードの下で、肺をすすぎ、滅菌外科用ブレード(#20、ハンドル#4に適合)を使用して肺を細かく刻みます。0.3 mg/mL の IV 型コラゲナーゼ、1 mg/mL のディスパーゼ、5 mg/mL の DNase I を含む Ca2+/Mg2+ を含む HBSS の最初の 5 mL をミンチ組織に加え、10 mL 血清ピペットを使用して移すことにより、ミンチした肺を 15 mL チューブに移します。0.3 mg/mLのIV型コラゲナーゼ、1 mg/mLのディスパーゼ、および5 mg/mLのDNase Iを含むCa2+/Mg2+ を含む残りの5 mLのHBSSで細胞培養皿を洗浄することにより、残りのミンチ組織残渣を回収して移します。
- 0.3 mg/mLのIV型コラゲナーゼ、1 mg/mLのディスパーゼ、および5 mg/mLのDNase Iを含むCa2+/Mg2+ を含むHBSSで、37°Cに45分間維持した回転式シェーカーで、ミンチした肺組織をインキュベートします。3回の15分間隔のそれぞれで、層状フードの下で、ミンチ組織を10mLの血清ピペットに10回通過させ、細胞をよりよく解離させます。
- 得られた細胞懸濁液を100 μmストレーナに通し、20 mLの冷生細胞イメージング溶液(20 mM HEPESを含む生理食塩水、pH 7.4)を含む50 mLチューブに単一細胞を回収し、5%未満のウシ胎児血清(FBS)を含有します。細胞を500 g で4°Cで10分間遠心分離して回収します。
- 上清を吸引し、細胞ペレットを赤血球溶解バッファー1 mLに再懸濁し、チューブを室温(RT)で5分間放置して赤血球を除去します。5% FBS 未満の 20 mL のコールド ライブ セル イメージング ソリューションを添加します。細胞を500 g で4°Cで10分間遠心分離して回収します。
- 上清を吸引し、5% FBS 未満の 20 mL の冷たい生細胞イメージング溶液に細胞ペレットを再懸濁します。得られた細胞懸濁液を40 μmのストレーナに通し、5% FBS未満の20 mLの冷生細胞イメージング溶液を含む50 mLのチューブに単一細胞を回収します。細胞を500 g で4°Cで10分間遠心分離して回収します。
- 上清を吸引し、5% FBS 未満の 10 mL の冷たい生細胞イメージング溶液に細胞ペレットを再懸濁します。細胞をカウントし、細胞濃度を ~5-10 x 106 cells/mL に調整します。
3. Fluorescence Activated Cell Sorting (FACS) によるレチノイド含有肺細胞の単離
- 細胞懸濁液のアリコートを取り出し、染色されていないゲーティングコントロールとして使用するために取っておきます。生存率色素SYTOX Greenを残りの細胞懸濁液(1:1000希釈、最終濃度30 nM)に加えます。
- 細胞懸濁液をポリスチレン5 mL(12 x 75 mm)収集チューブに取り付けられたフィルターに通します。
- 455 nmでの発光に基づいて、生きた個々のレチノイド含有細胞を選別することにより、FACS細胞の単離を進めます。前方散布図のプロットを使用して、逐次的な一重項識別を実行します (前方散布図の高さ/FSC-H 対前方散布図面積/FSC-A)。散乱特性(側方散乱)とSYTOX Greenによる染色により、死細胞を除外します。
- 350 nmでの励起時に455 nmでの発光を使用して、単一の生きたレチノイド含有細胞をゲート、ソーティング、および収集します。
注:記載された手順を用いて、約5・105 個のレチノイド含有肺細胞を1つのマウス肺から収集することができる。 - フローサイトメトリーソフトウェアを使用してFACSデータ解析を実施します。
結果
肺レチノイド含有細胞の単離
マウス肺(Lrat+/+およびLrat-/-由来)マウスを酵素的に消化し、上記で概説した手順に従って単一細胞懸濁液を調製し、FACSに供した。細胞のソーティングとデータ取得は、SpectroFlo CSソフトウェアバージョン1.3.0で操作するCytek Aurora™セルソーターシステムで、100 μmのノズルと15 psiの圧力を使用して実行しました。まず、前方散乱光のプロット(前方散乱光の高さ/FSC-H 対前方散乱領域/FSC-A)を単一細胞(シングレット)の選択とゲートに適用し、続いて側方散乱光とSYTOX Green染色によるデッドセルの識別を行いました(図2)。最後に、レチノイド含有細胞の標的集団を選別するために、λ = 455 nmで高い自家蛍光を有する生細胞の単一細胞の異なる集団を選択しました(図2A)。適用された歩行および全体的なアプローチの特異性を確認するために、Lrat-/-マウス由来の肺細胞懸濁液を、レチノイド自家蛍光のゲーティングを調整するためのネガティブコントロールとして使用した。Lrat-/-マウスはREを合成することができず、肺にレチノイドを蓄積することもできません1。特に、同一のFACSゲーティング戦略を使用すると、λ = 455 nmで高い自家蛍光を示す異なる細胞集団を、Lrat-/-肺からの単一細胞懸濁液で検出できません(図2B)。
採取した初代肺レチノイド含有細胞は、レチノイド濃度、細胞形態、遺伝子発現、および薬理学的操作に対する応答性をさらに分析するために、直接分析または培養することができます(図1)。
この手順を使用して、肺レチノイド含有細胞1間に異なる細胞集団が存在することを早期に示すことができました。具体的には、FACSで採取したレチノイド含有細胞のシングルセルRNAシーケンシングを行ったところ、これらの細胞の中で間質細胞群(全採取細胞の83%)が最も多く、次いで内皮細胞群(全採取細胞の7%)、上皮細胞(全採取細胞の5%)、骨髄系細胞(全採取細胞の約5%)であることを示しました1。.単離されたレチノイド含有肺細胞の不均一性に関するデータは、記載された手順の特異性を低下させるものではありません。むしろ、これらのデータは、表現型的に多様な細胞と広範なレチノイド媒介性細胞コミュニケーションが関与する、成人の肺におけるレチノイド代謝のこれまで予想されていなかった複雑さを強調しています。
肺Col1a2+レチノイド含有細胞の単離
単離されたレチノイド含有細胞の間に不均一な細胞集団が存在することを考えると、研究者は特定の研究に焦点を当てたいと思うかもしれません レチノイド代謝に関与する肺細胞タイプの研究。この目的のために、標的細胞集団の追加の in vivo 細胞特異的標識を行うことができる。
非常に不均一な肺細胞集団の中で、線維芽細胞特性を持つ肺間葉系間質細胞の亜集団は、肺脂質間質細胞または肺脂肪線維芽細胞と呼ばれ、レチノイドを蓄積することができる主要な細胞タイプです1,57,58。in vivoで肺線維芽細胞の亜集団を標識するために、線維芽細胞にtdTomato遺伝子を発現するマウス(F-tdTマウス)を、tdTomatoレポーターカセットを保有するマウスとCol1a2-CreERマウスを交配して作製しました。F-tdTマウスにおけるCre発現は、24時間ごとに1回、合計5日間連続して2mgのタモキシフェンを注入することにより誘導されました。最終的なタモキシフェン注射の1か月後、マウスを実験に使用しました。このアプローチにより、Col1a2+線維芽細胞をtdTomatoタンパク質で標識し、上記の手順を使用して消化された肺の単一細胞懸濁液からそれらを単離することができました。このアプローチにより、生きた細胞(SYTOX Green陰性)の単一のtdTomato+細胞を捕捉することができます(図3)。次に、レチノイド含有細胞の亜集団を、上記のようにレチノイド自家蛍光(図3)に基づくゲーティング戦略を用いて、捕捉した全てのtdTomato+細胞から分離することができる。さらに、この手順により、レチノイド蛍光シグナルの強度に基づいてtdTomato+細胞の異なる集団をその後の選別および分離収集を、高、中、および低のレチノイド含有細胞亜集団に行うことができます。
タモキシフェン処理F-tdTマウス(図4A)から肺線維芽細胞の標的細胞集団を単離し、抗Pdgfrα 磁気ビーズと磁気活性化セルソーティング(MACS)を用いて、肺線維芽細胞の標的細胞集団を単離することにより、効果的なCre組換えおよびtdTomato発現を確認しました。さらに、選別されたレチノイド含有細胞中のレチノイドの存在を確認するために、HPLC分析を実施しました(図4B)。
採取した初代肺レチノイド含有線維芽細胞は、レチノイド濃度、細胞形態、遺伝子発現、および薬理学的操作に対する応答性をさらに分析するために、直接分析または培養することができます。例えば、野生型(Lrat+/+)動物から単離された肺レチノイド含有線維芽細胞の特徴の1つは、標準的な免疫細胞化学技術を用いて培養細胞内で可視化できる脂質液滴の存在です(図4C)。
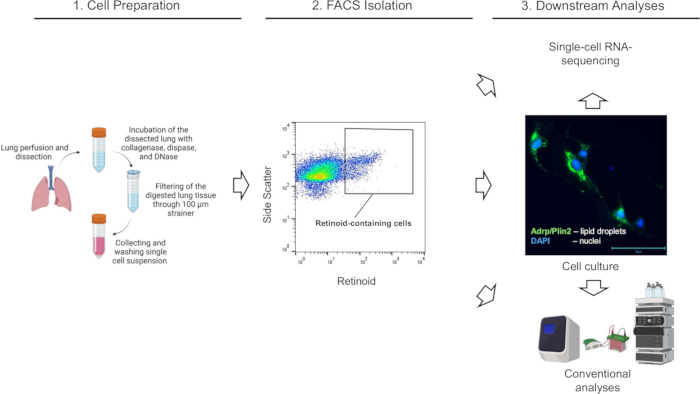
図 1: 説明されている実験ワークフローの概略図。この図の拡大版を表示するには、ここをクリックしてください。
(Biorender.com で作成)

(A)野生型C57Bl6/J(Lrat+/+)マウスから単離された肺細胞懸濁液からλ=350nmで励起し、λ=455nmでの発光を用いて、単一の生きたレチノイド含有細胞(囲まれた領域によって定義される)を選別するためのゲーティング戦略。(B)λ=350nmでの励起時にλ=455nmでの発光を使用して、Lrat-/−マウスから単離された肺細胞懸濁液に適用して、単一の生きたレチノイド含有細胞を選別するためのゲーティング戦略;囲まれた領域は、Lrat-/-肺で検出されたレチノイド含有細胞を示していません。数字はゲートセルの割合を示します。この図の拡大版を表示するには、ここをクリックしてください。
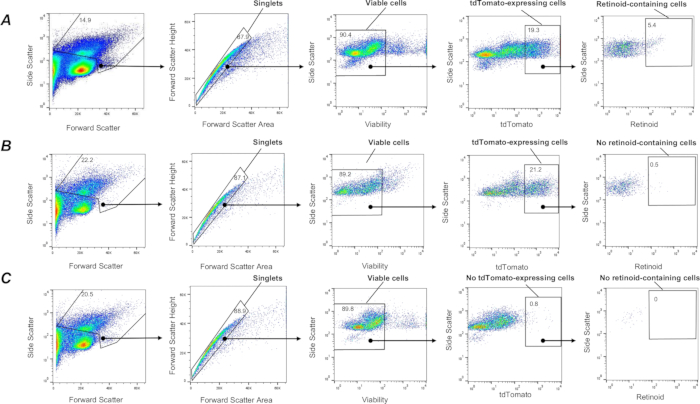
図3:肺レチノイド含有Col1a2+線維芽細胞のFACS単離。(A)野生型(C57Bl6/J)遺伝的背景上のF-TdTomマウスから単離された肺細胞懸濁液からλ= 350 nmで励起するとλ = 455 nmで発光し、単一の生tdTomato+レチノイド含有細胞(囲まれた領域で定義される)を選別するためのゲーティング戦略。パネル(B)Lrat-/-(C57Bl6/J)バックグラウンド上のF-TdTomマウスから単離された肺細胞懸濁液に適用されたλ= 350nmでの励起時にλ= 455nmでの発光を使用して、単一の、生きた、tdTomato+レチノイド含有細胞(囲まれた領域によって定義される)を選別するためのゲーティング戦略;囲まれた領域は、Lrat-/-背景上のF-TdTomマウスの肺に検出されたレチノイド含有細胞を示しています。(C)λ=350nmでの励起時にλ=455nmでの発光を使用して、tdTomato-マウスから単離された肺細胞懸濁液に適用されたλ=455nmでの発光を使用して、単一の、生きたtdTomato+レチノイド含有細胞(囲まれた領域によって定義される)を選別するためのゲーティング戦略;囲まれた領域は、検出されたtdTomato+がないことを示しています。数字はゲートセルの割合を示します。この図の拡大版を表示するには、ここをクリックしてください。
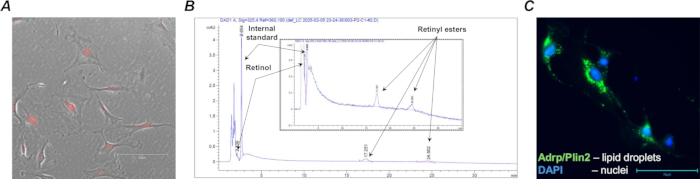
図4:レチノイド含有Col1a2+ / tdTomato+ 線維芽細胞。 (A)培養中のMACS単離野生型(Lrat+/+)Col1a2+ /tdTomato+ 肺細胞の代表的な顕微鏡写真;特徴的なtdTomato蛍光を有する培養細胞を、TX Redフィルターと20倍の倍率を用いて捕捉しました。(B)1・105選別されたレチノイド含有細胞から抽出されたレチノイド種(レチノールおよびレチニルエステル)の特徴的なピークおよび保持時間を示すHPLCプロファイル(拡大鏡を挿入した状態)。(C)脂質飛沫関連脂肪分化関連タンパク質(Adrp/Perilipin 2)について染色した培養中のFACS単離野生型(Lrat+/+)Col1a2+ /tdTomato+ 肺細胞の代表的な顕微鏡写真;染色された細胞は、GFPフィルターと40倍の倍率を使用してキャプチャされました。スケールバーは75μmです。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ヒトおよび動物の組織におけるビタミンA検出の能力と、蛍光顕微鏡を用いたその組織学的可視化は、1940年代に初めて報告された59,60。その後、レチノイド自家蛍光の現象は、in vitroで組織中の高濃度のビタミンAの位置を特定することを目的とした研究に首尾よく適用され61、蛍光顕微鏡を用いて動物胚組織62の形態形成を特徴付けることを目的とした研究に成功した。後に観察され、実験的に確認されたのは、細胞性レチノイドの特有の自家蛍光(λ=350nmでの励起とλ=455nmでの特徴的な青緑色発光)が特定の細胞型と関連しており、したがって、これらの細胞63,64,65を単離し特徴付けるために適用できることである。
レチノイド自家蛍光は、レチノイド含有細胞の同一性を確立するため、および/または肝臓41、42、43、44、膵臓45、46、腎臓41、47、および肺41におけるこれらの細胞の存在量を定量化するために、公開された研究で使用されてきた.さらに、いくつかの研究グループは、レチノイド蛍光を使用してFACSによって単離し、肝臓44、48、49、50、51、52、53 、肺1などの生体組織から初代レチノイド含有細胞を研究したことを報告しています。
ここでは、FACSを使用して肺レチノイド含有細胞を同定および選別するための主要な特徴としてレチノイド自家蛍光を使用できるプロトコルについて説明します。検出される蛍光レチノイドには、レチノールとレチニルエステルのみが含まれます。したがって、これらのビタミンA誘導体(主にレチニルエステル)を含む細胞のみを選別することができます。さらに、研究者が細胞特異性を絞り込むために追加の細胞特異的標識アプローチを利用できるプロトコルのさらなる進歩を提供します。これは、肺レチノイド含有細胞を蛍光色素標識抗体で標識し、追加のソーティングを行うことで達成できます1。あるいは、Cre発現効率と細胞特異性の検証後に、細胞特異的なCreリコンビナーゼ発現動物モデルを使用してレポーター蛍光タンパク質を発現することにより、in vivo で肺細胞の細胞特異的な標識をさらに達成することができます。ここで説明するプロトコルは、このアプローチの多くのオプションの1つとして、肺線維芽細胞におけるtdTomatoタンパク質のCo1a2駆動型発現の使用を強調しています。しかし、このアプローチは、適切なCre発現モデルを使用すれば、内皮細胞、上皮細胞、骨髄細胞など、他の肺細胞タイプにも適用できます。
記載されたプロトコルは、損傷した(炎症を起こした、線維性など)肺からの細胞単離にも適用できる;ただし、この場合、いくつかの制限を考慮する必要があります。肺の損傷は、レチノイド濃度1の進行性の低下と関連しているため、このプロトコルの適用を制限し、細胞収量を減少させる可能性があります。一方、肺の損傷は、線維芽細胞の活性化と、Col1a2を含む細胞外マトリックスタンパク質の発現上昇に関連しています。Creの発現がCol1a2プロモーターによって駆動されることから、tdTomatoの発現を増強することができ、その結果、本研究で用いたF-tdTマウスの肺におけるtdTomato発現細胞数やtdTomatoシグナルの強度に影響を与えることができます。
まとめると、ここで説明するプロトコルは、肺のレチノイド代謝の細胞的側面と in vivoでの脂質媒介性細胞通信についてより深い洞察を得るための具体的で強力なツールを提供します。
開示事項
著者は何も開示していません。
謝辞
この研究は、国立衛生研究所/国立心臓・肺・血液研究所 (NIH/NHLBI) R01 HL171112 (I.S.) からの助成金、ラトガース大学環境曝露・疾患センターからのキャリア開発賞 (I.S.) の資金提供を受けた国立衛生研究所/国立環境衛生科学研究所 (NIH/NIEHS) P30 ES005022 によって資金提供されました。 ラトガース大学、ニュージャージー州立大学(ISへ)からのスタートアップ資金。著者らは、Rutgers Cancer InstituteのImmune Monitoring and Flow Cytometry Shared Resource(一部はNCI-CCSG P30CA072770-5920からの資金提供を受けています)のスタッフに対し、本稿で紹介した研究への貢献に感謝の意を表したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 10 mL serological pipette | Avantor/VWR | 76452-284 | |
| 100 µm strainer | Greiner Bio-One | 542000 | |
| 15 mL falcon tube | Corning | 352099 | |
| 40 µm strainer | Greiner Bio-One | 542040 | |
| 50 mL falcon tube | Corning | 352070 | |
| Cell culture dish, 35 mm ´ 10 mm | Corning | 430165 | |
| Cell sorting media | Gibco | A59688DJ | |
| Collagenase type IV | Worthington Biochemical Corporation | LS004188 | |
| Cytek Aurora Cell Sorter System | Cytek Biosciences | ||
| Dispase II | Sigma-Aldrich | D4693 | |
| DNase I | Sigma-Aldrich | DN25 | |
| Falcon brand 5-ml polypropylene round bottom tube, 12 mm ´ 75 mm | Corning | 352063 | |
| Falcon brand 5-ml polystyrene round-bottom tube with cell-strainer cap, 12 mm ´ 75 mm | Corning | 352235 | |
| FlowJo software | Becton Dickinson | flow cytometry software | |
| HBSS with Ca2+/Mg2+ | Gibco | 14925-092 | |
| HBSS without Ca2+/Mg2+ | Gibco | 14175-095 | |
| Nalgene Rapid-Flow Sterile Disposable Bottle Top Filters | ThermoFisher | 595-3320 | |
| Red Cell lysis buffer | Sigma-Aldrich | R7757 | |
| SpectroFlo CS software | Cytek Biosciences | Version 1.3.0 | |
| Surgical Design Royaltek Stainless Steel Surgical Scalpel Blades | Fisher Scientific | 22-079-683 | |
| SYTOX Green dead cell stain | Invitrogen | S34860 | |
| Tamoxifen | Sigma-Aldrich | T2859 |
参考文献
- Shmarakov, I. O., et al. Retinoids stored locally in the lung are required to attenuate the severity of acute lung injury in male mice. Nat Commun. 14 (1), 851 (2023).
- Bogue, C. W., Jacobs, H. C., Dynia, D. W., Wilson, C. M., Gross, I. Retinoic acid increases surfactant protein mRNA in fetal rat lung in culture. Am J Physiol Lung Cell Mol Physiol. 271 (5), L862-L868 (1996).
- Ng-Blichfeldt, J. -. P., et al. Retinoic acid signaling balances adult distal lung epithelial progenitor cell growth and differentiation. EBioMedicine. 36, 461-474 (2018).
- Chen, F., et al. Prenatal retinoid deficiency leads to airway hyperresponsiveness in adult mice. J Clin Invest. 124 (2), 801-811 (2014).
- Esteban-Pretel, G., Marin, M. P., Renau-Piqueras, J., Barber, T., Timoneda, J. Vitamin A deficiency alters rat lung alveolar basement membrane: reversibility by retinoic acid. J Nutr Biochem. 21 (3), 227-236 (2010).
- Massaro, G. D., Massaro, D. Postnatal treatment with retinoic acid increases the number of pulmonary alveoli in rats. Am J Physiol. 270 (2 Pt 1), L305-L310 (1996).
- Hind, M., Maden, M. Retinoic acid induces alveolar regeneration in the adult mouse lung. Eur Respir J. 23 (1), 20-27 (2004).
- Belloni, P. N., Garvin, L., Mao, C. P., Bailey-Healy, I., Leaffer, D. Effects of all-trans-retinoic acid in promoting alveolar repair. Chest. 117 (5 Suppl 1), 235S-241S (2000).
- Veness-Meehan, K. A., Bottone, F. G., Stiles, A. D. Effects of retinoic acid on airspace development and lung collagen in hyperoxia-exposed newborn rats. Pediatr Res. 48 (4), 434-444 (2000).
- Cho, S. J., George, C. L., Snyder, J. M., Acarregui, M. J. Retinoic acid and erythropoietin maintain alveolar development in mice treated with an angiogenesis inhibitor. Am J Respir Cell Mol Biol. 33 (6), 622-628 (2005).
- Massaro, G. D., Massaro, D. Retinoic acid treatment abrogates elastase-induced pulmonary emphysema in rats. Nat Med. 3 (6), 675-677 (1997).
- Stinchcombe, S. V., Maden, M. Retinoic acid induced alveolar regeneration: critical differences in strain sensitivity. Am J Respir Cell Mol Biol. 38 (2), 185-191 (2008).
- Fraslon, C., Bourbon, J. R. Retinoids control surfactant phospholipid biosynthesis in fetal rat lung. Am J Physiol. 266 (6 Pt 1), L705-L712 (1994).
- Zachman, R. D. Role of vitamin A in lung development. J Nutr. 125 (6 Suppl), 1634s-1638s (1995).
- van Bennekum, A. M., et al. Lipoprotein lipase expression level influences tissue clearance of chylomicron retinyl ester. J Lipid Res. 40 (3), 565-574 (1999).
- Blaner, W. S., et al. Lipoprotein lipase hydrolysis of retinyl ester: possible implications for retinoid uptake by cells. J Biol Chem. 269 (24), 16559-16565 (1994).
- Trites, M. J., Febbraio, M., Clugston, R. D. Absence of CD36 alters systemic vitamin A homeostasis. Sci Rep. 10 (1), 20386 (2020).
- Wassef, L., Quadro, L. Uptake of dietary retinoids at the maternal-fetal barrier: in vivo evidence for the role of lipoprotein lipase and alternative pathways. J Biol Chem. 286 (37), 32198-32207 (2011).
- Spiegler, E., Kim, Y. -. K., Wassef, L., Shete, V., Quadro, L. Maternal-fetal transfer and metabolism of vitamin A and its precursor β-carotene in the developing tissues. Biochim Biophys Acta Mol Cell Biol Lipids. 1821 (1), 88-98 (2012).
- Kedishvili, N. Y. Enzymology of retinoic acid biosynthesis and degradation. J Lipid Res. 54 (7), 1744-1760 (2013).
- Channabasappa, S., Caldwell, S., Kanthan, R., Singh, B. Retinoid receptors are expressed in mouse and human lungs. Anat Rec. 305 (9), 2281-2289 (2022).
- Kimura, Y., et al. Retinoid receptors in the developing human lung. Clin Sci (Lond). 103 (6), 613-621 (2002).
- Yang, L., Naltner, A., Yan, C. Overexpression of dominant negative retinoic acid receptor alpha causes alveolar abnormality in transgenic neonatal lungs. Endocrinology. 144 (7), 3004-3011 (2003).
- Snyder, J. M., et al. Alveolarization in retinoic acid receptor-beta-deficient mice. Pediatr Res. 57 (3), 384-391 (2005).
- Gao, R. -. w., et al. Retinoic acid promotes primary fetal alveolar epithelial type II cell proliferation and differentiation to alveolar epithelial type I cells. In Vitro Cell Dev Biol Anim. 51 (5), 479-487 (2015).
- Dirami, G., et al. Lung retinol storing cells synthesize and secrete retinoic acid, an inducer of alveolus formation. Am J Physiol Lung Cell Mol Physiol. 286 (2), L249-L256 (2004).
- Massaro, G. D., Massaro, D., Chambon, P. Retinoic acid receptor-alpha regulates pulmonary alveolus formation in mice after, but not during, perinatal period. Am J Physiol Lung Cell Mol Physiol. 284 (2), L431-L433 (2003).
- Massaro, G. D., et al. Retinoic acid receptor-beta: an endogenous inhibitor of the perinatal formation of pulmonary alveoli. Physiol Genomics. 4 (1), 51-57 (2000).
- McGowan, S., et al. Mice bearing deletions of retinoic acid receptors demonstrate reduced lung elastin and alveolar numbers. Am J Respir Cell Mol Biol. 23 (2), 162-167 (2000).
- Yan, C., et al. Retinoic acid-receptor activation of SP-B gene transcription in respiratory epithelial cells. Am J Physiol Lung Cell Mol Physiol. 275 (2), L239-L246 (1998).
- Ghaffari, M., Whitsett, J. A., Yan, C. Inhibition of hSP-B promoter in respiratory epithelial cells by a dominant negative retinoic acid receptor. Am J Physiol Lung Cell Mol Physiol. 276 (3), L398-L404 (1999).
- Yang, L., et al. Synergy between signal transducer and activator of transcription 3 and retinoic acid receptor-α in regulation of the surfactant protein b gene in the lung. Mol Endocrinol. 18 (6), 1520-1532 (2004).
- Metzler, M. D., Snyder, J. M. Retinoic acid differentially regulates expression of surfactant-associated proteins in human fetal lung. Endocrinology. 133 (5), 1990-1998 (1993).
- George, T. N., Snyder, J. M. Regulation of surfactant protein gene expression by retinoic acid metabolites. Pediatr Res. 41 (5), 692-701 (1997).
- Naltner, A., Ghaffari, M., Whitsett, J. A., Yan, C. Retinoic acid stimulation of the human surfactant protein B promoter is thyroid transcription factor 1 site-dependent. J Biol Chem. 275 (1), 56-62 (2000).
- Ng-Blichfeldt, J. P., et al. Deficient retinoid-driven angiogenesis may contribute to failure of adult human lung regeneration in emphysema. Thorax. 72 (6), 510-521 (2017).
- Lochbaum, R., et al. Retinoic acid signalling adjusts tight junction permeability in response to air-liquid interface conditions. Cell Signal. 65, 109421 (2020).
- Mamidi, S., Hofer, T. P., Hoffmann, R., Ziegler-Heitbrock, L., Frankenberger, M. All-trans retinoic acid up-regulates prostaglandin-e synthase expression in human macrophages. Immunobiology. 217 (6), 593-600 (2012).
- Hashimoto, S., et al. Retinoic acid differentially regulates interleukin-1beta and interleukin-1 receptor antagonist production by human alveolar macrophages. Leuk Res. 22 (11), 1057-1061 (1998).
- Li, S., Lei, Y., Lei, J., Li, H. Alltrans retinoic acid promotes macrophage phagocytosis and decreases inflammation via inhibiting CD14/TLR4 in acute lung injury. Mol Med Rep. 24 (6), (2021).
- Nagy, N. E., et al. Storage of vitamin A in extrahepatic stellate cells in normal rats. J Lipid Res. 38 (4), 645-658 (1997).
- Thompson, K. C., et al. Primary rat and mouse hepatic stellate cells express the macrophage inhibitor cytokine interleukin-10 during the course of activation in vitro. Hepatology. 28 (6), 1518-1524 (1998).
- Zhang, X. Y., Sun, C. K., Wheatley, A. M. A novel approach to the quantification of hepatic stellate cells in intravital fluorescence microscopy of the liver using a computerized image analysis system. Microvasc Res. 60 (3), 232-240 (2000).
- D'Ambrosio, D. N., et al. Distinct populations of hepatic stellate cells in the mouse liver have different capacities for retinoid and lipid storage. PLoS One. 6 (9), e24993 (2011).
- Apte, M. V., et al. Periacinar stellate shaped cells in rat pancreas: identification, isolation, and culture. Gut. 43 (1), 128-133 (1998).
- Kim, N., et al. Formation of vitamin A lipid droplets in pancreatic stellate cells requires albumin. Gut. 58 (10), 1382-1390 (2009).
- Kida, Y., et al. Characterization of vitamin A-storing cells in mouse fibrous kidneys using Cygb/STAP as a marker of activated stellate cells. Arch Histol Cytol. 70 (2), 95-106 (2007).
- Ogawa, T., et al. Identification of vitamin A-free cells in a stellate cell-enriched fraction of normal rat liver as myofibroblasts. Histochem Cell Biol. 127 (2), 161-174 (2007).
- Tacke, F., Weiskirchen, R. Update on hepatic stellate cells: pathogenic role in liver fibrosis and novel isolation techniques. Expert Rev Gastroenterol Hepatol. 6 (1), 67-80 (2012).
- Bartneck, M., et al. Isolation and time lapse microscopy of highly pure hepatic stellate cells. Anal Cell Pathol (Amst). , (2015).
- Balaphas, A., et al. Optimized isolation and characterization of C57BL/6 mouse hepatic stellate cells. Cells. 11 (9), (2022).
- Kubota, H., Yao, H. L., Reid, L. M. Identification and characterization of vitamin A-storing cells in fetal liver: implications for functional importance of hepatic stellate cells in liver development and hematopoiesis. Stem Cells. 25 (9), 2339-2349 (2007).
- Larsen, A. K., et al. Autofluorescence in freshly isolated adult human liver sinusoidal cells. Eur J Histochem. 65 (4), (2021).
- Shaner, N. C., Patterson, G. H., Davidson, M. W. Advances in fluorescent protein technology. J Cell Sci. 120 (24), 4247-4260 (2007).
- National Research Council. . Guide for the Care and Use of Laboratory Animals. , (2011).
- O'Byrne, S. M., et al. Retinoid absorption and storage is impaired in mice lacking lecithin: retinol acyltransferase (LRAT). J Biol Chem. 280 (42), 35647-35657 (2005).
- McGowan, S. E., Torday, J. S. The pulmonary lipofibroblast (lipid interstitial cell) and its contributions to alveolar development. Annu Rev Physiol. 59, 43-62 (1997).
- McGowan, S. E. The lipofibroblast: more than a lipid-storage depot. Am J Physiol Lung Cell Mol Physiol. 316 (5), L869-L871 (2019).
- Meyer, K. A., Popper, H., Ragins, A. B. Histologic distribution of vitamin A in biopsy specimens of the liver. Arch Surg. 43 (3), 376-385 (1941).
- Popper, H. L. Histological demonstration of vitamin A in rats by means of fluorescence microscopy. Proc Soc Exp Biol Med. 43, 133-136 (1940).
- Van Exan, R. J., Hardy, M. H. Localization of vitamin A by autofluorescence during induced metaplastic changes in cultures of skin. In Vitro. 15 (8), 631-640 (1979).
- Schweigert, F. J., Siegling, C., Tzimas, G., Seeger, J., Nau, H. Distribution of endogenous retinoids, retinoid binding proteins (RBP, CRABPI) and nuclear retinoid X receptor beta (RXRbeta) in the porcine embryo. Reprod Nutr Dev. 42 (4), 285-294 (2002).
- Wake, K. Perisinusoidal stellate cells (fat-storing cells, interstitial cells, lipocytes), their related structure in and around the liver sinusoids, and vitamin A-storing cells in extrahepatic organs. Int Rev Cytol. 66, 303-353 (1980).
- Senoo, H., Kojima, N., Sato, M. Vitamin A-storing cells (stellate cells). Vitam Horm. 75, 131-159 (2007).
- Senoo, H., et al. Hepatic stellate cell (vitamin A-storing cell) and its relative--past, present and future. Cell Biol Int. 34 (12), 1247-1272 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved