Method Article
通过细胞分选分离含肺类视黄醇的细胞
摘要
下面描述的方案是一种简单有效的方法,通过利用特异性类视黄醇自发荧光和采用荧光激活细胞分选,从高度异质的肺细胞群中分离含维甲酸的细胞。
摘要
类维生素 A(维生素 A 及其代谢物)是肺泡微环境的重要组成部分,需要细胞类型特异性类维生素 A 代谢来维持发育中和成人肺的功能健康。肺细胞利用特定途径,允许从血液中有效吸收循环类视黄醇 (ROH),然后在细胞内逐步将 ROH 转化为转录活性的类视黄酸物种,全反式维甲酸 (ATRA)。ATRA 介导的(或类维生素 A 介导的)信号转导对于调节肺泡形成、表面活性剂产生、血管生成、通透性和免疫至关重要。重要的是,特定的肺细胞,包括成纤维细胞,可以以视黄酯 (RE) 的形式积累类视黄醇,这些类视黄醇可以储存或进一步动员为 ROH,以便在需要时转移到邻近细胞。通过利用类视黄醇自发荧光(在 350 nm 激发时在 455 nm 处发射)和采用荧光激活细胞分选 (FACS),可以从消化肺的单细胞悬液中分离和收集含肺类视黄醇的肺细胞。用红色荧光蛋白对肺细胞进行额外的细胞特异性 体内 标记,可以分离和收集含有特异性类视黄醇的肺细胞群。收集的细胞可以直接分析或培养,以进一步分析细胞形态、基因表达和对药理学作的反应性。这种分离和应用技术对于肺部健康和肺损伤的动物模型研究非常重要,可以更深入地了解肺部类维生素 A 代谢的细胞方面和脂质介导的细胞通讯。
引言
类维生素 A(维生素 A 及其代谢物)是肺泡微环境的重要组成部分,需要细胞类型特异性类视黄醇代谢和信号传导来维持发育中和成人肺的功能健康 1,2,3,4,5,6,7,8,9,10,11 ,12,13,14。肺细胞利用特定途径,允许从血液中有效吸收循环饮食衍生的类视黄醇作为视黄醇 (ROH)15,16,17,18,19,然后在细胞内逐步将 ROH 转化为转录活性的类视黄酸物种,全反式维甲酸 (ATRA)20.ATRA 介导的(或类视黄醇介导的)信号转导是通过 ATRA 与其三种不同的同源核激素受体、视黄酸受体(RARα、RARβ 和 RARγ 21,22)相互作用实现的,并且对调节肺泡形成至关重要 23,24,25,26,27,28,29,表面活性剂的产生30,31,32,33,34,35,血管生成36,通透性37 和免疫 38,39,40。重要的是,特定的肺细胞,尤其是肺成纤维细胞,可以以视黄酯 (RE) 的形式积累类视黄醇,这些类视黄醇可以储存或进一步动员为 ROH,以便在需要时转移到邻近细胞1。
类维生素 A 代谢和信号传导的复杂性,以及肺的细胞复杂性,使得旨在 探索体内肺部 类维生素 A 代谢的研究具有挑战性。我们概述了一种简单而强大的方案,用于通过利用特异性类视黄醇自发荧光(在 350 nm 激发时在 455 nm 处发射)和采用荧光激活细胞分选 (FACS) 从高度异质的肺细胞群中分离含维甲酸的细胞(图 1)。如果研究的目标是根据原代活肺细胞储存类维生素 A 的能力分离和表征原代活肺细胞,则该方案不需要额外的细胞标记,但活力染色除外。这显著缩短了细胞分选的准备时间,无需额外染色,并允许分离高产量的活原代细胞。但是,如果研究的目标是分离和表征特定的肺细胞群(成纤维细胞、内皮细胞、上皮细胞或免疫细胞),则可以在用细胞特异性抗体标记分选的含维甲酸的细胞后进行额外的细胞分选。
类视黄醇自发荧光已在已发表的研究中用于确定含类视黄醇细胞的身份和/或量化这些细胞在肝脏 41,42,43,44、胰腺45,46、肾脏41,47 和肺41 中的丰度.此外,几个研究小组报告了使用类视黄醇荧光通过 FACS 分离并研究活组织中含维甲酸的原代含维甲酸的细胞,包括肝脏44、48、49、50、51、52、53 和肺1。在当前的方案中,我们展示了如何在使用 tdTomato(红色荧光蛋白)分离含有类视黄醇的细胞之前在体内标记特定细胞群。tdTomato 的光谱特性(在 554 nm 激发时在 581 nm 处的发射54)和亮度不会干扰类视黄醇自发荧光,因此可以方便地在分选过程中实现细胞特异性。鉴于未受损的类视黄醇代谢和信号传导在正常肺泡微环境中的关键作用1,所描述的肺细胞分离技术是肺部健康和疾病动物模型研究的有用工具,可以更深入地了解肺部类视黄醇代谢的细胞方面和脂质介导的体内细胞通讯。
研究方案
所有涉及小鼠的描述程序和实验均经罗格斯大学机构动物护理和使用委员会 (IACU PROTO202200111 C) (IACUC) 批准进行,根据美国国家科学院55 编写的实验动物护理和使用指南中概述的标准。
1. 实验的注意事项和准备
- 畜牧业和作
注意:三个月大(10-12 周龄)雄性和雌性小鼠可用于研究。在所述实验中使用了 C57BL/6J 遗传背景上的卵磷脂:视黄醇酰基转移酶缺陷小鼠 (Lrat-缺陷, Lrat-/- 小鼠56) 和年龄匹配的同窝小鼠 (野生型, Lrat+/+ 小鼠)。在成纤维细胞(F-tdT 小鼠)中表达 tdTomato 基因的小鼠是通过杂交携带 tdTomato 报告盒 (B6.Cg-Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J,Jackson Lab 菌株 #007914) 与 Col1a2-CreER 小鼠 (B6.Cg-Tg(Col1a2-Cre/ERT,-ALPP)7Cpd/2J,Jackson 实验室菌株 #029567)。- 采用表达 Cre 的小鼠模型,这是在 体内标记目标细胞群的众多可用选项之一。
注意:根据靶细胞的选择、Cre 表达、Cre 介导的重组效率和细胞特异性,研究人员可以使用任何可靠的 Cre 表达小鼠模型。 - 使用 tdTomato 转基因表达(如下所述他莫昔芬处理后)标记 Col1a2 + 成纤维细胞,然后如下所述从消化肺的单细胞悬液中分离它们。
- 采用表达 Cre 的小鼠模型,这是在 体内标记目标细胞群的众多可用选项之一。
- Cre 介导的体内重组和转基因激活
- 通过腹膜内 (IP) 注射 2 mg 他莫昔芬,每 24 小时一次,共连续 5 天,诱导 F-tdT 小鼠的 Cre 表达。
- 注射前用 70% 乙醇对注射部位进行消毒。在最后一次他莫昔芬注射后 1 个月使用小鼠进行实验。
- 在分选实验之前检查 Cre 重组的有效性。通过使用抗 Pdgfrα 磁珠和磁激活细胞分选 (MACS) 从他莫昔芬处理的 F-tdT 小鼠中分离肺成纤维细胞的靶细胞群,确认有效的 Cre 重组和 tdTomato 表达。
- 制备塑料和玻璃器皿的溶液
注意:对于下述程序,应遵循无菌技术。涉及溶液制备、组织消化和细胞分离的程序应在层流罩下进行。溶液应使用 0.2 μm 过滤器过滤进行消毒;手术工具和实验室器具应通过高压灭菌进行消毒。- 在层流罩下,准备不含钙和镁的汉克斯平衡盐溶液 (HBSS)(不含 Ca2+/Mg2+的 HBSS,含有 5.3 mM KCl、0.4 mM KH2PO4、4.2 mM NaHCO3、137.9 mM NaCl、0.3 mM Na2HPO4、5.6 mM D-葡萄糖)用于肺灌注(每只小鼠 5 mL)。使用 0.2 μm 过滤器对溶液进行消毒,并用溶液填充注射器。
- 在层流罩下,用钙和镁(含 Ca2+/Mg2+ 的 HBSS,含 1.3 mM CaCl2、0.5 MgCl2·6H2O,0.4 mM 硫酸镁4·7H2O、5.3 mM KCl、0.4 mM KH2PO4、4.2 mM NaHCO3、137.9 mM NaCl、0.3 mM Na2HPO4、5.6 mM D-葡萄糖),含有 0.3 mg/mL 的 IV 型胶原酶和 1 mg/mL 用于肺灌注的分散酶(每只小鼠 10 mL)。使用 0.2 μm 过滤器对溶液进行消毒,并用溶液填充注射器。
- 在层流罩下,用 Ca2+/Mg2+ 制备 HBSS,含有 0.3 mg/mL 的 IV 型胶原酶、1 mg/mL 的分散酶和 5 mg/mL 的 DNase I,用于肺消化(每只小鼠 10 mL)。使用 0.2 μm 过滤器对溶液进行消毒,并用溶液填充注射器。
- 在层流罩下,用 2 mL 含 Ca2+/Mg2+ 的无菌 HBSS 填充细胞培养皿(35 mm 10 mm,每个从一只小鼠收集的肺一个培养皿)。将含有 Ca2+/Mg2+ 的 HBSS 的培养皿放在冰上。
2. 单细胞悬液的肺灌注、消化和收集
- 通过 IP 注射以 0.01 mL/g 体重的剂量施用含有 10 mg/mL 氯胺酮和 2 mg/mL 甲苯噻嗪的麻醉混合物来麻醉小鼠。
- 通过评估脚趾捏合反应,确保鼠标处于深度无意识状态。去除手术部位松散的毛发和可见的污垢/碎屑,用 70% 酒精夹住并擦拭手术部位进行消毒。
- 使用无菌手术工具,打开腹腔和胸腔。切开肋骨和横膈膜,露出肺和心脏。
注意:这将确保立即死亡,因为开胸手术会导致小鼠麻醉时呼吸停止;如果执行得当,这部分程序从手术开始到开胸手术,然后是动物死亡,最多需要 3 分钟。 - 切开下腔静脉并应用吸收垫以吸收释放的血液。
- 使用 10 mL 注射器通过心脏 右心室原位灌注肺部,注射器带有 25 G X 1“ 针头,其中装有 5 mL 不含 Ca2+/Mg2+ 的无菌 HBSS。如果灌注成功,肺组织会变成白色。
- 使用 10 mL 注射器 原位 灌注肺部,注射器用 25 G X 1“ 针头灌注 10 mL 无菌 HBSS,含 Ca2+/Mg2+,含有 IV 型胶原酶 (0.3 mg/mL) 和分散酶 (1 mg/mL)。
- 取出肺并将其转移到细胞培养皿 (35 mm X 10 mm) 中,其中含有 2 mL 含 Ca2+/Mg2+ 的无菌 HBSS。
- 在层流罩下,冲洗肺部并使用无菌手术刀片(#20,适合手柄 #4)将其切成小块。将前 5 mL 含 Ca2+/Mg2+ 的 HBSS (含有 0.3 mg/mL IV 型胶原酶、1 mg/mL 分散酶和 5 mg/mL DNase I)添加到切碎的组织中,并将切碎的肺转移到 15 mL 管中,并使用 10 mL 血清移液管转移。用含有 0.3 mg/mL IV 型胶原酶、1 mg/mL 分散酶和 5 mg/mL DNase I 的 Ca2+/Mg2+ 洗涤细胞培养皿,收集并转移剩余的切碎的组织残留物。
- 将切碎的肺组织在含有 0.3 mg/mL IV 型胶原酶、1 mg/mL 分散酶和 5 mg/mL DNase I 的 Ca2+/Mg2+ 的 HBSS 中在旋转振荡器上孵育,保持在 37 °C 45 分钟。在三个 15 分钟的间隔中,在层流罩下,将切碎的组织通过 10 mL 血清移液管 10 次,以更好地解离细胞。
- 将所得细胞悬液通过 100 μm 过滤器,将单细胞收集到含有 20 mL 冷活细胞成像溶液(含 20 mM HEPES 的生理盐水,pH 7.4)且胎牛血清 (FBS) 含量低于 5% 的 50 mL 试管中。通过在 4 °C 下以 500 g 离心 10 分钟来收集细胞。
- 吸出上清液,将细胞沉淀重悬于 1 mL 红细胞裂解缓冲液中,并在室温 (RT) 下放置试管 5 分钟以消除红细胞。加入 20 mL 含 FBS 少于 5% 的冷活细胞成像溶液。通过在 4 °C 下以 500 g 离心 10 分钟来收集细胞。
- 吸出上清液,并将细胞沉淀重悬于 20 mL FBS 含量低于 5% 的冷活细胞成像溶液中。将所得细胞悬液通过 40 μm 过滤器,将单细胞收集到含有 20 mL 冷活细胞成像溶液(FBS 含量低于 5%)的 50 mL 试管中。通过在 4 °C 下以 500 g 离心 10 分钟来收集细胞。
- 吸出上清液,并将细胞沉淀重悬于 10 mL 含 FBS 少于 5% 的冷活细胞成像溶液中。对细胞进行计数,并将细胞浓度调节至 ~5-10 x 106 个细胞/mL。
3. 使用荧光激活细胞分选 (FACS) 分离含维A酸的肺细胞
- 取等分试样的细胞悬液,放在一边用作未染色的门控对照。将活力染料 SYTOX Green 添加到剩余的细胞悬液中(1:1000 稀释,终浓度 30 nM)。
- 使细胞悬液通过连接到聚苯乙烯 5 mL (12 x 75 mm) 收集管的过滤器。
- 通过根据它们在 455 nm 处的发射对含有单个类视黄醇的活细胞进行分类,进行 FACS 细胞分离。使用前向散射图(前向散射高度/FSC-H 与前向散射区域/FSC-A)进行顺序单态鉴别。通过散射特性(侧向散射)和用 SYTOX Green 染色排除死细胞。
- 在 350 nm 激发时,使用 455 nm 发射对单个活的含维甲酸的细胞进行门控、分选和收集。
注意:使用所描述的程序,可以从一个小鼠肺中收集大约 5·105 个含维甲酸的肺细胞。 - 使用流式细胞术软件进行 FACS 数据分析。
结果
分离含肺类维生素 A 的细胞
对小鼠肺(来自 Lrat + / + 和 Lrat - / - )小鼠进行酶消化,制备单细胞悬液并根据上述程序进行 FACS。在 Cytek Aurora™ 细胞分选仪系统上进行细胞分选和数据采集,该系统由 SpectroFlo CS 软件版本 1.3.0作,使用 100 μm 喷嘴和 15 psi 压力。首先,应用前向散射图(前向散射高度/FSC-H 与前向散射面积/FSC-A)来选择和设门单细胞(单体),然后使用侧向散射和 SYTOX Green 染色进行死细胞区分(图 2)。最后,为了对含维甲酸细胞的目标群体进行分类,选择了在 λ = 455 nm 处具有高自发荧光的不同活单细胞群(图 2A)。为了确认所应用步态和整体方法的特异性,使用 Lrat-/- 小鼠的肺细胞悬液作为调节类视黄醇自发荧光门控的阴性对照。 Lrat-/- 小鼠无法合成 REs,也不能在肺部积累类维生素A 1。值得注意的是,使用相同的 FACS 门控策略,无法在来自 Lrat-/- 肺的单细胞悬液中检测到在 λ = 455 nm 处具有高自发荧光的不同细胞群(图 2B)。
收集后,可以直接分析或培养含原代肺类维生素 A 的细胞,以进一步分析类维生素 A 浓度、细胞形态、基因表达和对药理学作的反应性(图 1)。
使用该程序,我们能够更早地证明在含类维生素 A 的肺细胞中存在不同的细胞群1。具体来说,通过对 FACS 收集的含维甲酸的细胞进行单细胞 RNA 测序,我们发现在这些细胞中,基质细胞组(占收集细胞总数的 83%)最丰富,其次是内皮细胞(占收集细胞总数的 7%)、上皮细胞(占收集细胞总数的 5%)和髓样细胞(约占收集细胞总数的 5%)1.关于分离的含维A酸肺细胞异质性的数据并没有降低所描述程序的特异性;相反,这些数据突出了成人肺中以前未曾预料到的类维生素 A 代谢的复杂性,涉及表型多样化的细胞和广泛的类维生素 A 介导的细胞通讯。
分离含肺 Col1a2+ 类维生素 A 的细胞
鉴于分离的含维甲酸细胞中存在异质性细胞群,研究人员可能希望专注于研究参与类视黄醇代谢的特定肺细胞类型。为此,可以对靶细胞群进行额外的 体内 细胞特异性标记。
在高度异质的肺细胞群中,具有成纤维细胞特征的肺间充质基质细胞亚群,称为肺脂质间质细胞或肺脂成纤维细胞,是能够积累类视黄醇的主要细胞类型 1,57,58。为了在体内标记肺成纤维细胞亚群,通过将携带 tdTomato 报告盒的小鼠与 Col1a2-CreER 小鼠杂交来产生在成纤维细胞 (F-tdT 小鼠) 中表达 tdTomato 基因的小鼠。通过每 24 h 一次 ip 注射 2 mg 他莫昔芬诱导 F-tdT 小鼠 Cre 表达,共连续 5 d;最后一次他莫昔芬注射后一个月,小鼠用于实验。这种方法允许用 tdTomato 蛋白标记 Col1a2 + 成纤维细胞,并使用上述程序从消化肺的单细胞悬液中分离它们。该方法允许捕获活的(SYTOX Green 阴性)单个 tdTomato + 细胞(图 3)。接下来,如上所述,可以使用基于类视黄醇自发荧光的门控策略(图 3)从所有捕获的 tdTomato + 细胞中分离出含类视黄醇的细胞亚群。此外,该程序允许根据类视黄醇荧光信号的强度将不同的 tdTomato + 细胞群随后分选和分离收集为高、中和低含类视黄醇的细胞亚群。
通过使用抗 Pdgfrα 磁珠和磁激活细胞分选 (MACS) 从他莫昔芬处理的 F-tdT 小鼠中分离肺成纤维细胞的靶细胞群 (图 4A) 来确认有效的 Cre 重组和 tdTomato 表达。此外,还进行了 HPLC 分析以确认分选的含维甲酸细胞中存在类视黄醇(图 4B)。
收集后,可以直接分析或培养含原代肺维甲酸的成纤维细胞,以进一步分析类维生素 A 浓度、细胞形态、基因表达和对药理学作的反应性。例如,从野生型 (Lrat+/+) 动物中分离的含肺类维生素 A 的成纤维细胞的特征之一是存在脂滴,可以使用标准免疫细胞化学技术在培养细胞中观察到这些脂滴(图 4C)。
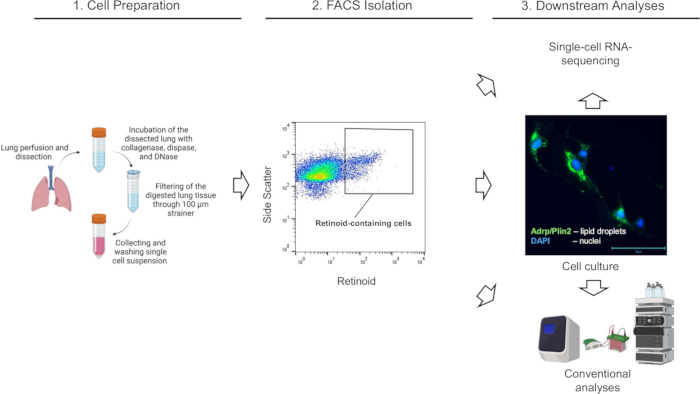
图 1:所述实验工作流程的示意图。请单击此处查看此图的较大版本。
(使用 Biorender.com 创建)

图 2:含肺类视黄醇细胞的 FACS 分离。 (A) 一种门控策略,用于在 λ = 455 nm 激发时以 λ = 455 nm 的发射从野生型 C57Bl6/J (Lrat+/+) 小鼠中分离的肺细胞悬液中分选单个活的、含维甲酸的细胞(由封闭区域定义)。(B) 一种门控策略,用于在 λ = 350 nm 激发下使用 λ = 455 nm 的发射对单个、活的、含维甲酸的细胞进行分选,应用于从 Lrat-/- 小鼠分离的肺细胞悬液;封闭区域描绘了 Lrat-/- 肺中未检测到含维甲酸的细胞;数字表示门控单元的百分比。 请单击此处查看此图的较大版本。
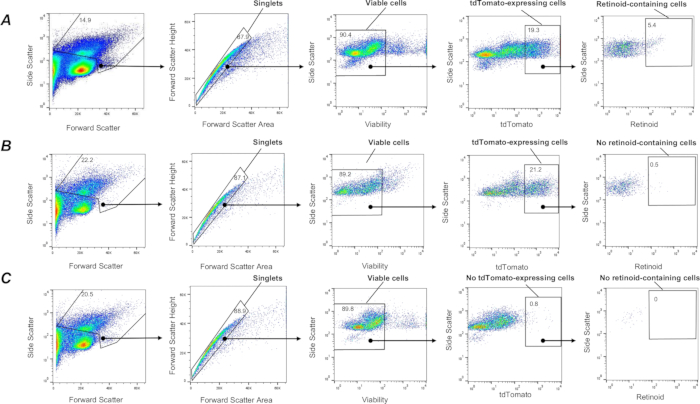
图 3:含肺类维生素 A 的 Col1a2 + 成纤维细胞的 FACS 分离。(A) 一种门控策略,用于在 λ = 350 nm 激发时,使用 λ = 455 nm 的发射对单个活的含 tdTomato + 类视黄醇 + 的细胞(由封闭区域定义)进行分选,这些细胞悬液来自野生型 (C57Bl6/J) 遗传背景上从 F-TdTom 小鼠分离的肺细胞悬液中分离。图 (B) 一种门控策略,用于在 λ = 455 nm 激发下使用 λ = 455 nm 的发射分选单个活的含 tdTomato + 类视黄醇 + 类视黄醇的细胞(由封闭区域定义),应用于从 Lrat-/-(C57Bl6/J) 背景上的从 F-TdTom 小鼠分离的肺细胞悬液;封闭区域描绘了在 Lrat-/- 背景下的 F-TdTom 小鼠的肺部未检测到含维甲酸的细胞。(C) 一种门控策略,用于在 λ = 455 nm 激发下使用 λ = 455 nm 的发射分选单个活的、含 tdTomato+ 类视黄醇的细胞(由封闭区域定义),应用于从 tdTomato 小鼠分离的肺细胞悬液;封闭区域描绘未检测到 tdTomato+;数字表示门控单元的百分比。请单击此处查看此图的较大版本。
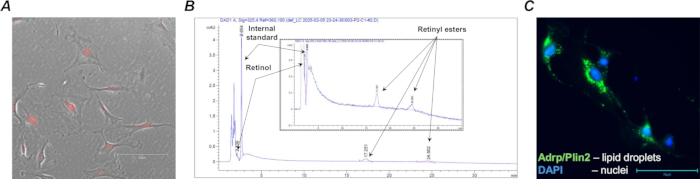
图 4:含维甲酸的 Col1a2+ / tdTomato+ 成纤维细胞。 (A) 培养物中 MACS 分离的野生型 (Lrat+/+) Col1a2+ / tdTomato+ 肺细胞的代表性显微照片;使用 TX Red 滤光片和 20 倍放大倍率捕获具有特征性 tdTomato 荧光的培养细胞;比例尺为 150 μm。(B) HPLC 曲线(插入放大倍数),显示从 1·105 个分选的含维甲酸细胞中提取的类视黄醇种类(视黄醇和视黄酯)的特征峰和保留时间。(C) FACS 分离的野生型 (Lrat+/+) Col1a2+ / tdTomato+ 肺细胞在培养物中对脂滴相关脂肪分化相关蛋白 (Adrp/Perilipin 2) 进行染色的代表性显微照片;使用 GFP 滤光片和 40 倍放大倍率捕获染色细胞;比例尺为 75 μm。 请单击此处查看此图的较大版本。
讨论
早在 1940 年代,就首次报道了人类和动物组织中维生素 A 的检测能力及其使用荧光显微镜的组织学可视化59,60。然后,类视黄醇自发荧光现象成功地应用于旨在定位体外组织中高浓度维生素 A 61 和使用荧光显微镜表征动物胚胎组织形态发生62 的研究。后来通过实验观察和证实,细胞类维生素 A 的独特自发荧光(λ = 350 nm 激发,λ = 455 nm 处的特征蓝绿色发射)与特定细胞类型相关,因此可用于分离和表征这些细胞 63,64,65。
类视黄醇自发荧光已在已发表的研究中用于确定含类视黄醇细胞的身份和/或量化这些细胞在肝脏 41,42,43,44、胰腺45,46、肾脏41,47 和肺41 中的丰度.此外,几个研究小组报告了使用类视黄醇荧光通过 FACS 分离并研究活组织中含维甲酸的原代含维甲酸的细胞,包括肝脏44、48、49、50、51、52、53 和肺1。
在这里,我们描述了可以使用类视黄醇自发荧光作为主要特征来使用 FACS 识别和分类含维甲酸的肺类化合物细胞的方案。检测到的荧光类维生素 A 仅包括视黄醇和视黄酯。因此,只能对含有这些维生素 A 衍生物(主要是视黄酯)的细胞进行分类。此外,我们还提供了协议的额外进展,研究人员可以利用额外的细胞特异性标记方法来缩小细胞特异性的范围。这可以通过用荧光染料偶联抗体标记含肺类视黄醇的细胞并进行额外分选来实现1。或者,在验证 Cre 表达效率和细胞特异性后,通过使用表达细胞特异性 Cre 重组酶的动物模型表达报告荧光蛋白,可以在 体内 实现肺细胞的额外细胞特异性标记。此处描述的方案强调了在肺成纤维细胞中使用 Co1a 2 驱动的 tdTomato 蛋白表达作为该方法的众多选项之一。然而,当使用适当的 Cre 表达模型时,这种方法可以应用于其他肺细胞类型,包括内皮细胞、上皮细胞和髓细胞。
所描述的方案也可用于从受伤(发炎、纤维化等)肺部分离的细胞;但是,在这种情况下,应考虑几个限制。肺损伤与类维生素 A 浓度1 的进行性下降有关,因此,这会限制该方案的应用并降低细胞产量。另一方面,肺损伤与成纤维细胞活化和细胞外基质蛋白(包括 Col1a2)表达升高有关。鉴于 Cre 表达是由 Col1a2 启动子驱动的,tdTomato 表达可以增强,从而影响表达 tdTomato 的细胞数量以及我们研究中使用的 F-tdT 小鼠肺部 tdTomato 信号的强度。
综上所述,此处描述的方案提供了一种特定而强大的工具,可以更深入地了解肺部类维生素 A 代谢的细胞方面和 体内脂质介导的细胞通讯。
披露声明
作者没有什么可披露的。
致谢
这项工作由国立卫生研究院/国家心脏、肺和血液研究所(NIH/NHLBI)的R01 HL171112(给I.S.)资助,由美国国立卫生研究院/国家环境健康科学研究院(NIEHS)P30资助的职业发展奖(给I.S.)由美国国立卫生研究院/国家环境健康科学研究院(NIH/NIEHS)P30资助ES005022, 以及来自罗格斯大学、新泽西州立大学(I.S.)的启动资金。作者要感谢罗格斯癌症研究所免疫监测和流式细胞术共享资源的工作人员(部分由 NCI-CCSG P30CA072770-5920 资助),感谢他们对本手稿中介绍的工作做出的贡献。
材料
| Name | Company | Catalog Number | Comments |
| 10 mL serological pipette | Avantor/VWR | 76452-284 | |
| 100 µm strainer | Greiner Bio-One | 542000 | |
| 15 mL falcon tube | Corning | 352099 | |
| 40 µm strainer | Greiner Bio-One | 542040 | |
| 50 mL falcon tube | Corning | 352070 | |
| Cell culture dish, 35 mm ´ 10 mm | Corning | 430165 | |
| Cell sorting media | Gibco | A59688DJ | |
| Collagenase type IV | Worthington Biochemical Corporation | LS004188 | |
| Cytek Aurora Cell Sorter System | Cytek Biosciences | ||
| Dispase II | Sigma-Aldrich | D4693 | |
| DNase I | Sigma-Aldrich | DN25 | |
| Falcon brand 5-ml polypropylene round bottom tube, 12 mm ´ 75 mm | Corning | 352063 | |
| Falcon brand 5-ml polystyrene round-bottom tube with cell-strainer cap, 12 mm ´ 75 mm | Corning | 352235 | |
| FlowJo software | Becton Dickinson | flow cytometry software | |
| HBSS with Ca2+/Mg2+ | Gibco | 14925-092 | |
| HBSS without Ca2+/Mg2+ | Gibco | 14175-095 | |
| Nalgene Rapid-Flow Sterile Disposable Bottle Top Filters | ThermoFisher | 595-3320 | |
| Red Cell lysis buffer | Sigma-Aldrich | R7757 | |
| SpectroFlo CS software | Cytek Biosciences | Version 1.3.0 | |
| Surgical Design Royaltek Stainless Steel Surgical Scalpel Blades | Fisher Scientific | 22-079-683 | |
| SYTOX Green dead cell stain | Invitrogen | S34860 | |
| Tamoxifen | Sigma-Aldrich | T2859 |
参考文献
- Shmarakov, I. O., et al. Retinoids stored locally in the lung are required to attenuate the severity of acute lung injury in male mice. Nat Commun. 14 (1), 851 (2023).
- Bogue, C. W., Jacobs, H. C., Dynia, D. W., Wilson, C. M., Gross, I. Retinoic acid increases surfactant protein mRNA in fetal rat lung in culture. Am J Physiol Lung Cell Mol Physiol. 271 (5), L862-L868 (1996).
- Ng-Blichfeldt, J. -. P., et al. Retinoic acid signaling balances adult distal lung epithelial progenitor cell growth and differentiation. EBioMedicine. 36, 461-474 (2018).
- Chen, F., et al. Prenatal retinoid deficiency leads to airway hyperresponsiveness in adult mice. J Clin Invest. 124 (2), 801-811 (2014).
- Esteban-Pretel, G., Marin, M. P., Renau-Piqueras, J., Barber, T., Timoneda, J. Vitamin A deficiency alters rat lung alveolar basement membrane: reversibility by retinoic acid. J Nutr Biochem. 21 (3), 227-236 (2010).
- Massaro, G. D., Massaro, D. Postnatal treatment with retinoic acid increases the number of pulmonary alveoli in rats. Am J Physiol. 270 (2 Pt 1), L305-L310 (1996).
- Hind, M., Maden, M. Retinoic acid induces alveolar regeneration in the adult mouse lung. Eur Respir J. 23 (1), 20-27 (2004).
- Belloni, P. N., Garvin, L., Mao, C. P., Bailey-Healy, I., Leaffer, D. Effects of all-trans-retinoic acid in promoting alveolar repair. Chest. 117 (5 Suppl 1), 235S-241S (2000).
- Veness-Meehan, K. A., Bottone, F. G., Stiles, A. D. Effects of retinoic acid on airspace development and lung collagen in hyperoxia-exposed newborn rats. Pediatr Res. 48 (4), 434-444 (2000).
- Cho, S. J., George, C. L., Snyder, J. M., Acarregui, M. J. Retinoic acid and erythropoietin maintain alveolar development in mice treated with an angiogenesis inhibitor. Am J Respir Cell Mol Biol. 33 (6), 622-628 (2005).
- Massaro, G. D., Massaro, D. Retinoic acid treatment abrogates elastase-induced pulmonary emphysema in rats. Nat Med. 3 (6), 675-677 (1997).
- Stinchcombe, S. V., Maden, M. Retinoic acid induced alveolar regeneration: critical differences in strain sensitivity. Am J Respir Cell Mol Biol. 38 (2), 185-191 (2008).
- Fraslon, C., Bourbon, J. R. Retinoids control surfactant phospholipid biosynthesis in fetal rat lung. Am J Physiol. 266 (6 Pt 1), L705-L712 (1994).
- Zachman, R. D. Role of vitamin A in lung development. J Nutr. 125 (6 Suppl), 1634s-1638s (1995).
- van Bennekum, A. M., et al. Lipoprotein lipase expression level influences tissue clearance of chylomicron retinyl ester. J Lipid Res. 40 (3), 565-574 (1999).
- Blaner, W. S., et al. Lipoprotein lipase hydrolysis of retinyl ester: possible implications for retinoid uptake by cells. J Biol Chem. 269 (24), 16559-16565 (1994).
- Trites, M. J., Febbraio, M., Clugston, R. D. Absence of CD36 alters systemic vitamin A homeostasis. Sci Rep. 10 (1), 20386 (2020).
- Wassef, L., Quadro, L. Uptake of dietary retinoids at the maternal-fetal barrier: in vivo evidence for the role of lipoprotein lipase and alternative pathways. J Biol Chem. 286 (37), 32198-32207 (2011).
- Spiegler, E., Kim, Y. -. K., Wassef, L., Shete, V., Quadro, L. Maternal-fetal transfer and metabolism of vitamin A and its precursor β-carotene in the developing tissues. Biochim Biophys Acta Mol Cell Biol Lipids. 1821 (1), 88-98 (2012).
- Kedishvili, N. Y. Enzymology of retinoic acid biosynthesis and degradation. J Lipid Res. 54 (7), 1744-1760 (2013).
- Channabasappa, S., Caldwell, S., Kanthan, R., Singh, B. Retinoid receptors are expressed in mouse and human lungs. Anat Rec. 305 (9), 2281-2289 (2022).
- Kimura, Y., et al. Retinoid receptors in the developing human lung. Clin Sci (Lond). 103 (6), 613-621 (2002).
- Yang, L., Naltner, A., Yan, C. Overexpression of dominant negative retinoic acid receptor alpha causes alveolar abnormality in transgenic neonatal lungs. Endocrinology. 144 (7), 3004-3011 (2003).
- Snyder, J. M., et al. Alveolarization in retinoic acid receptor-beta-deficient mice. Pediatr Res. 57 (3), 384-391 (2005).
- Gao, R. -. w., et al. Retinoic acid promotes primary fetal alveolar epithelial type II cell proliferation and differentiation to alveolar epithelial type I cells. In Vitro Cell Dev Biol Anim. 51 (5), 479-487 (2015).
- Dirami, G., et al. Lung retinol storing cells synthesize and secrete retinoic acid, an inducer of alveolus formation. Am J Physiol Lung Cell Mol Physiol. 286 (2), L249-L256 (2004).
- Massaro, G. D., Massaro, D., Chambon, P. Retinoic acid receptor-alpha regulates pulmonary alveolus formation in mice after, but not during, perinatal period. Am J Physiol Lung Cell Mol Physiol. 284 (2), L431-L433 (2003).
- Massaro, G. D., et al. Retinoic acid receptor-beta: an endogenous inhibitor of the perinatal formation of pulmonary alveoli. Physiol Genomics. 4 (1), 51-57 (2000).
- McGowan, S., et al. Mice bearing deletions of retinoic acid receptors demonstrate reduced lung elastin and alveolar numbers. Am J Respir Cell Mol Biol. 23 (2), 162-167 (2000).
- Yan, C., et al. Retinoic acid-receptor activation of SP-B gene transcription in respiratory epithelial cells. Am J Physiol Lung Cell Mol Physiol. 275 (2), L239-L246 (1998).
- Ghaffari, M., Whitsett, J. A., Yan, C. Inhibition of hSP-B promoter in respiratory epithelial cells by a dominant negative retinoic acid receptor. Am J Physiol Lung Cell Mol Physiol. 276 (3), L398-L404 (1999).
- Yang, L., et al. Synergy between signal transducer and activator of transcription 3 and retinoic acid receptor-α in regulation of the surfactant protein b gene in the lung. Mol Endocrinol. 18 (6), 1520-1532 (2004).
- Metzler, M. D., Snyder, J. M. Retinoic acid differentially regulates expression of surfactant-associated proteins in human fetal lung. Endocrinology. 133 (5), 1990-1998 (1993).
- George, T. N., Snyder, J. M. Regulation of surfactant protein gene expression by retinoic acid metabolites. Pediatr Res. 41 (5), 692-701 (1997).
- Naltner, A., Ghaffari, M., Whitsett, J. A., Yan, C. Retinoic acid stimulation of the human surfactant protein B promoter is thyroid transcription factor 1 site-dependent. J Biol Chem. 275 (1), 56-62 (2000).
- Ng-Blichfeldt, J. P., et al. Deficient retinoid-driven angiogenesis may contribute to failure of adult human lung regeneration in emphysema. Thorax. 72 (6), 510-521 (2017).
- Lochbaum, R., et al. Retinoic acid signalling adjusts tight junction permeability in response to air-liquid interface conditions. Cell Signal. 65, 109421 (2020).
- Mamidi, S., Hofer, T. P., Hoffmann, R., Ziegler-Heitbrock, L., Frankenberger, M. All-trans retinoic acid up-regulates prostaglandin-e synthase expression in human macrophages. Immunobiology. 217 (6), 593-600 (2012).
- Hashimoto, S., et al. Retinoic acid differentially regulates interleukin-1beta and interleukin-1 receptor antagonist production by human alveolar macrophages. Leuk Res. 22 (11), 1057-1061 (1998).
- Li, S., Lei, Y., Lei, J., Li, H. Alltrans retinoic acid promotes macrophage phagocytosis and decreases inflammation via inhibiting CD14/TLR4 in acute lung injury. Mol Med Rep. 24 (6), (2021).
- Nagy, N. E., et al. Storage of vitamin A in extrahepatic stellate cells in normal rats. J Lipid Res. 38 (4), 645-658 (1997).
- Thompson, K. C., et al. Primary rat and mouse hepatic stellate cells express the macrophage inhibitor cytokine interleukin-10 during the course of activation in vitro. Hepatology. 28 (6), 1518-1524 (1998).
- Zhang, X. Y., Sun, C. K., Wheatley, A. M. A novel approach to the quantification of hepatic stellate cells in intravital fluorescence microscopy of the liver using a computerized image analysis system. Microvasc Res. 60 (3), 232-240 (2000).
- D'Ambrosio, D. N., et al. Distinct populations of hepatic stellate cells in the mouse liver have different capacities for retinoid and lipid storage. PLoS One. 6 (9), e24993 (2011).
- Apte, M. V., et al. Periacinar stellate shaped cells in rat pancreas: identification, isolation, and culture. Gut. 43 (1), 128-133 (1998).
- Kim, N., et al. Formation of vitamin A lipid droplets in pancreatic stellate cells requires albumin. Gut. 58 (10), 1382-1390 (2009).
- Kida, Y., et al. Characterization of vitamin A-storing cells in mouse fibrous kidneys using Cygb/STAP as a marker of activated stellate cells. Arch Histol Cytol. 70 (2), 95-106 (2007).
- Ogawa, T., et al. Identification of vitamin A-free cells in a stellate cell-enriched fraction of normal rat liver as myofibroblasts. Histochem Cell Biol. 127 (2), 161-174 (2007).
- Tacke, F., Weiskirchen, R. Update on hepatic stellate cells: pathogenic role in liver fibrosis and novel isolation techniques. Expert Rev Gastroenterol Hepatol. 6 (1), 67-80 (2012).
- Bartneck, M., et al. Isolation and time lapse microscopy of highly pure hepatic stellate cells. Anal Cell Pathol (Amst). , (2015).
- Balaphas, A., et al. Optimized isolation and characterization of C57BL/6 mouse hepatic stellate cells. Cells. 11 (9), (2022).
- Kubota, H., Yao, H. L., Reid, L. M. Identification and characterization of vitamin A-storing cells in fetal liver: implications for functional importance of hepatic stellate cells in liver development and hematopoiesis. Stem Cells. 25 (9), 2339-2349 (2007).
- Larsen, A. K., et al. Autofluorescence in freshly isolated adult human liver sinusoidal cells. Eur J Histochem. 65 (4), (2021).
- Shaner, N. C., Patterson, G. H., Davidson, M. W. Advances in fluorescent protein technology. J Cell Sci. 120 (24), 4247-4260 (2007).
- National Research Council. . Guide for the Care and Use of Laboratory Animals. , (2011).
- O'Byrne, S. M., et al. Retinoid absorption and storage is impaired in mice lacking lecithin: retinol acyltransferase (LRAT). J Biol Chem. 280 (42), 35647-35657 (2005).
- McGowan, S. E., Torday, J. S. The pulmonary lipofibroblast (lipid interstitial cell) and its contributions to alveolar development. Annu Rev Physiol. 59, 43-62 (1997).
- McGowan, S. E. The lipofibroblast: more than a lipid-storage depot. Am J Physiol Lung Cell Mol Physiol. 316 (5), L869-L871 (2019).
- Meyer, K. A., Popper, H., Ragins, A. B. Histologic distribution of vitamin A in biopsy specimens of the liver. Arch Surg. 43 (3), 376-385 (1941).
- Popper, H. L. Histological demonstration of vitamin A in rats by means of fluorescence microscopy. Proc Soc Exp Biol Med. 43, 133-136 (1940).
- Van Exan, R. J., Hardy, M. H. Localization of vitamin A by autofluorescence during induced metaplastic changes in cultures of skin. In Vitro. 15 (8), 631-640 (1979).
- Schweigert, F. J., Siegling, C., Tzimas, G., Seeger, J., Nau, H. Distribution of endogenous retinoids, retinoid binding proteins (RBP, CRABPI) and nuclear retinoid X receptor beta (RXRbeta) in the porcine embryo. Reprod Nutr Dev. 42 (4), 285-294 (2002).
- Wake, K. Perisinusoidal stellate cells (fat-storing cells, interstitial cells, lipocytes), their related structure in and around the liver sinusoids, and vitamin A-storing cells in extrahepatic organs. Int Rev Cytol. 66, 303-353 (1980).
- Senoo, H., Kojima, N., Sato, M. Vitamin A-storing cells (stellate cells). Vitam Horm. 75, 131-159 (2007).
- Senoo, H., et al. Hepatic stellate cell (vitamin A-storing cell) and its relative--past, present and future. Cell Biol Int. 34 (12), 1247-1272 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。