Method Article
Aislamiento de células que contienen retinoides pulmonares mediante clasificación celular
En este artículo
Resumen
El protocolo que se describe a continuación es una forma sencilla y eficaz de aislar células que contienen retinoides de poblaciones de células pulmonares muy heterogéneas mediante el uso de la autofluorescencia de retinoides específicos y el empleo de la clasificación de células activadas por fluorescentes.
Resumen
Los retinoides (vitamina A y sus metabolitos) son un componente lipídico esencial del microambiente alveolar, y se requiere un metabolismo de retinoides específico del tipo celular para mantener la salud funcional de los pulmones en desarrollo y adultos. Las células pulmonares utilizan vías específicas, lo que permite la absorción eficiente de los retinoides circulantes de la sangre como retinol (ROH), seguido de la conversión escalonada intracelular de ROH en la especie de retinoide transcripcionalmente activa, ácido trans-retinoico (ATRA). La señalización mediada por ATRA (o mediada por retinoides) es crucial para regular la alveolarización pulmonar, la producción de surfactante, la angiogénesis, la permeabilidad y la inmunidad. Es importante destacar que las células pulmonares específicas, incluidos los fibroblastos, pueden acumular retinoides en forma de ésteres de retinilo (RE), que pueden almacenarse o movilizarse aún más como ROH para transferirlos a las células vecinas cuando sea necesario. Las células que contienen retinoides pulmonares pueden aislarse y recogerse de la suspensión unicelular de los pulmones digeridos mediante el uso de la autofluorescencia de retinoides (la emisión a 455 nm tras la excitación a 350 nm) y mediante el empleo de la clasificación celular activada por fluorescencia (FACS). El marcaje in vivo adicional específico de células pulmonares con proteína fluorescente roja permite aislar y recolectar poblaciones específicas de células pulmonares que contienen retinoides. Las células recolectadas se pueden analizar o cultivar directamente para realizar análisis posteriores de la morfología celular, la expresión génica y la capacidad de respuesta a las manipulaciones farmacológicas. Esta técnica de aislamiento y aplicación es importante para los estudios de modelos animales de salud pulmonar y lesión pulmonar para obtener una comprensión más profunda de los aspectos celulares del metabolismo de los retinoides en los pulmones y las comunicaciones celulares mediadas por lípidos.
Introducción
Los retinoides (vitamina A y sus metabolitos) son un componente lipídico esencial del microambiente alveolar, y el metabolismo y la señalización de los retinoides específicos del tipo celular son necesarios para mantener la salud funcional del pulmón en desarrollo y adulto 1,2,3,4,5,6,7,8,9,10,11 ,12,13,14. Las células pulmonares utilizan vías específicas, lo que permite la absorción eficiente de los retinoides circulantes derivados de la dieta de la sangre como retinol (ROH)15,16,17,18,19, seguido de la conversión escalonada intracelular de ROH en la especie de retinoide transcripcionalmente activa, ácido trans-retinoico (ATRA)20. La señalización mediada por ATRA (o mediada por retinoides) se logra a través de la interacción de ATRA con sus tres receptores de hormonas nucleares afines distintos, los receptores de ácido retinoico (RARα, RARβ y RARγ21,22), y es crucial para regular la alveolarización pulmonar 23,24,25,26,27,28,29, producción de surfactante30,31,32,33,34,35, angiogénesis36, permeabilidad37 e inmunidad 38,39,40. Es importante destacar que las células pulmonares específicas, especialmente los fibroblastos pulmonares, pueden acumular retinoides en forma de ésteres de retinilo (RE), que pueden almacenarse o movilizarse posteriormente como ROH para transferirlos a las células vecinas cuando sea necesario1.
La complejidad del metabolismo y la señalización de los retinoides, así como la complejidad celular del pulmón, hacen que los estudios destinados a explorar el metabolismo de los retinoides en el pulmón in vivo sean un desafío. Hemos esbozado un protocolo simple y robusto para aislar células que contienen retinoides (Figura 1) de poblaciones de células pulmonares altamente heterogéneas mediante el uso de la autofluorescencia retinoide específica (la emisión a 455 nm tras la excitación a 350 nm) y mediante el empleo de la clasificación celular activada por fluorescencia (FACS). El protocolo no requiere marcaje celular adicional, excepto para la tinción de viabilidad si el objetivo del estudio es aislar y caracterizar células pulmonares vivas primarias en función de su capacidad para almacenar retinoides. Esto reduce significativamente el tiempo de preparación para la clasificación de células, elimina la necesidad de tinción adicional y permite aislar altos rendimientos de células primarias viables. Sin embargo, si el objetivo del estudio es aislar y caracterizar poblaciones específicas de células pulmonares (fibroblastos, células endoteliales, epiteliales o inmunitarias), se puede realizar una clasificación celular adicional después de etiquetar las células clasificadas que contienen retinoides con anticuerpos específicos de la célula.
La autofluorescencia de retinoides se ha utilizado en estudios publicados para establecer las identidades de las células que contienen retinoides y/o para cuantificar la abundancia de estas células en el hígado 41,42,43,44, el páncreas45,46, los riñones41,47 y el pulmón41. Además, varios grupos de investigación informaron sobre el uso de la fluorescencia de retinoides para aislar por FACS y estudiar células primarias que contienen retinoides de tejidos vivos, incluyendo el hígado 44,48,49,50,51,52,53 y el pulmón 1. En el protocolo actual, mostramos cómo se pueden etiquetar poblaciones celulares específicas in vivo antes de aislar células que contienen retinoides utilizando tdTomato (proteína fluorescente roja). Las características espectrales de tdTomato (la emisión a 581 nm tras la excitación a 554 nm54) y el brillo no interfieren con la autofluorescencia de los retinoides y, por lo tanto, hacen que sea conveniente lograr la especificidad celular durante la clasificación. Dado el papel crítico del metabolismo de los retinoides no comprometidos y la señalización dentro del microambiente alveolar normal1, la técnica descrita de aislamiento de células pulmonares es una herramienta útil en los estudios de modelos animales de salud y enfermedad pulmonar para obtener una comprensión más profunda de los aspectos celulares del metabolismo de los retinoides en los pulmones y las comunicaciones celulares mediadas por lípidos in vivo.
Protocolo
Todos los procedimientos y experimentos descritos con ratones se llevaron a cabo con la aprobación del Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Rutgers (IACUC ID: PROTO202200111) de acuerdo con los criterios descritos en la Guía para el Cuidado y Uso de Animales de Laboratorio elaborada por la Academia Nacional de Ciencias55.
1. Consideraciones y preparativos para el experimento
- Ganadería y manipulaciones
NOTA: En los estudios se pueden utilizar ratones machos y hembras de tres meses de edad (10-12 semanas de edad). En los experimentos descritos se utilizaron ratones deficientes en lecitina:retinol aciltransferasa (Lrat-deficientes, Lrat-/- ratones56) con un fondo genético C57BL/6J y compañeros de camada de la misma edad (ratones de tipo salvaje, Lrat+/+). Los ratones que expresan el gen tdTomato en fibroblastos (ratones F-tdT) se generaron cruzando ratones que albergaban un casete reportero tdTomato (B6. Cg-Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J, Jackson Lab cepa #007914) con ratones Col1a2-CreER (B6. Cg-Tg (Col1a2-Cre / ERT, -ALPP) 7Cpd / 2J, cepa de Jackson Lab # 029567).- Emplee el modelo de ratón que expresa Cre, una de las muchas opciones disponibles para etiquetar la población de células objetivo in vivo.
NOTA: Dependiendo de la elección de la célula objetivo, la expresión de Cre, la eficiencia de la recombinación mediada por Cre y la especificidad de la célula, los investigadores pueden utilizar cualquier modelo de ratón fiable que exprese Cre. - Utilice la expresión del transgén tdTomato (tras el tratamiento con tamoxifeno como se describe a continuación) para marcar los fibroblastos Col1a2+ , seguido de su aislamiento a partir de suspensiones unicelulares del pulmón digerido como se describe a continuación.
- Emplee el modelo de ratón que expresa Cre, una de las muchas opciones disponibles para etiquetar la población de células objetivo in vivo.
- Recombinación mediada por Cre y activación de transgenes in vivo
- Inducir la expresión de Cre en ratones F-tdT mediante la inyección intraperitoneal (IP) de 2 mg de tamoxifeno una vez cada 24 h durante un total de 5 días consecutivos.
- Desinfecte el lugar de la inyección con etanol al 70% antes de la inyección. Utilice los ratones para experimentos 1 mes después de la última inyección de tamoxifeno.
- Comprobar la eficacia de la recombinación de Cre antes de los experimentos de clasificación. Confirmar la recombinación efectiva de Cre y la expresión de tdTomato aislando la población celular diana de fibroblastos pulmonares de los ratones F-tdT tratados con tamoxifeno utilizando perlas magnéticas anti-Pdgfrα y clasificación de células activadas magnéticamente (MACS).
- Preparación de soluciones, plástico y cristalería
NOTA: Se deben seguir técnicas asépticas para los procedimientos que se describen a continuación. Los procedimientos que involucran preparaciones de solución, digestión de tejidos y aislamiento celular deben realizarse bajo la cubierta laminar. Las soluciones deben esterilizarse por filtración con un filtro de 0,2 μm; Las herramientas quirúrgicas, así como el material de laboratorio, deben esterilizarse en autoclave.- Bajo el capó laminar, prepare la solución salina equilibrada de Hanks (HBSS), libre de calcio y magnesio (HBSS sin Ca2+/Mg2+, que contiene 5,3 mM de KCl, 0,4 mM de KH2PO4, 4,2 mM de NaHCO3, 137,9 mM de NaCl, 0,3 mM de Na2HPO4, 5,6 mM de D-glucosa) para la perfusión pulmonar (5 mL por ratón). Esterilice la solución con un filtro de 0,2 μm y llene la jeringa con la solución.
- Bajo la cubierta laminar, prepare la solución salina equilibrada de Hanks con calcio y magnesio (HBSS con Ca2+/Mg2+, que contiene 1,3 mM CaCl2, 0,5 MgCl2·6H2O, 0,4 mM MgSO4·7H2O, 5,3 mM KCl, 0,4 mM KH2PO4, 4,2 mM NaHCO3, 137,9 mM NaCl, 0,3 mM Na2HPO4, 5,6 mM D-Glucosa), que contiene 0,3 mg/mL de colagenasa tipo IV y 1 mg/mL de dispasa para la perfusión pulmonar (10 mL por ratón). Esterilice la solución con un filtro de 0,2 μm y llene la jeringa con la solución.
- Bajo la cubierta laminar, prepare HBSS con Ca2+/Mg2+, que contenga 0,3 mg/ml de colagenasa tipo IV, 1 mg/ml de dispasa y 5 mg/ml de DNasa I para la digestión pulmonar (10 ml por ratón). Esterilice la solución con un filtro de 0,2 μm y llene la jeringa con la solución.
- Bajo la cubierta laminar, llene una placa de cultivo celular (35 mm 10 mm, una placa por pulmón recolectado de un ratón) con 2 mL de HBSS estéril con Ca2+/Mg2+. Coloque los platos que contienen HBSS con Ca2+/Mg2+ en hielo.
2. Perfusión pulmonar, digestión y recolección de suspensión unicelular
- Anestesiar al ratón administrando un cóctel de anestesia que contenga 10 mg/mL de ketamina y 2 mg/mL de xilacina a una dosis de 0,01 mL/g de peso corporal mediante inyección IP.
- Asegúrese de que el ratón esté en un estado profundo de inconsciencia evaluando la respuesta de pellizco del dedo del pie. Retire el cabello suelto y la suciedad/residuos visibles del sitio quirúrgico, corte y limpie el sitio quirúrgico con alcohol al 70% para la desinfección.
- Con el uso de herramientas quirúrgicas estériles, abra las cavidades abdominal y torácica. Corta las costillas y el diafragma para exponer los pulmones y el corazón.
NOTA: Esto asegurará una muerte instantánea ya que la toracotomía provocará un cese de la respiración mientras el ratón está anestesiado; Si se realiza correctamente, esta parte del procedimiento tomará hasta 3 minutos desde el inicio del procedimiento hasta la toracotomía, seguida de la muerte del animal. - Corta la vena cava inferior y aplica una almohadilla absorbente para absorber la sangre liberada.
- Perfundir los pulmones in situ a través del ventrículo derecho del corazón usando una jeringa de 10 mL con una aguja de 25 G X 1" llena con 5 mL de HBSS estéril sin Ca2+/Mg2+. Si la perfusión es exitosa, el tejido pulmonar se volverá blanco.
- Perfundir los pulmones in situ utilizando una jeringa de 10 mL con una aguja de 25 G X 1" llena de 10 mL de HBSS estéril con Ca2+/Mg2+, que contiene colagenasa tipo IV (0,3 mg/mL) y dispasa (1 mg/mL).
- Extraer los pulmones y transferirlos a una placa de cultivo celular (35 mm X 10 mm) con 2 mL de HBSS estéril con Ca2+/Mg2+.
- Debajo de la capucha laminar, enjuague los pulmones y píquelos en pedazos pequeños con una cuchilla quirúrgica estéril (# 20, se adapta al mango # 4). Transfiera el pulmón picado a un tubo de 15 mL agregando los primeros 5 mL de HBSS con Ca2+/Mg2+ que contenga 0,3 mg/mL de colagenasa tipo IV, 1 mg/mL de dispasa y 5 mg/mL de DNasa I al tejido picado y transfiriéndolo usando una pipeta serológica de 10 mL. Recoja y transfiera los residuos restantes de tejido picado lavando la placa de cultivo celular con los 5 mL restantes de HBSS con Ca2+/Mg2+ que contiene 0,3 mg/mL de colagenasa tipo IV, 1 mg/mL de dispasa y 5 mg/mL de DNasa I.
- Incubar el tejido pulmonar picado en HBSS con Ca2+/Mg2+ que contiene 0,3 mg/mL de colagenasa tipo IV, 1 mg/mL de dispasa y 5 mg/mL de DNasa I en un agitador giratorio mantenido a 37 °C durante 45 min. En cada uno de los tres intervalos de 15 minutos, bajo la cubierta laminar, se pasa el tejido picado 10 veces a través de una pipeta serológica de 10 mL para disociar mejor las células.
- Pase la suspensión celular resultante a través de un colador de 100 μm para recolectar células individuales en un tubo de 50 mL que contiene 20 mL de solución de imágenes de células vivas frías (solución salina fisiológica que contiene 20 mM de HEPES, pH 7.4) que contiene menos del 5% de suero fetal bovino (FBS). Recoja las células por centrifugación a 500 g durante 10 min a 4 °C.
- Aspirar el sobrenadante y resuspender el pellet celular en 1 mL de tampón de lisado de glóbulos rojos y dejar el tubo durante 5 min a temperatura ambiente (RT) para eliminar los eritrocitos. Agregue 20 ml de solución fría para imágenes de células vivas que contenga menos del 5% de FBS. Recoja las células por centrifugación a 500 g durante 10 min a 4 °C.
- Aspire el sobrenadante y vuelva a suspender el pellet de células en 20 ml de solución de imágenes de células vivas frías que contenga menos del 5% de FBS. Pase la suspensión celular resultante a través de un filtro de 40 μm para recolectar células individuales en un tubo de 50 mL que contiene 20 mL de solución de imágenes de células vivas frías que contiene menos del 5% de FBS. Recoja las células por centrifugación a 500 g durante 10 min a 4 °C.
- Aspire el sobrenadante y vuelva a suspender el pellet de células en 10 ml de solución fría para imágenes de células vivas que contenga menos del 5% de FBS. Cuente las células y ajuste la concentración de células a ~5-10 x 106 células/mL.
3. Aislamiento de células pulmonares que contienen retinoides mediante clasificación de células activadas por fluorescencia (FACS)
- Tome una alícuota de suspensión de celdas y déjela a un lado para usarla como un control de compuerta sin manchas. Añadir el colorante de viabilidad SYTOX Green a la suspensión celular restante (dilución 1:1000, concentración final 30 nM).
- Pase las suspensiones celulares a través del filtro conectado al tubo colector de poliestireno de 5 mL (12 x 75 mm).
- Proceda con el aislamiento de células FACS clasificando las células vivas que contienen retinoides individuales en función de su emisión a 455 nm. Realice la discriminación secuencial de singletes utilizando un gráfico para la dispersión directa (altura de dispersión directa/FSC-H frente a área de dispersión directa/FSC-A). Excluya las células muertas por características de dispersión (dispersión lateral) y tinción con SYTOX Green.
- Detecte, clasifique y recoja células individuales, vivas y que contengan retinoides, utilizando la emisión a 455 nm tras la excitación a 350 nm.
NOTA: Utilizando el procedimiento descrito, se pueden recolectar alrededor de 5'105 células pulmonares que contienen retinoides de un pulmón de ratón. - Realice análisis de datos FACS utilizando software de citometría de flujo.
Resultados
Aislamiento de células pulmonares que contienen retinoides pulmonares
Los pulmones de ratón (de Lrat+/+ y Lrat-/-) se digierieron enzimáticamente, y las suspensiones unicelulares se prepararon y sometieron a FACS de acuerdo con el procedimiento descrito anteriormente. La clasificación celular y la adquisición de datos se realizaron en un sistema clasificador de células Cytek Aurora™ operado por el software SpectroFlo CS versión 1.3.0 utilizando una boquilla de 100 μm y una presión de 15 psi. En primer lugar, se aplicaron gráficos para la dispersión directa (altura de dispersión directa/FSC-H frente a área de dispersión directa/FSC-A) para seleccionar y controlar las células individuales (singletes), seguidas de la discriminación de células muertas mediante dispersión lateral y tinción SYTOX Green (Figura 2). Finalmente, para clasificar la población objetivo de células que contienen retinoides, se seleccionó una población distinta de células individuales vivas con alta autofluorescencia a λ = 455 nm (Figura 2A). Para confirmar la especificidad de la marcha aplicada y el enfoque general, se utilizó la suspensión de células pulmonares de los ratones Lrat-/- como control negativo para ajustar la activación de la autofluorescencia de los retinoides. Los ratones Lrat-/- son incapaces de sintetizar REs y no pueden acumular retinoides en sus pulmones1. En particular, utilizando la misma estrategia de compuerta FACS, no se puede detectar una población celular distinta con alta autofluorescencia a λ = 455 nm en la suspensión de una sola célula de los pulmones Lrat-/- (Figura 2B).
Una vez recolectadas, las células primarias que contienen retinoides pulmonares se pueden analizar o cultivar directamente para análisis posteriores de las concentraciones de retinoides, la morfología celular, la expresión génica y la capacidad de respuesta a las manipulaciones farmacológicas (Figura 1).
Utilizando este procedimiento, pudimos demostrar anteriormente que diferentes poblaciones celulares están presentes entre las células que contienen retinoidespulmonares 1. Específicamente, al llevar a cabo la secuenciación de ARN de una sola célula de células que contienen retinoides recolectadas por FACS, demostramos que entre estas células el grupo de células estromales (83% del total de células recolectadas) era el más abundante, seguido por las endoteliales (7% del total de células recolectadas), epiteliales (5% del total de células recolectadas) y las células mieloides (aproximadamente el 5% del total de células recolectadas)1. Los datos sobre la heterogeneidad de las células pulmonares aisladas que contienen retinoides no disminuyen la especificidad del procedimiento descrito; Más bien, estos datos ponen de relieve una complejidad previamente insospechada del metabolismo de los retinoides en el pulmón adulto que involucra células fenotípicamente diversas y una amplia comunicación celular mediada por retinoides.
Aislamiento de células pulmonares que contienen retinoides Col1a2+
Dada la presencia de poblaciones celulares heterogéneas entre las células aisladas que contienen retinoides, los investigadores pueden querer centrarse en el estudio de un tipo específico de células pulmonares implicadas en el metabolismo de los retinoides. Para ello, se puede realizar un marcaje adicional in vivo específico de la población de células diana.
Entre las poblaciones de células pulmonares altamente heterogéneas, una subpoblación de células estromales mesenquimales pulmonares con características fibroblásticas, denominadas células intersticiales lipídicas pulmonares o lipofibroblastos pulmonares, es el tipo de célula predominante capaz de acumular retinoides 1,57,58. Para etiquetar una subpoblación de fibroblastos pulmonares in vivo, se generaron ratones que expresaban el gen tdTomato en fibroblastos (ratones F-tdT) cruzando ratones que albergaban un casete reportero tdTomato con ratones Col1a2-CreER. La expresión de Cre en ratones F-tdT se indujo mediante la inyección ip de 2 mg de tamoxifeno una vez cada 24 h durante un total de 5 días consecutivos; Un mes después de la última inyección de tamoxifeno, los ratones se utilizaron para experimentos. Este enfoque permitió marcar fibroblastos Col1a2+ con proteína tdTomato y su aislamiento a partir de suspensiones unicelulares del pulmón digerido mediante un procedimiento descrito anteriormente. El enfoque permite capturar células vivas (SYTOX Green negativas) de un solo tdTomato+ (Figura 3). A continuación, se puede segregar una subpoblación de células que contienen retinoides de todas las células tdTomato+ capturadas utilizando una estrategia de compuerta basada en la autofluorescencia de retinoides (Figura 3) como se ha descrito anteriormente. Además, este procedimiento permite la clasificación posterior y la recolección separada de diferentes poblaciones de células tdTomato+ en función de la intensidad de la señal de fluorescencia de retinoides en subpoblaciones celulares con alto, intermedio y bajo contenido de retinoides.
La recombinación efectiva de Cre y la expresión de tdTomato se confirmaron mediante el aislamiento de la población celular diana de fibroblastos pulmonares de los ratones F-tdT tratados con tamoxifeno (Figura 4A) utilizando perlas magnéticas anti-Pdgfrα y clasificación de células activadas magnéticamente (MACS). Además, se llevó a cabo un análisis de HPLC para confirmar la presencia de retinoides en las células clasificadas que contenían retinoides (Figura 4B).
Una vez recolectados, los fibroblastos primarios que contienen retinoides pulmonares se pueden analizar o cultivar directamente para análisis posteriores de la concentración de retinoides, la morfología celular, la expresión génica y la respuesta a las manipulaciones farmacológicas. Por ejemplo, uno de los rasgos característicos de los fibroblastos pulmonares que contienen retinoides pulmonares aislados de un animal de tipo salvaje (Lrat+/+) es la presencia de gotas de lípidos que pueden visualizarse en células cultivadas mediante técnicas inmunocitoquímicas estándar (Figura 4C).
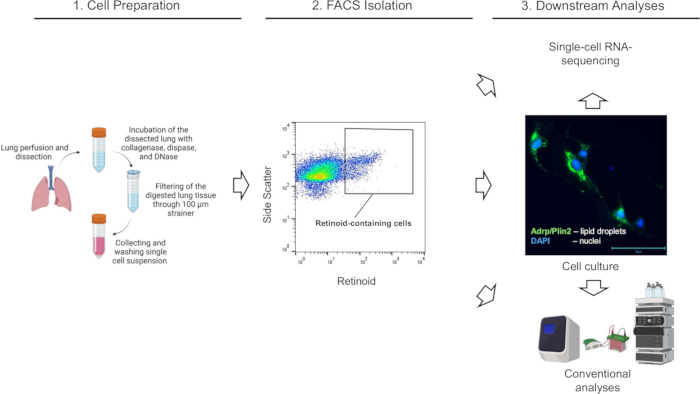
Figura 1: Una representación esquemática del flujo de trabajo experimental descrito. Haga clic aquí para ver una versión más grande de esta figura.
(Creado con Biorender.com)

Figura 2: Aislamiento de FACS de células que contienen retinoides pulmonares. (A) Una estrategia de compuerta para clasificar células individuales, vivas, que contienen retinoides (definidas por el área cerrada) utilizando la emisión a λ = 455 nm tras la excitación a λ = 350 nm de suspensiones de células pulmonares aisladas de un ratón C57Bl6/J (Lrat+/+) de tipo salvaje. (B) Una estrategia de compuerta para clasificar células individuales, vivas, que contienen retinoides utilizando la emisión a λ = 455 nm tras la excitación a λ = 350 nm aplicada a suspensiones de células pulmonares aisladas de un ratón Lrat-/- ; el área cerrada no muestra células retinoides detectadas en los pulmones Lrat-/- ; Los números indican el porcentaje de celdas cerradas. Haga clic aquí para ver una versión más grande de esta figura.
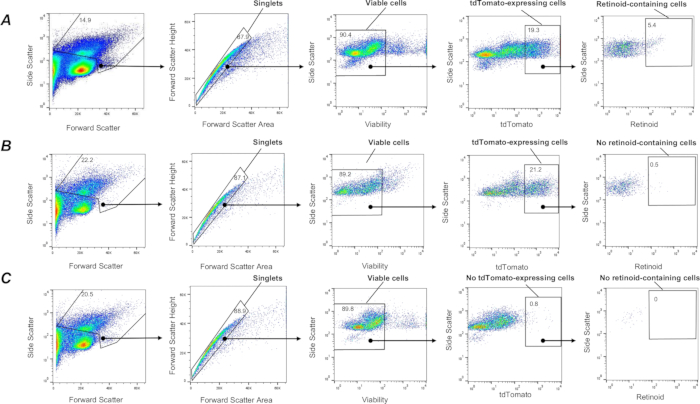
Figura 3: Aislamiento FACS de fibroblastos Col1a2+ que contienen retinoides pulmonares. (A) Una estrategia de compuerta para clasificar células individuales vivas que contienen retinoidoides tdTomato+ (definidas por el área encerrada) utilizando la emisión a λ = 455 nm tras la excitación a λ = 350 nm de suspensiones de células pulmonares aisladas de un ratón F-TdTom en un fondo genético de tipo salvaje (C57Bl6/J). Panel (B) Una estrategia de compuerta para clasificar células individuales vivas que contienen retinoide tdTomato+ (definidas por el área cerrada) utilizando la emisión a λ = 455 nm tras la excitación a λ = 350 nm aplicada a suspensiones de células pulmonares aisladas de un ratón F-TdTom en un fondo Lrat-/- (C57Bl6/J); El área cerrada no muestra ninguna célula que contenga retinoides detectada en los pulmones de ratones F-TdTom en un fondo Lrat-/-. (C) Una estrategia de compuerta para clasificar células individuales vivas que contienen retinoide tdTomato+ (definidas por el área cerrada) utilizando la emisión a λ = 455 nm tras la excitación a λ = 350 nm aplicada a suspensiones de células pulmonares aisladas de un ratón tdTomato; el área cerrada muestra que no se ha detectado ningún tdTomato+; Los números indican el porcentaje de celdas cerradas. Haga clic aquí para ver una versión más grande de esta figura.
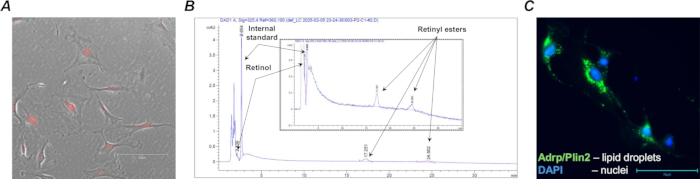
Figura 4: Fibroblastos Col1a2+ / tdTomato+ que contienen retinoides. (A) Una microfotografía representativa de células pulmonares Col1a2+ / tdTomato+ aisladas de tipo silvestre (Lrat+/+) MACS en cultivo; las células cultivadas con fluorescencia característica de tdTomato se capturaron utilizando el filtro TX Red y un aumento de 20x; la barra de escala es de 150 μm. (B) Un perfil de HPLC (con aumento insertado) que muestra picos característicos y tiempos de retención de especies de retinoides (retinol y ésteres de retinilo) extraídos de 1,105 células clasificadas que contienen retinoides. (C) Una microfotografía representativa de células pulmonares Col1a2+ / tdTomato+ aisladas de FACS de tipo silvestre (Lrat+/+) en cultivo teñidas para la proteína relacionada con la diferenciación adiposa asociada a gotas de lípidos (Adrp/Perilipin 2); las células teñidas se capturaron con filtro GFP y aumento de 40x; La barra de escala es de 75 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La capacidad de detección de vitamina A en tejidos humanos y animales y su visualización histológica mediante microscopía fluorescente se informó por primera vez en la década de 1940 59,60. El fenómeno de la autofluorescencia de los retinoides se aplicó con éxito a los estudios destinados a localizar altas concentraciones de vitamina A en los tejidos in vitro61 y a caracterizar la morfogénesis de los tejidos embrionarios animales62 mediante microscopía fluorescente. Más tarde se observó y confirmó experimentalmente que la autofluorescencia distintiva de los retinoides celulares (excitación a λ = 350 nm con la característica emisión azul-verde a λ = 455 nm) se asocia con tipos celulares específicos y, por lo tanto, se puede aplicar para aislar y caracterizar estas células 63,64,65.
La autofluorescencia de retinoides se ha utilizado en estudios publicados para establecer las identidades de las células que contienen retinoides y/o para cuantificar la abundancia de estas células en el hígado 41,42,43,44, el páncreas45,46, los riñones41,47 y el pulmón41. Además, varios grupos de investigación informaron sobre el uso de la fluorescencia de retinoides para aislar por FACS y estudiar células primarias que contienen retinoides de tejidos vivos, incluyendo el hígado 44,48,49,50,51,52,53 y el pulmón 1.
Aquí, describimos el protocolo en el que la autofluorescencia de retinoides se puede utilizar como característica principal para identificar y clasificar las células que contienen retinoides pulmonares mediante FACS. Los retinoides fluorescentes detectados incluyen retinol y ésteres de retinilo solamente. Por lo tanto, solo se pueden clasificar las células que contienen estos derivados de la vitamina A (principalmente ésteres de retinilo). Además, proporcionamos un avance adicional del protocolo en el que los investigadores pueden utilizar enfoques adicionales de etiquetado específicos de células para reducir la especificidad de la célula. Esto se puede lograr mediante el marcaje de células que contienen retinoides pulmonares con anticuerpos conjugados con fluorocromo y una clasificación adicional1. Alternativamente, se puede lograr un marcaje celular adicional de las células pulmonares in vivo mediante la expresión de proteínas fluorescentes reporteras utilizando modelos animales que expresan Cre-recombinasa específicos de la célula después de la validación de la eficiencia de expresión de Cre y la especificidad celular. El protocolo descrito aquí destaca el uso de la expresión de la proteína tdTomato impulsada por Co1a2 en fibroblastos pulmonares como una de las muchas opciones de este enfoque. Sin embargo, este enfoque se puede aplicar a otros tipos de células pulmonares, incluidas las células endoteliales, epiteliales y mieloides, cuando se utiliza un modelo de expresión de Cre adecuado.
El protocolo descrito también se puede aplicar a aislamientos celulares de los pulmones lesionados (inflamados, fibróticos, etc.); Sin embargo, en este caso, se deben tener en cuenta varias limitaciones. Las lesiones pulmonares se asocian a una disminución progresiva de las concentraciones de retinoides1, lo que, por lo tanto, puede limitar la aplicación de este protocolo y reducir el rendimiento celular. Por otro lado, las lesiones pulmonares se asocian con la activación de fibroblastos y la expresión elevada de proteínas de la matriz extracelular, incluida la Col1a2. Dado que la expresión de Cre es impulsada por el promotor de Col1a2, la expresión de tdTomato puede mejorarse, afectando así al número de células que expresan tdTomato, así como a la intensidad de la señal de tdTomato en los pulmones de los ratones F-tdT que se utilizaron en nuestro estudio.
En conjunto, el protocolo descrito aquí proporciona una herramienta específica y poderosa para obtener una visión más profunda de los aspectos celulares del metabolismo de los retinoides en los pulmones y las comunicaciones celulares mediadas por lípidos in vivo.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por una subvención de los Institutos Nacionales de Salud/Instituto Nacional del Corazón, los Pulmones y la Sangre (NIH/NHLBI) R01 HL171112 (a I.S.), un premio de desarrollo profesional (a I.S.) del Centro de Exposiciones y Enfermedades Ambientales de Rutgers financiado por los Institutos Nacionales de Salud/Instituto Nacional de Ciencias de la Salud Ambiental (NIH/NIEHS) P30 ES005022, y fondos de puesta en marcha de Rutgers, la Universidad Estatal de Nueva Jersey (a I.S.). Los autores desean agradecer al personal del Recurso Compartido de Monitoreo Inmunitario y Citometría de Flujo del Instituto Oncológico de Rutgers (financiado, en parte, con fondos del NCI-CCSG P30CA072770-5920) por sus contribuciones al trabajo presentado en este manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 10 mL serological pipette | Avantor/VWR | 76452-284 | |
| 100 µm strainer | Greiner Bio-One | 542000 | |
| 15 mL falcon tube | Corning | 352099 | |
| 40 µm strainer | Greiner Bio-One | 542040 | |
| 50 mL falcon tube | Corning | 352070 | |
| Cell culture dish, 35 mm ´ 10 mm | Corning | 430165 | |
| Cell sorting media | Gibco | A59688DJ | |
| Collagenase type IV | Worthington Biochemical Corporation | LS004188 | |
| Cytek Aurora Cell Sorter System | Cytek Biosciences | ||
| Dispase II | Sigma-Aldrich | D4693 | |
| DNase I | Sigma-Aldrich | DN25 | |
| Falcon brand 5-ml polypropylene round bottom tube, 12 mm ´ 75 mm | Corning | 352063 | |
| Falcon brand 5-ml polystyrene round-bottom tube with cell-strainer cap, 12 mm ´ 75 mm | Corning | 352235 | |
| FlowJo software | Becton Dickinson | flow cytometry software | |
| HBSS with Ca2+/Mg2+ | Gibco | 14925-092 | |
| HBSS without Ca2+/Mg2+ | Gibco | 14175-095 | |
| Nalgene Rapid-Flow Sterile Disposable Bottle Top Filters | ThermoFisher | 595-3320 | |
| Red Cell lysis buffer | Sigma-Aldrich | R7757 | |
| SpectroFlo CS software | Cytek Biosciences | Version 1.3.0 | |
| Surgical Design Royaltek Stainless Steel Surgical Scalpel Blades | Fisher Scientific | 22-079-683 | |
| SYTOX Green dead cell stain | Invitrogen | S34860 | |
| Tamoxifen | Sigma-Aldrich | T2859 |
Referencias
- Shmarakov, I. O., et al. Retinoids stored locally in the lung are required to attenuate the severity of acute lung injury in male mice. Nat Commun. 14 (1), 851 (2023).
- Bogue, C. W., Jacobs, H. C., Dynia, D. W., Wilson, C. M., Gross, I. Retinoic acid increases surfactant protein mRNA in fetal rat lung in culture. Am J Physiol Lung Cell Mol Physiol. 271 (5), L862-L868 (1996).
- Ng-Blichfeldt, J. -. P., et al. Retinoic acid signaling balances adult distal lung epithelial progenitor cell growth and differentiation. EBioMedicine. 36, 461-474 (2018).
- Chen, F., et al. Prenatal retinoid deficiency leads to airway hyperresponsiveness in adult mice. J Clin Invest. 124 (2), 801-811 (2014).
- Esteban-Pretel, G., Marin, M. P., Renau-Piqueras, J., Barber, T., Timoneda, J. Vitamin A deficiency alters rat lung alveolar basement membrane: reversibility by retinoic acid. J Nutr Biochem. 21 (3), 227-236 (2010).
- Massaro, G. D., Massaro, D. Postnatal treatment with retinoic acid increases the number of pulmonary alveoli in rats. Am J Physiol. 270 (2 Pt 1), L305-L310 (1996).
- Hind, M., Maden, M. Retinoic acid induces alveolar regeneration in the adult mouse lung. Eur Respir J. 23 (1), 20-27 (2004).
- Belloni, P. N., Garvin, L., Mao, C. P., Bailey-Healy, I., Leaffer, D. Effects of all-trans-retinoic acid in promoting alveolar repair. Chest. 117 (5 Suppl 1), 235S-241S (2000).
- Veness-Meehan, K. A., Bottone, F. G., Stiles, A. D. Effects of retinoic acid on airspace development and lung collagen in hyperoxia-exposed newborn rats. Pediatr Res. 48 (4), 434-444 (2000).
- Cho, S. J., George, C. L., Snyder, J. M., Acarregui, M. J. Retinoic acid and erythropoietin maintain alveolar development in mice treated with an angiogenesis inhibitor. Am J Respir Cell Mol Biol. 33 (6), 622-628 (2005).
- Massaro, G. D., Massaro, D. Retinoic acid treatment abrogates elastase-induced pulmonary emphysema in rats. Nat Med. 3 (6), 675-677 (1997).
- Stinchcombe, S. V., Maden, M. Retinoic acid induced alveolar regeneration: critical differences in strain sensitivity. Am J Respir Cell Mol Biol. 38 (2), 185-191 (2008).
- Fraslon, C., Bourbon, J. R. Retinoids control surfactant phospholipid biosynthesis in fetal rat lung. Am J Physiol. 266 (6 Pt 1), L705-L712 (1994).
- Zachman, R. D. Role of vitamin A in lung development. J Nutr. 125 (6 Suppl), 1634s-1638s (1995).
- van Bennekum, A. M., et al. Lipoprotein lipase expression level influences tissue clearance of chylomicron retinyl ester. J Lipid Res. 40 (3), 565-574 (1999).
- Blaner, W. S., et al. Lipoprotein lipase hydrolysis of retinyl ester: possible implications for retinoid uptake by cells. J Biol Chem. 269 (24), 16559-16565 (1994).
- Trites, M. J., Febbraio, M., Clugston, R. D. Absence of CD36 alters systemic vitamin A homeostasis. Sci Rep. 10 (1), 20386 (2020).
- Wassef, L., Quadro, L. Uptake of dietary retinoids at the maternal-fetal barrier: in vivo evidence for the role of lipoprotein lipase and alternative pathways. J Biol Chem. 286 (37), 32198-32207 (2011).
- Spiegler, E., Kim, Y. -. K., Wassef, L., Shete, V., Quadro, L. Maternal-fetal transfer and metabolism of vitamin A and its precursor β-carotene in the developing tissues. Biochim Biophys Acta Mol Cell Biol Lipids. 1821 (1), 88-98 (2012).
- Kedishvili, N. Y. Enzymology of retinoic acid biosynthesis and degradation. J Lipid Res. 54 (7), 1744-1760 (2013).
- Channabasappa, S., Caldwell, S., Kanthan, R., Singh, B. Retinoid receptors are expressed in mouse and human lungs. Anat Rec. 305 (9), 2281-2289 (2022).
- Kimura, Y., et al. Retinoid receptors in the developing human lung. Clin Sci (Lond). 103 (6), 613-621 (2002).
- Yang, L., Naltner, A., Yan, C. Overexpression of dominant negative retinoic acid receptor alpha causes alveolar abnormality in transgenic neonatal lungs. Endocrinology. 144 (7), 3004-3011 (2003).
- Snyder, J. M., et al. Alveolarization in retinoic acid receptor-beta-deficient mice. Pediatr Res. 57 (3), 384-391 (2005).
- Gao, R. -. w., et al. Retinoic acid promotes primary fetal alveolar epithelial type II cell proliferation and differentiation to alveolar epithelial type I cells. In Vitro Cell Dev Biol Anim. 51 (5), 479-487 (2015).
- Dirami, G., et al. Lung retinol storing cells synthesize and secrete retinoic acid, an inducer of alveolus formation. Am J Physiol Lung Cell Mol Physiol. 286 (2), L249-L256 (2004).
- Massaro, G. D., Massaro, D., Chambon, P. Retinoic acid receptor-alpha regulates pulmonary alveolus formation in mice after, but not during, perinatal period. Am J Physiol Lung Cell Mol Physiol. 284 (2), L431-L433 (2003).
- Massaro, G. D., et al. Retinoic acid receptor-beta: an endogenous inhibitor of the perinatal formation of pulmonary alveoli. Physiol Genomics. 4 (1), 51-57 (2000).
- McGowan, S., et al. Mice bearing deletions of retinoic acid receptors demonstrate reduced lung elastin and alveolar numbers. Am J Respir Cell Mol Biol. 23 (2), 162-167 (2000).
- Yan, C., et al. Retinoic acid-receptor activation of SP-B gene transcription in respiratory epithelial cells. Am J Physiol Lung Cell Mol Physiol. 275 (2), L239-L246 (1998).
- Ghaffari, M., Whitsett, J. A., Yan, C. Inhibition of hSP-B promoter in respiratory epithelial cells by a dominant negative retinoic acid receptor. Am J Physiol Lung Cell Mol Physiol. 276 (3), L398-L404 (1999).
- Yang, L., et al. Synergy between signal transducer and activator of transcription 3 and retinoic acid receptor-α in regulation of the surfactant protein b gene in the lung. Mol Endocrinol. 18 (6), 1520-1532 (2004).
- Metzler, M. D., Snyder, J. M. Retinoic acid differentially regulates expression of surfactant-associated proteins in human fetal lung. Endocrinology. 133 (5), 1990-1998 (1993).
- George, T. N., Snyder, J. M. Regulation of surfactant protein gene expression by retinoic acid metabolites. Pediatr Res. 41 (5), 692-701 (1997).
- Naltner, A., Ghaffari, M., Whitsett, J. A., Yan, C. Retinoic acid stimulation of the human surfactant protein B promoter is thyroid transcription factor 1 site-dependent. J Biol Chem. 275 (1), 56-62 (2000).
- Ng-Blichfeldt, J. P., et al. Deficient retinoid-driven angiogenesis may contribute to failure of adult human lung regeneration in emphysema. Thorax. 72 (6), 510-521 (2017).
- Lochbaum, R., et al. Retinoic acid signalling adjusts tight junction permeability in response to air-liquid interface conditions. Cell Signal. 65, 109421 (2020).
- Mamidi, S., Hofer, T. P., Hoffmann, R., Ziegler-Heitbrock, L., Frankenberger, M. All-trans retinoic acid up-regulates prostaglandin-e synthase expression in human macrophages. Immunobiology. 217 (6), 593-600 (2012).
- Hashimoto, S., et al. Retinoic acid differentially regulates interleukin-1beta and interleukin-1 receptor antagonist production by human alveolar macrophages. Leuk Res. 22 (11), 1057-1061 (1998).
- Li, S., Lei, Y., Lei, J., Li, H. Alltrans retinoic acid promotes macrophage phagocytosis and decreases inflammation via inhibiting CD14/TLR4 in acute lung injury. Mol Med Rep. 24 (6), (2021).
- Nagy, N. E., et al. Storage of vitamin A in extrahepatic stellate cells in normal rats. J Lipid Res. 38 (4), 645-658 (1997).
- Thompson, K. C., et al. Primary rat and mouse hepatic stellate cells express the macrophage inhibitor cytokine interleukin-10 during the course of activation in vitro. Hepatology. 28 (6), 1518-1524 (1998).
- Zhang, X. Y., Sun, C. K., Wheatley, A. M. A novel approach to the quantification of hepatic stellate cells in intravital fluorescence microscopy of the liver using a computerized image analysis system. Microvasc Res. 60 (3), 232-240 (2000).
- D'Ambrosio, D. N., et al. Distinct populations of hepatic stellate cells in the mouse liver have different capacities for retinoid and lipid storage. PLoS One. 6 (9), e24993 (2011).
- Apte, M. V., et al. Periacinar stellate shaped cells in rat pancreas: identification, isolation, and culture. Gut. 43 (1), 128-133 (1998).
- Kim, N., et al. Formation of vitamin A lipid droplets in pancreatic stellate cells requires albumin. Gut. 58 (10), 1382-1390 (2009).
- Kida, Y., et al. Characterization of vitamin A-storing cells in mouse fibrous kidneys using Cygb/STAP as a marker of activated stellate cells. Arch Histol Cytol. 70 (2), 95-106 (2007).
- Ogawa, T., et al. Identification of vitamin A-free cells in a stellate cell-enriched fraction of normal rat liver as myofibroblasts. Histochem Cell Biol. 127 (2), 161-174 (2007).
- Tacke, F., Weiskirchen, R. Update on hepatic stellate cells: pathogenic role in liver fibrosis and novel isolation techniques. Expert Rev Gastroenterol Hepatol. 6 (1), 67-80 (2012).
- Bartneck, M., et al. Isolation and time lapse microscopy of highly pure hepatic stellate cells. Anal Cell Pathol (Amst). , (2015).
- Balaphas, A., et al. Optimized isolation and characterization of C57BL/6 mouse hepatic stellate cells. Cells. 11 (9), (2022).
- Kubota, H., Yao, H. L., Reid, L. M. Identification and characterization of vitamin A-storing cells in fetal liver: implications for functional importance of hepatic stellate cells in liver development and hematopoiesis. Stem Cells. 25 (9), 2339-2349 (2007).
- Larsen, A. K., et al. Autofluorescence in freshly isolated adult human liver sinusoidal cells. Eur J Histochem. 65 (4), (2021).
- Shaner, N. C., Patterson, G. H., Davidson, M. W. Advances in fluorescent protein technology. J Cell Sci. 120 (24), 4247-4260 (2007).
- National Research Council. . Guide for the Care and Use of Laboratory Animals. , (2011).
- O'Byrne, S. M., et al. Retinoid absorption and storage is impaired in mice lacking lecithin: retinol acyltransferase (LRAT). J Biol Chem. 280 (42), 35647-35657 (2005).
- McGowan, S. E., Torday, J. S. The pulmonary lipofibroblast (lipid interstitial cell) and its contributions to alveolar development. Annu Rev Physiol. 59, 43-62 (1997).
- McGowan, S. E. The lipofibroblast: more than a lipid-storage depot. Am J Physiol Lung Cell Mol Physiol. 316 (5), L869-L871 (2019).
- Meyer, K. A., Popper, H., Ragins, A. B. Histologic distribution of vitamin A in biopsy specimens of the liver. Arch Surg. 43 (3), 376-385 (1941).
- Popper, H. L. Histological demonstration of vitamin A in rats by means of fluorescence microscopy. Proc Soc Exp Biol Med. 43, 133-136 (1940).
- Van Exan, R. J., Hardy, M. H. Localization of vitamin A by autofluorescence during induced metaplastic changes in cultures of skin. In Vitro. 15 (8), 631-640 (1979).
- Schweigert, F. J., Siegling, C., Tzimas, G., Seeger, J., Nau, H. Distribution of endogenous retinoids, retinoid binding proteins (RBP, CRABPI) and nuclear retinoid X receptor beta (RXRbeta) in the porcine embryo. Reprod Nutr Dev. 42 (4), 285-294 (2002).
- Wake, K. Perisinusoidal stellate cells (fat-storing cells, interstitial cells, lipocytes), their related structure in and around the liver sinusoids, and vitamin A-storing cells in extrahepatic organs. Int Rev Cytol. 66, 303-353 (1980).
- Senoo, H., Kojima, N., Sato, M. Vitamin A-storing cells (stellate cells). Vitam Horm. 75, 131-159 (2007).
- Senoo, H., et al. Hepatic stellate cell (vitamin A-storing cell) and its relative--past, present and future. Cell Biol Int. 34 (12), 1247-1272 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados