Method Article
عزل الخلايا المحتوية على الرتينويد في الرئة عن طريق فرز الخلايا
In This Article
Summary
البروتوكول الموضح أدناه هو طريقة بسيطة وفعالة لعزل الخلايا المحتوية على الريتينويد من مجموعات خلايا الرئة غير المتجانسة للغاية من خلال الاستفادة من التألق الذاتي للريتينويد المحدد واستخدام فرز الخلايا المنشطة بالفلورسنت.
Abstract
تعتبر الرتينويدات (فيتامين أ ومستقلباته) مكونا دهنيا أساسيا في البيئة المكروية السنخية ، ويلزم استقلاب الريتينويد الخاص بنوع الخلية للحفاظ على الصحة الوظيفية للرئتين النامية والبالغين. تستخدم خلايا الرئة مسارات محددة ، مما يسمح بالامتصاص الفعال للرتينويدات المنتشرة من الدم مثل الريتينول (ROH) ، متبوعا بالتحويل التدريجي داخل الخلايا ل ROH إلى أنواع الريتينويد النشطة النسخ ، حمض الريتينويك (ATRA). تعد الإشارات بوساطة ATRA (أو بوساطة الريتينويد) أمرا بالغ الأهمية لتنظيم السنخية للرئة ، وإنتاج الفاعل بالسطح ، وتكوين الأوعية الدموية ، والنفاذية ، والمناعة. الأهم من ذلك ، أن خلايا الرئة المحددة ، بما في ذلك الخلايا الليفية ، يمكن أن تتراكم الريتينويدات في شكل استرات الريتينيل (RE) ، والتي يمكن تخزينها أو تعبئتها بشكل أكبر على شكل ROH لنقلها إلى الخلايا المجاورة عند الحاجة. يمكن عزل الخلايا المحتوية على الريتينويد في الرئة وجمعها من معلق الخلية المفردة للرئتين المهضومة عن طريق استخدام التألق الذاتي للريتينويد (الانبعاث عند 455 نانومتر عند الإثارة عند 350 نانومتر) وباستخدام فرز الخلايا المنشط بالفلورة (FACS). يسمح وضع العلامات الإضافية الخاصة بالخلايا في الجسم الحي لخلايا الرئة ببروتين الفلورسنت الأحمر بعزل وجمع مجموعات خلايا رئوية محددة تحتوي على الريتينويد. يمكن تحليل الخلايا التي تم جمعها أو زراعتها مباشرة لمزيد من التحليلات لمورفولوجيا الخلية والتعبير الجيني والاستجابة للتلاعب الدوائي. تعد تقنية العزل والتطبيق هذه مهمة لدراسات النماذج الحيوانية لصحة الرئة وإصابة الرئة لاكتساب نظرة أعمق على الجوانب الخلوية لعملية التمثيل الغذائي للريتينويد في الرئتين والاتصالات الخلوية بوساطة الدهون.
Introduction
تعتبر الرتينويدات (فيتامين أ ومستقلباته) مكونا دهنيا أساسيا في البيئة المكروية السنخية ، ويلزم استقلاب وإشارات الريتينويد الخاصة بنوع الخلية للحفاظ على الصحة الوظيفية للرئة النامية والبالغة1،2،3،4،5،6،7،8،9،10،11، 12،13،14. تستخدم خلايا الرئة مسارات محددة ، مما يسمح بالامتصاص الفعال للريتينويدات المشتقة من النظام الغذائي المنتشرة من الدم مثل الريتينول (ROH) 15،16،17،18،19 ، متبوعا بالتحويل التدريجي داخل الخلايا ل ROH إلى أنواع الريتينويد النشطة النسخ ، حمض الريتينويك (ATRA) بالكامل (ATRA)20. يتم تحقيق الإشارات بوساطة ATRA (أو بوساطة الريتينويد) من خلال تفاعل ATRA مع مستقبلات الهرمونات النووية الثلاثة المتشابهة المتميزة ، ومستقبلات حمض الريتينويك (RARα و RARβ و RARγ21،22) ، وهي ضرورية لتنظيم السنخية للرئة23،24،25،26،27،28،29 ، إنتاج الفاعل بالسطح30، 31،32،33،34،35 ، تكوين الأوعيةالدموية 36 ، النفاذية37 ، والمناعة38،39،40. الأهم من ذلك ، أن خلايا الرئة المحددة ، وخاصة الخلايا الليفية الرئوية ، يمكن أن تتراكم الرتينويدات في شكل استرات الريتينيل (RE) ، والتي يمكن تخزينها أو تعبئتها بشكل أكبر على شكل ROH لنقلها إلى الخلايا المجاورة عند الحاجة1.
إن تعقيد استقلاب الريتينويد والإشارات ، بالإضافة إلى التعقيد الخلوي للرئة ، يجعل الدراسات التي تهدف إلى استكشاف استقلاب الريتينويد في الرئة في الجسم الحي صعبة. لقد حددنا بروتوكولا بسيطا وقويا لعزل الخلايا المحتوية على الريتينويد (الشكل 1) من مجموعات خلايا الرئة غير المتجانسة للغاية من خلال الاستفادة من التألق الذاتي للريتينويد المحدد (الانبعاث عند 455 نانومتر عند الإثارة عند 350 نانومتر) وباستخدام فرز الخلايا المنشط بالفلورة (FACS). لا يتطلب البروتوكول تسمية إضافية للخلايا باستثناء تلطيخ الجدوى إذا كان الهدف من الدراسة هو عزل وتوصيف خلايا الرئة الحية الأولية بناء على قدرتها على تخزين الرتينويدات. هذا يقلل بشكل كبير من وقت التحضير لفرز الخلايا ، ويلغي الحاجة إلى تلطيخ إضافي ، ويسمح بعزل عوائد عالية من الخلايا الأولية القابلة للحياة. ومع ذلك ، إذا كان الهدف من الدراسة هو عزل وتوصيف مجموعات معينة من خلايا الرئة (الخلايا الليفية أو الخلايا البطانية أو الظهارية أو المناعية) ، فيمكن إجراء فرز إضافي للخلايا بعد تسمية الخلايا المحتوية على الريتينويد المصنفة بالأجسام المضادة الخاصة بالخلايا.
تم استخدام التألق الذاتي للريتينويد في الدراسات المنشورة لتحديد هويات الخلايا المحتوية على الريتينويد و / أو لتحديد وفرة هذه الخلايا في الكبد41،42،43،44 ، والبنكرياس45،46 ، والكلى41،47 ، والرئة41. علاوة على ذلك ، أبلغت العديد من المجموعات البحثية عن استخدام مضان الريتينويد للعزل بواسطة FACS ودراسة الخلايا الأولية المحتوية على الريتينويد من الأنسجة الحية ، بما في ذلك الكبد44،48،49،50،51،52،53 والرئة1. في البروتوكول الحالي ، نوضح كيف يمكن تصنيف مجموعات خلايا معينة في الجسم الحي قبل عزل الخلايا المحتوية على الريتينويد باستخدام tdTomato (بروتين الفلورسنت الأحمر). لا تتداخل الخصائص الطيفية ل tdTomato (الانبعاث عند 581 نانومتر عند الإثارة عند 554 نانومتر54) والسطوع مع التألق الذاتي للريتينويد ، وبالتالي تجعله مناسبا لتحقيق خصوصية الخلية أثناء الفرز. نظرا للدور الحاسم لعملية التمثيل الغذائي للريتينويد غير المنازلة والإشارات داخل البيئة المكروية السنخية الطبيعية1 ، فإن التقنية الموصوفة لعزل خلايا الرئة هي أداة مفيدة في دراسات النماذج الحيوانية لصحة الرئة وأمراضها لاكتساب نظرة أعمق على الجوانب الخلوية لاستقلاب الريتينويد في الرئتين والاتصالات الخلوية بوساطة الدهون في الجسم الحي.
Protocol
تم إجراء جميع الإجراءات والتجارب الموصوفة التي شملت الفئران بموافقة اللجنة المؤسسية لرعاية واستخدامها (IACUC) بجامعة روتجرز (IACUC ID: PROTO202200111) وفقا للمعايير الموضحة في دليل رعاية واستخدام المختبر التي أعدتها الأكاديمية الوطنية للعلوم55.
1. الاعتبارات والاستعدادات للتجربة
- تربية والتلاعب بها
ملاحظة: يمكن استخدام الفئران من الذكور والإناث بعمر ثلاثة أشهر (10-12 أسبوعا) في الدراسات. الليسيثين: الفئران التي تعاني من نقص الريتينول أسيل ترانسفيراز (نقص Lrat ، Lrat-/- الفئران56) على خلفية وراثية C57BL / 6J ورفقاء القمامة المتطابقين مع العمر (النوع البري ، الفئران Lrat +/+) تم استخدامها في التجارب الموصوفة. الفئران التي تعبر عن tdTomato الجين في الخلايا الليفية (فئران F-tdT) تم إنشاؤها عن طريق تهجين الفئران التي تؤوي كاسيت مراسل tdTomato (B6. Cg-Gt (ROSA) 26Sortm14 (CAG-tdTomato) Hze / J ، سلالة Jackson Lab # 007914) مع الفئران Col1a2-CreER (B6. Cg-Tg (Col1a2-Cre / ERT ، -ALPP) 7CPD / 2J ، سلالة جاكسون لاب # 029567).- استخدم نموذج الماوس المعبر عن Cre ، وهو أحد الخيارات العديدة المتاحة لتسمية مجموعة الخلايا المستهدفة في الجسم الحي.
ملاحظة: اعتمادا على اختيار الخلية المستهدفة ، وتعبير Cre ، وكفاءة إعادة التركيب بوساطة Cre ، وخصوصية الخلية ، قد يستخدم الباحثون أي نموذج فأر موثوق به يعبر عن Cre. - استخدم تعبير الجينات المعدلة وراثيا tdTomato (عند علاج تاموكسيفين كما هو موضح أدناه) لتسمية الخلايا الليفية Col1a2 + ، متبوعا بعزلها عن معلقات الخلية المفردة للرئة المهضومة كما هو موضح أدناه.
- استخدم نموذج الماوس المعبر عن Cre ، وهو أحد الخيارات العديدة المتاحة لتسمية مجموعة الخلايا المستهدفة في الجسم الحي.
- إعادة التركيب بوساطة Cre والتنشيط المعدل وراثيا في الجسم الحي
- تحفيز تعبير Cre في الفئران F-tdT من خلال الحقن داخل الصفاق (IP) 2 ملغ من تاموكسيفين مرة كل 24 ساعة لمدة 5 أيام متتالية.
- تعقيم موقع الحقن ب 70٪ إيثانول قبل الحقن. استخدم الفئران للتجارب بعد شهر واحد من حقن تاموكسيفين النهائي.
- تحقق من فعالية إعادة تركيب Cre قبل تجارب الفرز. تأكد من إعادة تركيب Cre الفعالة وتعبير tdTomato عن طريق عزل مجموعة الخلايا المستهدفة من الخلايا الليفية الرئوية من الفئران F-tdT المعالجة بتاموكسيفين باستخدام الخرز المغناطيسي المضاد ل Pdgfrα وفرز الخلايا المنشطة مغناطيسيا (MACS).
- تحضير المحاليل والأواني البلاستيكية والزجاجية
ملاحظة: يجب اتباع تقنيات التعقيم للإجراءات الموضحة أدناه. يجب أن تتم الإجراءات التي تنطوي على مستحضرات المحلول وهضم الأنسجة وعزل الخلايا تحت الغطاء الرقائقي. يجب تعقيم المحاليل عن طريق الترشيح باستخدام مرشح 0.2 ميكرومتر ؛ يجب تعقيم الأدوات الجراحية وكذلك أدوات المختبر عن طريق التعقيم.- تحت الغطاء الرقائقي ، قم بإعداد محلول الملح المتوازن من هانكس (HBSS) ، الخالي من الكالسيوم والمغنيسيوم (HBSS بدون Ca2 + / Mg2+ ، يحتوي على 5.3 ملي كلوريد كلوريد الرأس ، 0.4 ملي كيلو هيدروجين2PO4 ، 4.2 ملي NaHCO3 ، 137.9 ملي كلوريد الصوديوم ، 0.3 ملي Na2HPO4 ، 5.6 ملي مولار D-Glucose) لتروية الرئة (5 مل لكل فأر). عقم المحلول باستخدام مرشح 0.2 ميكرومتر واملأ المحقنة بالمحلول.
- تحت الغطاء الرقائقي ، قم بإعداد محلول الملح المتوازن من هانكس بالكالسيوم والمغنيسيوم (HBSS مع Ca2 + / Mg2+ ، يحتوي على 1.3 ملي CaCl2 ، 0.5 MgCl2 ·6 ساعات2درجة ، 0.4 ملي مجم4 ·7H2O ، 5.3 ملي KCl ، 0.4 ملي KH2PO4 ، 4.2 ملي NaHCO3 ، 137.9 ملي كلوريد الصوديوم ، 0.3 ملي Na2HPO4 ، 5.6 ملي مولار D-Glucose) ، تحتوي على 0.3 مجم / مل من النوع الرابع من الكولاجيناز و 1 مجم / مل من التباين لتروية الرئة (10 مل لكل فأر). عقم المحلول باستخدام مرشح 0.2 ميكرومتر واملأ المحقنة بالمحلول.
- تحت الغطاء الرقائقي ، قم بإعداد HBSS مع Ca2 + / Mg2+ ، الذي يحتوي على 0.3 مجم / مل من النوع الرابع من الكولاجيناز ، و 1 مجم / مل من التباين ، و 5 مجم / مل من DNase I لهضم الرئة (10 مل لكل فأر). عقم المحلول باستخدام مرشح 0.2 ميكرومتر واملأ المحقنة بالمحلول.
- تحت الغطاء الرقائقي ، املأ طبق ثقافة الخلية (35 مم 10 مم ، طبق واحد لكل رئة مجمعة من فأر واحد) ب 2 مل من HBSS المعقم مع Ca2 + / Mg2+. ضع الطبق (الأطباق) التي تحتوي على HBSS مع Ca2 + / Mg2+ على الثلج.
2. نضح الرئة ، والهضم ، وجمع تعليق الخلية المفردة
- تخدير الفأر عن طريق إعطاء كوكتيل تخدير يحتوي على 10 مجم / مل من الكيتامين و 2 مجم / مل زيلازين بجرعة 0.01 مل / جم من وزن الجسم عن طريق حقن IP.
- تأكد من أن الفأر في حالة عميقة من فقدان الوعي من خلال تقييم استجابة قرصة إصبع القدم. قم بإزالة الشعر المتساقط والأوساخ / الحطام المرئي من موقع الجراحة ، وقم بقص ومسح موقع الجراحة باستخدام 70٪ كحول للتطهير.
- باستخدام أدوات جراحية معقمة ، افتح تجاويف البطن والصدر. قطع الضلوع والحجاب الحاجز لكشف الرئتين والقلب.
ملاحظة: سيضمن ذلك الموت الفوري لأن بضع الصدر سيؤدي إلى توقف التنفس أثناء تخدير الفأر. إذا تم تنفيذه بشكل صحيح ، فسيستغرق هذا الجزء من الإجراء ما يصل إلى 3 دقائق من بداية الإجراء حتى بضع الصدر ، يليه موت. - قطع الوريد الأجوف السفلي وتطبيق وسادة ماصة لامتصاص الدم المنبعث.
- قم بنقخ الرئتين في الموقع من خلال البطين الأيمن للقلب باستخدام حقنة سعة 10 مل بإبرة 25 جم × 1 بوصة مملوءة ب 5 مل من HBSS المعقم بدون Ca2 +/Mg2+. إذا نجح التروية ، ستصبح أنسجة الرئة بيضاء.
- قم بنشر الرئتين في الموقع باستخدام حقنة سعة 10 مل بإبرة 25 جم × 1 بوصة مملوءة ب 10 مل من HBSS المعقم مع Ca2 + / Mg2+ ، يحتوي على الكولاجيناز من النوع الرابع (0.3 مجم / مل) وتباين (1 مجم / مل).
- قم بإزالة الرئتين ونقلهما إلى طبق زراعة الخلايا (35 مم × 10 مم) مع 2 مل من HBSS المعقم مع Ca2 + / Mg2+.
- تحت الغطاء الرقائقي ، اشطف الرئتين وافرمهما إلى قطع صغيرة باستخدام شفرة جراحية معقمة (# 20 ، يناسب المقبض # 4). انقل الرئة المفرومة إلى أنبوب سعة 15 مل عن طريق إضافة أول 5 مل من HBSS مع Ca2 +/Mg2+ يحتوي على 0.3 ملغم/مل من النوع الرابع من الكولاجيناز ، و 1 مجم / مل من التباين ، و 5 مجم / مل من DNase I إلى الأنسجة المفرومة ونقلها باستخدام ماصة مصلية سعة 10 مل. جمع ونقل بقايا الأنسجة المفرومة المتبقية عن طريق غسل طبق زراعة الخلية مع 5 مل المتبقية من HBSS مع Ca2 + / Mg2+ تحتوي على 0.3 مجم / مل من النوع الرابع من الكولاجيناز ، و 1 مجم / مل من التباين ، و 5 مجم / مل من DNase I.
- احتضان أنسجة الرئة المفرومة في HBSS مع Ca2 +/Mg2+ التي تحتوي على 0.3 ملغم/مل من الكولاجيناز من النوع الرابع، و1 ملغم/مل من التباين، و5 ملغم/مل من DNase I على شاكر دوار يتم الاحتفاظ به عند 37 درجة مئوية لمدة 45 دقيقة. في كل فترة من الفواصل الثلاثة التي تبلغ مدتها 15 دقيقة ، تحت الغطاء الرقائقي ، مرر الأنسجة المفرومة 10 مرات عبر ماصة مصلية سعة 10 مل لفصل الخلايا بشكل أفضل.
- مرر معلق الخلية الناتج من خلال مصفاة 100 ميكرومتر لتجميع الخلايا المفردة في أنبوب سعة 50 مل يحتوي على 20 مل من محلول تصوير الخلايا الحية الباردة (محلول ملحي فسيولوجي يحتوي على 20 ملي مولار HEPES ، درجة الحموضة 7.4) يحتوي على أقل من 5٪ من مصل الأبقار الجنينية (FBS). اجمع الخلايا عن طريق الطرد المركزي عند 500 جم لمدة 10 دقائق عند 4 درجات مئوية.
- استنشق المادة الطافية وأعد تعليق حبيبات الخلية في 1 مل من محلول تحلل خلايا الدم الحمراء واترك الأنبوب لمدة 5 دقائق في درجة حرارة الغرفة (RT) للقضاء على كريات الدم الحمراء. أضف 20 مل من محلول تصوير الخلايا الحية الباردة الذي يحتوي على أقل من 5٪ FBS. اجمع الخلايا عن طريق الطرد المركزي عند 500 جم لمدة 10 دقائق عند 4 درجات مئوية.
- استنشق المادة الطافية وأعد تعليق حبيبات الخلية في 20 مل من محلول تصوير الخلايا الحية الباردة الذي يحتوي على أقل من 5٪ FBS. مرر معلق الخلية الناتج عبر مصفاة 40 ميكرومتر لتجميع الخلايا المفردة في أنبوب سعة 50 مل يحتوي على 20 مل من محلول تصوير الخلايا الحية الباردة الذي يحتوي على أقل من 5٪ FBS. اجمع الخلايا عن طريق الطرد المركزي عند 500 جم لمدة 10 دقائق عند 4 درجات مئوية.
- استنشق المادة الطافية وأعد تعليق حبيبات الخلية في 10 مل من محلول تصوير الخلايا الحية الباردة الذي يحتوي على أقل من 5٪ FBS. عد الخلايا واضبط تركيز الخلية إلى ~ 5-10 × 106 خلايا / مل.
3. عزل خلايا الرئة المحتوية على الريتينويد باستخدام فرز الخلايا المنشطة بالفلورة (FACS)
- خذ حصة من تعليق الخلية وضعها جانبا لاستخدامها كعنصر تحكم في البوابات غير ملوثة. أضف صبغة البقاء SYTOX Green إلى تعليق الخلية المتبقي (تخفيف 1: 1000 ، التركيز النهائي 30 نانومتر).
- قم بتمرير معلقات الخلية عبر المرشح المتصل بأنبوب تجميع البوليسترين سعة 5 مل (12 × 75 مم).
- تابع عزل خلايا FACS عن طريق فرز الخلايا الحية الفردية المحتوية على الريتينويد بناء على انبعاثها عند 455 نانومتر. قم بإجراء تمييز فردي تسلسلي باستخدام مخطط للتشتت الأمامي (ارتفاع الانتثار الأمامي/FSC-H مقابل منطقة التشتت الأمامية/FSC-A). استبعاد الخلايا الميتة عن طريق خصائص التشتت (التشتت الجانبي) والتلوين باستخدام SYTOX Green.
- قم ببوابة وفرز وجمع خلايا مفردة حية تحتوي على الريتينويد باستخدام الانبعاث عند 455 نانومتر عند الإثارة عند 350 نانومتر.
ملاحظة: باستخدام الإجراء الموصوف ، يمكن جمع حوالي 5 · 10 5 خلايا رئوية تحتويعلى الريتينويد من رئة فأر واحدة. - قم بإجراء تحليل بيانات FACS باستخدام برنامج قياس التدفق الخلوي.
النتائج
عزل الخلايا المحتوية على الرتينويد في الرئة
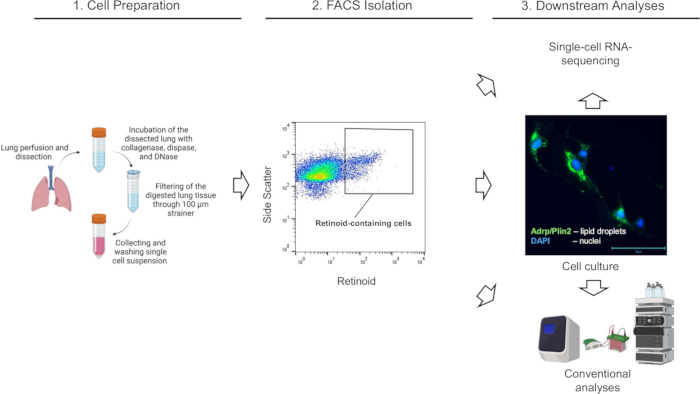
تم هضم رئتي الفئران (من الفئران Lrat +/+ و Lrat-/-) إنزيميا ، وتم تحضير معلقات أحادية الخلية وإخضاعها ل FACS وفقا للإجراء الموضح أعلاه. تم إجراء فرز الخلايا والحصول على البيانات على نظام Cytek Aurora™ Cell Sorter الذي يتم تشغيله بواسطة الإصدار 1.3.0 من برنامج SpectroFlo CS باستخدام فوهة 100 ميكرومتر وضغط 15 رطل لكل بوصة مربعة. أولا ، تم تطبيق مخططات التشتت الأمامي (ارتفاع التشتت الأمامي / FSC-H مقابل منطقة التشتت الأمامية / FSC-A) لتحديد وبوابة الخلايا المفردة (المفردة) ، متبوعا بتمييز الخلايا الميتة باستخدام التشتت الجانبي وتلوين SYTOX Green (الشكل 2). أخيرا ، لفرز المجموعة المستهدفة من الخلايا المحتوية على الريتينويد ، تم اختيار مجموعة مميزة من الخلايا المفردة الحية ذات التألق الذاتي العالي عند λ = 455 نانومتر (الشكل 2 أ). لتأكيد خصوصية المشي المطبق والنهج العام ، تم استخدام تعليق الخلايا الرئوية من الفئران Lrat-/- كعنصر تحكم سلبي لضبط بوابة التألق الذاتي للريتينويد. الفئران Lrat-/- غير قادرة على تصنيع RETes ولا يمكنها تجميع الريتينويدات في رئتيها1. والجدير بالذكر أنه باستخدام استراتيجية بوابات FACS المتطابقة ، لا يمكن اكتشاف مجموعة خلايا مميزة ذات تألق ذاتي مرتفع عند λ = 455 نانومتر في تعليق الخلية المفردة من رئتي Lrat- / - (الشكل 2 ب).
بمجرد جمعها ، يمكن تحليل الخلايا الأولية المحتوية على الريتينويد أو زراعتها مباشرة لمزيد من التحليلات لتركيزات الريتينويد ، ومورفولوجيا الخلية ، والتعبير الجيني ، والاستجابة للتلاعب الدوائي (الشكل 1).
باستخدام هذا الإجراء ، تمكنا من إظهار وجود مجموعات خلايا مختلفة بين الخلايا المحتوية على الرئة1. على وجه التحديد ، من خلال إجراء تسلسل الحمض النووي الريبي أحادي الخلية للخلايا المحتوية على الريتينويد التي تم جمعها بواسطة FACS ، أظهرنا أنه من بين هذه الخلايا ، كانت مجموعة الخلايا اللحمية (83٪ من إجمالي الخلايا التي تم جمعها) هي الأكثر وفرة ، تليها البطانية (7٪ من إجمالي الخلايا المجمعة) ، والظهارية (5٪ من إجمالي الخلايا المجمعة) ، والخلايا النخاعية (حوالي 5٪ من إجمالي الخلايا المجمعة)1. البيانات المتعلقة بعدم تجانس خلايا الرئة المعزولة المحتوية على الريتينويد لا تقلل من خصوصية الإجراء الموصوف. بدلا من ذلك ، تسلط هذه البيانات الضوء على التعقيد غير المتوقع سابقا لعملية التمثيل الغذائي للريتينويد في الرئة البالغة والذي يتضمن خلايا متنوعة ظاهريا واتصالات خلوية واسعة النطاق بوساطة الريتينويد.
عزل الخلايا المحتوية على الرئة Col1a2+
نظرا لوجود مجموعات خلايا غير متجانسة بين الخلايا المعزولة المحتوية على الريتينويد ، قد يرغب الباحثون في التركيز على دراسة نوع معين من خلايا الرئة المشاركة في استقلاب الريتينويد. لهذا الغرض ، يمكن إجراء وضع علامات إضافية خاصة بالخلايا في الجسم الحي لمجموعة الخلايا المستهدفة.
من بين مجموعات خلايا الرئة غير المتجانسة للغاية ، فإن مجموعة سكانية فرعية من الخلايا اللحمية الوسيطة الرئوية ذات الخصائص الليفية ، والتي يشار إليها باسم الخلايا الخلالية الدهنية الرئوية أو الخلايا الليفية الدهنية الرئوية ، هي نوع الخلايا السائد القادر على تراكم الرتينويدات 1،57،58. لتسمية مجموعة سكانية فرعية من الخلايا الليفية الرئوية في الجسم الحي ، تم إنشاء الفئران التي تعبر عن جين tdTomato في الخلايا الليفية (فئران F-tdT) عن طريق عبور الفئران التي تؤوي كاسيت مراسل tdTomato مع فئران Col1a2-CreER. تم تحفيز التعبير عن Cre في الفئران F-tdT من خلال حقن IP من 2 مجم من تاموكسيفين مرة كل 24 ساعة لمدة 5 أيام متتالية. بعد شهر واحد من الحقن النهائي للتاموكسيفين ، تم استخدام الفئران في التجارب. سمح هذا النهج بتسمية الخلايا الليفية Col1a2 + ببروتين tdTomato وعزلها عن معلقات الخلية المفردة للرئة المهضومة باستخدام الإجراء الموصوف أعلاه. يسمح هذا النهج بالتقاط خلايا حية (SYTOX Green سلبية) ، خلايا tdTomato+ مفردة (الشكل 3). بعد ذلك ، يمكن فصل مجموعة سكانية فرعية من الخلايا المحتوية على الريتينويد عن جميع خلايا tdTomato+ التي تم التقاطها باستخدام استراتيجية بوابات تعتمد على التألق الذاتي للريتينويد (الشكل 3) كما هو موضح أعلاه. بالإضافة إلى ذلك ، يسمح هذا الإجراء بالفرز اللاحق والتجميع المنفصل لمجموعات مختلفة من خلايا tdTomato+ بناء على شدة إشارة مضان الريتينويد إلى مجموعات سفلية عالية ومتوسطة ومنخفضة من الخلايا المحتوية على الريتينويد.
تم تأكيد إعادة تركيب Cre الفعالة وتعبير tdTomato عن طريق عزل مجموعة الخلايا المستهدفة من الخلايا الليفية الرئوية من الفئران F-tdT المعالجة بتاموكسيفين (الشكل 4 أ) باستخدام الخرز المغناطيسي المضاد ل Pdgfrα وفرز الخلايا المنشطة مغناطيسيا (MACS). بالإضافة إلى ذلك ، تم إجراء تحليل HPLC لتأكيد وجود الريتينويدات في الخلايا المحتوية على الريتينويد التي تم فرزها (الشكل 4 ب).
بمجرد جمعها ، يمكن تحليل الخلايا الليفية الأولية المحتوية على الرتينويد أو زراعتها مباشرة لمزيد من التحليلات لتركيز الريتينويد ، ومورفولوجيا الخلية ، والتعبير الجيني ، والاستجابة للتلاعب الدوائي. على سبيل المثال ، تتمثل إحدى السمات المميزة للأرومات الليفية المحتوية على الريتينويد الرئوية المعزولة من من النوع البري (Lrat +/+) في وجود قطرات دهنية يمكن تصورها في الخلايا المستنبتة باستخدام تقنيات الكيمياء المناعية القياسية (الشكل 4 ج).
الشكل 1: تمثيل تخطيطي لسير العمل التجريبي الموصوف. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
(تم إنشاؤه باستخدام Biorender.com)

الشكل 2: عزل FACS للخلايا المحتوية على الرتينويد في الرئة. (أ) استراتيجية بوابة لفرز الخلايا المفردة الحية المحتوية على الريتينويد (تحددها المنطقة المغلقة) باستخدام الانبعاث عند λ = 455 نانومتر عند الإثارة عند λ = 350 نانومتر من معلقات خلايا الرئة المعزولة من فأر C57Bl6 / J من النوع البري (Lrat +/+). (ب) استراتيجية بوابات لفرز الخلايا المفردة الحية المحتوية على الريتينويد باستخدام الانبعاث عند λ = 455 نانومتر عند الإثارة عند λ = 350 نانومتر المطبقة على معلقات خلايا الرئة المعزولة من فأر Lrat-/- ؛ لا تصور المنطقة المغلقة أي خلايا تحتوي على الريتينويد المكتشفة في رئتي Lrat-/ - ؛ تشير الأرقام إلى النسبة المئوية للخلايا المسورة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
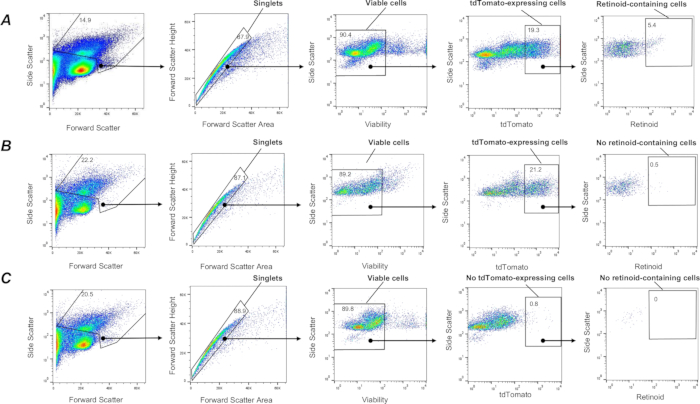
الشكل 3: عزل FACS للأرومات الليفية Col1a2 + المحتوية على الرتينويد. (أ) استراتيجية بوابة لفرز الخلايا المفردة الحية tdTomato+ المحتوية على الريتينويد (تحددها المنطقة المغلقة) باستخدام الانبعاث عند λ = 455 نانومتر عند الإثارة عند λ = 350 نانومتر من معلقات خلايا الرئة المعزولة من فأر F-TdTom على خلفية وراثية من النوع البري (C57Bl6 / J). اللوحة (ب) استراتيجية بوابات لفرز الخلايا المفردة الحية tdTomato+ المحتوية على الريتينويد (المحددة بالمنطقة المغلقة) باستخدام الانبعاث عند λ = 455 نانومتر عند الإثارة عند λ = 350 نانومتر المطبقة على معلقات خلايا الرئة المعزولة من فأر F-TdTom على خلفية Lrat-/- (C57Bl6/J)؛ لا تصور المنطقة المغلقة أي خلايا مكتشفة تحتوي على الريتينويد في الرئتين من فئران F-TdTom على خلفية Lrat-/-. (ج) استراتيجية بوابة لفرز الخلايا المفردة الحية tdTomato+ المحتوية على الريتينويد (المحددة بالمنطقة المغلقة) باستخدام الانبعاث عند λ = 455 نانومتر عند الإثارة عند λ = 350 نانومتر المطبقة على معلقات خلايا الرئة المعزولة من tdطماطم - فأر ؛ المنطقة المغلقة لا تصور أي tdTomato+; تشير الأرقام إلى النسبة المئوية للخلايا المسورة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
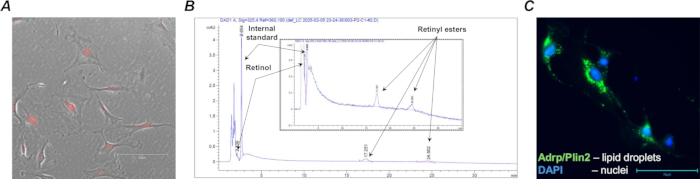
الشكل 4: الخلايا الليفية المحتوية على الرتينويد Col1a2 + / tdTomato+. (أ) صورة مصغرة تمثيلية لخلايا الرئة من النوع البري المعزول من MACS (LRAT+/+) Col1a2+ / tdTomato+ في المزرعة؛ تم التقاط الخلايا المستنبتة ذات tdTomato المميز باستخدام مرشح TX Red وتكبير 20x ؛ شريط المقياس هو 150 ميكرومتر. (ب) ملف تعريف HPLC (مع تكبير مدرج) يظهر القمم المميزة وأوقات الاحتفاظ بأنواع الريتينويد (استرات الريتينول والريتينيل) المستخرجة من 1 · 105 خلايا محتوية على الريتينويد. (ج) صورة مصغرة تمثيلية لخلايا الرئة المعزولة من النوع البري المعزول FACS (Lrat+/+) Col1a2+ / tdTomato+ في مزرعة ملطخة بالبروتين المرتبط بالتمايز الدهني المرتبط بقطرات الدهون (Adrp/Perilipin 2)؛ تم التقاط الخلايا الملطخة باستخدام مرشح GFP وتكبير 40x ؛ شريط المقياس 75 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
تم الإبلاغ عن قدرة الكشف عن فيتامين أ في الأنسجة البشرية والحيوانية وتصوره النسيجي باستخدام الفحص المجهري الفلوري لأول مرة في الأربعينيات من القرن العشرين59،60. ثم تم تطبيق ظاهرة التألق الذاتي للريتينويد بنجاح على الدراسات التي تهدف إلى تحديد تركيزات عالية من فيتامين أ في الأنسجة في المختبر61 وتوصيف تشكل الأنسجة الجنينية الحيوانية62 باستخدام المجهر الفلوري. لوحظ لاحقا وأكد تجريبيا أن التألق الذاتي المميز للريتينويدات الخلوية (الإثارة عند λ = 350 نانومتر مع الانبعاث الأزرق والأخضر المميز عند λ = 455 نانومتر) يرتبط بأنواع معينة من الخلايا ، وبالتالي ، يمكن تطبيقه لعزل وتوصيف هذه الخلايا63،64،65.
تم استخدام التألق الذاتي للريتينويد في الدراسات المنشورة لتحديد هويات الخلايا المحتوية على الريتينويد و / أو لتحديد وفرة هذه الخلايا في الكبد41،42،43،44 ، والبنكرياس45،46 ، والكلى41،47 ، والرئة41. علاوة على ذلك ، أبلغت العديد من المجموعات البحثية عن استخدام مضان الريتينويد للعزل بواسطة FACS ودراسة الخلايا الأولية المحتوية على الريتينويد من الأنسجة الحية ، بما في ذلك الكبد44،48،49،50،51،52،53 والرئة1.
هنا ، نصف البروتوكول حيث يمكن استخدام التألق الذاتي للريتينويد كميزة أساسية لتحديد وفرز الخلايا المحتوية على الرتينويد باستخدام FACS. تشمل الرتينويدات الفلورية المكتشفة استرات الريتينول والريتينيل فقط. وبالتالي ، يمكن فرز الخلايا التي تحتوي على مشتقات فيتامين أ فقط (استرات الريتينيل بشكل أساسي). بالإضافة إلى ذلك ، نقدم تقدما إضافيا للبروتوكول حيث يمكن للمحققين استخدام أساليب وضع العلامات الإضافية الخاصة بالخلايا لتضييق نطاق خصوصية الخلية. يمكن تحقيق ذلك عن طريق تسمية الخلايا المحتوية على الرتينويد الرئوية بالأجسام المضادة المترافقة بالفلوروكروم والفرز الإضافي1. بدلا من ذلك ، يمكن تحقيق وضع علامات إضافية خاصة بالخلايا لخلايا الرئة في الجسم الحي عن طريق التعبير عن بروتينات الفلورسنت المراسلة باستخدام Cre-recombinase الخاص بالخلية التي تعبر عن نماذج حيوانية بعد التحقق من كفاءة تعبير Cre وخصوصية الخلية. يسلط البروتوكول الموصوف هنا الضوء على استخدام التعبير المدفوع ب Co1a2 لبروتين tdTomato في الخلايا الليفية الرئوية كأحد الخيارات العديدة لهذا النهج. ومع ذلك ، يمكن تطبيق هذا النهج على أنواع خلايا الرئة الأخرى ، بما في ذلك الخلايا البطانية والظهارية والنخاعية ، عند استخدام نموذج تعبير Cre المناسب.
يمكن أيضا تطبيق البروتوكول الموصوف على عزلات الخلايا من الرئتين المصابة (الملتهبة ، الليفية ، إلخ). ومع ذلك، في هذه الحالة، ينبغي أن تؤخذ في الاعتبار عدة قيود. ترتبط إصابات الرئة بانخفاض تدريجي في تركيزات الريتينويد1 ، والتي ، بالتالي ، يمكن أن تحد من تطبيق هذا البروتوكول وتقلل من إنتاجية الخلايا. من ناحية أخرى ، ترتبط إصابات الرئة بتنشيط الخلايا الليفية والتعبير المرتفع عن بروتينات المصفوفة خارج الخلية ، بما في ذلك Col1a2. بالنظر إلى أن تعبير Cre مدفوع بمحفز Col1a2 ، يمكن تعزيز تعبير tdTomato ، مما يؤثر على عدد الخلايا التي تعبر عن tdTomato بالإضافة إلى شدة إشارة tdTomato في رئتي الفئران F-tdT التي تم استخدامها في دراستنا.
مجتمعة ، يوفر البروتوكول الموصوف هنا أداة محددة وقوية لاكتساب نظرة أعمق على الجوانب الخلوية لاستقلاب الريتينويد في الرئتين والاتصالات الخلوية بوساطة الدهون في الجسم الحي.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم تمويل هذا العمل من خلال منحة من المعاهد الوطنية للصحة / المعهد الوطني للقلب والرئة والدم (NIH / NHLBI) R01 HL171112 (إلى IS) ، وجائزة التطوير الوظيفي (إلى IS) من مركز روتجرز للتعرضات البيئية والأمراض بتمويل من المعاهد الوطنية للصحة / المعهد الوطني لعلوم الصحة البيئية (NIH / NIEHS) P30 ES005022 ، وصناديق بدء التشغيل من روتجرز ، جامعة ولاية نيو جيرسي (إلى IS). يود المؤلفون أن يعرب عن تقديرهم لموظفي المورد المشترك لمراقبة المناعة وقياس التدفق الخلوي في معهد روتجرز للسرطان (مدعوم جزئيا بتمويل من NCI-CCSG P30CA072770-5920) لمساهماتهم في العمل المقدم في هذه المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| 10 mL serological pipette | Avantor/VWR | 76452-284 | |
| 100 µm strainer | Greiner Bio-One | 542000 | |
| 15 mL falcon tube | Corning | 352099 | |
| 40 µm strainer | Greiner Bio-One | 542040 | |
| 50 mL falcon tube | Corning | 352070 | |
| Cell culture dish, 35 mm ´ 10 mm | Corning | 430165 | |
| Cell sorting media | Gibco | A59688DJ | |
| Collagenase type IV | Worthington Biochemical Corporation | LS004188 | |
| Cytek Aurora Cell Sorter System | Cytek Biosciences | ||
| Dispase II | Sigma-Aldrich | D4693 | |
| DNase I | Sigma-Aldrich | DN25 | |
| Falcon brand 5-ml polypropylene round bottom tube, 12 mm ´ 75 mm | Corning | 352063 | |
| Falcon brand 5-ml polystyrene round-bottom tube with cell-strainer cap, 12 mm ´ 75 mm | Corning | 352235 | |
| FlowJo software | Becton Dickinson | flow cytometry software | |
| HBSS with Ca2+/Mg2+ | Gibco | 14925-092 | |
| HBSS without Ca2+/Mg2+ | Gibco | 14175-095 | |
| Nalgene Rapid-Flow Sterile Disposable Bottle Top Filters | ThermoFisher | 595-3320 | |
| Red Cell lysis buffer | Sigma-Aldrich | R7757 | |
| SpectroFlo CS software | Cytek Biosciences | Version 1.3.0 | |
| Surgical Design Royaltek Stainless Steel Surgical Scalpel Blades | Fisher Scientific | 22-079-683 | |
| SYTOX Green dead cell stain | Invitrogen | S34860 | |
| Tamoxifen | Sigma-Aldrich | T2859 |
References
- Shmarakov, I. O., et al. Retinoids stored locally in the lung are required to attenuate the severity of acute lung injury in male mice. Nat Commun. 14 (1), 851 (2023).
- Bogue, C. W., Jacobs, H. C., Dynia, D. W., Wilson, C. M., Gross, I. Retinoic acid increases surfactant protein mRNA in fetal rat lung in culture. Am J Physiol Lung Cell Mol Physiol. 271 (5), L862-L868 (1996).
- Ng-Blichfeldt, J. -. P., et al. Retinoic acid signaling balances adult distal lung epithelial progenitor cell growth and differentiation. EBioMedicine. 36, 461-474 (2018).
- Chen, F., et al. Prenatal retinoid deficiency leads to airway hyperresponsiveness in adult mice. J Clin Invest. 124 (2), 801-811 (2014).
- Esteban-Pretel, G., Marin, M. P., Renau-Piqueras, J., Barber, T., Timoneda, J. Vitamin A deficiency alters rat lung alveolar basement membrane: reversibility by retinoic acid. J Nutr Biochem. 21 (3), 227-236 (2010).
- Massaro, G. D., Massaro, D. Postnatal treatment with retinoic acid increases the number of pulmonary alveoli in rats. Am J Physiol. 270 (2 Pt 1), L305-L310 (1996).
- Hind, M., Maden, M. Retinoic acid induces alveolar regeneration in the adult mouse lung. Eur Respir J. 23 (1), 20-27 (2004).
- Belloni, P. N., Garvin, L., Mao, C. P., Bailey-Healy, I., Leaffer, D. Effects of all-trans-retinoic acid in promoting alveolar repair. Chest. 117 (5 Suppl 1), 235S-241S (2000).
- Veness-Meehan, K. A., Bottone, F. G., Stiles, A. D. Effects of retinoic acid on airspace development and lung collagen in hyperoxia-exposed newborn rats. Pediatr Res. 48 (4), 434-444 (2000).
- Cho, S. J., George, C. L., Snyder, J. M., Acarregui, M. J. Retinoic acid and erythropoietin maintain alveolar development in mice treated with an angiogenesis inhibitor. Am J Respir Cell Mol Biol. 33 (6), 622-628 (2005).
- Massaro, G. D., Massaro, D. Retinoic acid treatment abrogates elastase-induced pulmonary emphysema in rats. Nat Med. 3 (6), 675-677 (1997).
- Stinchcombe, S. V., Maden, M. Retinoic acid induced alveolar regeneration: critical differences in strain sensitivity. Am J Respir Cell Mol Biol. 38 (2), 185-191 (2008).
- Fraslon, C., Bourbon, J. R. Retinoids control surfactant phospholipid biosynthesis in fetal rat lung. Am J Physiol. 266 (6 Pt 1), L705-L712 (1994).
- Zachman, R. D. Role of vitamin A in lung development. J Nutr. 125 (6 Suppl), 1634s-1638s (1995).
- van Bennekum, A. M., et al. Lipoprotein lipase expression level influences tissue clearance of chylomicron retinyl ester. J Lipid Res. 40 (3), 565-574 (1999).
- Blaner, W. S., et al. Lipoprotein lipase hydrolysis of retinyl ester: possible implications for retinoid uptake by cells. J Biol Chem. 269 (24), 16559-16565 (1994).
- Trites, M. J., Febbraio, M., Clugston, R. D. Absence of CD36 alters systemic vitamin A homeostasis. Sci Rep. 10 (1), 20386 (2020).
- Wassef, L., Quadro, L. Uptake of dietary retinoids at the maternal-fetal barrier: in vivo evidence for the role of lipoprotein lipase and alternative pathways. J Biol Chem. 286 (37), 32198-32207 (2011).
- Spiegler, E., Kim, Y. -. K., Wassef, L., Shete, V., Quadro, L. Maternal-fetal transfer and metabolism of vitamin A and its precursor β-carotene in the developing tissues. Biochim Biophys Acta Mol Cell Biol Lipids. 1821 (1), 88-98 (2012).
- Kedishvili, N. Y. Enzymology of retinoic acid biosynthesis and degradation. J Lipid Res. 54 (7), 1744-1760 (2013).
- Channabasappa, S., Caldwell, S., Kanthan, R., Singh, B. Retinoid receptors are expressed in mouse and human lungs. Anat Rec. 305 (9), 2281-2289 (2022).
- Kimura, Y., et al. Retinoid receptors in the developing human lung. Clin Sci (Lond). 103 (6), 613-621 (2002).
- Yang, L., Naltner, A., Yan, C. Overexpression of dominant negative retinoic acid receptor alpha causes alveolar abnormality in transgenic neonatal lungs. Endocrinology. 144 (7), 3004-3011 (2003).
- Snyder, J. M., et al. Alveolarization in retinoic acid receptor-beta-deficient mice. Pediatr Res. 57 (3), 384-391 (2005).
- Gao, R. -. w., et al. Retinoic acid promotes primary fetal alveolar epithelial type II cell proliferation and differentiation to alveolar epithelial type I cells. In Vitro Cell Dev Biol Anim. 51 (5), 479-487 (2015).
- Dirami, G., et al. Lung retinol storing cells synthesize and secrete retinoic acid, an inducer of alveolus formation. Am J Physiol Lung Cell Mol Physiol. 286 (2), L249-L256 (2004).
- Massaro, G. D., Massaro, D., Chambon, P. Retinoic acid receptor-alpha regulates pulmonary alveolus formation in mice after, but not during, perinatal period. Am J Physiol Lung Cell Mol Physiol. 284 (2), L431-L433 (2003).
- Massaro, G. D., et al. Retinoic acid receptor-beta: an endogenous inhibitor of the perinatal formation of pulmonary alveoli. Physiol Genomics. 4 (1), 51-57 (2000).
- McGowan, S., et al. Mice bearing deletions of retinoic acid receptors demonstrate reduced lung elastin and alveolar numbers. Am J Respir Cell Mol Biol. 23 (2), 162-167 (2000).
- Yan, C., et al. Retinoic acid-receptor activation of SP-B gene transcription in respiratory epithelial cells. Am J Physiol Lung Cell Mol Physiol. 275 (2), L239-L246 (1998).
- Ghaffari, M., Whitsett, J. A., Yan, C. Inhibition of hSP-B promoter in respiratory epithelial cells by a dominant negative retinoic acid receptor. Am J Physiol Lung Cell Mol Physiol. 276 (3), L398-L404 (1999).
- Yang, L., et al. Synergy between signal transducer and activator of transcription 3 and retinoic acid receptor-α in regulation of the surfactant protein b gene in the lung. Mol Endocrinol. 18 (6), 1520-1532 (2004).
- Metzler, M. D., Snyder, J. M. Retinoic acid differentially regulates expression of surfactant-associated proteins in human fetal lung. Endocrinology. 133 (5), 1990-1998 (1993).
- George, T. N., Snyder, J. M. Regulation of surfactant protein gene expression by retinoic acid metabolites. Pediatr Res. 41 (5), 692-701 (1997).
- Naltner, A., Ghaffari, M., Whitsett, J. A., Yan, C. Retinoic acid stimulation of the human surfactant protein B promoter is thyroid transcription factor 1 site-dependent. J Biol Chem. 275 (1), 56-62 (2000).
- Ng-Blichfeldt, J. P., et al. Deficient retinoid-driven angiogenesis may contribute to failure of adult human lung regeneration in emphysema. Thorax. 72 (6), 510-521 (2017).
- Lochbaum, R., et al. Retinoic acid signalling adjusts tight junction permeability in response to air-liquid interface conditions. Cell Signal. 65, 109421 (2020).
- Mamidi, S., Hofer, T. P., Hoffmann, R., Ziegler-Heitbrock, L., Frankenberger, M. All-trans retinoic acid up-regulates prostaglandin-e synthase expression in human macrophages. Immunobiology. 217 (6), 593-600 (2012).
- Hashimoto, S., et al. Retinoic acid differentially regulates interleukin-1beta and interleukin-1 receptor antagonist production by human alveolar macrophages. Leuk Res. 22 (11), 1057-1061 (1998).
- Li, S., Lei, Y., Lei, J., Li, H. Alltrans retinoic acid promotes macrophage phagocytosis and decreases inflammation via inhibiting CD14/TLR4 in acute lung injury. Mol Med Rep. 24 (6), (2021).
- Nagy, N. E., et al. Storage of vitamin A in extrahepatic stellate cells in normal rats. J Lipid Res. 38 (4), 645-658 (1997).
- Thompson, K. C., et al. Primary rat and mouse hepatic stellate cells express the macrophage inhibitor cytokine interleukin-10 during the course of activation in vitro. Hepatology. 28 (6), 1518-1524 (1998).
- Zhang, X. Y., Sun, C. K., Wheatley, A. M. A novel approach to the quantification of hepatic stellate cells in intravital fluorescence microscopy of the liver using a computerized image analysis system. Microvasc Res. 60 (3), 232-240 (2000).
- D'Ambrosio, D. N., et al. Distinct populations of hepatic stellate cells in the mouse liver have different capacities for retinoid and lipid storage. PLoS One. 6 (9), e24993 (2011).
- Apte, M. V., et al. Periacinar stellate shaped cells in rat pancreas: identification, isolation, and culture. Gut. 43 (1), 128-133 (1998).
- Kim, N., et al. Formation of vitamin A lipid droplets in pancreatic stellate cells requires albumin. Gut. 58 (10), 1382-1390 (2009).
- Kida, Y., et al. Characterization of vitamin A-storing cells in mouse fibrous kidneys using Cygb/STAP as a marker of activated stellate cells. Arch Histol Cytol. 70 (2), 95-106 (2007).
- Ogawa, T., et al. Identification of vitamin A-free cells in a stellate cell-enriched fraction of normal rat liver as myofibroblasts. Histochem Cell Biol. 127 (2), 161-174 (2007).
- Tacke, F., Weiskirchen, R. Update on hepatic stellate cells: pathogenic role in liver fibrosis and novel isolation techniques. Expert Rev Gastroenterol Hepatol. 6 (1), 67-80 (2012).
- Bartneck, M., et al. Isolation and time lapse microscopy of highly pure hepatic stellate cells. Anal Cell Pathol (Amst). , (2015).
- Balaphas, A., et al. Optimized isolation and characterization of C57BL/6 mouse hepatic stellate cells. Cells. 11 (9), (2022).
- Kubota, H., Yao, H. L., Reid, L. M. Identification and characterization of vitamin A-storing cells in fetal liver: implications for functional importance of hepatic stellate cells in liver development and hematopoiesis. Stem Cells. 25 (9), 2339-2349 (2007).
- Larsen, A. K., et al. Autofluorescence in freshly isolated adult human liver sinusoidal cells. Eur J Histochem. 65 (4), (2021).
- Shaner, N. C., Patterson, G. H., Davidson, M. W. Advances in fluorescent protein technology. J Cell Sci. 120 (24), 4247-4260 (2007).
- National Research Council. . Guide for the Care and Use of Laboratory Animals. , (2011).
- O'Byrne, S. M., et al. Retinoid absorption and storage is impaired in mice lacking lecithin: retinol acyltransferase (LRAT). J Biol Chem. 280 (42), 35647-35657 (2005).
- McGowan, S. E., Torday, J. S. The pulmonary lipofibroblast (lipid interstitial cell) and its contributions to alveolar development. Annu Rev Physiol. 59, 43-62 (1997).
- McGowan, S. E. The lipofibroblast: more than a lipid-storage depot. Am J Physiol Lung Cell Mol Physiol. 316 (5), L869-L871 (2019).
- Meyer, K. A., Popper, H., Ragins, A. B. Histologic distribution of vitamin A in biopsy specimens of the liver. Arch Surg. 43 (3), 376-385 (1941).
- Popper, H. L. Histological demonstration of vitamin A in rats by means of fluorescence microscopy. Proc Soc Exp Biol Med. 43, 133-136 (1940).
- Van Exan, R. J., Hardy, M. H. Localization of vitamin A by autofluorescence during induced metaplastic changes in cultures of skin. In Vitro. 15 (8), 631-640 (1979).
- Schweigert, F. J., Siegling, C., Tzimas, G., Seeger, J., Nau, H. Distribution of endogenous retinoids, retinoid binding proteins (RBP, CRABPI) and nuclear retinoid X receptor beta (RXRbeta) in the porcine embryo. Reprod Nutr Dev. 42 (4), 285-294 (2002).
- Wake, K. Perisinusoidal stellate cells (fat-storing cells, interstitial cells, lipocytes), their related structure in and around the liver sinusoids, and vitamin A-storing cells in extrahepatic organs. Int Rev Cytol. 66, 303-353 (1980).
- Senoo, H., Kojima, N., Sato, M. Vitamin A-storing cells (stellate cells). Vitam Horm. 75, 131-159 (2007).
- Senoo, H., et al. Hepatic stellate cell (vitamin A-storing cell) and its relative--past, present and future. Cell Biol Int. 34 (12), 1247-1272 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved