Method Article
Выделение и культивирование первичных холангиоцитов у мышей с поликистозом печени с использованием двухступенчатого метода пищеварения
В этой статье
Резюме
Этот протокол описывает оптимизированный двухэтапный метод пищеварения для выделения первичных холангиоцитов высокой чистоты и высокой жизнеспособности от мышей дикого типа и мышей с поликистозом печени.
Аннотация
В этом протоколе мы оптимизировали двухэтапный метод пищеварения для выделения первичных холангиоцитов высокой чистоты и высокой жизнеспособности от мышей дикого типа и мышей с поликистозом печени (PLD). После обезболивания мышей печень перфузировали через нижнюю полую вену 50 мл раствора А, а затем 30 мл раствора В при 37 °С для ферментативного переваривания ткани печени. Механическую диссоциацию, встряхивание и микродиссекцию проводили для удаления адгезивных паренхиматозных клеток, оставляя неповрежденное желчное дерево. Затем желчное дерево мелко измельчали и переваривали путем встряхивания в течение 60 минут при 37 °C. Полученную одноклеточную суспензию собирали с помощью клеточного фильтра размером 70 мкм. Холангиоциты очищали с помощью иммуномагнитной изоляции. Клеточную суспензию инкубировали с антителом против EpCAM при вращении в течение 45 мин при 4°С, с последующим добавлением гранул протеина G и дальнейшим вращением в течение еще 45 мин при 4°С. После трех промываний PBS холангиоциты собирали с помощью магнитного сепаратора. Очищенные первичные холангиоциты ресуспендировали в питательной среде для холангиоцитов и высевали на чашки для клеточных культур, покрытые коллагеном крысиного хвоста I типа 1 мг/мл. Чистота холангиоцитов была подтверждена иммуноокрашиванием на холангиоцит-специфический маркер цитокератин-19 (CK19). Хотя это исследование было сосредоточено на выделении первичных холангиоцитов от мышей дикого типа и PLD, мы уверены, что протокол может быть применен и к другим моделям мышей. Этот подробный двухэтапный метод пищеварения облегчает исследования холангиопатий in vitro и разработку таргетной терапии.
Введение
Холангиоциты, эпителиальные клетки, выстилающие внутрипеченочное желчное дерево, образуют монослой и составляют примерно 3-5% от общей популяции клеток печени1. Эти клетки соединяются между собой в печени, создавая сложную трехмерную протоковуюсеть2. В нормальных условиях холангиоциты выполняют жизненно важные функции, включая секрецию, всасывание, восстановление повреждений и служат иммунным барьером, тем самым играя решающую роль в физиологии и патологии печени. Тем не менее, дисфункция холангиоцитов может привести к различным заболеваниям, включая PLD, первичный склерозирующий холангит, холангиокарциному и холестатическое повреждение печени 3,4,5.
Среди заболеваний, связанных с холангиопатией, PLD выделяется как наследственное заболевание, характеризующееся образованием многочисленных заполненных жидкостью кист, происходящих из холангиоцитов. Прогрессирующее увеличение этих кист значительно снижает качество жизни пациентов6. Существующие варианты лечения PLD остаются недостаточными, предлагая ограниченную эффективность и часто связанные с высокой частотой рецидивов и осложнений7. Это подчеркивает настоятельную необходимость разработки безопасных и эффективных терапевтических стратегий для удовлетворения неудовлетворенных клинических потребностей в лечении PLD.
Исследования механизмов холангиопатий, в том числе PLD, были значительно затруднены отсутствием подходящих клеточных линий. Чтобы устранить это ограничение, использование мышиных моделей заболевания и выделение первичных холангиоцитов из этих моделей для экспериментов in vitro оказалось неоценимым для раскрытия молекулярных механизмов, лежащих в основе холангиопатий, и определения потенциальных терапевтических стратегий.
В нашем недавнем исследовании8 мы успешно создали мышиную модель PLD с использованием мышей с условным нокаутом Pkd1 (KO). Кисты печени наблюдались уже через 1 месяц после делеции Pkd1 и постепенно увеличивались в размерах с течением времени. В то время как протоколы выделения холангиоцитов у крыс и человека хорошо задокументированы 9,10, выделение первичных холангиоцитов у мышей остается особенно сложным из-за их небольшого размера и сложной архитектуры воротной вены и желчевыводящей системы. Существующие методы сталкиваются со значительными ограничениями, включая низкую чистоту клеток, плохую жизнеспособность, сложные процедуры и высокую стоимость11,12.
В данной рукописи представлен подробный протокол выделения первичных холангиоцитов высокой чистоты от мышей с использованием двухступенчатого метода пищеварения. Этот оптимизированный подход направлен на поддержку исследований in vitro , облегчение изучения молекулярных механизмов, лежащих в основе холангиопатий, и продвижение разработки новых терапевтических стратегий.
протокол
Все протоколы лечения и экспериментов с мышами были одобрены Этическим комитетом Тяньцзиньского медицинского университета (Doc. No: TMUa-MEC 2022016).
1. Подготовка оборудования и решений
- Стерилизуйте хирургические инструменты (ножницы, щипцы и ручки скальпеля) путем автоклавирования не менее чем за 1 день до выделения клеток.
- Не менее чем за 1 день до выделения клеток приготовьте питательную среду для холангиоцитов с использованием реагентов, перечисленных в таблице 1. Простерилизуйте питательную среду холангиоцитов, отфильтровав ее через фильтр 0,22 мкм.
- Не менее чем за 1 день до выделения клеток приготовьте раствор А и раствор В с использованием реагентов, перечисленных в таблице 2 , для перфузии печени мышей. Раствор А и раствор В стерилизуйте автоклавированием или фильтруйте через фильтр 0,22 мкм и отрегулируйте их pH до 7,35 с помощью стерильного NaOH при осторожном перемешивании.
ПРИМЕЧАНИЕ: Питательная среда для холангиоцитов, раствор А и раствор В можно хранить при температуре 4°C не менее одного месяца. - Перед началом эксперимента добавьте порошок коллагеназы II в раствор B и аккуратно перемешайте до достижения конечной концентрации 0,5 мг/мл. Перед использованием разогрейте раствор А и раствор В на водяной бане при температуре 37 °C.
- Непосредственно перед началом эксперимента приготовьте 6-сантиметровую посуду, наполненную стерильным ПБС, и положите ее на лед, чтобы они оставались холодными во время процедуры.
2. Перфузия пищеварения печени
- Обезболите мышь с помощью ингаляции с передозировкой изофлурана. Поместите мышь под наркозом в положение лежа на спине и закрепите ее клейкой лентой, чтобы облегчить процедуру.
- Откройте брюшную полость мыши после стерилизации брюшной полости с помощью 75% этанола, а затем завяжите узел вокруг нижней полой вены с помощью обжатой иглы. Промойте внутривенный катетер 24 г раствором А с помощью шприца объемом 20 мл.
- Вставьте внутривенный катетер в нижнюю полую вену ниже скользящего узла, зафиксируйте скользящий узел и зафиксируйте катетер на месте с помощью клейкой ленты.
- Перфузируйте печень 50 мл раствора А через нижнюю полую вену с помощью шприца объемом 20 мл и надрежьте воротную вену печени для дренирования перфузионного раствора. Поддерживайте скорость перфузии на уровне 10 мл/мин.
- Продолжайте перфузию 30 мл раствора В, содержащего коллагеназу II, со скоростью потока 3,5 мл/мин с помощью перистальтического насоса.
ПРИМЕЧАНИЕ: Этот этап предназначен для переваривания тканей печени. - Удалите успешно перфузированную ткань печени и поместите ее в 6-сантиметровую посуду, наполненную холодным стерильным ПБС.
3. Выделение холангиоцитов
Примечание: Поскольку количество холангиоцитов у нормальных мышей относительно невелико, рекомендуется использовать для процедуры группу из 2-6 мышей. Тем не менее, для моделей заболеваний мышей с аномальной пролиферацией холангиоцитов, таких как PLD, достаточно холангиоцитов от одной мыши. Если не указано иное, образцы и реагенты всегда должны храниться на льду, а все процедуры должны выполняться в шкафу биологической безопасности.
- Механически диссоциируйте и встряхните ткани печени с помощью изогнутых щипцов. Впоследствии проводят микродиссекцию под препарирующим микроскопом для удаления адгезивных паренхиматозных клеток, оставляя неповрежденным желчевыводящее дерево. Удалите ткань желчного пузыря, прежде чем переходить к следующему этапу.
Промойте салфетку 2 раза с PBS. - Измельчите желчевыводящее дерево с помощью хирургического лезвия и разварите его в 3 мл раствора для сбраживания (Таблица 3) на каждую мышь с встряхиванием (90 об/мин) при температуре 37 °C в течение 60 минут. На отметке 30 минут аккуратно нанесите смесь пипеткой с помощью наконечника пипетки, чтобы тщательно перемешать.
ПРИМЕЧАНИЕ: Раствор для дигестона должен быть свежеприготовленным перед использованием. - Пропустите клеточную суспензию через сетчатое фильтр 70 мкм. С помощью поршня шприца объемом 5 мл или 10 мл аккуратно надавите на клеточную суспензию через сетчатое фильтр. Промойте ситечко с помощью PBS.
- Центрифугируйте клеточную суспензию при 500 x g в течение 5 мин при 4 °C. Промойте ячейки 3 раза средой RPMI.
- Снова центрифугируйте при 500 x g в течение 5 мин при 4 °C.
- Отбраковать надосадочную жидкость и ресуспендировать клетки в 900 мкл среды RPMI, содержащей 40 Ед/мл ДНКазы I. Добавить 2 мкг антитела против EpCAM и инкубировать суспензию на ротаторе (20 об/мин) при 4 °C в течение 45 мин.
- Центрифугируйте при 500 x g в течение 5 мин при 4 °C.
- Выбросьте надосадочную жидкость и ресуспендируйте клетки в 1 мл среды RPMI, содержащей 40 Ед/мл ДНКазы I. Предварительно промойте шарики протеина G 1 мл среды RPMI. Добавьте 20 мкл гранул белка G в клеточную суспензию и инкубируйте с вращением (20 об/мин) при 4 °C еще 45 мин.
Примечание: Антитело против EpCAM также может быть предварительно инкубировано с гранулами белка G для создания комплекса гранулы-антитела перед введением клеточной суспензии. - Промойте ячейки 3 раза PBS с помощью магнитного сепаратора.
- Подсчет клеток и оценка жизнеспособности клеток с помощью окрашивания Trypan Blue (0,04%, 3 мин) на гемоцитометре.
ПРИМЕЧАНИЕ: Нет необходимости удалять шарики из холангиоцитов, они отделятся естественным образом после начала культивирования и не будут мешать культивированию клеток.
4. Культура холангиоцитов
ПРИМЕЧАНИЕ: Приготовьте свежие блюда для культуры клеток крысиного хвоста I типа, покрытые коллагеном, перед культивированием холангиоцитов. Предварительно охладите все реагенты на льду.
- Следуя инструкциям производителя, смешайте стерильный ddH2O, 10x PBS, 1 N NaOH и коллаген крысиного хвоста типа I для достижения конечной концентрации 1 мг/мл коллагена крысиного хвоста типа I в 1x PBS. Равномерно покройте смесью чашки для клеточных культур и поместите чашки в инкубатор при температуре 37 °C с 5%CO2 на 30 минут, чтобы дать коллагену застыть.
- Вымойте посуду для клеточных культур типа I типа крысиного хвоста, покрытую коллагеном, предварительно подогретым PBS.
- Ресуспендируйте холангиоциты в предварительно подогретой среде для культивирования холангиоцитов. Поместите клеточную суспензию в 1 мг/мл 1 мг/мл типа I типа в чашки для клеточных культур, покрытые коллагеном, и инкубируйте при 37 °C с 5%CO2. Заменяйте среду каждые 2 дня.
5. Пассирование и криоконсервация холангиоцитов
- Холангиоциты дважды промыть PBS, затем инкубировать клетки в 0,25% трипсине при 37 °C в течение 5-10 минут.
- Добавьте равный объем питательной среды для холангиоцитов для нейтрализации трипсина, затем центрифугируйте при 500 x g в течение 5 минут.
- Приготовьте чашки для клеточных культур типа I крысиного хвоста, покрытые коллагеном, как описано в шаге 4.1.
- Выполните шаги 4.2 и 4.3.
- Если требуется криоконсервация, повторно суспендируйте холангиоциты в среде хранения (9:1 FBS: DMSO) и храните в морозильной камере при температуре -80 °C или жидком азоте. Разморозьте ячейки по мере необходимости для дальнейшего использования.
6. Валидация холангиоцитов
Примечание: Чистоту холангиоцитов оценивали путем окрашивания на маркер холангиоцитов CK19.
- Промыть холангиоциты 2 раза с PBS, затем зафиксировать клетки в 4% параформальдегиде на 15 минут.
- Промыть холангиоциты PBS, затем проникнуть в клетки 1% Triton X-100 в течение 8 минут.
- Промойте холангиоциты PBS, затем заблокируйте клетки в 5% BSA на 1 ч.
- Промойте холангиоциты PBS, затем инкубируйте клетки с первичным антителом против CK19 (разведение 1:12 с 2% BSA) в течение ночи при 4 °C.
- Промойте холангиоциты 2 раза с PBS, затем инкубируйте клетки с вторичным антителом Alexa Fluor 488 против крыс (разведение 1:1000 с PBS) в течение 1 часа при комнатной температуре.
- Холангиоциты промыть PBS, окрашивать 4',6-диамидино-2-фенилиндолом в течение 15 мин и наблюдать под микроскопом.
Результаты
Схема рабочего процесса двухэтапного расщепления, используемого для выделения холангиоцитов, показана на рисунке 1. Вся процедура занимает ~5 часов. Сначала печень перфузируется раствором А через нижнюю полую вену для удаления крови, на что указывает бледность печени. Затем печень перфузируют раствором В, содержащим коллагеназу II, чтобы инициировать переваривание тканей. Этот начальный этап пищеварения чувствителен ко времени, и об успешном переваривании свидетельствует заметная мягкость ткани. Далее механическая диссоциация и мягкое встряхивание с помощью изогнутых щипцов помогают удалить гепатоциты; Правильное пищеварение подтверждается при отделении большого количества гепатоцитов. Под препарирующим микроскопом оставшиеся адгезивные паренхиматозные клетки аккуратно удаляют путем микродиссекции, оставляя неповрежденным желчевыводящее дерево (рис. 2).
На втором этапе пищеварения ткань расщепляется на одноклеточную суспензию, которая все еще содержит некоторое количество гепатоцитов и фибробластов. Наконец, из этой суспензии получают холангиоциты высокой чистоты путем иммуномагнитной сепарации. Оценку жизнеспособности клеток проводили с помощью окрашивания Trypan Blue на гемоцитометре. Результаты продемонстрировали успешное выделение высокожизнеспособных холангиоцитов (рис. 3). Иммунофлуоресцентное окрашивание CK19 (рис. 4) подтвердило, что этот метод стабильно дает холангиоциты мышей высокой чистоты.
Первичные холангиоциты обычно прилипали к поверхности культуры и образовывали монослой в течение примерно 24 ч, демонстрируя быструю пролиферацию в течение первых трех пассажей, особенно в моделях заболеваний мышей с аномальной пролиферацией холангиоцитов, таких как PLD (рис. 5). Однако при более поздних пассажах скорость роста снизилась, а клетки стали крупнее и приобрели вакуолизированную морфологию. Нет необходимости удалять бусины из холангиоцитов, они отделятся естественным образом после начала культивирования и не будут мешать культивированию клеток. Криоконсервация и размораживание клеток не оказывали существенного влияния на жизнеспособность клеток.
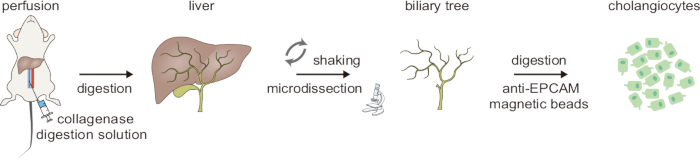
Рисунок 1: Схематический обзор двухступенчатого процесса расщепления для выделения холангиоцитов. Эта цифра была взята из Ji et al8. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Репрезентативное изображение желчного дерева, выделенного у мыши с поликистозом печени. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Оценка жизнеспособности клеток выделенных холангиоцитов с помощью окрашивания Trypan Blue. Масштабные линейки = 50 μм. Маленькие черные частицы, окружающие клетки и находящиеся на заднем плане, представляют собой гранулы белка G. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
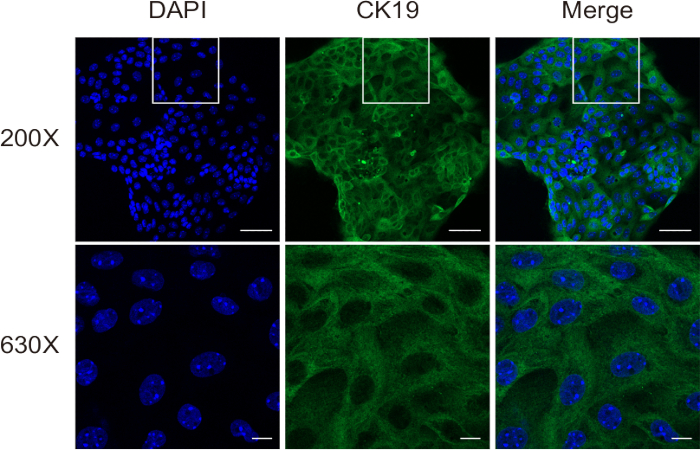
Рисунок 4: Оценка чистоты клеток выделенных холангиоцитов с помощью иммунофлуоресцентного окрашивания для CK19. Масштабные линейки: = 50 μм [верхний] и 10 μм [нижний]. Эта цифра была взята из Ji et al8. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
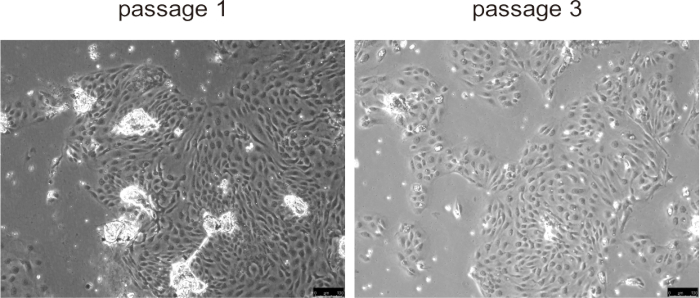
Рисунок 5: Репрезентативные изображения выделенных холангиоцитов в пассаже 1 и пассаже 3. Масштабные линейки = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Компоненты | Количество |
| DMEM/F12 (1:1) | 415 мл |
| Фетальная бычья сыворотка (FBS) | 50 мл |
| Заменимые аминокислоты MEM (100x) | 5 мл |
| Инсулин-трансферрин-селен (100x) | 5 мл |
| Витаминный раствор МЕМ (100x) | 5 мл |
| Химически определенный липидный концентрат (100x) | 5 мл |
| Пенициллин-стрептомицин (100x) | 5 мл |
| Раствор гентамицина/амфотерицина (500x) | 1 мл |
| 100 мМ Na пируват | 250 мкл |
| 10 мг/мл ингибитор соевого трипсина | 2,5 мл |
| 200 мМ L-глютамина | 5 мл |
| 10 мг/мл Дексаметазона | 20 μл |
| 1,7 мг/мл 3,3',5-трийодо-L-тиронин | 1 мл |
| 1 мг/мл эпидермального фактора роста | 12,5 мкл |
| 20 мМ Форсколин | 250 мкл |
| Этаноламин | 13 мкл |
Таблица 1: Состав среды для культивирования холангиоцитов.
| Компоненты | Количество | |
| Решение А | NaCl | 4,0908 г |
| KCl | 0,1578 г | |
| Na2HPO4 | 0,1072 г | |
| ХЕПЕС | 2,9789 г | |
| 50 мМ ЭГТА (pH = 8) | 5 мл | |
| 1,5 М MgCl2 | 34 мкл | |
| ддН2О | 500 мл | |
| ПРИМЕЧАНИЕ: Отрегулируйте pH до 7,35 с помощью стерильного NaOH. | ||
| Решение Б | NaCl | 4,0908 г |
| KCl | 0,1578 г | |
| Na2HPO4 | 0,1072 г | |
| ХЕПЕС | 2,9789 г | |
| 2 М CaCl2 | 1,25 мл | |
| ддН2О | 500 мл | |
| ПРИМЕЧАНИЕ: Отрегулируйте pH до 7,35 с помощью стерильного NaOH. Перед применением следует добавить порошок коллагеназы II для достижения конечной концентрации 0,5 мг/мл. | ||
Таблица 2: Состав раствора А и раствора В.
| Компоненты | Количество |
| 3,2 мг/мл коллагеназы XI | 300 μл |
| 10 мг/мл гиалуронидазы | 120 мкл |
| 10 Ед/мкл ДНКазы I | 12 μл |
| Пенициллин-стрептомицин (100x) | 30 μл |
| RPMI средний | 2.538 мл |
Таблица 3: Состав раствора для дигезна.
Обсуждение
Этот протокол предоставляет подробный метод выделения первичных холангиоцитов высокой чистоты от мышей с использованием двухступенчатого процесса пищеварения, что позволяет изучить молекулярные механизмы, лежащие в основе холангиопатий. Для обеспечения успешной изоляции холангиоцитов необходимо выполнить несколько критических шагов.
Первым важным шагом является обеспечение эффективной перфузии и пищеварения с помощью раствора А и раствора В. Успешная перфузия с помощью раствора А была подтверждена тем, что печень побледнела, а успешное переваривание с помощью раствора Б было подтверждено тем, что ткань печени стала заметно мягкой. Сбой в перфузии будет препятствовать перевариванию тканей печени и последующему выделению желчного дерева. Чтобы повысить эффективность пищеварения, можно увеличить объемы раствора А и раствора В, уменьшить скорость потока перфузии или мягко надавить на печень ватным тампоном.
Второй критический этап включает в себя механическую диссоциацию и мягкое встряхивание ткани печени изогнутыми щипцами с последующей микродиссекцией под препарирующим микроскопом для удаления адгезивных паренхиматозных клеток и выделения неповрежденного желчного дерева. Этот шаг был ключом к получению холангиоцитов высокой чистоты. Эффективность может быть повышена за счет захвата больших желчных протоков изогнутыми щипцами во время встряхивания и полоскания холодным PBS. Если печень переваривается успешно, многие гепатоциты отделяются, что делает микродиссекцию относительно простой. Однако, если разложение неполное, а образец ценен, процесс микродиссекции потребует кропотливых усилий, что увеличит рабочую нагрузку и потенциально снизит как выход клеток, так и чистоту. Таким образом, обеспечение надлежащей перфузии раствором В для переваривания печени имело первостепенное значение.
Третьим критическим этапом является повторное переваривание желчевыводящего дерева с образованием одноклеточной суспензии. Время переваривания следует оптимизировать, наблюдая за клетками под микроскопом: переваривание может снизить жизнеспособность клеток, в то время как недоваривание может привести к неиспользованной желчной ткани. Кроме того, включение соответствующих антибиотиков во все реагенты помогает свести к минимуму загрязнение.
Используя этот оптимизированный двухэтапный протокол пищеварения, мы успешно выделили холангиоциты высокой чистоты и высокой жизнеспособности у мышей. Хотя это исследование было сосредоточено на выделении первичных холангиоцитов из мышиных моделей дикого типа и PLD, мы уверены, что протокол может быть применен и к другим моделям мышей с заболеваниями. Процесс первоначального переваривания ткани печени для выделения желчевыводящего дерева с последующим вторым этапом пищеварения значительно повысил эффективность иммуномагнитного разделения и позволил получить большее количество жизнеспособных клеток. Выделенные холангиоциты хорошо подходили для эпигенетических экспериментов, требующих высокой жизнеспособности, таких как ATAC-seq, ChIP-seq, ChIP-seq с низким входом и CUT&TAG. Кроме того, эти первичные холангиоциты могут быть культивированы in vitro для различных функциональных анализов, включая 3D-кистозный рост, пролиферацию клеток, апоптоз и анализ клеточного цикла.
В ранее опубликованном исследовании8 мы выделили как нормальные, так и кистозные первичные холангиоциты от мышей дикого типа и мышей с PLD обоих полов. Мультиомическое профилирование первичных холангиоцитов у самцов и самок мышей с PLD выявило специфичную для пола эпигенетическую динамику в холангиоцитах во время цистогенеза печени. Кроме того, мы определили потенциальную эпигенетическую терапевтическую стратегию для пациентов с PLD мужского пола путем фармакологического ингибирования эпигенетических модифицирующих ферментов как в мышиных моделях PLD, так и в экспериментах in vitro с первичными холангиоцитами.
Наш подход имеет несколько заметных преимуществ по сравнению с опубликованными в настоящее время методами выделения холангиоцитов. По сравнению с методом Kudira et al.13, который включает в себя непосредственное переваривание ткани печени в одноклеточную суспензию после перфузионного разложения с последующим градиентным центрифугированием и иммуномагнитной изоляцией, наш метод проще, экономичнее и эффективнее. Ключевым преимуществом является изоляция желчевыводящего дерева перед иммуномагнитной изоляцией, что улучшает общий процесс. Кроме того, не требуя удаления гранул из холангиоцитов, этот метод позволяет достичь более высокого выхода и повышенной жизнеспособности выделенных клеток. По сравнению с методом Ueno et al.14, который дисоциирует и измельчает остатки портального тракта от перфузии пищеварения печени для 3D-культуры с последующим 7-дневным периодом культивирования перед получением суспензии одиночных клеток, наш метод более эффективен по времени. Выделение желчевыводящих путей с последующей иммуномагнитной изоляцией также значительно повышает чистоту клеток.
Однако, несмотря на эти преимущества, наша двухступенчатая техника пищеварения все еще имеет некоторые ограничения. Он относительно трудоемкий, допускает лишь ограниченное количество проходов и требует тщательной микродиссекции, чтобы избежать загрязнения паренхимы.
В заключение, мы разработали и оптимизировали двухступенчатый метод разложения для выделения первичных холангиоцитов высокой чистоты и высокой жизнеспособности у мышей. Этот подход является ценным инструментом для изучения молекулярных механизмов, лежащих в основе холангиопатий, и предлагает основу для определения потенциальных терапевтических стратегий.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Эта работа была поддержана грантами Муниципальной комиссии по образованию Тяньцзиня (2022ZD054 для L.Z.)
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | PALL | 4612 | |
| 0.25% Trypsin | Gibco | 25200-056 | |
| 10 mL syringe | KONSMED | 10 mL 1.2*30TWLB | |
| 20 mL syringe | KONSMED | 20 mL 1.2*30TWLB | |
| 24 G intravenous catheter | WEGO | 24GX19 mm/Y-G | |
| 3,3',5-triiodo-L-thyronine | Sigma | T5516 | 1.7 mg/mL stock |
| 4% paraformaldehyde | Solarbio | P1110 | |
| 5 mL syringe | KONSMED | 5 mL 0.7*30TWLB | |
| 6 cm dishes | Thermo Scientific | 150462 | |
| 70 µm cell strainer | Corning | 352350 | |
| anti-CK19 antibody | DSHB | TROMA-III | |
| anti-EpCAM antibody | DSHB | G8.8 | |
| BSA | Solarbio | A8020 | |
| CaCl2 | Sangon Biotech | A501330 | 2 M stock |
| Chemically-defined lipid concentrate (100x) | Gibco | 11905-031 | |
| Collagenase II | Worthington | LS004176 | |
| Collagenase XI | Sigma | C7657 | 3.2 mg/mL stock |
| Dexamethasone | Sigma | D1756 | 10 mg/mL stock |
| Dissecting Microscope | Leica | EZ4 | |
| DMEM/F12 (1:1) | VivaCell biosciences | C3130-0500 | |
| DMSO | Sigma | D2650 | |
| DNase I | Sigma | D4513 | 10 U/μL stock |
| Donkey anti-rat Alexa Fluor 488 secondary antibody | Invitrogen | A21208 | |
| EGTA | Solarbio | E8050 | 50 mM (PH = 8) stock |
| Epidermal growth factor (1 mg/mL) | Sigma | SRP3196 | |
| Ethanolamine | Sigma | E9508 | |
| Fetal Bovine Serum | VivaCell biosciences | C04001-500 | |
| Forskolin | Sigma | F3917 | 20 mM stock |
| Gentamicin/amphotericin solution (500x) | Gibco | R01510 | |
| Hemocytometer | QIUJING | XB.K.25. | |
| HEPES | Sigma | H4034 | |
| Hyaluronidase | Sigma | H3506 | 10 mg/mL stock |
| Insulin-transferrin-selenium (100x) | Gibco | 41400045 | |
| Isoflurane | RWD | R510-22-10 | |
| KCl | Sangon Biotech | A100395 | |
| L-Glutamine (200 mM) | Sigma | G7513 | |
| Magnetic separator | Promega | Z5342 | |
| MEM non-essential amino acids (100x) | Gibco | 11140050 | |
| MEM vitamin solution (100x) | Gibco | 11120052 | |
| MgCl2 | Sangon Biotech | A100288 | 1.5 M stock |
| Na Pyruvate (100 mM) | Gibco | 11360070 | |
| Na2HPO4 | Sangon Biotech | A600487 | |
| NaCl | Sangon Biotech | A610476 | |
| NaOH | Sangon Biotech | A620617 | 1 N stock |
| PBS | VivaCell biosciences | C3580-0500 | |
| PBS | Solarbio | P1010 | |
| Penicillin-Streptomycin (100x) | Gibco | 15140-122 | |
| Peristaltic pump | BaodingRongbai | YZ1515PPS | |
| Protein G beads | Invitrogen | 10004D | |
| Rotator | Kylin-Bell | QB-528 | |
| RPMI | VivaCell biosciences | C3010-0500 | |
| Soybean trypsin inhibitor | Sigma | T6522 | 10 mg/mL stock |
| Swaged needle | Jinhuan Medical | HM601 | |
| Triton X-100 | Solarbio | T8200 | |
| Trypan blue | Sigma | T6146 | 10 mg/mL stock |
| Type I rat tail collagen | BD | 354236 |
Ссылки
- Wang, Z., et al. Human cholangiocytes form a polarized and functional bile duct on hollow fiber membranes. Front Bioeng Biotechnol. 10, 868857 (2022).
- Li, P., et al. Three-dimensional human bile duct formation from chemically induced human liver progenitor cells. Front Bioeng Biotechnol. 11, 1249769 (2023).
- Fabris, L., et al. Pathobiology of inherited biliary diseases: a roadmap to understand acquired liver diseases. Nat Rev Gastroenterol Hepatol. 16 (8), 497-511 (2019).
- Jalan-Sakrikar, N., et al. Central role for cholangiocyte pathobiology in cholestatic liver diseases. Hepatology. , (2024).
- Ilyas, S. I., Gores, G. J. Pathogenesis, diagnosis, and management of cholangiocarcinoma. Gastroenterology. 145 (6), 1215-1229 (2013).
- Perugorria, M. J., et al. Polycystic liver diseases: advanced insights into the molecular mechanisms. Nat Rev Gastroenterol Hepatol. 11 (12), 750-761 (2014).
- Masyuk, T. V., Masyuk, A. I., LaRusso, N. F. Polycystic liver disease: Advances in understanding and treatment. Annu Rev Pathol. 17, 251-269 (2022).
- Ji, R., et al. Multi-omics profiling of cholangiocytes reveals sex-specific chromatin state dynamics during hepatic cystogenesis in polycystic liver disease. J Hepatol. 78 (4), 754-769 (2023).
- Tabibian, J. H., et al. Characterization of cultured cholangiocytes isolated from livers of patients with primary sclerosing cholangitis. Lab Invest. 94 (10), 1126-1133 (2014).
- Muff, M. A., et al. Development and characterization of a cholangiocyte cell line from the PCK rat, an animal model of autosomal recessive polycystic kidney disease. Lab Invest. 86 (9), 940-950 (2006).
- Nagaya, M., Katsuta, H., Kaneto, H., Bonner-Weir, S., Weir, G. C. Adult mouse intrahepatic biliary epithelial cells induced in vitro to become insulin-producing cells. J Endocrinol. 201 (1), 37-47 (2009).
- Karjoo, S., Wells, R. G. Isolation of neonatal extrahepatic cholangiocytes. J Vis Exp. (88), e51621 (2014).
- Kudira, R., et al. Isolation and culturing primary chaolangiocytes from mouse liver. Bio Protoc. 11 (20), e4192 (2021).
- Ueno, Y., et al. Evaluation of differential gene expression by microarray analysis in small and large cholangiocytes isolated from normal mice. Liver Int. 23 (6), 449-459 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены