Method Article
Isolamento e coltura di colangiociti primari da topi con malattia epatica policistica utilizzando un metodo di digestione in due fasi
In questo articolo
Riepilogo
Questo protocollo descrive un metodo di digestione ottimizzato in due fasi per isolare i colangiociti primari ad alta purezza e alta vitalità da topi wild-type e topi con malattia epatica policistica.
Abstract
In questo protocollo, abbiamo ottimizzato un metodo di digestione in due fasi per isolare i colangiociti primari ad alta purezza e alta vitalità da topi wild-type e topi con malattia epatica policistica (PLD). Dopo aver anestetizzato i topi, i fegati sono stati perfusi attraverso la vena cava inferiore con 50 ml di soluzione A, seguiti da 30 ml di soluzione B a 37 °C per digerire enzimaticamente il tessuto epatico. La dissociazione meccanica, l'agitazione e la microdissezione sono state eseguite per rimuovere le cellule parenchimali aderenti, lasciando intatto un albero biliare. L'albero biliare è stato poi finemente tritato e digerito agitando per 60 minuti a 37 °C. La sospensione a cellula singola risultante è stata raccolta utilizzando un filtro cellulare da 70 μm. I colangiociti sono stati purificati mediante isolamento immunomagnetico. La sospensione cellulare è stata incubata con un anticorpo anti-EpCAM in rotazione per 45 minuti a 4 °C, seguita dall'aggiunta di perline di proteina G e da un'ulteriore rotazione per altri 45 minuti a 4 °C. Dopo tre lavaggi con PBS, i colangiociti sono stati raccolti utilizzando un separatore magnetico. I colangiociti primari purificati sono stati risospesi in terreno di coltura per colangiociti e seminati su piastre di coltura cellulare rivestite con 1 mg/mL di collagene di coda di ratto di tipo I. La purezza dei colangiociti è stata confermata mediante immunocolorazione per il marcatore specifico dei colangiociti, la citocheratina-19 (CK19). Sebbene questo studio si sia concentrato sull'isolamento dei colangiociti primari da topi wild-type e PLD, siamo fiduciosi che il protocollo possa essere applicato anche ad altri modelli murini di malattia. Questo dettagliato metodo di digestione in due fasi facilita gli studi in vitro sulle colangiopatie e lo sviluppo di terapie mirate.
Introduzione
I colangiociti, le cellule epiteliali che rivestono l'albero biliare intraepatico, formano un monostrato e costituiscono circa il 3-5% della popolazione cellulare totale del fegato1. Queste cellule si interconnettono all'interno del fegato per creare una complessa rete duttale tridimensionale2. In condizioni normali, i colangiociti svolgono funzioni vitali, tra cui secrezione, assorbimento, riparazione delle lesioni e fungono da barriera immunitaria, svolgendo così un ruolo critico nella fisiologia e nella patologia epatica. Tuttavia, la disfunzione dei colangiociti può portare a varie malattie, tra cui PLD, colangite sclerosante primitiva, colangiocarcinoma e danno epatico colestatico 3,4,5.
Tra le malattie correlate alla colangiopatia, la PLD si distingue come una malattia ereditaria caratterizzata dalla formazione di numerose cisti piene di liquido originate dai colangiociti. Il progressivo ingrossamento di queste cisti riduce significativamente la qualità della vita dei pazienti6. Le attuali opzioni terapeutiche per la PLD rimangono insufficienti, offrendo un'efficacia limitata e spesso associate ad alti tassi di recidiva e complicanze7. Ciò evidenzia l'urgente necessità di sviluppare strategie terapeutiche sicure ed efficaci per affrontare le richieste cliniche insoddisfatte nella gestione della PLD.
La ricerca sui meccanismi delle colangiopatie, compresa la PLD, è stata notevolmente ostacolata dalla mancanza di linee cellulari adeguate. Per affrontare questa limitazione, l'uso di modelli murini di malattia e l'isolamento di colangiociti primari da questi modelli per esperimenti in vitro si sono dimostrati preziosi per scoprire i meccanismi molecolari alla base delle colangiopatie e identificare potenziali strategie terapeutiche.
Nel nostro recente studio8, abbiamo stabilito con successo un modello murino PLD utilizzando topi knockout condizionali (KO) Pkd1. Le cisti epatiche sono state osservate già 1 mese dopo la delezione di Pkd1 e sono aumentate progressivamente di dimensioni nel tempo. Mentre i protocolli per isolare i colangiociti dai ratti e dagli esseri umani sono ben documentati 9,10, l'isolamento dei colangiociti primari dai topi rimane particolarmente impegnativo a causa delle loro piccole dimensioni e dell'intricata architettura della vena porta e del sistema biliare. I metodi esistenti devono affrontare limitazioni significative, tra cui bassa purezza cellulare, scarsa vitalità, procedure complesse e costi elevati11,12.
Questo manoscritto presenta un protocollo dettagliato per isolare i colangiociti primari ad alta purezza dai topi utilizzando un metodo di digestione in due fasi. Questo approccio ottimizzato mira a supportare gli studi in vitro , facilitando lo studio dei meccanismi molecolari alla base delle colangiopatie e promuovendo lo sviluppo di nuove strategie terapeutiche.
Protocollo
Tutti i protocolli sperimentali e di cura dei topi sono stati approvati dal Comitato Etico dell'Università di Medicina di Tianjin (Doc. No: TMUa-MEC 2022016).
1. Preparazione delle attrezzature e delle soluzioni
- Sterilizzare gli strumenti chirurgici (forbici, pinze e manici di bisturi) in autoclave almeno 1 giorno prima dell'isolamento cellulare.
- Almeno 1 giorno prima dell'isolamento cellulare, preparare il terreno di coltura dei colangiociti utilizzando i reagenti elencati nella Tabella 1. Sterilizzare il terreno di coltura dei colangiociti filtrandolo attraverso un filtro da 0,22 μm.
- Almeno 1 giorno prima dell'isolamento cellulare, preparare la Soluzione A e la Soluzione B utilizzando i reagenti elencati nella Tabella 2 per la perfusione epatica di topo. Sterilizzare la soluzione A e la soluzione B in autoclave o filtrando attraverso un filtro da 0,22 μm e regolare il loro pH a 7,35 utilizzando NaOH sterile in agitazione delicata.
NOTA: Il terreno di coltura dei colangiociti, la soluzione A e la soluzione B possono essere conservati a 4°C per almeno un mese. - Prima di iniziare l'esperimento, aggiungere la polvere di collagenasi II alla soluzione B e mescolare delicatamente per ottenere una concentrazione finale di 0,5 mg/mL. Preriscaldare sia la soluzione A che la soluzione B in un bagno d'acqua a 37 °C prima dell'uso.
- Immediatamente prima di iniziare l'esperimento, preparare piatti di 6 cm riempiti con PBS sterile e metterli sul ghiaccio per mantenerli freddi durante la procedura.
2. Perfusione della digestione del tessuto epatico
- Anestetizzare il topo con un sovradosaggio di inalazione di isoflurano. Posizionare il topo anestetizzato in posizione supina e fissarlo con del nastro adesivo per facilitare la procedura.
- Aprire la cavità addominale del topo dopo aver sterilizzato l'addome con etanolo al 75% e poi, legare un nodo scorsoio attorno alla vena cava inferiore usando un ago pressato. Sciacquare un catetere endovenoso da 24 G con la soluzione A utilizzando una siringa da 20 ml.
- Inserire il catetere endovenoso nella vena cava inferiore sotto il nodo scorsoio, fissare il nodo scorsoio e fissare il catetere in posizione con del nastro adesivo.
- Perfondere il fegato con 50 mL di soluzione A attraverso la vena cava inferiore utilizzando una siringa da 20 mL e incidere la vena porta epatica per drenare la soluzione di perfusione. Mantenere la velocità di perfusione a 10 ml/min.
- Continuare la perfusione con 30 mL di Soluzione B contenente collagenasi II a una velocità di flusso di 3,5 mL/min utilizzando una pompa peristaltica.
NOTA: Questo passaggio è destinato alla digestione del tessuto epatico. - Rimuovere il tessuto epatico perfuso con successo e metterlo in un piatto di 6 cm riempito con PBS sterile freddo.
3. Isolamento dei colangiociti
NOTA: Poiché il numero di colangiociti nei topi normali è relativamente basso, si consiglia di utilizzare un gruppo di 2-6 topi per la procedura. Tuttavia, per i modelli murini di malattia con proliferazione anomala dei colangiociti, come la PLD, i colangiociti di un singolo topo sono sufficienti. Se non diversamente specificato, i campioni e i reagenti devono essere sempre conservati su ghiaccio e tutte le procedure devono essere eseguite in una cabina di sicurezza biologica.
- Dissociare e scuotere meccanicamente il tessuto epatico utilizzando una pinza curva. Successivamente, eseguire la microdissezione al microscopio da dissezione per rimuovere le cellule parenchimali aderenti, lasciando intatto un albero biliare. Rimuovere il tessuto della cistifellea prima di procedere al passaggio successivo.
Lavare il fazzoletto 2 volte con PBS. - Tritare finemente l'albero biliare utilizzando una lama chirurgica e digerirlo in 3 ml di soluzione digestiva (Tabella 3) per topo agitando (90 giri/min) a 37 °C per 60 minuti. Al segno dei 30 minuti, pipettare delicatamente la miscela utilizzando un puntale per pipetta per mescolare accuratamente.
NOTA: La soluzione digestiva deve essere preparata al momento prima dell'uso. - Far passare la sospensione cellulare attraverso un filtro cellulare da 70 μm. Utilizzare lo stantuffo di una siringa da 5 ml o 10 ml per premere delicatamente la sospensione cellulare attraverso il colino. Lavare il colino con PBS.
- Centrifugare la sospensione cellulare a 500 x g per 5 minuti a 4 °C. Lavare le celle 3 volte con mezzo RPMI.
- Centrifugare nuovamente a 500 x g per 5 min a 4 °C.
- Scartare il surnatante e risospendere le cellule in 900 μL di terreno RPMI contenente 40 U/mL di DNasi I. Aggiungere 2 μg di anticorpo anti-EpCAM e incubare la sospensione su un rotatore (20 giri/min) a 4 °C per 45 min.
- Centrifugare a 500 x g per 5 min a 4 °C.
- Scartare il surnatante e risospendere le cellule in 1 mL di terreno RPMI contenente 40 U/mL di DNasi I. Prelavare le perle di proteina G con 1 mL di terreno RPMI. Aggiungere 20 μL di perle di proteina G alla sospensione cellulare e incubare con rotazione (20 giri/min) a 4 °C per altri 45 minuti.
NOTA: L'anticorpo anti-EpCAM può anche essere preincubato con perle di proteina G per creare un complesso anticorpo a perlina prima di introdurre la sospensione cellulare. - Lavare le celle 3 volte con PBS utilizzando un separatore magnetico.
- Eseguire la conta cellulare e la valutazione della vitalità cellulare utilizzando la colorazione Trypan Blue (0,04%, 3 min) su un emocitometro.
NOTA: Non è necessario rimuovere le perle dai colangiociti, si staccheranno naturalmente una volta iniziata la coltura e non interferiranno con la coltura cellulare.
4. Coltura dei colangiociti
NOTA: Preparare piatti freschi per colture cellulari rivestite di collagene con coda di ratto di tipo I prima della coltura dei colangiociti. Preraffreddare tutti i reagenti con ghiaccio.
- Seguendo le istruzioni del produttore, mescolare ddH2O sterile, 10x PBS, 1 N NaOH e collagene di coda di ratto di tipo I per ottenere una concentrazione finale di 1 mg/mL di collagene di coda di ratto di tipo I in 1x PBS. Rivestire uniformemente le piastre di coltura cellulare con la miscela e posizionare le piastre in un incubatore a 37 °C con il 5% di CO2 per 30 minuti per consentire al collagene di solidificarsi.
- Lavare le piastre per colture cellulari rivestite di collagene con coda di ratto di tipo I con PBS preriscaldato.
- Risospendere i colangiociti in un terreno di coltura preriscaldato per colangiociti. Seminare la sospensione cellulare su piastre di coltura cellulare rivestite di collagene con coda di ratto di tipo I da 1 mg/mL e incubare a 37 °C con CO2 al 5%. Sostituire il mezzo ogni 2 giorni.
5. Passaging e crioconservazione dei colangiociti
- Lavare i colangiociti due volte con PBS, quindi incubare le cellule in tripsina allo 0,25% a 37 °C per 5-10 minuti.
- Aggiungere un volume uguale di terreno di coltura per colangiociti per neutralizzare la tripsina, quindi centrifugare a 500 x g per 5 minuti.
- Preparare piastre per colture cellulari rivestite di collagene con coda di ratto di tipo I come descritto al passaggio 4.1.
- Seguire i passaggi 4.2 e 4.3.
- Se è necessaria la crioconservazione, risospendere i colangiociti in un terreno di conservazione (9:1 FBS: DMSO) e conservarli in un congelatore a -80 °C o in azoto liquido. Scongelare le celle secondo necessità per un uso futuro.
6. Validazione dei colangiociti
NOTA: La purezza dei colangiociti è stata valutata mediante colorazione per il marcatore dei colangiociti CK19.
- Lavare i colangiociti 2 volte con PBS, quindi fissare le cellule in paraformaldeide al 4% per 15 minuti.
- Lavare i colangiociti con PBS, quindi permeabilizzare le cellule con Triton X-100 all'1% per 8 minuti.
- Lavare i colangiociti con PBS, quindi bloccare le cellule in BSA al 5% per 1 ora.
- Lavare i colangiociti con PBS, quindi incubare le cellule con l'anticorpo primario contro CK19 (diluizione 1:12 con BSA al 2%) per una notte a 4 °C.
- Lavare i colangiociti 2 volte con PBS, quindi incubare le cellule con l'anticorpo secondario Alexa Fluor 488 anti-ratto d'asino (diluizione 1:1.000 con PBS) per 1 ora a temperatura ambiente.
- Lavare i colangiociti con PBS, colorare con 4',6-diamidino-2-fenilindolo per 15 minuti e osservare al microscopio.
Risultati
Il diagramma del flusso di lavoro per il processo di digestione in due fasi utilizzato per isolare i colangiociti è mostrato nella Figura 1. L'intera procedura dura ~5 ore. In primo luogo, il fegato viene perfuso con la soluzione A attraverso la vena cava inferiore per rimuovere il sangue, come indicato dal fegato che diventa pallido. Il fegato viene quindi perfuso con la soluzione B contenente collagenasi II per avviare la digestione dei tessuti. Questa fase iniziale della digestione è sensibile al tempo e il successo della digestione è evidenziato dal tessuto che diventa notevolmente morbido. Successivamente, la dissociazione meccanica e l'agitazione delicata con una pinza curva aiutano a rimuovere gli epatociti; La corretta digestione è confermata quando un gran numero di epatociti si stacca. Al microscopio da dissezione, le cellule parenchimali aderenti rimanenti vengono accuratamente rimosse mediante microdissezione, lasciando un albero biliare intatto (Figura 2).
Nella seconda fase della digestione, il tessuto viene scomposto in una sospensione unicellulare, che contiene ancora alcuni epatociti e fibroblasti. Infine, da questa sospensione si ottengono colangiociti di elevata purezza attraverso la separazione immunomagnetica. La valutazione della vitalità cellulare è stata condotta utilizzando la colorazione con blu di tripano su un emocitometro. I risultati hanno dimostrato il successo dell'isolamento di colangiociti altamente vitali (Figura 3). La colorazione in immunofluorescenza per CK19 (Figura 4) ha confermato che questo metodo produce costantemente colangiociti di topo di elevata purezza.
I colangiociti primari hanno tipicamente aderito alla superficie di coltura e hanno formato un monostrato entro circa 24 ore, mostrando una rapida proliferazione durante i primi tre passaggi, specialmente nei modelli murini di malattia con proliferazione anomala dei colangiociti, come la PLD (Figura 5). Tuttavia, nei passaggi successivi, il tasso di crescita diminuiva e le cellule diventavano più grandi e sviluppavano una morfologia vacuolata. Non è necessario rimuovere le perle dai colangiociti, si staccheranno naturalmente una volta iniziata la coltura e non interferiranno con la coltura cellulare. La crioconservazione e lo scongelamento delle cellule non hanno influenzato in modo significativo la vitalità cellulare.
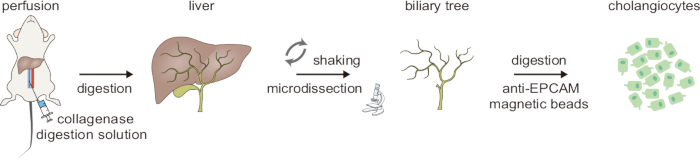
Figura 1: Panoramica schematica del processo di digestione in due fasi per l'isolamento dei colangiociti. Questa cifra è stata presa da Ji et al8. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Immagine rappresentativa dell'albero biliare isolato da un topo con malattia del fegato policistico. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Valutazione della vitalità cellulare di colangiociti isolati mediante colorazione con Trypan Blue. Barre di scala = 50 μm. Le piccole particelle nere che circondano le cellule e all'interno dello sfondo sono perle di proteina G. Clicca qui per visualizzare una versione più grande di questa figura.
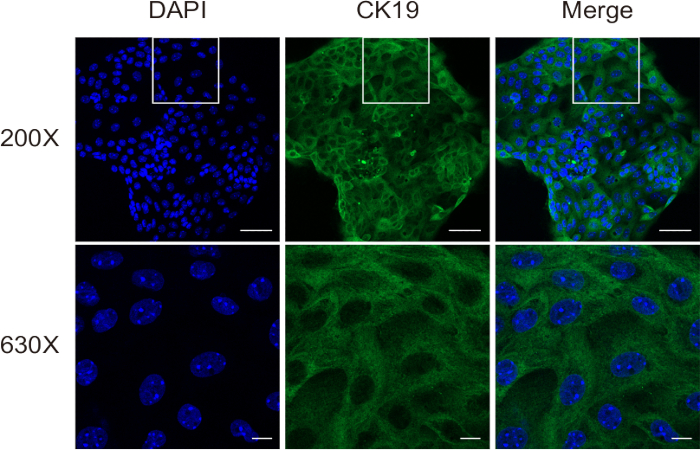
Figura 4: Valutazione della purezza cellulare di colangiociti isolati utilizzando la colorazione in immunofluorescenza per CK19. Barre della scala: = 50 μm [superiore] e 10 μm [inferiore]. Questa cifra è stata presa da Ji et al8. Clicca qui per visualizzare una versione più grande di questa figura.
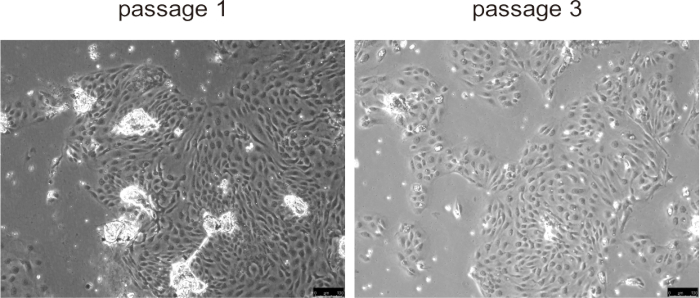
Figura 5: Immagini rappresentative di colangiociti isolati nel passaggio 1 e nel passaggio 3. Barre di scala = 100 μm. Clicca qui per visualizzare una versione più grande di questa figura.
| Componenti | Importo |
| DMEM/F12 (1:1) | 415 ml |
| Siero fetale bovino (FBS) | 50 ml |
| Aminoacidi non essenziali MEM (100x) | 5 ml |
| Insulina-transferrina-selenio (100x) | 5 ml |
| Soluzione vitaminica MEM (100x) | 5 ml |
| Concentrato lipidico chimicamente definito (100x) | 5 ml |
| Penicillina-Streptomicina (100x) | 5 ml |
| Soluzione di gentamicina/amfotericina (500x) | 1 ml |
| 100 mM di Na Piruvato | 250 μl |
| 10 mg/mL di inibitore della tripsina di soia | 2,5 ml |
| 200 mM di L-glutammina | 5 ml |
| 10 mg/mL di desametasone | 20 μl |
| 1,7 mg/mL di 3,3',5-triiodo-L-tironina | 1 ml |
| 1 mg/mL Fattore di crescita epidermico | 12,5 μl |
| 20 mM Forskolina | 250 μl |
| Etanolammina | 13 μl |
Tabella 1: Composizione del terreno di coltura dei colangiociti.
| Componenti | Importo | |
| Soluzione A | NaCl | 4,0908 grammi |
| Kcl | 0,1578 g | |
| Na2HPO4 | 0,1072 grammi | |
| HEPES | 2,9789 grammi | |
| 50 mM EGTA (PH = 8) | 5 ml | |
| 1,5 milioni di MgCl2 | 34 μl | |
| ddH2O | 500 ml | |
| NOTA: Regolare il pH a 7,35 utilizzando NaOH sterile. | ||
| Soluzione B | NaCl | 4,0908 grammi |
| Kcl | 0,1578 g | |
| Na2HPO4 | 0,1072 grammi | |
| HEPES | 2,9789 grammi | |
| 2 M CaCl2 | 1,25 ml | |
| ddH2O | 500 ml | |
| NOTA: Regolare il pH a 7,35 utilizzando NaOH sterile. La polvere di collagenasi II deve essere aggiunta per raggiungere una concentrazione finale di 0,5 mg/mL prima dell'uso. | ||
Tabella 2: Composizione della soluzione A e della soluzione B.
| Componenti | Importo |
| 3,2 mg/mL di collagenasi XI | 300 μl |
| 10 mg/mL di ialuronidasi | 120 μl |
| 10 U/μL DNasi I | 12 μl |
| Penicillina-Streptomicina (100x) | 30 μl |
| RPMI medio | 2,538 ml |
Tabella 3: Composizione della soluzione di digestione.
Discussione
Questo protocollo fornisce un metodo dettagliato per isolare i colangiociti primari ad alta purezza dai topi utilizzando un processo di digestione in due fasi, consentendo lo studio dei meccanismi molecolari alla base delle colangiopatie. Diversi passaggi critici sono essenziali per garantire il successo dell'isolamento dei colangiociti.
Il primo passo critico è garantire un'efficace perfusione e digestione utilizzando la Soluzione A e la Soluzione B. Il successo della perfusione con la Soluzione A è stato confermato dal fatto che il fegato è diventato pallido e il successo della digestione con la Soluzione B è stato confermato dal tessuto epatico che è diventato notevolmente morbido. Il fallimento della perfusione impedirebbe la digestione del tessuto epatico e comprometterebbe il successivo isolamento dell'albero biliare. Per migliorare l'efficienza della digestione, si potrebbero aumentare i volumi della soluzione A e della soluzione B, ridurre la velocità del flusso di perfusione o premere delicatamente il fegato con un batuffolo di cotone.
La seconda fase critica prevede la dissociazione meccanica e lo scuotimento delicato del tessuto epatico con una pinza curva, seguita dalla microdissezione al microscopio da dissezione per rimuovere le cellule parenchimali aderenti e isolare un albero biliare intatto. Questo passaggio è stato fondamentale per ottenere colangiociti di elevata purezza. L'efficienza potrebbe essere migliorata afferrando dotti biliari più grandi con una pinza curva durante l'agitazione e il risciacquo con PBS freddo. Se il fegato viene digerito con successo, molti epatociti si staccheranno, rendendo la microdissezione relativamente semplice. Tuttavia, se la digestione è incompleta e il campione è prezioso, il processo di microdissezione richiederà uno sforzo scrupoloso, aumentando il carico di lavoro e riducendo potenzialmente sia la resa che la purezza delle cellule. Pertanto, era fondamentale garantire una corretta perfusione con la soluzione B per la digestione epatica.
La terza fase critica è la seconda digestione dell'albero biliare per produrre una sospensione unicellulare. Il tempo di digestione dovrebbe essere ottimizzato osservando le cellule al microscopio: una sovradigestione può ridurre la vitalità cellulare, mentre una digestione insufficiente potrebbe portare a tessuto biliare inutilizzato. Inoltre, l'inclusione di antibiotici appropriati in tutti i reagenti aiuta a ridurre al minimo la contaminazione.
Utilizzando questo protocollo di digestione ottimizzato in due fasi, abbiamo isolato con successo i colangiociti di alta purezza e altamente vitali dai topi. Sebbene questo studio si sia concentrato sull'isolamento dei colangiociti primari da modelli murini wild-type e PLD, siamo fiduciosi che il protocollo possa essere applicato anche ad altri modelli murini di malattia. Il processo di digestione iniziale del tessuto epatico per isolare l'albero biliare, seguito da una seconda fase di digestione, ha migliorato significativamente l'efficienza della separazione immunomagnetica e ha prodotto un numero maggiore di cellule vitali. I colangiociti isolati erano adatti per esperimenti epigenetici che richiedevano un'elevata vitalità, come ATAC-seq, ChIP-seq, ChIP-seq a basso input e CUT&TAG. Inoltre, questi colangiociti primari potrebbero essere coltivati in vitro per vari saggi funzionali, tra cui la crescita cistica 3D, la proliferazione cellulare, l'apoptosi e l'analisi del ciclo cellulare.
Inuno studio 8 precedentemente pubblicato, abbiamo isolato i colangiociti primari sia normali che cistici da topi wild-type e PLD di entrambi i sessi. La profilazione multi-omica dei colangiociti primari di topi PLD maschi e femmine ha rivelato dinamiche epigenetiche sesso-specifiche nei colangiociti durante la cistogenesi epatica. Inoltre, abbiamo identificato una potenziale strategia terapeutica epigenetica per i pazienti maschi con PLD attraverso l'inibizione farmacologica di enzimi modificanti l'epigenetica sia in modelli murini di PLD che in esperimenti in vitro con colangiociti primari.
Il nostro approccio offre diversi vantaggi notevoli rispetto ai metodi di isolamento dei colangiociti attualmente pubblicati. Rispetto al metodo di Kudira et al.13, che prevede la digestione diretta del tessuto epatico in una sospensione unicellulare dopo la digestione per perfusione, seguita dalla centrifugazione in gradiente e dall'isolamento immunomagnetico, il nostro metodo è più semplice, più economico e più efficiente. Un vantaggio chiave è l'isolamento dell'albero biliare prima dell'isolamento immunomagnetico, che migliora il processo complessivo. Inoltre, non richiedendo la rimozione delle perle dai colangiociti, questo metodo consente di ottenere una resa più elevata e una maggiore vitalità delle cellule isolate. Rispetto al metodo di Ueno et al.14, che dissocia e sminuzza il residuo del tratto portale dalla perfusione della digestione epatica per la coltura 3D, seguito da un periodo di coltura di 7 giorni prima di generare una sospensione a singola cellula, il nostro metodo è più efficiente in termini di tempo. Anche l'isolamento dell'albero biliare, seguito dall'isolamento immunomagnetico, migliora significativamente la purezza cellulare.
Tuttavia, nonostante questi vantaggi, la nostra tecnica di digestione in due fasi presenta ancora alcune limitazioni. È relativamente laborioso, consente solo un numero limitato di passaggi e richiede un'attenta microdissezione per evitare la contaminazione parenchimale.
In conclusione, abbiamo sviluppato e ottimizzato un metodo di digestione in due fasi per isolare i colangiociti primari ad alta purezza e alta vitalità dai topi. Questo approccio fornisce un valido strumento per lo studio dei meccanismi molecolari alla base delle colangiopatie e offre una base per l'identificazione di potenziali strategie terapeutiche.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni della Commissione municipale per l'istruzione di Tianjin (2022ZD054 a L.Z.)
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | PALL | 4612 | |
| 0.25% Trypsin | Gibco | 25200-056 | |
| 10 mL syringe | KONSMED | 10 mL 1.2*30TWLB | |
| 20 mL syringe | KONSMED | 20 mL 1.2*30TWLB | |
| 24 G intravenous catheter | WEGO | 24GX19 mm/Y-G | |
| 3,3',5-triiodo-L-thyronine | Sigma | T5516 | 1.7 mg/mL stock |
| 4% paraformaldehyde | Solarbio | P1110 | |
| 5 mL syringe | KONSMED | 5 mL 0.7*30TWLB | |
| 6 cm dishes | Thermo Scientific | 150462 | |
| 70 µm cell strainer | Corning | 352350 | |
| anti-CK19 antibody | DSHB | TROMA-III | |
| anti-EpCAM antibody | DSHB | G8.8 | |
| BSA | Solarbio | A8020 | |
| CaCl2 | Sangon Biotech | A501330 | 2 M stock |
| Chemically-defined lipid concentrate (100x) | Gibco | 11905-031 | |
| Collagenase II | Worthington | LS004176 | |
| Collagenase XI | Sigma | C7657 | 3.2 mg/mL stock |
| Dexamethasone | Sigma | D1756 | 10 mg/mL stock |
| Dissecting Microscope | Leica | EZ4 | |
| DMEM/F12 (1:1) | VivaCell biosciences | C3130-0500 | |
| DMSO | Sigma | D2650 | |
| DNase I | Sigma | D4513 | 10 U/μL stock |
| Donkey anti-rat Alexa Fluor 488 secondary antibody | Invitrogen | A21208 | |
| EGTA | Solarbio | E8050 | 50 mM (PH = 8) stock |
| Epidermal growth factor (1 mg/mL) | Sigma | SRP3196 | |
| Ethanolamine | Sigma | E9508 | |
| Fetal Bovine Serum | VivaCell biosciences | C04001-500 | |
| Forskolin | Sigma | F3917 | 20 mM stock |
| Gentamicin/amphotericin solution (500x) | Gibco | R01510 | |
| Hemocytometer | QIUJING | XB.K.25. | |
| HEPES | Sigma | H4034 | |
| Hyaluronidase | Sigma | H3506 | 10 mg/mL stock |
| Insulin-transferrin-selenium (100x) | Gibco | 41400045 | |
| Isoflurane | RWD | R510-22-10 | |
| KCl | Sangon Biotech | A100395 | |
| L-Glutamine (200 mM) | Sigma | G7513 | |
| Magnetic separator | Promega | Z5342 | |
| MEM non-essential amino acids (100x) | Gibco | 11140050 | |
| MEM vitamin solution (100x) | Gibco | 11120052 | |
| MgCl2 | Sangon Biotech | A100288 | 1.5 M stock |
| Na Pyruvate (100 mM) | Gibco | 11360070 | |
| Na2HPO4 | Sangon Biotech | A600487 | |
| NaCl | Sangon Biotech | A610476 | |
| NaOH | Sangon Biotech | A620617 | 1 N stock |
| PBS | VivaCell biosciences | C3580-0500 | |
| PBS | Solarbio | P1010 | |
| Penicillin-Streptomycin (100x) | Gibco | 15140-122 | |
| Peristaltic pump | BaodingRongbai | YZ1515PPS | |
| Protein G beads | Invitrogen | 10004D | |
| Rotator | Kylin-Bell | QB-528 | |
| RPMI | VivaCell biosciences | C3010-0500 | |
| Soybean trypsin inhibitor | Sigma | T6522 | 10 mg/mL stock |
| Swaged needle | Jinhuan Medical | HM601 | |
| Triton X-100 | Solarbio | T8200 | |
| Trypan blue | Sigma | T6146 | 10 mg/mL stock |
| Type I rat tail collagen | BD | 354236 |
Riferimenti
- Wang, Z., et al. Human cholangiocytes form a polarized and functional bile duct on hollow fiber membranes. Front Bioeng Biotechnol. 10, 868857 (2022).
- Li, P., et al. Three-dimensional human bile duct formation from chemically induced human liver progenitor cells. Front Bioeng Biotechnol. 11, 1249769 (2023).
- Fabris, L., et al. Pathobiology of inherited biliary diseases: a roadmap to understand acquired liver diseases. Nat Rev Gastroenterol Hepatol. 16 (8), 497-511 (2019).
- Jalan-Sakrikar, N., et al. Central role for cholangiocyte pathobiology in cholestatic liver diseases. Hepatology. , (2024).
- Ilyas, S. I., Gores, G. J. Pathogenesis, diagnosis, and management of cholangiocarcinoma. Gastroenterology. 145 (6), 1215-1229 (2013).
- Perugorria, M. J., et al. Polycystic liver diseases: advanced insights into the molecular mechanisms. Nat Rev Gastroenterol Hepatol. 11 (12), 750-761 (2014).
- Masyuk, T. V., Masyuk, A. I., LaRusso, N. F. Polycystic liver disease: Advances in understanding and treatment. Annu Rev Pathol. 17, 251-269 (2022).
- Ji, R., et al. Multi-omics profiling of cholangiocytes reveals sex-specific chromatin state dynamics during hepatic cystogenesis in polycystic liver disease. J Hepatol. 78 (4), 754-769 (2023).
- Tabibian, J. H., et al. Characterization of cultured cholangiocytes isolated from livers of patients with primary sclerosing cholangitis. Lab Invest. 94 (10), 1126-1133 (2014).
- Muff, M. A., et al. Development and characterization of a cholangiocyte cell line from the PCK rat, an animal model of autosomal recessive polycystic kidney disease. Lab Invest. 86 (9), 940-950 (2006).
- Nagaya, M., Katsuta, H., Kaneto, H., Bonner-Weir, S., Weir, G. C. Adult mouse intrahepatic biliary epithelial cells induced in vitro to become insulin-producing cells. J Endocrinol. 201 (1), 37-47 (2009).
- Karjoo, S., Wells, R. G. Isolation of neonatal extrahepatic cholangiocytes. J Vis Exp. (88), e51621 (2014).
- Kudira, R., et al. Isolation and culturing primary chaolangiocytes from mouse liver. Bio Protoc. 11 (20), e4192 (2021).
- Ueno, Y., et al. Evaluation of differential gene expression by microarray analysis in small and large cholangiocytes isolated from normal mice. Liver Int. 23 (6), 449-459 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon