Method Article
Isolement et culture de cholangiocytes primaires de souris atteintes de polykystose hépatique à l’aide d’une méthode de digestion en deux étapes
Dans cet article
Résumé
Ce protocole décrit une méthode de digestion optimisée en deux étapes pour isoler les cholangiocytes primaires de haute pureté et de haute viabilité de souris de type sauvage et de souris atteintes de polykystose hépatique.
Résumé
Dans ce protocole, nous avons optimisé une méthode de digestion en deux étapes pour isoler des cholangiocytes primaires de haute pureté et de haute viabilité de souris de type sauvage et de souris atteintes de polykystose hépatique (DLP). Après avoir anesthésié les souris, les foies ont été perfusés à travers la veine cave inférieure avec 50 mL de solution A, suivis de 30 mL de solution B à 37 °C pour digérer enzymatiquement le tissu hépatique. Une dissociation mécanique, une secousse et une microdissection ont été effectuées pour éliminer les cellules parenchymateuses adhérentes, laissant un arbre biliaire intact. L’arbre biliaire a ensuite été finement haché et digéré en secouant pendant 60 min à 37 °C. La suspension unicellulaire résultante a été recueillie à l’aide d’une crépine à cellules de 70 μm. Les cholangiocytes ont été purifiés par isolement immunomagnétique. La suspension cellulaire a été incubée avec un anticorps anti-EpCAM en rotation pendant 45 minutes à 4 °C, suivie de l’ajout de billes de protéine G et d’une rotation supplémentaire pendant 45 minutes à 4 °C. Après trois lavages avec du PBS, les cholangiocytes ont été collectés à l’aide d’un séparateur magnétique. Les cholangiocytes primaires purifiés ont été remis en suspension dans un milieu de culture de cholangiocytes et ensemencés sur des boîtes de culture cellulaire recouvertes de 1 mg/mL de collagène de queue de rat de type I. La pureté des cholangiocytes a été confirmée par immunomarquage pour le marqueur cytokératine-19 (CK19), un marqueur spécifique des cholangiocytes. Bien que cette étude se soit concentrée sur l’isolement des cholangiocytes primaires de souris de type sauvage et de souris PLD, nous sommes convaincus que le protocole peut également être appliqué à d’autres modèles de souris pathologiques. Cette méthode de digestion détaillée en deux étapes facilite l’étude in vitro des cholangiopathies et le développement de thérapies ciblées.
Introduction
Les cholangiocytes, les cellules épithéliales qui tapissent l’arbre biliaire intrahépatique, forment une monocouche et constituent environ 3 à 5 % de la population cellulaire totale du foie1. Ces cellules s’interconnectent dans le foie pour créer un réseau canalaire tridimensionnel complexe2. Dans des conditions normales, les cholangiocytes remplissent des fonctions vitales, notamment la sécrétion, l’absorption, la réparation des lésions et servent de barrière immunitaire, jouant ainsi un rôle essentiel dans la physiologie et la pathologie du foie. Cependant, le dysfonctionnement des cholangiocytes peut entraîner diverses maladies, notamment la DLP, la cholangite sclérosante primitive, le cholangiocarcinome et les lésions hépatiques cholestatiques 3,4,5.
Parmi les maladies liées à la cholangiopathie, la DLP se distingue comme une maladie héréditaire caractérisée par la formation de nombreux kystes remplis de liquide provenant de cholangiocytes. L’élargissement progressif de ces kystes diminue considérablement la qualité de vie des patients6. Les options de traitement actuelles de la DLP restent insuffisantes, offrant une efficacité limitée tout en étant souvent associées à des taux élevés de récidive et de complications7. Cela souligne le besoin urgent de développer des stratégies thérapeutiques sûres et efficaces pour répondre aux demandes cliniques non satisfaites dans la prise en charge de la DLP.
La recherche sur les mécanismes des cholangiopathies, y compris la DLP, a été considérablement entravée par le manque de lignées cellulaires appropriées. Pour remédier à cette limitation, l’utilisation de modèles murins pathologiques et l’isolement des cholangiocytes primaires à partir de ces modèles pour des expériences in vitro se sont avérés inestimables pour découvrir les mécanismes moléculaires sous-jacents aux cholangiopathies et identifier des stratégies thérapeutiques potentielles.
Dans notre récente étude8, nous avons réussi à établir un modèle de souris PLD en utilisant des souris Pkd1 à knockout conditionnel (KO). Des kystes hépatiques ont été observés dès 1 mois après la délétion de Pkd1 et ont progressivement augmenté en taille au fil du temps. Bien que les protocoles permettant d’isoler les cholangiocytes des rats et des humains soient bien documentés 9,10, l’isolement des cholangiocytes primaires des souris reste particulièrement difficile en raison de leur petite taille et de l’architecture complexe de la veine porte et du système biliaire. Les méthodes existantes sont confrontées à des limites importantes, notamment une faible pureté cellulaire, une faible viabilité, des procédures complexes et des coûts élevés11,12.
Ce manuscrit présente un protocole détaillé pour isoler les cholangiocytes primaires de haute pureté des souris à l’aide d’une méthode de digestion en deux étapes. Cette approche optimisée vise à soutenir les études in vitro , à faciliter l’investigation des mécanismes moléculaires sous-jacents aux cholangiopathies et à faire progresser le développement de nouvelles stratégies thérapeutiques.
Protocole
Tous les soins de souris et les protocoles expérimentaux ont été approuvés par le comité d’éthique de l’Université de médecine de Tianjin (doc. n° : TMUa-MEC 2022016).
1. Préparation des équipements et des solutions
- Stérilisez les instruments chirurgicaux (ciseaux, pinces et manches de scalpel) par autoclave au moins 1 jour avant l’isolement cellulaire.
- Au moins 1 jour avant l’isolement cellulaire, préparez le milieu de culture de cholangiocytes à l’aide des réactifs indiqués dans le tableau 1. Stérilisez le milieu de culture des cholangiocytes en le filtrant à travers un filtre de 0,22 μm.
- Au moins 1 jour avant l’isolement cellulaire, préparer la solution A et la solution B à l’aide des réactifs énumérés au tableau 2 pour la perfusion hépatique de souris. Stérilisez la solution A et la solution B par autoclave ou filtrage à travers un filtre de 0,22 μm et ajustez leur pH à 7,35 à l’aide de NaOH stérile sous agitation douce.
REMARQUE : Le milieu de culture de cholangiocytes, la solution A et la solution B peuvent être conservés à 4 °C pendant au moins un mois. - Avant de commencer l’expérience, ajoutez de la poudre de collagénase II à la solution B et mélangez doucement pour obtenir une concentration finale de 0,5 mg/mL. Préchauffez la solution A et la solution B dans un bain-marie à 37 °C avant utilisation.
- Immédiatement avant de commencer l’expérience, préparez des plats de 6 cm remplis de PBS stérile et placez-les sur de la glace pour les garder froids pendant la procédure.
2. Perfusion de digestion du tissu hépatique
- Anesthésier la souris en utilisant une surdose d’inhalation d’isoflurane. Placez la souris anesthésiée en position couchée et fixez-la avec du ruban adhésif pour faciliter la procédure.
- Ouvrez la cavité abdominale de la souris après avoir stérilisé l’abdomen avec de l’éthanol à 75 %, puis faites un nœud coulant autour de la veine cave inférieure à l’aide d’une aiguille emboutie. Rincer un cathéter intraveineux de 24 g avec la solution A à l’aide d’une seringue de 20 ml.
- Insérez le cathéter intraveineux dans la veine cave inférieure sous le nœud coulant, fixez le nœud coulant et fixez le cathéter en place avec du ruban adhésif.
- Perfuser le foie avec 50 mL de la solution A à travers la veine cave inférieure à l’aide d’une seringue de 20 mL, et inciser la veine porte hépatique pour drainer la solution de perfusion. Maintenir le débit de perfusion à 10 mL/min.
- Poursuivre la perfusion avec 30 mL de la solution B contenant de la collagénase II à un débit de 3,5 mL/min à l’aide d’une pompe péristaltique.
REMARQUE : Cette étape est destinée à la digestion du tissu hépatique. - Retirez le tissu hépatique perfusé avec succès et placez-le dans une boîte de 6 cm remplie de PBS stérile et froid.
3. Isolement des cholangiocytes
REMARQUE : Comme le nombre de cholangiocytes chez les souris normales est relativement faible, il est recommandé d’utiliser un groupe de 2 à 6 souris pour la procédure. Cependant, pour les modèles de maladies chez la souris avec une prolifération anormale des cholangiocytes, tels que la DLP, les cholangiocytes d’une seule souris sont suffisants. Sauf indication contraire, les échantillons et les réactifs doivent toujours être conservés sur de la glace, et toutes les procédures doivent être effectuées dans une enceinte de sécurité biologique.
- Dissocier et secouer mécaniquement le tissu hépatique à l’aide d’une pince incurvée. Par la suite, effectuez une microdissection sous microscope à dissection pour éliminer les cellules parenchymateuses adhérentes, laissant un arbre biliaire intact. Retirez le tissu de la vésicule biliaire avant de passer à l’étape suivante.
Lavez le mouchoir 2 fois avec du PBS. - Hacher finement l’arbre biliaire à l’aide d’une lame chirurgicale et le digérer dans 3 mL de solution de digestion (tableau 3) par souris en agitant (90 tr/min) à 37 °C pendant 60 min. Au bout de 30 minutes, pipetez doucement le mélange à l’aide d’une pointe de pipette pour bien mélanger.
REMARQUE : La solution de digestion doit être fraîchement préparée avant utilisation. - Passez la suspension cellulaire dans une crépine de 70 μm. À l’aide du piston d’une seringue de 5 ml ou de 10 ml, appuyez doucement sur la suspension cellulaire à travers la crépine. Lavez la passoire avec du PBS.
- Centrifuger la suspension cellulaire à 500 x g pendant 5 min à 4 °C. Lavez les cellules 3 fois avec un milieu RPMI.
- Centrifuger à nouveau à 500 x g pendant 5 min à 4 °C.
- Jeter le surnageant et remettre les cellules en suspension dans 900 μL de milieu RPMI contenant 40 U/mL de DNase I. Ajouter 2 μg d’anticorps anti-EpCAM et incuber la suspension sur un rotateur (20 tr/min) à 4 °C pendant 45 min.
- Centrifugeuse à 500 x g pendant 5 min à 4 °C.
- Jeter le surnageant et remettre les cellules en suspension dans 1 mL de milieu RPMI contenant 40 U/mL de DNase I. Prélaver les billes de protéine G avec 1 mL de milieu RPMI. Ajouter 20 μL de billes de protéine G à la suspension cellulaire et incuber à rotation (20 tr/min) à 4 °C pendant 45 minutes supplémentaires.
REMARQUE : L’anticorps anti-EpCAM peut également être préincubé avec des billes de protéine G pour créer un complexe billes-anticorps avant d’introduire la suspension cellulaire. - Lavez les cellules 3 fois avec du PBS à l’aide d’un séparateur magnétique.
- Effectuer la numération cellulaire et l’évaluation de la viabilité cellulaire à l’aide de la coloration au bleu trypan (0,04 %, 3 min) sur un hémocytomètre.
REMARQUE : Il n’est pas nécessaire de retirer les billes des cholangiocytes, elles se détacheront naturellement une fois la culture commencée et n’interféreront pas avec la culture cellulaire.
4. Culture de cholangiocytes
REMARQUE : Préparez des plats de culture cellulaire frais enrobés de collagène de queue de rat de type I avant la culture des cholangiocytes. Prérefroidissez tous les réactifs sur de la glace.
- En suivant les instructions du fabricant, mélangez du collagène stérile ddH2O, 10x PBS, 1 N NaOH et du collagène de queue de rat de type I pour obtenir une concentration finale de 1 mg/mL de collagène de queue de rat de type I dans 1x PBS. Enduisez uniformément les boîtes de culture cellulaire avec le mélange et placez-les dans un incubateur à 37 °C avec 5 % de CO2 pendant 30 min pour permettre au collagène de se solidifier.
- Lavez les plats de culture cellulaire enrobés de collagène de queue de rat de type I avec du PBS préchauffé.
- Remettez les cholangiocytes en suspension dans un milieu de culture de cholangiocytes préchauffé. Ensemencer la suspension cellulaire dans des boîtes de culture cellulaire enrobées de collagène de queue de rat de type I de 1 mg / mL et incuber à 37 °C avec 5 % de CO2. Remplacez le milieu tous les 2 jours.
5. Passage et cryoconservation des cholangiocytes
- Laver les cholangiocytes deux fois avec du PBS, puis incuber les cellules dans de la trypsine à 0,25 % à 37 °C pendant 5 à 10 min.
- Ajouter un volume égal de milieu de culture de cholangiocytes pour neutraliser la trypsine, puis centrifuger à 500 x g pendant 5 min.
- Préparez des boîtes de culture cellulaire enrobées de collagène de queue de rat de type I comme décrit à l’étape 4.1.
- Suivez les étapes 4.2 et 4.3.
- Si une cryoconservation est nécessaire, remettre les cholangiocytes en suspension dans un milieu de stockage (9:1 FBS : DMSO) et les stocker dans un congélateur à -80 °C ou de l’azote liquide. Décongelez les cellules au besoin pour une utilisation future.
6. Validation des cholangiocytes
REMARQUE : La pureté des cholangiocytes a été évaluée par coloration pour le marqueur cholangiocytaire CK19.
- Lavez les cholangiocytes 2x avec du PBS, puis fixez les cellules dans du paraformaldéhyde à 4 % pendant 15 min.
- Lavez les cholangiocytes avec du PBS, puis perméabilisez les cellules avec 1 % de Triton X-100 pendant 8 min.
- Laver les cholangiocytes avec du PBS, puis bloquer les cellules dans 5 % de BSA pendant 1 h.
- Lavez les cholangiocytes avec du PBS, puis incubez les cellules avec l’anticorps primaire contre CK19 (dilution 1:12 avec 2 % de BSA) pendant la nuit à 4 °C.
- Lavez les cholangiocytes 2x avec du PBS, puis incubez les cellules avec l’anticorps secondaire anti-rat Alexa Fluor 488 (dilution 1:1 000 avec PBS) pendant 1 h à température ambiante.
- Lavez les cholangiocytes avec du PBS, colorez-les avec du 4',6-diamidino-2-phénylindole pendant 15 minutes et observez au microscope.
Résultats
Le schéma du flux de travail pour le processus de digestion en deux étapes utilisé pour isoler les cholangiocytes est illustré à la figure 1. L’ensemble de la procédure prend ~5 h. Tout d’abord, le foie est perfusé avec la solution A à travers la veine cave inférieure pour éliminer le sang, comme indiqué par le foie qui pâlit. Le foie est ensuite perfusé avec la solution B contenant de la collagénase II pour initier la digestion tissulaire. Cette étape initiale de la digestion est sensible au temps, et la réussite de la digestion est attestée par le fait que les tissus deviennent sensiblement mous. Ensuite, la dissociation mécanique et l’agitation douce à l’aide de pinces incurvées aident à éliminer les hépatocytes ; Une bonne digestion est confirmée lorsqu’un grand nombre d’hépatocytes se détachent. Au microscope à dissection, les cellules parenchymateuses adhérentes restantes sont soigneusement éliminées par microdissection, laissant un arbre biliaire intact (Figure 2).
Lors de la deuxième étape de digestion, le tissu est décomposé en une suspension unicellulaire, qui contient encore des hépatocytes et des fibroblastes. Enfin, des cholangiocytes de haute pureté sont obtenus à partir de cette suspension par séparation immunomagnétique. L’évaluation de la viabilité cellulaire a été réalisée à l’aide d’une coloration au bleu de trypan sur un hémocytomètre. Les résultats ont démontré l’isolement réussi de cholangiocytes hautement viables (Figure 3). La coloration par immunofluorescence de CK19 (Figure 4) a confirmé que cette méthode produit systématiquement des cholangiocytes de souris de haute pureté.
Les cholangiocytes primaires adhéraient généralement à la surface de la culture et formaient une monocouche en 24 heures environ, présentant une prolifération rapide au cours des trois premiers passages, en particulier dans les modèles de maladies murines avec une prolifération anormale des cholangiocytes, tels que la DLP (Figure 5). Cependant, lors des passages ultérieurs, le taux de croissance a diminué et les cellules sont devenues plus grandes et ont développé une morphologie vacuolisée. Il n’est pas nécessaire de retirer les billes des cholangiocytes, elles se détacheront naturellement une fois la culture commencée et n’interféreront pas avec la culture cellulaire. La cryoconservation et la décongélation des cellules n’ont pas affecté de manière significative la viabilité cellulaire.
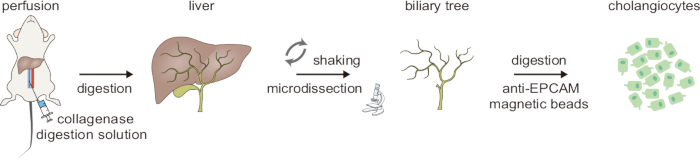
Figure 1 : Vue d’ensemble schématique du processus de digestion en deux étapes pour l’isolement des cholangiocytes. Ce chiffre est tiré de Ji et al8. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Image représentative de l’arbre biliaire isolé d’une souris atteinte d’une maladie polykystique du foie. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Évaluation de la viabilité cellulaire de cholangiocytes isolés à l’aide de la coloration au Trypan Blue. Barres d’échelle = 50 μm. Les petites particules noires qui entourent les cellules et à l’arrière-plan sont des perles de protéine G. Veuillez cliquer ici pour voir une version agrandie de cette figure.
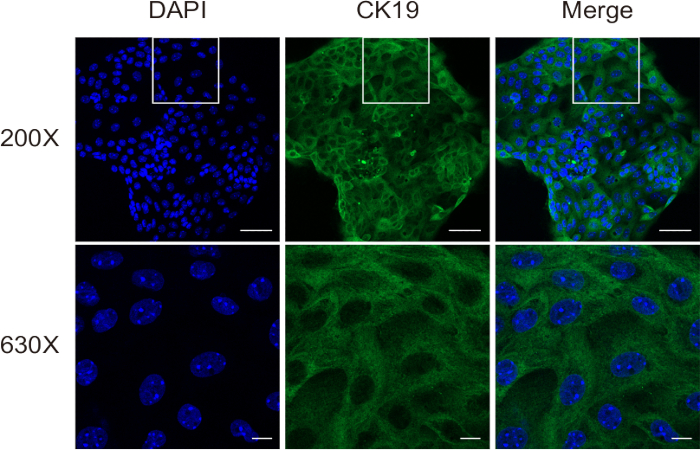
Figure 4 : Évaluation de la pureté cellulaire de cholangiocytes isolés à l’aide de la coloration par immunofluorescence pour CK19. Barres d’échelle : = 50 μm [supérieur] et 10 μm [inférieur]. Ce chiffre est tiré de Ji et al8. Veuillez cliquer ici pour voir une version agrandie de cette figure.
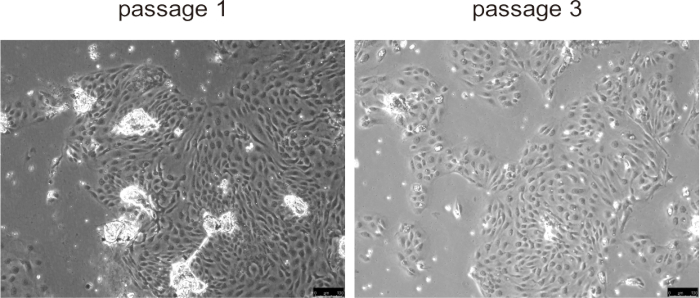
Figure 5 : Images représentatives de cholangiocytes isolés dans le passage 1 et le passage 3. Barres d’échelle = 100 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
| Composants | Quantité |
| DMEM/F12 (1:1) | 415 ml |
| Sérum fœtal bovin (FBS) | 50 ml |
| Acides aminés non essentiels MEM (100x) | 5 mL |
| Insuline-transfertrine-sélénium (100x) | 5 mL |
| Solution vitaminique MEM (100x) | 5 mL |
| Concentré de lipides chimiquement définis (100x) | 5 mL |
| Pénicilline-streptomycine (100x) | 5 mL |
| Solution de gentamicine/amphotéricine (500x) | 1 mL |
| 100 mM de Na Pyruvate | 250 μL |
| 10 mg/mL Inhibiteur de la trypsine de soja | 2,5 ml |
| 200 mM de L-Glutamine | 5 mL |
| 10 mg/mL de dexaméthasone | 20 μL |
| 1,7 mg/mL de 3,3',5-triiodo-L-thyronine | 1 mL |
| 1 mg/mL de facteur de croissance épidermique | 12,5 μL |
| 20 mM de forskoline | 250 μL |
| Éthanolamine | 13 μL |
Tableau 1 : Composition du milieu de culture des cholangiocytes.
| Composants | Quantité | |
| Solution A | NaCl | 4,0908 grammes |
| Kcl | 0,1578 g | |
| Na2HPO4 | 0,1072 g | |
| HEPES | 2,9789 grammes | |
| 50 mM EGTA (PH = 8) | 5 mL | |
| 1,5 M MgCl2 | 34 μL | |
| jjH2O | 500 ml | |
| REMARQUE : Ajustez le pH à 7,35 en utilisant du NaOH stérile. | ||
| Solution B | NaCl | 4,0908 grammes |
| Kcl | 0,1578 g | |
| Na2HPO4 | 0,1072 g | |
| HEPES | 2,9789 grammes | |
| 2 M CaCl2 | 1,25 mL | |
| jjH2O | 500 ml | |
| REMARQUE : Ajustez le pH à 7,35 en utilisant du NaOH stérile. La poudre de collagénase II doit être ajoutée pour atteindre une concentration finale de 0,5 mg/mL avant utilisation. | ||
Tableau 2 : Composition de la solution A et de la solution B.
| Composants | Quantité |
| 3,2 mg/mL de collagénase XI | 300 μL |
| 10 mg/mL d’hyaluronidase | 120 μL |
| 10 U/μL DNase I | 12 μL |
| Pénicilline-streptomycine (100x) | 30 μL |
| RPMI moyen | 2,538 ml |
Tableau 3 : Composition de la solution de digestion.
Discussion
Ce protocole fournit une méthode détaillée pour isoler les cholangiocytes primaires de haute pureté de souris à l’aide d’un processus de digestion en deux étapes, permettant l’étude des mécanismes moléculaires sous-jacents aux cholangiopathies. Plusieurs étapes critiques sont essentielles pour assurer la réussite de l’isolement des cholangiocytes.
La première étape critique consiste à assurer une perfusion et une digestion efficaces à l’aide de la solution A et de la solution B. La perfusion réussie avec la solution A a été confirmée par la pâleur du foie, et la digestion réussie avec la solution B a été confirmée par le tissu hépatique devenant visiblement mou. Une défaillance de la perfusion entraverait la digestion du tissu hépatique et compromettrait l’isolement ultérieur de l’arbre biliaire. Pour améliorer l’efficacité de la digestion, on peut augmenter les volumes de la solution A et de la solution B, réduire le débit de perfusion ou presser doucement le foie avec un coton-tige.
La deuxième étape critique consiste à dissocier mécaniquement et à secouer doucement le tissu hépatique à l’aide d’une pince incurvée, suivie d’une microdissection sous microscope à dissection pour éliminer les cellules parenchymateuses adhérentes et isoler un arbre biliaire intact. Cette étape a été essentielle pour obtenir des cholangiocytes de haute pureté. L’efficacité pourrait être améliorée en saisissant les voies biliaires plus grandes avec des pinces incurvées pendant l’agitation et le rinçage avec du PBS froid. Si le foie est digéré avec succès, de nombreux hépatocytes se détacheront, ce qui rendra la microdissection relativement simple. Cependant, si la digestion n’est pas complète et que l’échantillon est précieux, le processus de microdissection nécessitera des efforts minutieux, augmentant la charge de travail et réduisant potentiellement le rendement et la pureté des cellules. Il était donc primordial d’assurer une bonne perfusion avec la solution B pour la digestion du foie.
La troisième étape critique est la deuxième digestion de l’arbre biliaire pour produire une suspension unicellulaire. Le temps de digestion doit être optimisé en observant les cellules au microscope : une surdigestion peut réduire la viabilité cellulaire, tandis qu’une sous-digestion peut entraîner une inutilisation du tissu biliaire. De plus, l’inclusion d’antibiotiques appropriés dans tous les réactifs permet de minimiser la contamination.
En utilisant ce protocole de digestion optimisé en deux étapes, nous avons réussi à isoler des cholangiocytes de haute pureté et hautement viables chez la souris. Bien que cette étude se soit concentrée sur l’isolement des cholangiocytes primaires à partir de modèles de souris de type sauvage et de PLD, nous sommes convaincus que le protocole peut également être appliqué à d’autres modèles de souris pathologiques. Le processus de digestion initiale du tissu hépatique pour isoler l’arbre biliaire, suivi d’une deuxième étape de digestion, a considérablement amélioré l’efficacité de la séparation immunomagnétique et a donné un plus grand nombre de cellules viables. Les cholangiocytes isolés étaient bien adaptés aux expériences épigénétiques nécessitant une viabilité élevée, telles que ATAC-seq, ChIP-seq, ChIP-seq à faible intrant et CUT&TAG. De plus, ces cholangiocytes primaires pourraient être cultivés in vitro pour divers tests fonctionnels, notamment la croissance kystique 3D, la prolifération cellulaire, l’apoptose et l’analyse du cycle cellulaire.
Dans une étude publiée précédemment8, nous avons isolé des cholangiocytes primaires normaux et kystiques de souris de type sauvage et de souris PLD des deux sexes. Le profilage multi-omique des cholangiocytes primaires de souris PLD mâles et femelles a révélé une dynamique épigénétique spécifique au sexe dans les cholangiocytes au cours de la cystogenèse hépatique. De plus, nous avons identifié une stratégie thérapeutique épigénétique potentielle pour les patients masculins atteints de DLP par l’inhibition pharmacologique des enzymes modificatrices épigénétiques dans des modèles murins de DLP et des expériences in vitro avec des cholangiocytes primaires.
Notre approche offre plusieurs avantages notables par rapport aux méthodes d’isolement des cholangiocytes actuellement publiées. Par rapport à la méthode de Kudira et al.13, qui consiste à digérer directement le tissu hépatique en une suspension unicellulaire après la digestion par perfusion, suivie d’une centrifugation par gradient et d’un isolement immunomagnétique, notre méthode est plus simple, plus rentable et plus efficace. Un avantage clé est l’isolement de l’arbre biliaire avant l’isolement immunomagnétique, ce qui améliore le processus global. De plus, en ne nécessitant pas l’ablation des billes des cholangiocytes, cette méthode permet d’obtenir un rendement plus élevé et une viabilité accrue des cellules isolées. Par rapport à la méthode d’Ueno et al.14, qui dissocie et hache le résidu du tractus porte de la perfusion de digestion hépatique pour une culture 3D, suivie d’une période de culture de 7 jours avant de générer une suspension unicellulaire, notre méthode est plus efficace en termes de temps. L’isolement de l’arbre biliaire, suivi de l’isolement immunomagnétique, améliore également considérablement la pureté cellulaire.
Cependant, malgré ces avantages, notre technique de digestion en deux étapes présente encore certaines limites. Il demande relativement beaucoup de main-d’œuvre, ne permet qu’un nombre limité de passages et nécessite une microdissection minutieuse pour éviter la contamination parenchymateuse.
En conclusion, nous avons développé et optimisé une méthode de digestion en deux étapes pour isoler les cholangiocytes primaires de haute pureté et de haute viabilité des souris. Cette approche constitue un outil précieux pour l’étude des mécanismes moléculaires sous-jacents aux cholangiopathies et offre une base pour l’identification de stratégies thérapeutiques potentielles.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Ce travail a été soutenu par des subventions de la Commission municipale de l’éducation de Tianjin (2022ZD054 à L.Z.)
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | PALL | 4612 | |
| 0.25% Trypsin | Gibco | 25200-056 | |
| 10 mL syringe | KONSMED | 10 mL 1.2*30TWLB | |
| 20 mL syringe | KONSMED | 20 mL 1.2*30TWLB | |
| 24 G intravenous catheter | WEGO | 24GX19 mm/Y-G | |
| 3,3',5-triiodo-L-thyronine | Sigma | T5516 | 1.7 mg/mL stock |
| 4% paraformaldehyde | Solarbio | P1110 | |
| 5 mL syringe | KONSMED | 5 mL 0.7*30TWLB | |
| 6 cm dishes | Thermo Scientific | 150462 | |
| 70 µm cell strainer | Corning | 352350 | |
| anti-CK19 antibody | DSHB | TROMA-III | |
| anti-EpCAM antibody | DSHB | G8.8 | |
| BSA | Solarbio | A8020 | |
| CaCl2 | Sangon Biotech | A501330 | 2 M stock |
| Chemically-defined lipid concentrate (100x) | Gibco | 11905-031 | |
| Collagenase II | Worthington | LS004176 | |
| Collagenase XI | Sigma | C7657 | 3.2 mg/mL stock |
| Dexamethasone | Sigma | D1756 | 10 mg/mL stock |
| Dissecting Microscope | Leica | EZ4 | |
| DMEM/F12 (1:1) | VivaCell biosciences | C3130-0500 | |
| DMSO | Sigma | D2650 | |
| DNase I | Sigma | D4513 | 10 U/μL stock |
| Donkey anti-rat Alexa Fluor 488 secondary antibody | Invitrogen | A21208 | |
| EGTA | Solarbio | E8050 | 50 mM (PH = 8) stock |
| Epidermal growth factor (1 mg/mL) | Sigma | SRP3196 | |
| Ethanolamine | Sigma | E9508 | |
| Fetal Bovine Serum | VivaCell biosciences | C04001-500 | |
| Forskolin | Sigma | F3917 | 20 mM stock |
| Gentamicin/amphotericin solution (500x) | Gibco | R01510 | |
| Hemocytometer | QIUJING | XB.K.25. | |
| HEPES | Sigma | H4034 | |
| Hyaluronidase | Sigma | H3506 | 10 mg/mL stock |
| Insulin-transferrin-selenium (100x) | Gibco | 41400045 | |
| Isoflurane | RWD | R510-22-10 | |
| KCl | Sangon Biotech | A100395 | |
| L-Glutamine (200 mM) | Sigma | G7513 | |
| Magnetic separator | Promega | Z5342 | |
| MEM non-essential amino acids (100x) | Gibco | 11140050 | |
| MEM vitamin solution (100x) | Gibco | 11120052 | |
| MgCl2 | Sangon Biotech | A100288 | 1.5 M stock |
| Na Pyruvate (100 mM) | Gibco | 11360070 | |
| Na2HPO4 | Sangon Biotech | A600487 | |
| NaCl | Sangon Biotech | A610476 | |
| NaOH | Sangon Biotech | A620617 | 1 N stock |
| PBS | VivaCell biosciences | C3580-0500 | |
| PBS | Solarbio | P1010 | |
| Penicillin-Streptomycin (100x) | Gibco | 15140-122 | |
| Peristaltic pump | BaodingRongbai | YZ1515PPS | |
| Protein G beads | Invitrogen | 10004D | |
| Rotator | Kylin-Bell | QB-528 | |
| RPMI | VivaCell biosciences | C3010-0500 | |
| Soybean trypsin inhibitor | Sigma | T6522 | 10 mg/mL stock |
| Swaged needle | Jinhuan Medical | HM601 | |
| Triton X-100 | Solarbio | T8200 | |
| Trypan blue | Sigma | T6146 | 10 mg/mL stock |
| Type I rat tail collagen | BD | 354236 |
Références
- Wang, Z., et al. Human cholangiocytes form a polarized and functional bile duct on hollow fiber membranes. Front Bioeng Biotechnol. 10, 868857 (2022).
- Li, P., et al. Three-dimensional human bile duct formation from chemically induced human liver progenitor cells. Front Bioeng Biotechnol. 11, 1249769 (2023).
- Fabris, L., et al. Pathobiology of inherited biliary diseases: a roadmap to understand acquired liver diseases. Nat Rev Gastroenterol Hepatol. 16 (8), 497-511 (2019).
- Jalan-Sakrikar, N., et al. Central role for cholangiocyte pathobiology in cholestatic liver diseases. Hepatology. , (2024).
- Ilyas, S. I., Gores, G. J. Pathogenesis, diagnosis, and management of cholangiocarcinoma. Gastroenterology. 145 (6), 1215-1229 (2013).
- Perugorria, M. J., et al. Polycystic liver diseases: advanced insights into the molecular mechanisms. Nat Rev Gastroenterol Hepatol. 11 (12), 750-761 (2014).
- Masyuk, T. V., Masyuk, A. I., LaRusso, N. F. Polycystic liver disease: Advances in understanding and treatment. Annu Rev Pathol. 17, 251-269 (2022).
- Ji, R., et al. Multi-omics profiling of cholangiocytes reveals sex-specific chromatin state dynamics during hepatic cystogenesis in polycystic liver disease. J Hepatol. 78 (4), 754-769 (2023).
- Tabibian, J. H., et al. Characterization of cultured cholangiocytes isolated from livers of patients with primary sclerosing cholangitis. Lab Invest. 94 (10), 1126-1133 (2014).
- Muff, M. A., et al. Development and characterization of a cholangiocyte cell line from the PCK rat, an animal model of autosomal recessive polycystic kidney disease. Lab Invest. 86 (9), 940-950 (2006).
- Nagaya, M., Katsuta, H., Kaneto, H., Bonner-Weir, S., Weir, G. C. Adult mouse intrahepatic biliary epithelial cells induced in vitro to become insulin-producing cells. J Endocrinol. 201 (1), 37-47 (2009).
- Karjoo, S., Wells, R. G. Isolation of neonatal extrahepatic cholangiocytes. J Vis Exp. (88), e51621 (2014).
- Kudira, R., et al. Isolation and culturing primary chaolangiocytes from mouse liver. Bio Protoc. 11 (20), e4192 (2021).
- Ueno, Y., et al. Evaluation of differential gene expression by microarray analysis in small and large cholangiocytes isolated from normal mice. Liver Int. 23 (6), 449-459 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon