Method Article
Isolierung und Kultivierung von primären Cholangiozyten aus Mäusen mit polyzystischer Lebererkrankung unter Verwendung einer zweistufigen Verdauungsmethode
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine optimierte zweistufige Verdaumethode zur Isolierung von hochreinen und lebensfähigen primären Cholangiozyten aus Wildtyp-Mäusen und Mäusen mit polyzystischer Lebererkrankung.
Zusammenfassung
In diesem Protokoll haben wir eine zweistufige Verdauungsmethode optimiert, um hochreine und lebensfähige primäre Cholangiozyten von Wildtyp-Mäusen und Mäusen mit polyzystischer Lebererkrankung (PLD) zu isolieren. Nach der Anästhesie der Mäuse wurden die Lebern durch die untere Hohlvene mit 50 ml Lösung A perfundiert, gefolgt von 30 ml Lösung B bei 37 °C, um das Lebergewebe enzymatisch zu verdauen. Mechanische Dissoziation, Schütteln und Mikrodissektion wurden durchgeführt, um adhärente Parenchymzellen zu entfernen, wobei ein intakter Gallenbaum übrig blieb. Anschließend wurde der Gallenbaum fein zerkleinert und unter Schütteln 60 min bei 37 °C verdaut. Die resultierende Einzelzellsuspension wurde mit einem 70 μm Zellsieb aufgefangen. Die Cholangiozyten wurden mittels immunomagnetischer Isolierung aufgereinigt. Die Zellsuspension wurde mit einem Anti-EpCAM-Antikörper unter Rotation für 45 Minuten bei 4 °C inkubiert, gefolgt von der Zugabe von Protein-G-Kügelchen und einer weiteren Rotation von weiteren 45 Minuten bei 4 °C. Nach drei Wäschen mit PBS wurden die Cholangiozyten mit einem Magnetseparator gesammelt. Die gereinigten primären Cholangiozyten wurden in Cholangiozyten-Kulturmedium resuspendiert und auf Zellkulturschalen ausgesät, die mit 1 mg/ml Typ-I-Rattenschwanzkollagen beschichtet waren. Die Reinheit der Cholangiozyten wurde durch Immunfärbung des Cholangiozyten-spezifischen Markers Cytokeratin-19 (CK19) bestätigt. Obwohl sich diese Studie auf die Isolierung primärer Cholangiozyten aus Wildtyp- und PLD-Mäusen konzentrierte, sind wir zuversichtlich, dass das Protokoll auch auf andere Mausmodelle angewendet werden kann. Diese detaillierte zweistufige Verdauungsmethode ermöglicht in vitro Studien von Cholangiopathien und die Entwicklung zielgerichteter Therapien.
Einleitung
Cholangiozyten, die Epithelzellen, die den intrahepatischen Gallenbaum auskleiden, bilden eine Monoschicht und machen etwa 3-5 % der gesamten Zellpopulation der Leber aus1. Diese Zellen verbinden sich in der Leber zu einem komplexen dreidimensionalen duktalen Netzwerk2. Unter normalen Bedingungen erfüllen Cholangiozyten lebenswichtige Funktionen, einschließlich Sekretion, Absorption, Reparatur von Verletzungen und dienen als Immunbarriere, wodurch sie eine entscheidende Rolle in der Physiologie und Pathologie der Leber spielen. Eine Dysfunktion der Cholangiozyten kann jedoch zu verschiedenen Krankheiten führen, darunter PLD, primär sklerosierende Cholangitis, Cholangiokarzinom und cholestatische Leberschädigung 3,4,5.
Unter den Krankheiten, die mit der Cholangiopathie in Verbindung stehen, sticht PLD als Erbkrankheit hervor, die durch die Bildung zahlreicher flüssigkeitsgefüllter Zysten gekennzeichnet ist, die von Cholangiozyten ausgehen. Die fortschreitende Vergrößerung dieser Zysten verringert die Lebensqualität der Patienten erheblich6. Die derzeitigen Behandlungsoptionen für PLD sind nach wie vor unzureichend und bieten eine begrenzte Wirksamkeit, sind aber oft mit hohen Rezidivraten und Komplikationen verbunden7. Dies unterstreicht die dringende Notwendigkeit, sichere und wirksame therapeutische Strategien zu entwickeln, um den ungedeckten klinischen Bedarf im PLD-Management zu decken.
Die Erforschung der Mechanismen von Cholangiopathien, einschließlich PLD, wurde durch den Mangel an geeigneten Zelllinien erheblich behindert. Um diese Einschränkung zu beheben, haben sich die Verwendung von Krankheitsmausmodellen und die Isolierung von primären Cholangiozyten aus diesen Modellen für In-vitro-Experimente als von unschätzbarem Wert erwiesen, um die molekularen Mechanismen aufzudecken, die Cholangiopathien zugrunde liegen, und potenzielle therapeutische Strategien zu identifizieren.
In unserer aktuellen Studie8 haben wir erfolgreich ein PLD-Mausmodell mit Pkd1-bedingtem Knockout (KO) Mäusen etabliert. Leberzysten wurden bereits 1 Monat nach der Pkd1-Deletion beobachtet und nahmen im Laufe der Zeit progressiv an Größe zu. Während Protokolle zur Isolierung von Cholangiozyten aus Ratten und Menschen gut dokumentiert sind 9,10, bleibt die Isolierung von primären Cholangiozyten aus Mäusen aufgrund ihrer geringen Größe und der komplizierten Architektur der Pfortader- und Gallengangssystem eine besondere Herausforderung. Bestehende Methoden sind mit erheblichen Einschränkungen konfrontiert, darunter geringe Zellreinheit, schlechte Viabilität, komplexe Verfahren und hohe Kosten 11,12.
Dieses Manuskript stellt ein detailliertes Protokoll zur Isolierung hochreiner primärer Cholangiozyten aus Mäusen mit einer zweistufigen Verdauungsmethode vor. Dieser optimierte Ansatz zielt darauf ab, In-vitro-Studien zu unterstützen, die Untersuchung der molekularen Mechanismen zu erleichtern, die Cholangiopathien zugrunde liegen, und die Entwicklung neuartiger therapeutischer Strategien voranzutreiben.
Protokoll
Alle Behandlungs- und Versuchsprotokolle für Mäuse wurden von der Ethikkommission der Medizinischen Universität Tianjin genehmigt (Dok.-Nr.: TMUa-MEC 2022016).
1. Vorbereitung von Geräten und Lösungen
- Sterilisieren Sie chirurgische Instrumente (Scheren, Pinzetten und Skalpellgriffe), indem Sie sie mindestens 1 Tag vor der Zellisolierung autoklavieren.
- Bereiten Sie das Cholangiozyten-Kulturmedium mindestens 1 Tag vor der Zellisolierung mit den in Tabelle 1 aufgeführten Reagenzien vor. Sterilisieren Sie das Cholangiozyten-Nährmedium, indem Sie es durch einen 0,22-μm-Filter filtrieren.
- Bereiten Sie Lösung A und Lösung B mindestens 1 Tag vor der Zellisolierung mit den in Tabelle 2 aufgeführten Reagenzien für die Leberperfusion der Maus vor. Sterilisieren Sie Lösung A und Lösung B durch Autoklavieren oder Filtrieren durch einen 0,22-μm-Filter und stellen Sie ihren pH-Wert mit sterilem NaOH unter sanftem Rühren auf 7,35 ein.
HINWEIS: Cholangiozyten-Nährmedium, Lösung A und Lösung B können mindestens einen Monat lang bei 4 °C gelagert werden. - Geben Sie vor Beginn des Experiments Kollagenase II-Pulver zu Lösung B und mischen Sie vorsichtig, um eine Endkonzentration von 0,5 mg/ml zu erreichen. Sowohl Lösung A als auch Lösung B vor Gebrauch in einem 37 °C warmen Wasserbad vorwärmen.
- Bereiten Sie unmittelbar vor Beginn des Experiments 6 cm große Schalen vor, die mit sterilem PBS gefüllt sind, und legen Sie sie auf Eis, um sie während des Eingriffs kalt zu halten.
2. Durchblutung der Verdauung des Lebergewebes
- Betäuben Sie die Maus mit einer Überdosis Isofluran-Inhalation. Legen Sie die betäubte Maus in Rückenlage und sichern Sie sie mit Klebeband, um den Eingriff zu erleichtern.
- Öffnen Sie die Bauchhöhle der Maus, nachdem Sie den Bauch mit 75% Ethanol sterilisiert haben, und binden Sie dann mit einer gepressten Nadel einen Schlupfknoten um die untere Hohlvene. Spülen Sie einen intravenösen 24-G-Katheter mit Lösung A mit einer 20-ml-Spritze.
- Führen Sie den intravenösen Katheter in die untere Hohlvene unterhalb des Slipknotens ein, befestigen Sie den Slipknoten und fixieren Sie den Katheter mit Klebeband.
- Perfundieren Sie die Leber mit 50 ml Lösung A durch die untere Hohlvene mit einer 20-ml-Spritze und schneiden Sie die Leberpfortader ein, um die Perfusionslösung abzulassen. Halten Sie die Perfusionsrate bei 10 ml/min.
- Setzen Sie die Perfusion mit 30 mL Lösung B, die Kollagenase II enthält, bei einer Flussrate von 3,5 mL/min mit einer Schlauchpumpe fort.
HINWEIS: Dieser Schritt ist für die Verdauung von Lebergewebe vorgesehen. - Entnehmen Sie das erfolgreich durchblutete Lebergewebe und legen Sie es in eine 6 cm große Schale, die mit kaltsterilem PBS gefüllt ist.
3. Isolierung von Cholangiozyten
HINWEIS: Da die Anzahl der Cholangiozyten bei normalen Mäusen relativ gering ist, wird empfohlen, eine Gruppe von 2-6 Mäusen für das Verfahren zu verwenden. Für Mauskrankheitsmodelle mit abnormaler Cholangiozytenproliferation, wie z. B. PLD, sind jedoch die Cholangiozyten einer einzelnen Maus ausreichend. Sofern nicht anders angegeben, müssen Proben und Reagenzien immer auf Eis aufbewahrt werden, und alle Eingriffe sollten in einer biologischen Sicherheitswerkbank durchgeführt werden.
- Dissoziieren und schütteln Sie das Lebergewebe mechanisch mit einer gebogenen Pinzette. Führen Sie anschließend eine Mikrodissektion unter einem Präpariermikroskop durch, um anhaftende Parenchymzellen zu entfernen, wobei ein intakter Gallenbaum übrig bleibt. Entferne das Gallenblasengewebe, bevor du mit dem nächsten Schritt fortfährst.
Waschen Sie das Taschentuch 2x mit PBS. - Zerkleinern Sie den Gallenbaum mit einer chirurgischen Klinge fein und verdauen Sie ihn in 3 ml Aufschlusslösung (Tabelle 3) pro Maus unter Schütteln (90 U/min) bei 37 °C für 60 Minuten. Nach 30 Minuten pipettieren Sie die Mischung vorsichtig mit einer Pipettenspitze, um sie gründlich zu mischen.
HINWEIS: Die Aufschlusslösung sollte vor der Verwendung frisch zubereitet werden. - Die Zellsuspension wird durch ein 70 μm Zellsieb geleitet. Verwenden Sie den Kolben einer 5-ml- oder 10-ml-Spritze, um die Zellsuspension vorsichtig durch das Sieb zu drücken. Waschen Sie das Sieb mit PBS.
- Die Zellsuspension bei 500 x g für 5 min bei 4 °C zentrifugieren. Waschen Sie die Zellen 3x mit RPMI-Medium.
- Erneut bei 500 x g für 5 min bei 4 °C zentrifugieren.
- Der Überstand wird verworfen und die Zellen werden in 900 μl RPMI-Medium mit 40 μl DNase I resuspendiert. 2 μg Anti-EpCAM-Antikörper werden hinzugefügt und die Suspension auf einem Rotator (20 U/min) bei 4 °C für 45 min inkubiert.
- Zentrifugieren Sie bei 500 x g für 5 min bei 4 °C.
- Verwerfen Sie den Überstand und resuspendieren Sie die Zellen in 1 ml RPMI-Medium, das 40 U/ml DNase I enthält. Geben Sie 20 μl Protein G-Kügelchen in die Zellsuspension und inkubieren Sie mit Rotation (20 U/min) bei 4 °C für weitere 45 Minuten.
HINWEIS: Der Anti-EpCAM-Antikörper kann auch mit Protein-G-Kügelchen vorinkubiert werden, um vor der Einführung der Zellsuspension einen Bead-Antikörper-Komplex zu erzeugen. - Waschen Sie die Zellen 3x mit PBS mit einem Magnetabscheider.
- Führen Sie die Zellzählung und die Beurteilung der Zellviabilität mit Trypanblau-Färbung (0,04 %, 3 min) auf einem Hämozytometer durch.
HINWEIS: Es ist nicht notwendig, die Kügelchen von den Cholangiozyten zu entfernen, sie lösen sich auf natürliche Weise, sobald die Kultivierung beginnt, und beeinträchtigen die Zellkultur nicht.
4. Kultur der Cholangiozyten
HINWEIS: Bereiten Sie vor der Cholangiozytenkultur frische, mit Kollagen überzogene Zellkulturschalen vom Typ I zu. Alle Reagenzien auf Eis vorkühlen.
- Mischen Sie gemäß den Anweisungen des Herstellers steriles ddH2O, 10x PBS, 1 N NaOH und Typ I Rattenschwanzkollagen, um eine Endkonzentration von 1 mg/ml Typ I Rattenschwanzkollagen in 1x PBS zu erreichen. Beschichten Sie die Zellkulturschalen gleichmäßig mit der Mischung und stellen Sie die Schalen 30 Minuten lang bei 37 °C mit 5 % CO2 in einen Inkubator, damit sich das Kollagen verfestigen kann.
- Waschen Sie die mit Kollagen überzogenen Zellkulturschalen vom Typ I mit Rattenschwanz mit vorgewärmtem PBS.
- Resuspendieren Sie die Cholangiozyten in vorgewärmtem Cholangiozyten-Kulturmedium. Die Zellsuspension wird auf 1 mg/ml Typ I mit Kollagen beschichtete Zellkulturschalen vom Typ I ausgesät und bei 37 °C mit 5 % CO2 inkubiert. Ersetzen Sie das Medium alle 2 Tage.
5. Passieren und Kryokonservieren von Cholangiozyten
- Waschen Sie die Cholangiozyten zweimal mit PBS und inkubieren Sie die Zellen dann in 0,25% Trypsin bei 37 °C für 5-10 Minuten.
- Fügen Sie ein gleiches Volumen Cholangiozyten-Nährmedium hinzu, um das Trypsin zu neutralisieren, und zentrifugieren Sie dann 5 Minuten lang bei 500 x g .
- Bereiten Sie mit Kollagen beschichtete Zellkulturschalen vom Typ I mit Rattenschwanz zu, wie in Schritt 4.1 beschrieben.
- Führen Sie die Schritte 4.2 und 4.3 aus.
- Wenn eine Kryokonservierung erforderlich ist, resuspendieren Sie die Cholangiozyten in einem Lagermedium (9:1 FBS: DMSO) und lagern Sie sie in einem -80 °C Gefrierschrank oder flüssigem Stickstoff. Tauen Sie die Zellen nach Bedarf für die zukünftige Verwendung auf.
6. Validierung der Cholangiozyten
HINWEIS: Die Reinheit der Cholangiozyten wurde durch Färbung auf den Cholangiozytenmarker CK19 beurteilt.
- Waschen Sie die Cholangiozyten 2x mit PBS, fixieren Sie dann die Zellen für 15 min in 4% Paraformaldehyd.
- Waschen Sie die Cholangiozyten mit PBS und permeabilisieren Sie die Zellen dann 8 Minuten lang mit 1% Triton X-100.
- Waschen Sie die Cholangiozyten mit PBS und blockieren Sie dann die Zellen 1 h lang in 5% BSA.
- Waschen Sie die Cholangiozyten mit PBS und inkubieren Sie die Zellen dann mit dem Primärantikörper gegen CK19 (Verdünnung 1:12 mit 2 % BSA) über Nacht bei 4 °C.
- Waschen Sie die Cholangiozyten 2x mit PBS, dann inkubieren Sie die Zellen mit dem Esels-Anti-Ratten-Sekundärantikörper Alexa Fluor 488 (Verdünnung 1:1.000 mit PBS) für 1 h bei Raumtemperatur.
- Waschen Sie die Cholangiozyten mit PBS, färben Sie sie 15 Minuten lang mit 4',6-Diamidino-2-phenylindol und betrachten Sie sie unter dem Mikroskop.
Ergebnisse
Das Workflow-Diagramm für den zweistufigen Verdauungsprozess zur Isolierung von Cholangiozyten ist in Abbildung 1 dargestellt. Der gesamte Vorgang dauert ~5 h. Zuerst wird die Leber durch die untere Hohlvene mit Lösung A durchblutet, um Blut zu entfernen, was durch das Blassen der Leber angezeigt wird. Die Leber wird dann mit Lösung B perfundiert, die Kollagenase II enthält, um die Gewebeverdauung zu initiieren. Dieser erste Verdauungsschritt ist zeitkritisch, und eine erfolgreiche Verdauung zeigt sich darin, dass das Gewebe spürbar weich wird. Als nächstes helfen mechanische Dissoziation und sanftes Schütteln mit gekrümmten Pinzetten bei der Entfernung von Hepatozyten; Eine ordnungsgemäße Verdauung wird bestätigt, wenn sich eine große Anzahl von Hepatozyten ablöst. Unter einem Präpariermikroskop werden die verbleibenden anhaftenden Parenchymzellen vorsichtig durch Mikrodissektion entfernt, so dass ein intakter Gallenbaum übrig bleibt (Abbildung 2).
Im zweiten Verdauungsschritt wird das Gewebe in eine einzellige Suspension zerlegt, die noch einige Hepatozyten und Fibroblasten enthält. Schließlich werden aus dieser Suspension durch immunomagnetische Trennung hochreine Cholangiozyten gewonnen. Die Beurteilung der Zellviabilität wurde mittels Trypanblau-Färbung auf einem Hämozytometer durchgeführt. Die Ergebnisse zeigten die erfolgreiche Isolierung von hochlebensfähigen Cholangiozyten (Abbildung 3). Die Immunfluoreszenzfärbung von CK19 (Abbildung 4) bestätigte, dass diese Methode konsistent hochreine Maus-Cholangiozyten liefert.
Primäre Cholangiozyten hafteten typischerweise an der Kulturoberfläche und bildeten innerhalb von etwa 24 Stunden eine Monoschicht, die während der ersten drei Durchgänge eine schnelle Proliferation zeigte, insbesondere in Mauskrankheitsmodellen mit abnormaler Cholangiozytenproliferation, wie z. B. PLD (Abbildung 5). Bei späteren Durchgängen nahm die Wachstumsrate jedoch ab, und die Zellen wurden größer und entwickelten eine vakuolisierte Morphologie. Es ist nicht notwendig, die Kügelchen von den Cholangiozyten zu entfernen, sie lösen sich auf natürliche Weise, sobald die Kultivierung beginnt, und beeinträchtigen die Zellkultur nicht. Die Kryokonservierung und das Auftauen der Zellen hatten keinen signifikanten Einfluss auf die Lebensfähigkeit der Zellen.
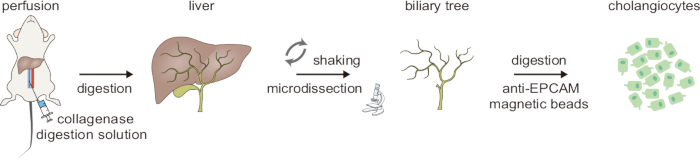
Abbildung 1: Schematische Übersicht über den zweistufigen Verdauprozess zur Isolierung von Cholangiozyten. Diese Abbildung stammt von Ji et al.8. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Repräsentatives Bild des Gallenbaums, das aus einer Maus mit polyzystischer Lebererkrankung isoliert wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Beurteilung der Zellviabilität von isolierten Cholangiozyten mittels Trypanblau-Färbung. Maßstabsleisten = 50 μm. Die kleinen schwarzen Partikel, die die Zellen umgeben und im Hintergrund stehen, sind Protein-G-Kügelchen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
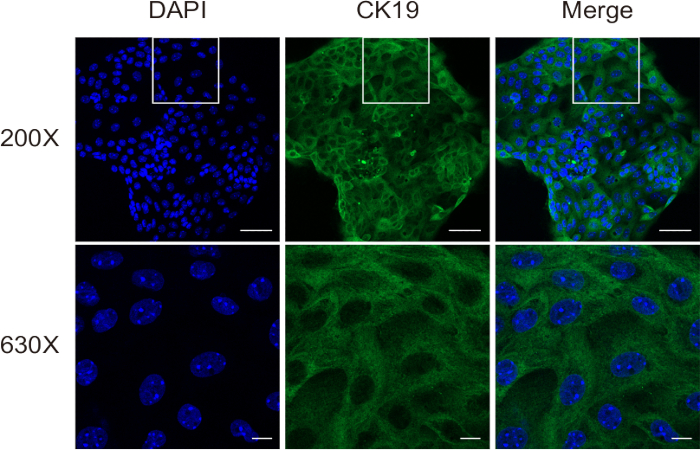
Abbildung 4: Bewertung der Zellreinheit von isolierten Cholangiozyten mittels Immunfluoreszenzfärbung für CK19. Maßstabsleisten: = 50 μm [oben] und 10 μm [unten]. Diese Abbildung stammt von Ji et al.8. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
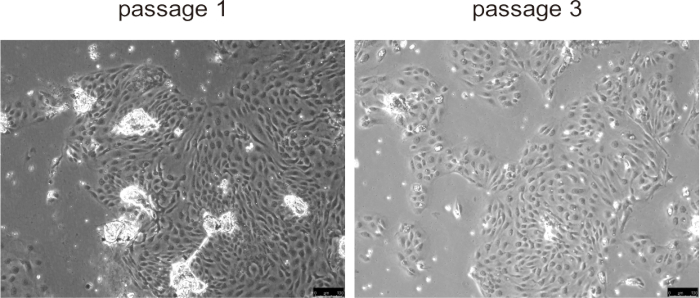
Abbildung 5: Repräsentative Bilder von isolierten Cholangiozyten in Passage 1 und Passage 3. Maßstabsbalken = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Komponenten | Menge |
| DMEM/F12 (1:1) | 415 mL |
| Fötales Rinderserum (FBS) | 50 mL |
| MEM nicht-essentielle Aminosäuren (100x) | 5 mL |
| Insulin-Transferrin-Selen (100x) | 5 mL |
| MEM Vitaminlösung (100x) | 5 mL |
| Chemisch definiertes Lipidkonzentrat (100x) | 5 mL |
| Penicillin-Streptomycin (100x) | 5 mL |
| Gentamicin/Amphotericin Lösung (500x) | 1 mL |
| 100 mM Na Pyruvat | 250 μL |
| 10 mg/ml Sojabohnen-Trypsin-Hemmer | 2,5 mL |
| 200 mM L-Glutamin | 5 mL |
| 10 mg/ml Dexamethason | ca. 20 μl |
| 1,7 mg/ml 3,3',5-Trijod-L-thyronin | 1 mL |
| 1 mg/ml Epidermaler Wachstumsfaktor | 12,5 μl |
| 20 mM Forskolin | 250 μL |
| Ethanolamin | 13 μL |
Tabelle 1: Zusammensetzung des Cholangiozyten-Kulturmediums.
| Komponenten | Menge | |
| Lösung A | NaCl | 4,0908 Gramm |
| Kcl | 0,1578 Gramm | |
| Na2HPO4 | 0,1072 Gramm | |
| HEPES | 2,9789 Gramm | |
| 50 mM EGTA (PH = 8) | 5 mL | |
| 1,5 M MgCl2 | 34 μL | |
| ddH2Ω | 500 mL | |
| HINWEIS: Stellen Sie den pH-Wert mit sterilem NaOH auf 7,35 ein. | ||
| Lösung B | NaCl | 4,0908 Gramm |
| Kcl | 0,1578 Gramm | |
| Na2HPO4 | 0,1072 Gramm | |
| HEPES | 2,9789 Gramm | |
| 2 M CaCl2 | 1,25 mL | |
| ddH2Ω | 500 mL | |
| HINWEIS: Stellen Sie den pH-Wert mit sterilem NaOH auf 7,35 ein. Kollagenase II-Pulver sollte vor der Anwendung hinzugefügt werden, um eine Endkonzentration von 0,5 mg/ml zu erreichen. | ||
Tabelle 2: Zusammensetzung von Lösung A und Lösung B.
| Komponenten | Menge |
| 3,2 mg/ml Kollagenase XI | 300 μL |
| 10 mg/ml Hyaluronidase | 120 μL |
| 10 U/μL DNase I | 12 μL |
| Penicillin-Streptomycin (100x) | 30 μL |
| RPMI mittel | 2.538 mL |
Tabelle 3: Zusammensetzung der Aufschlusslösung.
Diskussion
Dieses Protokoll bietet eine detaillierte Methode zur Isolierung hochreiner primärer Cholangiozyten aus Mäusen unter Verwendung eines zweistufigen Verdauungsprozesses, der die Untersuchung der molekularen Mechanismen ermöglicht, die Cholangiopathien zugrunde liegen. Mehrere kritische Schritte sind unerlässlich, um die erfolgreiche Isolierung von Cholangiozyten zu gewährleisten.
Der erste kritische Schritt ist die Sicherstellung einer effektiven Durchblutung und Verdauung mit Lösung A und Lösung B. Die erfolgreiche Perfusion mit Lösung A wurde durch eine blasse Leber bestätigt, und die erfolgreiche Verdauung mit Lösung B wurde durch eine spürbare Weichheit des Lebergewebes bestätigt. Ein Versagen der Durchblutung würde die Verdauung des Lebergewebes behindern und die anschließende Isolierung des Gallenbaums beeinträchtigen. Um die Verdauungseffizienz zu verbessern, könnte man das Volumen von Lösung A und Lösung B erhöhen, die Perfusionsflussrate verringern oder die Leber vorsichtig mit einem Wattestäbchen drücken.
Der zweite kritische Schritt besteht darin, das Lebergewebe mechanisch zu dissoziieren und vorsichtig mit einer gekrümmten Pinzette zu schütteln, gefolgt von einer Mikrodissektion unter einem Präpariermikroskop, um adhärente Parenchymzellen zu entfernen und einen intakten Gallenbaum zu isolieren. Dieser Schritt war der Schlüssel zur Gewinnung hochreiner Cholangiozyten. Die Effizienz konnte verbessert werden, indem größere Gallengänge mit einer gekrümmten Pinzette während des Schüttelns und Spülens mit kaltem PBS gegriffen wurden. Wenn die Leber erfolgreich verdaut wird, lösen sich viele Hepatozyten ab, was die Mikrodissektion relativ einfach macht. Wenn der Aufschluss jedoch unvollständig ist und die Probe wertvoll ist, erfordert der Mikrodissektionsprozess einen sorgfältigen Aufwand, der den Arbeitsaufwand erhöht und möglicherweise sowohl die Zellausbeute als auch die Reinheit verringert. Daher war die Sicherstellung einer ordnungsgemäßen Perfusion mit Lösung B für die Leberverdauung von größter Bedeutung.
Der dritte kritische Schritt ist der zweite Verdau des Gallenbaums, um eine einzellige Suspension herzustellen. Die Verdauungszeit sollte durch die Beobachtung der Zellen unter dem Mikroskop optimiert werden: Eine Überverdauung kann die Lebensfähigkeit der Zellen verringern, während eine Unterverdauung zu ungenutztem Gallengewebe führen kann. Darüber hinaus trägt die Aufnahme geeigneter Antibiotika in alle Reagenzien dazu bei, die Kontamination zu minimieren.
Mit diesem optimierten zweistufigen Verdauprotokoll ist es uns gelungen, hochreine und hochlebensfähige Cholangiozyten aus Mäusen zu isolieren. Während sich diese Studie auf die Isolierung primärer Cholangiozyten aus Wildtyp- und PLD-Mausmodellen konzentrierte, sind wir zuversichtlich, dass das Protokoll auch auf andere Krankheitsmausmodelle angewendet werden kann. Der Prozess der anfänglichen Verdauung des Lebergewebes zur Isolierung des Gallenbaums, gefolgt von einem zweiten Verdauungsschritt, verbesserte die Effizienz der immunomagnetischen Trennung signifikant und führte zu einer höheren Anzahl lebensfähiger Zellen. Die isolierten Cholangiozyten eigneten sich gut für epigenetische Experimente, die eine hohe Viabilität erforderten, wie z. B. ATAC-seq, ChIP-seq, Low-Input ChIP-seq und CUT&TAG. Darüber hinaus können diese primären Cholangiozyten in vitro für verschiedene funktionelle Assays kultiviert werden, darunter zystisches 3D-Wachstum, Zellproliferation, Apoptose und Zellzyklusanalyse.
In einer zuvor veröffentlichten Studie8 isolierten wir sowohl normale als auch zystische primäre Cholangiozyten von Wildtyp- und PLD-Mäusen beiderlei Geschlechts. Das Multi-Omics-Profiling von primären Cholangiozyten aus männlichen und weiblichen PLD-Mäusen zeigte eine geschlechtsspezifische epigenetische Dynamik in Cholangiozyten während der hepatischen Zystogenese. Darüber hinaus haben wir eine potenzielle epigenetische Therapiestrategie für männliche PLD-Patienten durch pharmakologische Hemmung epigenetisch modifizierender Enzyme sowohl in PLD-Mausmodellen als auch in vitro Experimenten mit primären Cholangiozyten identifiziert.
Unser Ansatz bietet mehrere bemerkenswerte Vorteile gegenüber den derzeit veröffentlichten Methoden zur Isolierung von Cholangiozyten. Im Vergleich zur Methode von Kudira et al.13, bei der Lebergewebe nach dem Perfusionsverdau direkt in eine Einzelzellsuspension verdaut wird, gefolgt von einer Gradientenzentrifugation und einer immunomagnetischen Isolierung, ist unsere Methode einfacher, kostengünstiger und effizienter. Ein wesentlicher Vorteil ist die Isolierung des Gallenbaums vor der immunomagnetischen Isolierung, was den Gesamtprozess verbessert. Da die Kügelchen nicht aus den Cholangiozyten entfernt werden müssen, erreicht diese Methode außerdem eine höhere Ausbeute und eine verbesserte Lebensfähigkeit der isolierten Zellen. Im Vergleich zur Methode von Ueno et al.14, bei der die Pfortaderrückstände aus der Leberverdauungsperfusion für die 3D-Kultur dissoziiert und zerkleinert werden, gefolgt von einer 7-tägigen Kulturperiode, bevor eine Einzelzellsuspension erzeugt wird, ist unsere Methode zeiteffizienter. Die Isolierung des Gallenbaums, gefolgt von der immunomagnetischen Isolierung, erhöht zudem die Zellreinheit erheblich.
Trotz dieser Vorteile hat unsere zweistufige Aufschlusstechnik jedoch noch einige Einschränkungen. Es ist relativ arbeitsintensiv, ermöglicht nur eine begrenzte Anzahl von Passagen und erfordert eine sorgfältige Mikrodissektion, um eine parenchymale Kontamination zu vermeiden.
Zusammenfassend haben wir eine zweistufige Aufschlussmethode zur Isolierung von hochreinen und lebensfähigen primären Cholangiozyten aus Mäusen entwickelt und optimiert. Dieser Ansatz stellt ein wertvolles Werkzeug dar, um die molekularen Mechanismen zu untersuchen, die Cholangiopathien zugrunde liegen, und bietet eine Grundlage für die Identifizierung potenzieller therapeutischer Strategien.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Diese Arbeit wurde durch Zuschüsse der Tianjin Municipal Education Commission (2022ZD054 an L.Z.)
Materialien
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | PALL | 4612 | |
| 0.25% Trypsin | Gibco | 25200-056 | |
| 10 mL syringe | KONSMED | 10 mL 1.2*30TWLB | |
| 20 mL syringe | KONSMED | 20 mL 1.2*30TWLB | |
| 24 G intravenous catheter | WEGO | 24GX19 mm/Y-G | |
| 3,3',5-triiodo-L-thyronine | Sigma | T5516 | 1.7 mg/mL stock |
| 4% paraformaldehyde | Solarbio | P1110 | |
| 5 mL syringe | KONSMED | 5 mL 0.7*30TWLB | |
| 6 cm dishes | Thermo Scientific | 150462 | |
| 70 µm cell strainer | Corning | 352350 | |
| anti-CK19 antibody | DSHB | TROMA-III | |
| anti-EpCAM antibody | DSHB | G8.8 | |
| BSA | Solarbio | A8020 | |
| CaCl2 | Sangon Biotech | A501330 | 2 M stock |
| Chemically-defined lipid concentrate (100x) | Gibco | 11905-031 | |
| Collagenase II | Worthington | LS004176 | |
| Collagenase XI | Sigma | C7657 | 3.2 mg/mL stock |
| Dexamethasone | Sigma | D1756 | 10 mg/mL stock |
| Dissecting Microscope | Leica | EZ4 | |
| DMEM/F12 (1:1) | VivaCell biosciences | C3130-0500 | |
| DMSO | Sigma | D2650 | |
| DNase I | Sigma | D4513 | 10 U/μL stock |
| Donkey anti-rat Alexa Fluor 488 secondary antibody | Invitrogen | A21208 | |
| EGTA | Solarbio | E8050 | 50 mM (PH = 8) stock |
| Epidermal growth factor (1 mg/mL) | Sigma | SRP3196 | |
| Ethanolamine | Sigma | E9508 | |
| Fetal Bovine Serum | VivaCell biosciences | C04001-500 | |
| Forskolin | Sigma | F3917 | 20 mM stock |
| Gentamicin/amphotericin solution (500x) | Gibco | R01510 | |
| Hemocytometer | QIUJING | XB.K.25. | |
| HEPES | Sigma | H4034 | |
| Hyaluronidase | Sigma | H3506 | 10 mg/mL stock |
| Insulin-transferrin-selenium (100x) | Gibco | 41400045 | |
| Isoflurane | RWD | R510-22-10 | |
| KCl | Sangon Biotech | A100395 | |
| L-Glutamine (200 mM) | Sigma | G7513 | |
| Magnetic separator | Promega | Z5342 | |
| MEM non-essential amino acids (100x) | Gibco | 11140050 | |
| MEM vitamin solution (100x) | Gibco | 11120052 | |
| MgCl2 | Sangon Biotech | A100288 | 1.5 M stock |
| Na Pyruvate (100 mM) | Gibco | 11360070 | |
| Na2HPO4 | Sangon Biotech | A600487 | |
| NaCl | Sangon Biotech | A610476 | |
| NaOH | Sangon Biotech | A620617 | 1 N stock |
| PBS | VivaCell biosciences | C3580-0500 | |
| PBS | Solarbio | P1010 | |
| Penicillin-Streptomycin (100x) | Gibco | 15140-122 | |
| Peristaltic pump | BaodingRongbai | YZ1515PPS | |
| Protein G beads | Invitrogen | 10004D | |
| Rotator | Kylin-Bell | QB-528 | |
| RPMI | VivaCell biosciences | C3010-0500 | |
| Soybean trypsin inhibitor | Sigma | T6522 | 10 mg/mL stock |
| Swaged needle | Jinhuan Medical | HM601 | |
| Triton X-100 | Solarbio | T8200 | |
| Trypan blue | Sigma | T6146 | 10 mg/mL stock |
| Type I rat tail collagen | BD | 354236 |
Referenzen
- Wang, Z., et al. Human cholangiocytes form a polarized and functional bile duct on hollow fiber membranes. Front Bioeng Biotechnol. 10, 868857 (2022).
- Li, P., et al. Three-dimensional human bile duct formation from chemically induced human liver progenitor cells. Front Bioeng Biotechnol. 11, 1249769 (2023).
- Fabris, L., et al. Pathobiology of inherited biliary diseases: a roadmap to understand acquired liver diseases. Nat Rev Gastroenterol Hepatol. 16 (8), 497-511 (2019).
- Jalan-Sakrikar, N., et al. Central role for cholangiocyte pathobiology in cholestatic liver diseases. Hepatology. , (2024).
- Ilyas, S. I., Gores, G. J. Pathogenesis, diagnosis, and management of cholangiocarcinoma. Gastroenterology. 145 (6), 1215-1229 (2013).
- Perugorria, M. J., et al. Polycystic liver diseases: advanced insights into the molecular mechanisms. Nat Rev Gastroenterol Hepatol. 11 (12), 750-761 (2014).
- Masyuk, T. V., Masyuk, A. I., LaRusso, N. F. Polycystic liver disease: Advances in understanding and treatment. Annu Rev Pathol. 17, 251-269 (2022).
- Ji, R., et al. Multi-omics profiling of cholangiocytes reveals sex-specific chromatin state dynamics during hepatic cystogenesis in polycystic liver disease. J Hepatol. 78 (4), 754-769 (2023).
- Tabibian, J. H., et al. Characterization of cultured cholangiocytes isolated from livers of patients with primary sclerosing cholangitis. Lab Invest. 94 (10), 1126-1133 (2014).
- Muff, M. A., et al. Development and characterization of a cholangiocyte cell line from the PCK rat, an animal model of autosomal recessive polycystic kidney disease. Lab Invest. 86 (9), 940-950 (2006).
- Nagaya, M., Katsuta, H., Kaneto, H., Bonner-Weir, S., Weir, G. C. Adult mouse intrahepatic biliary epithelial cells induced in vitro to become insulin-producing cells. J Endocrinol. 201 (1), 37-47 (2009).
- Karjoo, S., Wells, R. G. Isolation of neonatal extrahepatic cholangiocytes. J Vis Exp. (88), e51621 (2014).
- Kudira, R., et al. Isolation and culturing primary chaolangiocytes from mouse liver. Bio Protoc. 11 (20), e4192 (2021).
- Ueno, Y., et al. Evaluation of differential gene expression by microarray analysis in small and large cholangiocytes isolated from normal mice. Liver Int. 23 (6), 449-459 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten